Adenosine deaminase
| Adenosine/AMP deaminase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| crystal structure of plasmodium yoelii adenosine deaminase (py02076) | |||||||||
| Danh pháp | |||||||||
| Ký hiệu | A_deaminase | ||||||||
| Pfam | PF00962 | ||||||||
| Pfam clan | CL0034 | ||||||||
| InterPro | IPR001365 | ||||||||
| PROSITE | PDOC00419 | ||||||||
| SCOP | 1add | ||||||||
| CDD | cd01320 | ||||||||
| |||||||||
| Adenosine/AMP deaminase N-terminal | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Danh pháp | |||||||||
| Ký hiệu | A_deaminase_N | ||||||||
| Pfam | PF08451 | ||||||||
| InterPro | IPR013659 | ||||||||
| |||||||||
Adenosine deaminase (còn được gọi là adenosine aminohydrolase, hoặc ADA) là một enzyme (EC) tham gia vào quá trình chuyển hóa purin. Nó là cần thiết cho sự phân hủy adenosine từ thực phẩm và cho sự thay đổi của axit nucleic trong các mô.
Chức năng chính của nó ở người là sự phát triển và duy trì hệ thống miễn dịch.[3] Tuy nhiên, vai trò sinh lý đầy đủ của ADA vẫn chưa được hiểu rõ.[4]
Kết cấu
[sửa | sửa mã nguồn]ADA tồn tại ở cả dạng nhỏ (dưới dạng monome) và dạng lớn (dưới dạng phức chất mờ).[4] Ở dạng monome, enzyme là một chuỗi polypeptide,[5] được gấp thành tám chuỗi các thùng α / parallel song song, bao quanh một túi sâu trung tâm là vị trí hoạt động.[3] Ngoài tám trung tâm β-thùng và tám ngoại vi α-xoắn, ADA cũng chứa thêm lăm xoắn: dư lượng 19-76 lần vào ba xoắn, nằm giữa β1 và α1 nếp gấp; và hai vòng xoắn carboxy-terminal antiparallel được đặt trên đầu cực amin của barrel-thùng.
Vị trí hoạt động ADA chứa một ion kẽm, nằm ở phần lõm sâu nhất của vị trí hoạt động và được phối hợp bởi năm nguyên tử từ His15, His17, His214, Asp295 và chất nền.[3] Kẽm là đồng yếu tố duy nhất cần thiết cho hoạt động.
Chất nền, adenosine, được ổn định và liên kết với vị trí hoạt động bằng chín liên kết hydro.[3] Nhóm carboxyl của Glam217, gần như là coplanar với vòng purine cơ chất, ở vị trí tạo thành liên kết hydro với N1 của chất nền. Nhóm carboxyl của Asp296, cũng là coplanar với vòng purine cơ chất, hình thành liên kết hydro với N7 của chất nền. Nhóm NH của Gly184 ở vị trí tạo thành liên kết hydro với N3 của chất nền. Asp296 hình thành liên kết cả với ion Zn 2+ cũng như với 6-OH của chất nền. His238 cũng liên kết hydro với cơ chất 6-OH. 3'-OH của ribose cơ chất tạo thành liên kết hydro với Asp19, trong khi 5'-OH tạo thành liên kết hydro với His17. Hai liên kết hydro tiếp theo được hình thành cho các phân tử nước, tại vị trí mở của vị trí hoạt động, bởi 2'-OH và 3'-OH của chất nền.
Do sự suy thoái của vị trí hoạt động bên trong enzyme, chất nền, một khi đã bị ràng buộc, gần như được cô lập hoàn toàn khỏi dung môi.[3] Độ tiếp xúc bề mặt của chất nền với dung môi khi liên kết là 0,5% độ tiếp xúc bề mặt của chất nền ở trạng thái tự do.
Phản ứng
[sửa | sửa mã nguồn]ADA không thể phục hồi deaminates adenosine, chuyển đổi nó vào liên quan nucleoside inosine bởi sự thay thế của amin nhóm cho một nhóm keto.
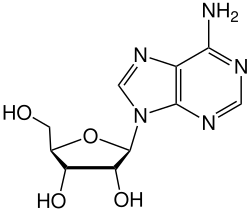

Inosine sau đó có thể được khử bằng (loại bỏ khỏi ribose) bởi một enzyme khác gọi là purine nucleoside phosphorylase (PNP), chuyển nó thành hypoxanthine.
Cơ chế xúc tác
[sửa | sửa mã nguồn]Cơ chế đề xuất cho quá trình khử xúc tác ADA là loại bỏ bổ sung lập thể thông qua trung gian tứ diện.[6] Theo một trong hai cơ chế, Zn 2+ như một chất điện ly mạnh kích hoạt một phân tử nước, bị khử bởi Asp295 cơ bản để tạo thành hydroxide tấn công.[3] His238 định hướng phân tử nước và ổn định điện tích của hydroxide tấn công. Glam217 được proton hóa để tặng một proton cho N1 của chất nền.
Phản ứng này là đặc thù do vị trí của dư lượng kẽm, Asp295 và His238, tất cả đều phải đối mặt với mặt B của vòng purine của chất nền.[3]
Ức chế cạnh tranh đã được quan sát đối với ADA, trong đó sản phẩm inosine hoạt động ở chất ức chế cạnh tranh đối với hoạt động của enzyme.[7]
Chức năng
[sửa | sửa mã nguồn]ADA được coi là một trong những enzyme chủ chốt của chuyển hóa purine.[6] Enzyme đã được tìm thấy ở vi khuẩn, thực vật, động vật không xương sống, động vật có xương sống và động vật có vú, với sự bảo tồn cao của chuỗi amino acid.[4] Mức độ cao của bảo tồn trình tự amino acid cho thấy bản chất quan trọng của ADA trong con đường trục vớt purine.
Chủ yếu, ADA ở người có liên quan đến sự phát triển và duy trì hệ thống miễn dịch. Tuy nhiên, hiệp hội ADA cũng đã được quan sát với sự biệt hóa tế bào biểu mô, dẫn truyền thần kinh và duy trì thai.[8] Người ta cũng đề xuất rằng ADA, ngoài việc phân hủy adenosine, còn kích thích giải phóng các amino acid kích thích và cần thiết cho sự kết hợp của các thụ thể adenosine A1 và protein G dị dưỡng.[4] Thiếu Adenosine deaminase dẫn đến xơ phổi,[9] cho thấy rằng việc tiếp xúc lâu dài với mức độ cao của adenosine có thể làm trầm trọng thêm các phản ứng viêm hơn là ức chế chúng. Người ta cũng đã nhận ra rằng protein và hoạt động của adenosine deaminase được điều hòa trong tim chuột biểu hiện quá mức HIF-1 alpha, điều này phần nào giải thích mức độ suy giảm của adenosine trong tim biểu hiện HIF-1 alpha khi bị thiếu máu cục bộ.[10]
Bệnh lý
[sửa | sửa mã nguồn]Một số đột biến trong gen của adenosine deaminase khiến nó không được biểu hiện. Sự thiếu hụt kết quả là một trong những nguyên nhân gây SCID, đặc biệt là di truyền lặn tự phát.[11] Mức độ thiếu ADA cũng có liên quan đến viêm phổi, chết tế bào tuyến ức và tín hiệu thụ thể tế bào T bị khiếm khuyết.[12][13]
Ngược lại, đột biến khiến enzyme này bị biểu hiện quá mức là một trong những nguyên nhân gây thiếu máu tan huyết.[14]
Có một số bằng chứng cho thấy một alen khác (ADA2) có thể dẫn đến tự kỷ.[15]
Mức độ ADA tăng cao cũng có liên quan đến AIDS.[12][16]
Đồng dạng
[sửa | sửa mã nguồn]Có 2 đồng phân của ADA: ADA1 và ADA2.
- ADA1 được tìm thấy trong hầu hết các tế bào cơ thể, đặc biệt là tế bào lympho và đại thực bào, nơi nó không chỉ xuất hiện trong cytosol và nhân mà còn dưới dạng ecto trên màng tế bào gắn với dipeptidyl peptidase-4 (hay còn gọi là CD26). ADA1 tham gia chủ yếu vào hoạt động nội bào, và tồn tại cả ở dạng nhỏ (monome) và dạng lớn (dimer).[4] Sự xen kẽ của các hình thức từ nhỏ đến lớn được quy định bởi một "yếu tố chuyển đổi" trong phổi.[17]
- ADA2 lần đầu tiên được xác định ở lá lách của con người.[18] Sau đó nó đã được tìm thấy trong các mô khác bao gồm đại thực bào nơi nó cùng tồn tại với ADA1. Hai isoforms điều chỉnh tỷ lệ adenosine và deoxyadenosine làm tăng khả năng tiêu diệt ký sinh trùng. ADA2 được tìm thấy chủ yếu trong huyết tương và huyết thanh người, và chỉ tồn tại dưới dạng homodimer.[19]
Ý nghĩa lâm sàng
[sửa | sửa mã nguồn]ADA2 là dạng chủ yếu có trong huyết tương của người và tăng ở nhiều bệnh, đặc biệt là những bệnh liên quan đến hệ miễn dịch: ví dụ viêm khớp dạng thấp, bệnh vẩy nến và bệnh sarcoid. Đồng vị ADA2 huyết tương cũng tăng trong hầu hết các bệnh ung thư. ADA2 không phổ biến nhưng chỉ tồn tại với ADA1 trong các đại thực bào đơn bào. [ <span title="This claim needs references to reliable sources. (June 2009)">cần dẫn nguồn</span> ] Tổng ADA huyết tương có thể được đo bằng phương pháp sắc ký lỏng hiệu năng cao hoặc kỹ thuật enzyme hoặc so màu. Có lẽ hệ thống đơn giản nhất là phép đo ammonia được giải phóng từ adenosine khi được phân hủy thành inosine. Sau khi ủ huyết tương bằng dung dịch adenosine đệm, amonia được phản ứng với thuốc thử Berthelot để tạo thành màu xanh lam tương xứng với lượng hoạt động của enzyme. Để đo ADA2, erythro-9- (2-hydroxy-3-nonyl) adenine (EHNA) được thêm vào trước khi ủ để ức chế hoạt động enzyme của ADA1.[18] Chính sự vắng mặt của ADA1 gây ra SCID.
ADA cũng có thể được sử dụng trong quá trình điều trị tràn dịch màng phổi lympho hoặc cổ trướng phúc mạc, trong đó các mẫu bệnh phẩm có mức độ ADA thấp về cơ bản không bao gồm bệnh lao.[20]
Hiện tượng tràn dịch màng phổi do lao có thể được chẩn đoán chính xác bằng cách tăng mức độ dịch màng phổi adenosine deaminase, trên 40 U mỗi lít.[21]
Cladribine và Pentostatin là các chất chống tân sinh được sử dụng trong điều trị bệnh bạch cầu tế bào lông; cơ chế hoạt động của chúng là ức chế adenosine deaminase.
Xem thêm
[sửa | sửa mã nguồn]Tham khảo
[sửa | sửa mã nguồn]- ^ a b c GRCh38: Ensembl release 89: ENSG00000196839 - Ensembl, May 2017
- ^ "Human PubMed Reference:".
- ^ a b c d e f g Wilson DK, Rudolph FB, Quiocho FA (tháng 5 năm 1991). "Atomic structure of adenosine deaminase complexed with a transition-state analog: understanding catalysis and immunodeficiency mutations". Science. Quyển 252 số 5010. tr. 1278–1284. doi:10.1126/science.1925539. PMID 1925539.
- ^ a b c d e Cristalli G, Costanzi S, Lambertucci C, Lupidi G, Vittori S, Volpini R, Camaioni E (tháng 3 năm 2001). "Adenosine deaminase: functional implications and different classes of inhibitors". Medicinal Research Reviews. Quyển 21 số 2. tr. 105–128. doi:10.1002/1098-1128(200103)21:2<105::AID-MED1002>3.0.CO;2-U. PMID 11223861.
- ^ Daddona PE, Kelley WN (tháng 1 năm 1977). "Human adenosine deaminase. Purification and subunit structure". The Journal of Biological Chemistry. Quyển 252 số 1. tr. 110–115. PMID 13062.
- ^ a b Losey HC, Ruthenburg AJ, Verdine GL (tháng 1 năm 2006). "Crystal structure of Staphylococcus aureus tRNA adenosine deaminase TadA in complex with RNA". Nature Structural & Molecular Biology. Quyển 13 số 2. tr. 153–159. doi:10.1038/nsmb1047.
- ^ Saboury AA, Divsalar A, Jafari GA, Moosavi-Movahedi AA, Housaindokht MR, Hakimelahi GH (tháng 5 năm 2002). "A product inhibition study on adenosine deaminase by spectroscopy and calorimetry". Journal of Biochemistry and Molecular Biology. Quyển 35 số 3. tr. 302–305. doi:10.5483/BMBRep.2002.35.3.302. PMID 12297022.
- ^ Moriwaki Y, Yamamoto T, Higashino K (tháng 10 năm 1999). "Enzymes involved in purine metabolism--a review of histochemical localization and functional implications". Histology and Histopathology. Quyển 14 số 4. tr. 1321–1340. PMID 10506947.
- ^ Blackburn MR (2003). "Too much of a good thing: adenosine overload in adenosine-deaminase-deficient mice". Trends in Pharmacological Sciences. Quyển 24 số 2. tr. 66–70. doi:10.1016/S0165-6147(02)00045-7. PMID 12559769.
- ^ Wu J, Bond C, Chen P, Chen M, Li Y, Shohet RV, Wright G (2015). "HIF-1α in the heart: remodeling nucleotide metabolism". Journal of Molecular and Cellular Cardiology. Quyển 82. tr. 194–200. doi:10.1016/j.yjmcc.2015.01.014. PMC 4405794. PMID 25681585.
- ^ Sanchez JJ, Monaghan G, Børsting C, Norbury G, Morling N, Gaspar HB (tháng 5 năm 2007). "Carrier frequency of a nonsense mutation in the adenosine deaminase (ADA) gene implies a high incidence of ADA-deficient severe combined immunodeficiency (SCID) in Somalia and a single, common haplotype indicates common ancestry". Annals of Human Genetics. Quyển 71 số Pt 3. tr. 336–47. doi:10.1111/j.1469-1809.2006.00338.x. PMID 17181544.
- ^ a b Blackburn MR, Kellems RE (2005). "Adenosine deaminase deficiency: metabolic basis of immune deficiency and pulmonary inflammation". Advances in Immunology. Advances in Immunology. Quyển 86. tr. 1–41. doi:10.1016/S0065-2776(04)86001-2. ISBN 9780120044863. PMID 15705418.
- ^ Apasov SG, Blackburn MR, Kellems RE, Smith PT, Sitkovsky MV (tháng 7 năm 2001). "Adenosine deaminase deficiency increases thymic apoptosis and causes defective T cell receptor signaling". The Journal of Clinical Investigation. Quyển 108 số 1. tr. 131–141. doi:10.1172/JCI10360. PMC 209335. PMID 11435465.
- ^ Chottiner EG, Cloft HJ, Tartaglia AP, Mitchell BS (tháng 3 năm 1987). "Elevated adenosine deaminase activity and hereditary hemolytic anemia. Evidence for abnormal translational control of protein synthesis". The Journal of Clinical Investigation. Quyển 79 số 3. tr. 1001–5. doi:10.1172/JCI112866. PMC 424261. PMID 3029177.
- ^ Persico AM, Militerni R, Bravaccio C, Schneider C, Melmed R, Trillo S, Montecchi F, Palermo MT, Pascucci T, Puglisi-Allegra S, Reichelt KL, Conciatori M, Baldi A, Keller F (tháng 12 năm 2000). "Adenosine deaminase alleles and autistic disorder: case-control and family-based association studies". American Journal of Medical Genetics. Quyển 96 số 6. tr. 784–90. doi:10.1002/1096-8628(20001204)96:6<784::AID-AJMG18>3.0.CO;2-7. PMID 11121182.
- ^ Cowan MJ, Brady RO, Widder KJ (tháng 2 năm 1986). "Elevated erythrocyte adenosine deaminase activity in patients with acquired immunodeficiency syndrome". Proceedings of the National Academy of Sciences of the United States of America. Quyển 83 số 4. tr. 1089–1091. doi:10.1073/pnas.83.4.1089. PMC 323016. PMID 3006027.
- ^ Schrader WP, Stacy AR (tháng 9 năm 1977). "Purification and subunit structure of adenosine deaminase from human kidney". The Journal of Biological Chemistry. Quyển 252 số 18. tr. 6409–6415. PMID 893413.
- ^ a b Schrader WP, Pollara B, Meuwissen HJ (tháng 1 năm 1978). "Characterization of the residual adenosine deaminating activity in the spleen of a patient with combined immunodeficiency disease and adenosine deaminase deficiency". Proceedings of the National Academy of Sciences of the United States of America. Quyển 75 số 1. tr. 446–50. doi:10.1073/pnas.75.1.446. PMC 411266. PMID 24216.
- ^ Zavialov AV, Engström A (tháng 10 năm 2005). "Human ADA2 belongs to a new family of growth factors with adenosine deaminase activity". The Biochemical Journal. Quyển 391 số Pt 1. tr. 51–57. doi:10.1042/BJ20050683. PMC 1237138. PMID 15926889.
- ^ Jiménez Castro D, Díaz Nuevo G, Pérez-Rodríguez E, Light RW (2003). "Diagnostic value of adenosine deaminase in nontuberculous lymphocytic pleural effusions" (PDF). Eur. Respir. J. Quyển 21 số 2. tr. 220–4. doi:10.1183/09031936.03.00051603. PMID 12608433.
- ^ Brunicardi F, Andersen D, Billiar T, Dunn D, Hunter J, Pollock RE (2005). "Chapter 18, question 16". Schwartz's principles of surgery (ấn bản thứ 8). New York: McGraw-Hill Professional. ISBN 978-0071410908.
Đọc thêm
[sửa | sửa mã nguồn]Liên kết ngoài
[sửa | sửa mã nguồn] GIẢM
39%
GIẢM
39%
 GIẢM
20%
GIẢM
20%












