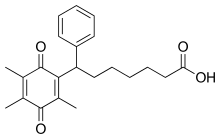
Seratrodast
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Bronica in Japan, Changnuo, Mai Xu Jia, Quan Kang Nuo in China and as Seradair in India. .[1] |
| AHFS/Drugs.com | Tên thuốc quốc tế |
| Dược đồ sử dụng | By mouth (tablets, granules) |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Liên kết protein huyết tương | >96% |
| Chu kỳ bán rã sinh học | 22 hours |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ECHA InfoCard | 100.220.176 |
| Dữ liệu hóa lý | |
| Công thức hóa học | C22H26O4 |
| Khối lượng phân tử | 354.43 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Seratrodast (tên phát triển, AA-2414; được bán trên thị trường với tên Bronica) [2] là một chất đối vận thụ thể thromboxane A 2 (TXA 2) (thụ thể TP) được sử dụng chủ yếu trong điều trị hen suyễn.[3][4] Đó là thuốc đối kháng thụ thể TP đầu tiên được phát triển dưới dạng thuốc chống hen và được phê duyệt tiếp thị tại Nhật Bản vào năm 1997.[5] Kể từ năm 2017 seratrodast đã được bán trên thị trường như Bronica ở Nhật Bản và Changnuo, Mai Xu Jia, Quan Kang Nuo ở Trung Quốc.[1]
Không giống như các chất ức chế tổng hợp thromboxane như ozagrel, seratrodast không ảnh hưởng đến sự hình thành huyết khối, thời gian tắc và thời gian chảy máu.[6] Seratrodast không có tác dụng đối với thời gian prothrombin và thời gian thromboplastin một phần được kích hoạt, do đó loại trừ bất kỳ hành động nào đối với dòng thác đông máu.[7]
Sử dụng trong y tế
[sửa | sửa mã nguồn]Seratrodast được sử dụng để điều trị hen suyễn.[8][9]
Không có nghiên cứu đầy đủ và có kiểm soát về huyết thanh ở phụ nữ mang thai. Thuốc chỉ nên được sử dụng trong thai kỳ nếu những lợi ích tiềm năng biện minh cho nguy cơ đối với thai nhi. Seratrodast không nên được sử dụng trong thời kỳ cho con bú.[9]
Sự an toàn và hiệu quả của seratrodast chưa được thiết lập ở trẻ em (<18 tuổi).[9]
Chống chỉ định và tương tác
[sửa | sửa mã nguồn]Seratrodast không nên được sử dụng ở những người bị bệnh gan.[9]
Sử dụng với paracetamol hoặc với kháng sinh cephem làm tăng nguy cơ tổn thương gan. Sử dụng với aspirin làm tăng khả dụng sinh học của seratrodast.[9]
Tác dụng phụ
[sửa | sửa mã nguồn]Các phản ứng bất lợi thường thấy nhất (0,1 đến 5%) bao gồm tăng transaminase, buồn nôn, chán ăn, khó chịu ở dạ dày, đau bụng, tiêu chảy, táo bón, khô miệng, rối loạn vị giác, buồn ngủ, nhức đầu, chóng mặt, đánh trống ngực và khó chịu.[9] Ít hơn 0,1% bệnh nhân bị nôn, giảm tiểu cầu, chảy máu cam, chảy máu, mất ngủ, run, tê, đỏ bừng và phù. Tất cả các phản ứng bất lợi được báo cáo là ở mức độ nhẹ đến trung bình, và được giải quyết khi ngưng thuốc.
Dược lý
[sửa | sửa mã nguồn]Thromboxane A2 (TXA2) được tạo ra trong phổi của những người mắc bệnh hen suyễn, và khi nó truyền tín hiệu qua thụ thể thromboxane, nó gây ra co thắt phế quản, co mạch, tiết chất nhầy và tăng phản ứng đường thở. Seratrodast ức chế hoạt động của thụ thể thromboxane, ngăn chặn tác dụng của TXA 2.[10]
Dược động học
[sửa | sửa mã nguồn]Dược động học của seratrodast đã được nghiên cứu ở Nhật Bản và da trắng, bao gồm cả người Ấn Độ, tình nguyện viên khỏe mạnh.[11][12][13][14] Nồng độ huyết thanh của huyết thanh tăng khi tăng liều. Sự hấp thu của seratrodast tương đối nhanh với nồng độ tối đa trong huyết tương là 4,6. Mùi / ml thu được trong 3 đến 4 giờ. Nồng độ huyết thanh trạng thái ổn định của huyết thanh huyết thanh đạt được trong vòng 45 ngày. Seratrodast được làm sạch từ từ, chủ yếu bằng biến đổi sinh học gan. Thuốc cho thấy sự phân rã biexponential trong hồ sơ huyết tương với thời gian bán hủy trung bình là 22 giờ. Khoảng 20% liều dùng được thu hồi trong nước tiểu, với 60% thu hồi nước tiểu ở dạng liên hợp
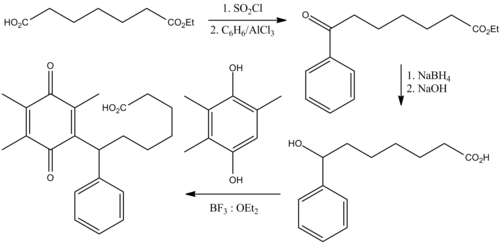
Hóa học
[sửa | sửa mã nguồn]Seratrodast có thể được chuẩn bị trong năm bước bắt đầu từ đơn chất axit pimelic.[15]
Lịch sử
[sửa | sửa mã nguồn]Seratrodast là thuốc đối kháng thụ thể thromboxane đầu tiên tiếp cận thị trường như một phương pháp điều trị hen suyễn; nó đã được phê duyệt tại Nhật Bản vào năm 1997.[8]
Xã hội và văn hoá
[sửa | sửa mã nguồn]Kể từ năm 2017 seratrodast đã được bán trên thị trường như Bronica ở Nhật Bản, Changnuo, Mai Xu Jia, Quan Kang Nuo ở Trung Quốc và như Seretra & Seradair ở Ấn Độ.[1]
Nghiên cứu
[sửa | sửa mã nguồn]Seratrodast được nghiên cứu trong viêm mũi dị ứng lâu năm, viêm phế quản mãn tính và khí phế thũng phổi mãn tính nhưng những nỗ lực đưa thuốc ra thị trường trong những chỉ định đó đã bị bỏ rơi vào khoảng năm 2000.[2]
Tham khảo
[sửa | sửa mã nguồn]- ^ a b c “Seratrodast international brands”. Drugs.com. Truy cập ngày 8 tháng 3 năm 2017.
- ^ a b “Seratrodast” (bằng tiếng Anh). AdisInsight. Truy cập ngày 8 tháng 3 năm 2017.
- ^ Endo S; Akiyama K (tháng 11 năm 1996). “[Thromboxane A2 receptor antagonist in asthma therapy]”. Nippon Rinsho (bằng tiếng Nhật). 54 (11): 3045–8. PMID 8950952.
- ^ Hada S; Hashizume M; Nishii S; Yoshioka F; Yasunaga K (tháng 1 năm 1993). “[Study on the inhibitory effect of AA-2414 on platelet aggregation and its clinical effect in asthmatic patients]”. Arerugi (bằng tiếng Nhật). 42 (1): 18–25. PMID 8457165.
- ^ Dogné JM; de Leval X; Benoit P; Delarge J; Masereel B (2002). “Thromboxane A2 inhibition: therapeutic potential in bronchial asthma”. Am J Respir Med. 1 (1): 11–7. doi:10.1007/bf03257158. PMID 14720071.
- ^ Dogné JM; Hanson J; de Leval X; Kolh P; Tchana-Sato V; de Leval L; Rolin S; Ghuysen A; Segers P (2004). “Pharmacological characterization of N-tert-butyl-N'-[2-(4'-methylphenylamino)-5-nitrobenzenesulfonyl]urea (BM-573), a novel thromboxane A2 receptor antagonist and thromboxane synthase inhibitor in a rat model of arterial thrombosis and its effects on bleeding time”. J Pharmacol Exp Ther. 309 (2): 498–505. doi:10.1124/jpet.103.063610. PMID 14742735.
- ^ Samara EE (1996). “Seratrodast (AA-2414)—A Novel Thromboxane-A2 Receptor Antagonist”. Cardiovascular Drug Reviews. 14 (3): 272–85. doi:10.1111/j.1527-3466.1996.tb00231.x.
- ^ a b Rolin, S; Masereel, B; Dogné, JM (ngày 8 tháng 3 năm 2006). “Prostanoids as pharmacological targets in COPD and asthma”. European Journal of Pharmacology. 533 (1–3): 89–100. doi:10.1016/j.ejphar.2005.12.058. PMID 16458293.
- ^ a b c d e f “医療用医薬品: ブロニカ (Japanese label)” (bằng tiếng Nhật). KEGG. tháng 10 năm 2016. Truy cập ngày 8 tháng 3 năm 2017.
- ^ Dogné, JM; de Leval, X; Benoit, P; Rolin, S; Pirotte, B; Masereel, B (tháng 2 năm 2002). “Therapeutic potential of thromboxane inhibitors in asthma”. Expert Opinion on Investigational Drugs. 11 (2): 275–81. doi:10.1517/13543784.11.2.275. PMID 11829716.
- ^ An open-labeled, randomized, cross-over bioequivalence study of Seratrodast 80mg under fasting condition. Data on file (appears on website on Seretra)
- ^ Hiraga K; Tateno M (1993). “The clinical phase I study of AA-2414, a thromboxane A, receptor antagonist – repeated-dose study at 160 mg once daily for 7 days”. Clin Pharmacol. 9 (Suppl. 8): 41–55.
- ^ Hussein Z; Samara E; Locke CS; Orchard MA; Ringham GL; Granneman GR (1994). “Characterization of the pharmacokinetics and pharmacodynamics of a new oral thromboxane A2-receptor antagonist AA-2414 in normal subjects: population analysis”. Clin Pharmacol Ther. 55 (4): 441–50. doi:10.1038/clpt.1994.54. PMID 8162671.
- ^ Samara E; Qian J; Locke CS; Granneman R; Dean R; Killian A (1996). “Single-dose and steady-state pharmacokinetics of seratrodast in healthy male and female volunteers”. Pharm Res. 13 (Suppl. 9).
- ^ Shiraishi M; Kato K; Terao S; Ashida Y; Terashita Z; Kito G (tháng 9 năm 1989). “Quinones. 4. Novel eicosanoid antagonists: synthesis and pharmacological evaluation”. Journal of Medicinal Chemistry. 32 (9): 2214–21. doi:10.1021/jm00129a030. PMID 2769691.
 GIẢM
11%
GIẢM
11%
 GIẢM
50%
GIẢM
50%
 GIẢM
18%
GIẢM
18%
 GIẢM
15%
GIẢM
15%