Ferulasuur
|
Algemeen | |
|---|---|
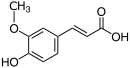
| Naam | Ferulasuur |
 |
 |
| Chemiese formule | |
| Molêre massa | 194.18 g/mol |
| CAS-nommer | 1135-24-6 |
| Fasegedrag | |
| Smeltpunt | 168 tot 172 °C |
| Kookpunt | |
| Digtheid | |
| Oplosbaarheid | 0.78 g/L[1] |
|
Suur-basis eienskappe | |
| pKa | 4.61[1] |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Ferulasuur is 'n hidroksikaneelsuur, 'n tipe organiese verbinding. Dit is 'n fenoliese verbinding wat in groot hoeveelhede voorkom in plant selwande, waar dit kovalent as sykettings gebind is aan molekules soos arabinoxilane. Ferulasuur is ook 'n komponent van lignien, en is 'n voorloper in die biosintese van ander aromatiese verbindings. Die naam is afgelei van die genus Ferula, met verwysing na die reuse-vinkel (Ferula communis).
Natuurlike voorkoms
[wysig | wysig bron]As 'n bousteen van lignosellulosevirbindings soos pektien[2] en lignien, is ferulasuur alomteenwoordig in die planteryk.
In voedsel
[wysig | wysig bron]Ferulasuur kom voor in 'n verskydenheid van plante wat as menslike voedsel dien, en word veral in springmielies en bamboeslote in hoë konsentrasies gevind.[3][4] Dit is 'n belangrike metaboliet van chlorogeniese suur in die menslike spysvertering, en word saam met kaffeïnsuur en isoferulasuur in die dunderm opgeneem, terwyl ander metaboliete soos dihidroferulasuur, feruloielglisien en dihidroferulasuursulfaat, deur bakterië in die dikderm vanaf chlorogeniese suur geproduseer word.[5]
In graan is ferulasuur in die semels gelokaliseer – die harde buitenste laag van die graan. In koring kom fenoliese verbindings hoofsaaklik as onoplosbare gebonde ferulasuur voor, en mag 'n rol speel in die weerstand teen swamsiektes van koring.[6] Die grootste bekende konsentrasie van ferulasuur glukosied is gevind in lynsaad (4.1 ± 0.2 g/kg).[7]
Asterid eudicot plante kan ook ferulasuur produseer. Die tee wat van die blare van yacón (Smallanthus sonchifolius) gebrou word, 'n plant wat tradisioneel in die noordelike en sentrale Andes gekweek word, bevat ferulasuur. Dit kom ook in peulgewasse voor, en die wit navy bean is die rykste bron van ferulasuur onder normale boontjiesoorte (Phaseolus vulgaris).[8]
Alhoewel daar baie bronne van ferulasuur in die natuur voorkom, hang sy biobeskikbaarheid af van die vorm waarin dit teenwoordig is. Vrye ferulasuur het swak wateroplosbaarheid en dus swak biobeskikbaarheid. In koring, byvoorbeeld, is ferulasuur egter aan selwandpolisakkariede gebind, sodat dit in die dunderm vrygelaat en geabsorbeer kan word.[9]
In kruiemedisyne
[wysig | wysig bron]Ferulasuur kom in kruie voor wat in Chinese tradisionele medisyne gebruik word soos Angelica sinensis (vroulike ginseng), Cimicifuga heracleifolia[10] en Ligusticum chuangxiong. Dit is ook gevind in die tee wat gebrou word uit die Europese centaury (Centaurium erythraea), 'n plant wat gebruik word die tradisionele medisyne van baie dele van Europa.[11]
In verwerkte voedsel
[wysig | wysig bron]Gaar suikermielies stel verhoogde vlakke van ferulasuur vry.[12] Dit kom in die vorm van plantsterool-esters in rys semelolie voor, wat 'n gewilde kookolie in verskeie oosterse lande is.[13]
Ferulasuur glukosied kom in kommersiële brood voor wat lynsaad bevat.[14] Rogbrood bevat ferulasuur dehidrodimere.[15]
Metabolisme
[wysig | wysig bron]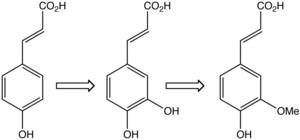
Biosintese
[wysig | wysig bron]Ferulasuur word in plantselle uit kaffeïnsuur geskep deur die aksie van die ensiem kaffeaat O-metieltransferase.[16]
Ferulasuur, saam met dihidroferulasuur, is 'n komponent van lignosellulose, en help om kruisverbindings by lignien en polisakkariede te skep, en sodoende die rigiditeit van selwande te verhoog.[17]
Dit is 'n tussenstap in die sintese van monolignole, die monomere van lignien, en word ook gebruik in die sintese van lignane.
Bioafbraak
[wysig | wysig bron]Ferulasuur word deur sekere tipes gis na 4-viniel-guiacol afgebreek, veral tipes wat gebruik word in die brou van koringbier, soos Saccharomyces delbrueckii (Torulaspora delbrueckii). Hierdie verbinding gee vir biere soos Weissbier en Wit hulle kenmerkende naeltjiegeur. Saccharomyces cerevisiae en Pseudomonas fluorescens is ook in staat om trans-ferulasuur in 2-metoksi-4-vinielfenol om te sit.[18] P. fluorescens bevat 'n ferulasuur dekarboksilase ensiem.[19]
Ekologie
[wysig | wysig bron]Ferulasuur is een van die verbindings wat die vir (virulensie) area van Agrobacterium tumefaciens se genoom aktiveer, en induseer sodoende die infeksie van plantselle.[20]
Biomediese oorwegings
[wysig | wysig bron]
Ferulasuur is, soos baie natuurlike fenole, 'n anti-oksidant in vitro in die sin dat dit reaktief is teenoor vrye radikale soos reaktiewe suurstof spesies (ROS). ROS en vrye radikale is moontlike oorsake van kanker en skade aan DNS, en versnel selveroudering.
In velprodukte wat askorbiensuur en vitamien E bevat, kan ferulasuur oksidatiewe stres en die vorming van timien dimere in die vel verminder.[21]
Ander toepassings
[wysig | wysig bron]Massa spektrometrie
[wysig | wysig bron]Dit word gebruik as 'n matriks vir proteïene in MALDI massaspektrometrie analises.[22]
Verwysings
[wysig | wysig bron]- ↑ 1,0 1,1 Mota, Fátima L.; Queimada, António J.; Pinho, Simão P.; Macedo, Eugénia A. (Augustus 2008). "Aqueous Solubility of Some Natural Phenolic Compounds". Industrial & Engineering Chemistry Research. 47 (15): 5182–5189. doi:10.1021/ie071452o.
- ↑ Saulnier, Luc; Thibault, Jean-François (1 Maart 1999). "Ferulic acid and diferulic acids as components of sugar-beet pectins and maize bran heteroxylans". Journal of the Science of Food and Agriculture. 79 (3): 396–402. doi:10.1002/(SICI)1097-0010(19990301)79:3<396::AID-JSFA262>3.0.CO;2-B.
- ↑ Zhao, Zhaohui; Moghadasian, Mohammed H. (Augustus 2008). "Chemistry, natural sources, dietary intake and pharmacokinetic properties of ferulic acid: A review". Food Chemistry. 109 (4): 691–702. doi:10.1016/j.foodchem.2008.02.039.
- ↑ Kumar, Naresh; Pruthi, Vikas (Desember 2014). "Potential applications of ferulic acid from natural sources". Biotechnology Reports. 4: 86–93. doi:10.1016/j.btre.2014.09.002.
- ↑ Bagchi, Debasis; Moriyama, Hiroyoshi; Swaroop, Anand (2016). Green Coffee Bean Extract in Human Health (in Engels). CRC Press. p. 92. ISBN 9781315353982. Besoek op 23 September 2017.
- ↑ Gelinas, Pierre; McKinnon, Carole M. (2006). "Effect of wheat variety, farming site, and bread-baking on total phenolics". International Journal of Food Science and Technology. 41 (3): 329–332. doi:10.1111/j.1365-2621.2005.01057.x.
- ↑ Beejmohun, Vickram; Fliniaux, Ophélie (2007). "Microwave-assisted extraction of the main phenolic compounds in flaxseed". Phytochemical Analysis. 18 (4): 275–285. doi:10.1002/pca.973.
- ↑ Luthria, Devanand L.; Pastor-Corrales, Marcial A. (2006). "Phenolic acids content of fifteen dry edible bean (Phaseolus vulgaris L.) varieties". Journal of Food Composition and Analysis. 19: 205–211. doi:10.1016/j.jfca.2005.09.003.
- ↑ Anson, Nuria Mateo; van den Berg, Robin; Bast, Aalt; Haenen, Guido R. M. M. (2009). "Bioavailability of ferulic acid is determined by its bioaccessibility". Journal of Cereal Science. 49 (2): 296–300. doi:10.1016/j.jcs.2008.12.001.
- ↑ Sakai, S.; Kawamata, H.; Kogure, T.; Mantani, N.; Terasawa, K.; Umatake, M.; Ochiai, H. (1999). "Inhibitory effect of ferulic acid and isoferulic acid on the production of macrophage inflammatory protein-2 in response to respiratory syncytial virus infection in RAW264.7 cells". Mediators of Inflammation. 8 (3): 173–175. doi:10.1080/09629359990513. PMC 1781798. PMID 10704056.
- ↑ Valentão, P.; Fernandes, E.; Carvalho, F.; Andrade, P. B.; Seabra, R. M.; Bastos, M. L. (2001). "Antioxidant Activity ofCentaurium erythraeaInfusion Evidenced by Its Superoxide Radical Scavenging and Xanthine Oxidase Inhibitory Activity". Journal of Agricultural and Food Chemistry. 49 (7): 3476–3479. doi:10.1021/jf001145s. PMID 11453794.
- ↑ "Cooking sweet corn boosts its ability to fight cancer and heart disease by freeing healthful compounds, Cornell scientists find" (in Engels). Cornell News. Geargiveer vanaf die oorspronklike op 21 Desember 2012. Besoek op 7 September 2009.
- ↑ Orthoefer, F. T. (2005). "Chapter 10: Rice Bran Oil". In Shahidi, F. (red.). Bailey's Industrial Oil and Fat Products. Vol. 2 (6th uitg.). John Wiley & Sons, Inc. p. 465. ISBN 978-0-471-38552-3. Besoek op 1 Maart 2012.
- ↑ Strandås, C.; Kamal-Eldin, A.; Andersson, R.; Åman, P. (2008). "Phenolic glucosides in bread containing flaxseed". Food Chemistry. 110 (4): 997–999. doi:10.1016/j.foodchem.2008.02.088.
- ↑ Boskov Hansen, H.; Andreasen, M.; Nielsen, M.; Larsen, L.; Knudsen, Bach K.; Meyer, A.; Christensen, L.; Hansen, Å. (2014). "Changes in dietary fibre, phenolic acids and activity of endogenous enzymes during rye bread-making". European Food Research and Technology. 214 (1): 33–42. doi:10.1007/s00217-001-0417-6. ISSN 1438-2377.
- ↑ Shahadi, Fereidoon; Naczk, Marian (2004). Phenolics in Food and Nutraceuticals. Florida: CRC Press. p. 4. ISBN 1-58716-138-9.
- ↑ Iiyama, K.; Lam, T. B.-T.; Stone, B. A. (1994). "Covalent Cross-Links in the Cell Wall". Plant Physiology. 104 (2): 315–320. doi:10.1104/pp.104.2.315. ISSN 0032-0889.
- ↑ Huang, Z.; Dostal, L.; Rosazza, J. P. (1993). "Microbial transformations of ferulic acid by Saccharomyces cerevisiae and Pseudomonas fluorescens". Applied and Environmental Microbiology. 59 (7): 2244–2250. PMC 182264. PMID 8395165.
- ↑ Huang, Z.; Dostal, L.; Rosazza, J. P. (1994). "Purification and characterization of a ferulic acid decarboxylase from Pseudomonas fluorescens". Journal of Bacteriology. 176 (19): 5912–5918. doi:10.1128/jb.176.19.5912-5918.1994. PMC 196807. PMID 7928951.
- ↑ Kalogeraki, Virginia S.; Zhu, Jun; Eberhard, Anatol; Madsen, Eugene L.; Winans, Stephen C. (November 1999). "The phenolic vir gene inducer ferulic acid is O-demethylated by the VirH2 protein of an Agrobacterium tumefaciens Ti plasmid". Molecular Microbiology. 34 (3): 512–522. doi:10.1046/j.1365-2958.1999.01617.x.
- ↑ Lin, F. H.; Lin, J. Y.; Gupta, R. D.; Tournas, J. A.; Burch, J. A.; Selim, M. A.; Monteiro-Riviere, N. A.; Grichnik, J. M.; Zielinski, J.; Pinnell, S. R. (2005). "Ferulic Acid Stabilizes a Solution of Vitamins C and E and Doubles its Photoprotection of Skin". Journal of Investigative Dermatology. 125 (4): 826–832. doi:10.1111/j.0022-202X.2005.23768.x. PMID 16185284.
- ↑ Beavis, R. C.; Chait, B. T.; Fales, H. M. (1989). "Cinnamic acid derivatives as matrices for ultraviolet laser desorption mass spectrometry of proteins". Rapid Communications in Mass Spectrometry. 3 (12): 432–435. doi:10.1002/rcm.1290031207. PMID 2520223.