Molibdeensuur
|
Algemeen | |
|---|---|
| Naam | Molibdeensuur |
 | |
| Chemiese formule | H2MoO4 |
| Molêre massa | 161,96 [g/mol][1] |
| CAS-nommer | 7782-91-4[1] |
| Voorkoms | H2MoO4 wit[2], H2SO4·H2 geel vastestof [1] |
| Reuk | reukloos [1] |
| Fasegedrag | |
| Selkonstantes | a=738,3pm; b=370,0pm; c=667,3pm; α=107,8°, β= 113,6°, γ= 91,2°[2] |
| Ruimtegroep | P1 |
| Nommer | 1 |
| Smeltpunt | |
| Kookpunt | |
| Digtheid | |
| Oplosbaarheid | Bietjie oplosbaar in koue water, meer oplosbaar in warm water[1] |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Molibdeensuur is 'n verbinding van molibdeen in sy hoogste 6+ oksidasietoestand met formule H2MoO4
Die suiwer stof is 'n vastestof, wat ook as hidraat H2MoO4·H2O bekend is. Sy anhidried is molibdeen(VI)oksied. Molibdeensuur en sy monohidraat kan ook as hidrate van molibdeen(VI)oksied beskou word: MoO3·H2O en MoO3·2H2O. Sy soute soos natriummolibdaat heet molibdate.
Maar die chemie van molibdeen in waterige oplossings, veral by verhoogde temperature en druk, was in 2010 nog taamlik swak bekend. Die waterige geochemie van molibdeen is nogtans ook by kamertemperatuur van geologiese belang gegewe die gebruik van molibdeen-isotope en hul fraksionering in die afbakening/opsporing van redokstoestande in omgewings van die paleo-Aarde se oppervlak.[3]
Kristalstruktuur
[wysig | wysig bron]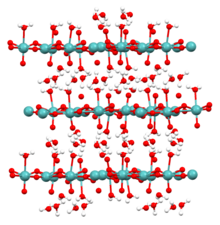
H2MoO4 kristalliseer in 'n trikliniese struktuur. Dit is opgebou uit geïsoleerde dubbele kettings van sterk verwronge [MoO5(H2O)]-oktaëders wat twee gemeenskaplike rande met mekaar deel.[2]
Die hidraat H2MoO4·H2O (oftewel MoO3·2H2O) kristalliseer in 'n monokliniese struktuur (P21/n met Z=16 en selkonstantes a=1047,6(5)pm; b=1382,2(6)pm; c=1060,6(5)pm en β 92,62 °. Die molibdeenatome word deur sterk verwronge oktaëders van vyf oksiedsuurstofatome en een watermolekule omring. Die ander watermolekule is los van die molbdeenatoom en net met waterstofbindings verbind, wat die beskrywing as 'n monohidraat H2MoO4·H2O bevestig. Die oktaëders deel hoekpunte en vorm lae ewewydig aan die b-as (010). Die hidraatwatermolekule word tussen hierdie lae aangetref.[4]
Chemiese eienskappe
[wysig | wysig bron]In water is dit 'n taamlik swak diprotiese suur:[3]
Teen 100 °C word die eerste ionisasie sterker (pKa1= 2,27), maar die tweede swakker (pKa2= 4,99)
Verwysings
[wysig | wysig bron]- ↑ 1,0 1,1 1,2 1,3 1,4 "Molybdic acid". PubChem NIH.
- ↑ 2,0 2,1 2,2 =H.R. Oswald, J.R. Günter, E. Dubler, (1975). "Topotactic decomposition and crystal structure of white molybdenum trioxide-monohydrate: Prediction of structure by topotaxy". Journal of Solid State Chemistry. 13 (4): 330–338. doi:10.1016/0022-4596(75)90148-6.
{{cite journal}}: AS1-onderhoud: ekstra leestekens (link) AS1-onderhoud: gebruik authors-parameter (link) - ↑ 3,0 3,1 Z. Minubayeva, T.M. Seward (2010). "Molybdic acid ionisation under hydrothermal conditions to 300 C". Geochemica et Cosmochemica Acta. 74: 4365–4374.
{{cite journal}}: AS1-onderhoud: gebruik authors-parameter (link) - ↑ BERNT KREBS (1972). "Die Kristallstruktur von MOO3.2H20". Acta Cryst. B28: 2222.

