Southern-klad

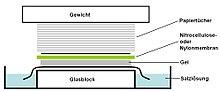
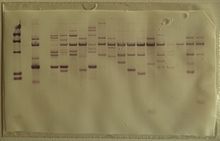


die Southern-klad (vanaf Engels "Southern blot") is 'n metode wat gebruik word in molekulêre biologie om 'n spesifieke basisvolgorde in DNS-monsters op te spoor. Die tegniek behels die oordrag van DNS fragmente wat met elektroforese geskei is op 'n filtermembraan en die daaropvolgende fragment opsporing deur hibridisering met komplementêre fragmente.
Die metode is vernoem na die Britse bioloog Edwin Southern wat dit in 1975 gepubliseer het.[1] Ander kladmetodes (Western klad,[2] northern-klad, eastern-klad en southwestern-klad) wat met soortgelyke beginsels werk, maar met RNA of proteïen, is in verwysing hiermee benoem. Aangesien dit 'n Eponiem is, word Southern met 'n hoofletter geskryf. Die name van die ander kladmetodes word nie noodwendig grootgeskryf nie.[3]
Metode
[wysig | wysig bron]- Restriksie-endonukleases word gebruik om hoë-molekulêre-gewig DNS-stringe in kleiner fragmente op te sny.
- Die DNS-fragmente word dan op 'n agarosegel deur elektroforese volgens hulle grootte geskei.
- Indien sommige van die DNS-fragmente groter as 15 kb lank is, kan die gel vooraf met 'n suur, bv. verdunde HCl, behandel word. Dit depurineer die DNS, m.a.w. die purienbasisse word geskei van die DNS skelet, wat meer doeltreffende oordrag van die gel na die membraan moontlik maak.
- As alkaliese oordragmetodes gebruik word, word die DNS-gel in 'n alkaliese oplossing (tipies met natriumhidroksied) geplaas om die dubbelstring-DNS te denatureer. Die denaturering in 'n alkaliese omgewing kan die binding van negatiefgelaaide timien aan positiefgelaaide aminogroepe van die membraan verbeter, en vernietig enige oorblywende RNS wat nog teenwoordig is in die DNS. Die keuse van alkaliese- of neutrale oordragsmetodes is egter empiries en kan tot soortgelyke resultate lei.
- 'n Nitrosellulose- (of, alternatiewelik, nylon) membraan word op die gel geplaas. Druk word eweredig oor die gel uitge-oefen (óf deur middel van vakuum, of deur 'n stapel handdoekpapier en 'n gewig bo-op die membraan en gel te plaas), om goeie, eweredige kontak tussen die gel en membraan te verseker. As die oordrag met vakuum gedoen word, word 20× SSC-buffer gebruik om die seël te bewerkstellig en te verhoed dat die gel uitdroog. Bufferoordrag deur kapillêre aksie vanaf 'n area van 'n hoë waterpotensiaal na 'n area van lae waterpotensiaal (gewoonlik filter papier en handdoekpapier) word dan gebruik om die DNS vanaf die gel na die membraan oor te dra; ioonuitruilingsinteraksies bind die DNS op die membraan as gevolg van die negatiewe lading van die DNS en positiewe lading van die membraan.
- Die membraan word dan gebak in 'n vakuumoond of 'n normale oond teen 80 °C vir 2 uur (standaard toestande; nitrosellulose- of nylon-membraan) of blootgestel aan ultraviolet bestraling (nylon-membraan) om die oorgedraagde DNS aan die membraan te bind.
- Die membraan word blootgestel aan 'n hibridisasiepeiler— 'n enkele DNS-fragment met 'n spesifieke volgorde wat in die teiken-DNS gevind word. Die peiler-DNS is gemerk sodat dit opgespoor kan word, gewoonlik deur die inkorporering van radioaktiwiteit of merking van die molekule met 'n fluoresserende- of chromogeniese kleurstof. In sommige gevalle kan van 'n hibridisasiepeiler van RNS, eerder as DNS, gemaak word.
- Na hibridisasie word oortollige peiler van die membraan afgewas (gewoonlik met behulp van SSC-buffer), en die patroon van hibridisasie word gevisualiseer op X-straal film deur outoradiografie, in die geval van 'n radio-aktiewe- of fluoresserende peiler, of deur die ontwikkeling van kleur op die membraan indien 'n chromogeniese deteksiemetode gebruik word.
Resultaat
[wysig | wysig bron]Hibridisering van die peiler met 'n spesifieke DNS-fragment op die filtermembraan dui daarop dat daardie fragment 'n DNS-volgorde bevat wat komplementêr is tot die peiler. Die oordrag van die DNS vanaf die elektroforesegel op 'n membraan vergemaklik die binding van die hibridisasiepeiler met die grootte-gefraksioneerde DNS. Dit maak dit ook moontlik om die hibridisasieprodukte van die peiler met die teiken-DNS te bevestig, wat nodig is vir verdere analise deur autoradiografie of ander opsporingsmetodes.
Southern klad analises van genomiese DNS wat met restriksie-ensieme verteer is, kan gebruik word om te bepaal hoeveel verskillende basisvolgordes in 'n genoom voorkom. 'n peiler wat slegs met 'n enkele DNS segment hibridiseer wat nie deur die restriksie-ensiem gesny is nie, sal 'n enkele band op 'n Southern klad gee, terwyl verskeie bande waarskynlik waargeneem word wanneer dit met 'n paar hoogs soortgelyke DNS basisvolgordes hibridiseer (bv., diegene wat die gevolg van volgorde duplikasie is). Wysiging van die hibridisasiekondisies (byvoorbeeld 'n verhoging van die hibridisasietemperatuur of 'n vermindering in sout konsentrasie) kan gebruik word om spesifisiteit te verhoog en hibridisasie van die peiler met volgordes wat minder as 100% soortgelyk is te verminder.
Toepassings
[wysig | wysig bron]Southern oordrag kan gebruik word vir homologie-gebaseerde klonering wat gebaseer is op die aminosuurvolgorde van die teiken proteïn. Oligonukleotides wat soortgelyk is aan die teikenvolgorde word voorberei. Hierdie oligonukleotides word chemies gesintetiseer, radioaktief geëtiketteer, en gebruik om 'n DNS volgorde biblioteek of ander versameling van gekloneerde DNS-fragmente deur te sif. Monsters wat met die peiler hibridiseer word verder geanaliseer, byvoorbeeld om die volledige volgorde van die teikengeen te verkry.
Southern-Klad kan ook gebruik word om gemetileerde setels in gene te identifiseer. Die restriksienukleases MspI en HpaII is hier veral nuttig, omdat beide van hulle binne dieselfde volgorde sny, maar HpaII slegs C-gemetileerde setels sny, terwyl MspI slegs ongemetileerde setels sny. Setels wat deur HpaII gesny word maar nie Mspl nie, is dus gemetileerd.[4]
Verwysings
[wysig | wysig bron]- ↑ Southern, Edwin Mellor (5 November 1975). "Detection of specific sequences among DNA fragments separated by gel electrophoresis". Journal of Molecular Biology. 98 (3): 503–517. doi:10.1016/S0022-2836(75)80083-0.
- ↑ Towbin (1979). "Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications". PNAS. 76 (9): 4350–4. doi:10.1073/pnas.76.9.4350.
- ↑ Burnette, W. Neal (April 1981). "Western Blotting: Electrophoretic Transfer of Proteins from Sodium Dodecyl Sulfate-Polyacrylamide Gels to Unmodified Nitrocellulose and Radiographic Detection with Antibody and Radioiodinated Protein A". Analytical Biochemistry. 112 (2): 195–203. doi:10.1016/0003-2697(81)90281-5.
- ↑ Biochemistry 3rd Edition, Matthews, Van Holde et al, Addison Wesley Publishing, pg 977