Waterstofoksalaat
|
Algemeen | |
|---|---|
| Naam | Waterstofoksalaat |
| IUSTC-naam | Waterstofetaandiöaat |
| Ander name | 2-hidroksi-2-oksoasetaat |
 |
|
| Chemiese formule | HC2O−4 |
| Molêre massa | 89,027 g•mol-1 |
| CAS-nommer | 920-52-5 |
| Fasegedrag | |
| Smeltpunt | |
| Kookpunt | |
| Digtheid | |
| Oplosbaarheid | |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
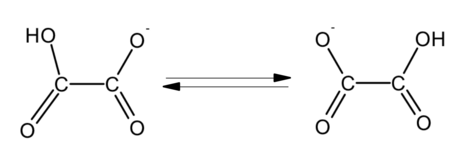
Waterstofoksalaat is 'n anioon met chemiese formule HC2O−4 (of HO2C-CO−2) wat van oksaalsuur deur die verlies van 'n enkele proton of, alternatiewelik, van die oksalaatanioon (C2O2−4) deur byvoeging van 'n proton afgelei is.
Verskeie waterstofoksalate is goed bestudeer, insluitend natriumwaterstofoksalaat (NaHC2O4),[1][2] kaliumwaterstofoksalaat (KHC2O4),[3] ammoniumwaterstofoksalaat (NH3HC2O4), rubidiumwaterstofoksalaat (RbHC2O4)[4] en dimetielammoniumwaterstofoksalaat ((CH3)2NH2HC2O4).[5]
Veral in ouer literatuur word daar ook na waterstofoksalate as bioksalate, suuroksalate of monobasiese oksalate verwys.
Waterstofoksalaat word as amfoteries geklassifiseer dws. dit kan óf 'n as suur óf as 'n basis in 'n chemiese reaksie reageer.
Struktuur
[wysig | wysig bron]Die meeste hidrogenoksalaatsoute is gehidreer. Byvoorbeeld, kaliumwaterstofoksalaat kristalliseer as 2KHC2O4·H2O. Hierdie materiale vertoon uitgebreide strukture as gevolg van waterstofbinding en anioon-katioon interaksies. Die hidrate dehidreer by verhitting:[3]
- 2KHC2O4·H2O → 2KHC2O4 + H2O
Waterstofoksalaat is gebruik om die intramolekulêre oordrag van die waterstofioon te bestudeer. Aangesien die reaksie oënskynlik bloot die beweging van die waterstofioon (proton) behels, is aanvaar dat die laagste energie-oriëntasie van die waterstofoksalaatmolekule wat die reaksie sou vergemaklik die cis-oriëntasie sou wees. 'n Meer ingewikkelde situasie is egter teenwoordig wat koppeling tussen die protonbeweging en die interne vryheidsgrade, beweging van die suurstofatome en kwantumtonneling van die waterstofioon behels.[6]
Kyk ook
[wysig | wysig bron]Verwysings
[wysig | wysig bron]- ↑ Tellgren, Roland; Olovsson, Ivar (1971). "The crystal structures of normal and deuterated sodium hydrogen oxalate monohydrate NaHC2O4·H2O and NaDC2O4·D2O. Hydrogen bond studies XXXVI". The Journal of Chemical Physics. 54: 127–134. Bibcode:1971JChPh..54..127T. doi:10.1063/1.1674582.
- ↑ Delaplane, R. G.; Tellgren, R.; Olovsson, I. (1984). "Neutron diffraction study of sodium hydrogen oxalate monohydrate, NaHC2O4·H2O, at 120 K". Acta Crystallographica. C40 (11): 1800–1803. doi:10.1107/S0108270184009616.
- ↑ 3,0 3,1 "The decomposition of potassium hydrogen oxalate hemihydrate". Proceedings of the Royal Society of London. Series A, Containing Papers of a Mathematical and Physical Character. The Royal Society. 125 (799): 635–646. 1929. doi:10.1098/rspa.1929.0192. ISSN 0950-1207.
- ↑ Hamadène, M.; Kherfi, H.; Guehria-Laidoudi, A. (2006). "The polymeric anhydrous rubidium hydrogen oxalate". Acta Crystallographica. A62: s280. doi:10.1107/S0108767306094414.
- ↑ Diallo, Waly; Gueye, Ndongo; Crochet, Aurélien; Plasseraud, Laurent; Cattey, Hélène (11 April 2015). "Crystal structure of dimethylammonium hydrogen oxalate hemi(oxalic acid)". Acta Crystallographica Section E Crystallographic Communications. International Union of Crystallography (IUCr). 71 (5): 473–475. doi:10.1107/s2056989015005964. ISSN 2056-9890.
- ↑ Bosch, Enric; Moreno, Miquel; Lluch, José María (1 Januarie 1992). "The role of coupling in intramolecular proton transfer reactions. The hydrogen oxalate anion as an example". Canadian Journal of Chemistry. Canadian Science Publishing. 70 (1): 100–106. doi:10.1139/v92-017. ISSN 0008-4042.