بروم
| |||||||||||||||||||
| المظهر | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| غاز/سائل: أحمر - بني صلب: بريق معدني  البروم في الحالة السائلة | |||||||||||||||||||
| الخواص العامة | |||||||||||||||||||
| الاسم، العدد، الرمز | بروم، 35، Br | ||||||||||||||||||
| تصنيف العنصر | هالوجين | ||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 17، 4، p | ||||||||||||||||||
| الكتلة الذرية | 79.904 غ·مول−1 | ||||||||||||||||||
| توزيع إلكتروني | Ar]; 4s2 3d10 4p5] | ||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 7 (صورة) | ||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||
| الطور | سائل | ||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | (Br2، سائل) 3.1028 غ·سم−3 | ||||||||||||||||||
| نقطة الانصهار | 265.8 ك، -7.2 °س، 19 °ف | ||||||||||||||||||
| نقطة الغليان | 332.0 ك، 58.8 °س، 137.8 °ف | ||||||||||||||||||
| النقطة الحرجة | 588 ك، 10.34 ميغاباسكال | ||||||||||||||||||
| حرارة الانصهار | Br2) 10.571) كيلوجول·مول−1 | ||||||||||||||||||
| حرارة التبخر | Br2) 29.96) كيلوجول·مول−1 | ||||||||||||||||||
| السعة الحرارية (عند 25 °س) | (Br2) 75.69 جول·مول−1·كلفن−1 | ||||||||||||||||||
| ضغط البخار | |||||||||||||||||||
| |||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||
| أرقام الأكسدة | 7, 5, 4, 3, 1, -1 (أكاسيده حمضية قوية) | ||||||||||||||||||
| الكهرسلبية | 2.96 (مقياس باولنغ) | ||||||||||||||||||
| طاقات التأين | الأول: 1139.9 كيلوجول·مول−1 | ||||||||||||||||||
| الثاني: 2103 كيلوجول·مول−1 | |||||||||||||||||||
| الثالث: 3470 كيلوجول·مول−1 | |||||||||||||||||||
| نصف قطر ذري | 120 بيكومتر | ||||||||||||||||||
| نصف قطر تساهمي | 3±120 بيكومتر | ||||||||||||||||||
| نصف قطر فان دير فالس | 185 بيكومتر | ||||||||||||||||||
| خواص أخرى | |||||||||||||||||||
| البنية البلورية | نظام بلوري معيني قائم | ||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة[1] | ||||||||||||||||||
| مقاومة كهربائية | 7.8×1010أوم·متر (20 °س) | ||||||||||||||||||
| الناقلية الحرارية | 0.122 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||
| سرعة الصوت | ( °20 س) 206 متر/ثانية | ||||||||||||||||||
| رقم CAS | 7726-95-6 | ||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||
| المقالة الرئيسية: نظائر البروم | |||||||||||||||||||
| |||||||||||||||||||
البروم عنصرٌ كيميائي رمزه Br وعدده الذرّي 35، ويقع في الجدول الدوري للعناصر ضمن عناصر الدورة الرابعة وفي المرتبة الثالثة ضمن مجموعة الهالوجينات؛ وتأتي خواصّه وسطاً بين جاريه الكلور واليود. عُزلَ هذا العنصر بشكلٍ مستقلٍّ من قبل كيميائِيَّين اثنين، وهما كارل ياكوب لوفيغ[ملاحظة 1] (في سنة 1825) وأنطوان جيروم بالارد[ملاحظة 2] (في سنة 1826)؛ واشتُقَّت تسمية هذا العنصر من الكلمة الإغريقية βρῶμος (بروموس)، وذلك بمعنى «نتن»، إشارةً لرائحته الكريهة.
يوجد البروم في الظروف القياسية من الضغط ودرجة الحرارة على هيئة سائل مدخّن ذي لون بنّي محمرّ، وهو يعطي أدخنةً من نفس اللون. البروم والزئبق هما العنصران الوحيدان في الطبيعة اللذان يوجدان في الطور السائل عند درجة حرارة الغرفة. إنّ عنصر البروم نشيطٌ كيميائياً، ولذلك لا يوجد على شكله العنصري الحرّ في الطبيعة، ولكن على شكل مركّبات البروميدات؛ وتُسهّل الانحلالية المرتفعة لأيون البروميد من تجمّعه في مياه المحيطات؛ ومن السهل لذلك استحصال هذا العنصر تجارياً من البحيرات تحت سطح البحر. يشكّل البروم عدداً معتبراً من مركّبات البروم العضوية، والتي تتفكّك عند درجات حرارة مرتفعة لتعطي ذرّات البروم الحرّة، وهي عملية توقف تشكّل الجذور الكيميائية الحرّة في التفاعلات التسلسلية الكيميائية. تجعل هذه الظاهرة من مركّبات البروم العضوية مفيدةً في تثبيط الحرائق، وحوالي أكثر من النصف من كمّيّة البروم المنتجة عالمياً تُستخدَم لذلك الغرض. يحدث هذا التفكّك أيضاً عند تعرّض مركّبات البروم العضوية إلى الأشعّة فوق البنفسجية، ممّا يطلق ذرّات البروم الحرّة إلى الغلاف الجوّي مسبّباً نضوب الأوزون. لذلك فإنّ العديد من مركّبات البروم العضوية، مثل مبيد الآفات برومو الميثان، لم تعد في طور الاستخدام. من جهةٍ أخرى، لا تزال مركّبات البروم مستخدمةً في مجال سوائل الحفر وفي مجال أفلام التصوير الضوئي وفي صناعة الكيماويات العضوية.
يؤدّي تعرّض الإنسان إلى كمّيّات كبيرة من أملاح البروميد إلى حدوث تسمّم بالبروم.[ملاحظة 3] من جهةٍ أخرى، لمركّبات البروم العضوية دورٌ في بعض أنواع الحياة البحرية مثل الطحالب. كانت أيونات البروميد البسيطة مستخدمةً في مجال الأدوية، حيث أنّ لها تأثير مثبّط على الجهاز العصبي المركزي، ولذلك كانت تستخدم على شكل مهدّئات، قبل أن تُستبدَل بأدويةٍ ذات تأثير أقصر أمداً؛ لكن لا يزال لها تطبيق صغير في مجال مضادّات الاختلاج.
التاريخ
[عدل]
اكتُشِفَ عنصر البروم بشكلٍ مستقلٍّ من كيميائِيَّين اثنين، وهما كارل ياكوب لوفيغ[2] وأنطوان جيروم بالارد[3][4] وذلك في سنتي 1825 و1826، على الترتيب.[5] قبل ذلك في سنة 1824 كان يوستوس فون ليبيغ يقوم بتحاليل للمياه ووجد مادّة جديدة، ولكنه اعتقد أنها أحادي كلوريد اليود، ثمّ أقرّ لاحقاً بعدم صواب رأيه، وأشاد بعمل لوفيغ.[6][7] ففي سنة 1825 تمكّن لوفيغ من عزل البروم من عيّنات لنبعٍ للمياه المعدنية في مدينة باد كرويتسناخ، وهي مسقط رأسه في ألمانيا؛ حيث استخدم محلولاً من الملح المعدني مشبعاً بالكلور، ثم استخلص البروم باستخدام ثنائي إيثيل الإيثر. عدما قام بتبخير الإيثر، حصل على سائلٍ بنّيٍ من البروم؛ والذي أخذ عينة منه مثالاً على تجاربه الناجحة أثناء التقدّم على وظيفة في مختبرات ليوبولد غملين في جامعة هايدلبرغ. إلّا أنّه تأخّر في نشر نتائجه، إذ سبقه بالارد في ذلك.[8] ففي فترةٍ زمنيةٍ مقاربةٍ كان بالارد يجري تجاربه على رماد العشب البحري من مستنقعات ملحية في مدينة مونبلييه، مسقط رأسه في فرنسا. كان العشب البحري يُجمَع في تلك الآونة من أجل الحصول على اليود، ولكنّه كان حاوياً أيضاً على البروم، وعندما قَطَّر بالارد محلولاً من رماد الأعشاب البحرية المشبع بالكلور حصل على سائلٍ بنّيٍ من البروم. كانت خواص المادّة الجديدة الناتجة وسطاً بين الكلور واليود، ولذلك فإنّه حاول في البداية أن يُثبت أنّ المادّة هي أحادي كلوريد اليود، ولكنّه لم ينجح بذلك، فتيقّن أنّها لعنصرٍ جديد، وأسماه موريد muride، وذلك من الكلمة اللاتينية موريا muria، والتي تعني الأجاج.[4][9][10]
تحقّق الكيميائيّون لوي نيكولا فوكلان ولوي جاك تينار ولوي جوزيف غي ـ لوساك من صحّة تجربة بالارد، وعُرضَت النتائج في محاضرةٍ في الأكاديمية الفرنسية للعلوم، ثمّ نُشرت لاحقاً في مجلّة علمية اختصاصية.[ملاحظة 4][11] صرّح بالارد في منشوره أنّه غيّر اسم العنصر الجديد المكتَشف من «موريد» إلى «بروم»[ملاحظة 5] استجابةً لطلبٍ من أنغلادا[ملاحظة 6]؛ في حين أنّ هناك مصادر أخرى تزعم أنّ غي-لوسالك هو من قام باقتراح تسمية البروم نظراً للرائحة الكريهة لأبخرته.[12][13] تُشتَق تسمية البروم من الكلمة الإغريقية βρῶμος (بروموس) والتي تعني «نتن».[3][9][11]
لم تُنتَج كمّيّات كبيرة من البروم حتّى سنة 1858، وذلك عندما اكتًشفت توضّعات ملحية في مدينة شتاسفورت الألمانية، حيث كان البروم ناتجاً ثانوياً من عملية استحصال البوتاس.[14] لم تكن تطبيقات البروم واسعةً في البداية، إذ كانت له استخدامات طبّية ثانوية؛ إلّا أنّه لاحقاً، ومع تطوّر أساليب جديدة في التصوير الضوئي (داجيرية[ملاحظة 7]) بدأ الاهتمام به، إذ أبدى أفضليةً على أبخرة اليود من أجل تشكيل طبقة هاليد الفضة الحسّاسة للضوء.[15] في أواخر القرن التاسع عشر استُخدم مركّبا بروميد البوتاسيوم وبروميد الصوديوم ضمن المواد المضادّة للاختلاج والمهدّئة؛ لكنّها تدريجياً فقدت أهمّيتها في ذلك المجال، خاصّةً مع توفّر بدائل مثل هيدرات الكلورال، ولاحقاً مركّبات الباربتيورات.[16] دخلت مركّبات برومية مثل بروميد الزيليل المسيّل للدموع ضمن الأسلحة المستخدمة في أوائل الحرب العالمية الأولى.[17]
الوفرة الطبيعية والإنتاج
[عدل]البروم هو أقلّ وفرةً طبيعية في القشرة الأرضية من الفلور أو الكلور، حيث يوجد فيها مجرّد حوالي 2.5 جزء في المليون (ppm) من البروم، وخاصّةً على شكل أملاح البروميد. تحوي القباب الملحية طبيعياً على كمّيّات صغيرة من بروميد البوتاسيوم وبرومات البوتاسيوم. يتركّز وجود أملاح البروميد في المحيطات، وذلك نتيجةً لحدوث عمليات رشح طويلة الأمد، إذ يشكّل البروم فيها حوالي 65 جزءاً في المليون، وذلك يوافق نسبةً مقدارها ذرّة بروم لكلّ 660 ذرّة كلور. تتركّز أملاح البروميد أيضاً في البحيرات المالحة مثل البحر الميت، والذي يحوي على نسبة 0.4% من أيونات البروميد.[18]

يُستخرَج البروم من الأجاج والبحيرات المالحة بسبب توفّره فيها،[19] ممّا يجعل من تلك المصادر الطبيعية مجديةً اقتصادياً لاستخراج البروم.[20][21] ازداد الإنتاج العالمي من البروم منذ منتصف القرن العشرين، ففي سنة 1961 كان الإنتاج حينها حوالي 100 ألف طن، ووصل إلى حوالي خمسة أضعاف تلك الكمّيّة في أوائل القرن الحادي والعشرين، تعدّ الولايات المتّحدة والصين والأردن من الدول الرائدة في إنتاج البروم.[19]
يُحرّر البروم من أملاحه بإجراء عملية أكسدة باستخدام غاز الكلور، كما في التفاعل التالي من ملح بروميد البوتاسيوم:
تُجمّع أبخرة البروم بواسطة تيّار من البخار، ثم يُكثّف ويُنقّى. يُخزّن البروم في حاويات معدنية مبطـّنة بالرصاص، والتي يمكن أن تسع مئاتٍ من الأطنان، ويُنقَل بالوسائط المناسبة. تعدّ صناعة وإنتاج البروم صغيرةً بالمقارنة مع صناعة الكلور، وهو متوفّر مخبرياً.[22] بالرغم من ذلك بمكن أن يُستحصَل على البروم مخبرياً من مفاعلة بروميد الصوديوم مع ثنائي أكسيد المنغنيز في وسطٍ من حمض الكبريتيك على الساخن، لتجمع حينها أبخرة البروم وتُقطّر.
النظائر
[عدل]للبروم نظيرَين مستقرَّين وهما 79Br و81Br، والمتوفِّران طبيعياً بنسبةٍ مقدارها 51% و49%، على الترتيب. لكلا النظيرين دورانٌ مغزلي نووي مقداره 3/2، ولذلك يمكن أن يستخدما في الرنين المغناطيسي النووي، مع أفضلية للنظير 81Br. تفيد نسبة التوزّع المقاربة لِـ 1:1 لهذين النظيرين في الطبيعة في التعرّف على المركّبات الكيميائية الحاوية على البروم باستخدام تقنية مطيافية الكتلة.
إنّ نظائر البروم المتبقيّة هي جميعها نظائر مشعّة، وهي ذات عمر نصف قصير؛ وأهمّها النظير 80Br بنصف عمر مقداره 17.7 دقيقة، و80mBr بنصف عمر مقداره 4.421 ساعة والنظير 82Br بنصف عمر مقداره 35.28 ساعة. يمكن لهذه النظائر المشعّة أن تُنتَج من التنشيط النيوتروني للبروم الطبيعي.[23] أمّا أكثر نظائر البروم المشعّة استقراراً فهو النظير 77Br بنصف عمر مقداره 57.04 ساعة. إنّ نمط الاضمحلال للنظائر الأخفّ من 79Br هو التقاط إلكترون للتحوّل إلى نظائر السيلينيوم الموافقة؛ أمّا الأثقل من 81Br فهو اضمحلال بيتّا إلى نظائر الكريبتون الموافقة؛ في حين أنّ النظير 80Br يمكن أن يضمحلّ وفق هذَين النمطين إلى النظائر المستقرّة 80Se أو 80Kr.[24]
الخواص الفيزيائية
[عدل]
البروم هو العنصر الوحيد غير الفلزّي الذي يوجد في صورة سائلة في درجة حرارة الغرفة. وهو سائل ثقيل بنّي-محمر، يتبخّر بسهولة في ظروف الضغط والحرارة القياسية، وله بخار أحمر (لونه يشبه ثنائي أكسيد النيتروجين) وله رائحة بغيضة تشبه رائحة الكلور. تساعد التطايرية المرتفعة للبروم في إطلاق تلك الرائحة الواخزة النافذة الكريهة.[25]
تخضع جميع الهالوجينات الأربع المستقرّة لذات قوى تجاذب فان دير فالس، والتي تزداد قوّتها مع ازدياد عدد الإلكترونات بين جزيئات الهالوجين ثنائية الذرّة المتجانسة. بالتالي فإنّ نقطتي غليان وانصهار البروم تكون وسطاً بين تلك التي للكلور واليود. كما أنّه نتيجةً لازدياد الوزن الجزيئي للهالوجينات نزولاً في المجموعة فإنّ كثافة وحرارة الانصهار وحرارة التبخّر للبروم هي أيضاً ذات قيمة تقع بين تلك التي للكلور واليود؛ على الرغم من انخفاض قيم حرارة التبخّر على العموم بالنسبة للهالوجينات، ممّا يؤدّي إلى تطايرها، وذلك بسبب البنية الجزيئية ثنائية الذرّة.[23] يغمقّ لون الهالوجينات نزولاً في المجموعة، فالفلور غازٌ ذو لون أصفر شاحب جدّاً، أمّا لون غاز الكلور فهو أصفر مخضرّ، في حين أنّ البروم هو سائل متطاير ذو لون بنّي محمرّ، والذي ينصهر عند −7.2 °س ويغلي عند 58.8 °س؛ في حين أنّ اليود هو صلبٌ بنفسجيٌّ غامق إلى أسود. تحدث هذه النزعة في تغيّر درجة اللون إلى الدُكْنَة بسبب أنّ أطوال الموجة من الضوء المرئي الممتصّ من الهالوجين تزداد نزولاً في المجموعة؛[23] وذلك بدوره عائدٌ إلى الانتقالات الإلكترونية الداخلية بين أعلى مدار جزيئي مشغول غير رابط πg وأدنى مدار جزيئي غير مشغول غير رابط σu.[26] يبهُت لون البروم عند درجات حرارة منخفضة بشكل كبير، بحيث أنّ البروم الصلب عند درجة حرارة −195 °س يكون ذا لون أصفر شاحب.[23]
كما هو الحال مع الكلور واليود في الحالة الصلبة، يتبلور البروم الصلب وفق نظام بلّوري معيني قائم، وذلك ضمن شبكة بلّورية ذات طبقات من جزيئات Br2. تبلغ المسافة Br–Br في البروم الصلب مقدار 227 بيكومتر (وهي قريبة من مسافة طول الرابطة Br–Br في البروم الغازي والتي تبلغ 228 بيكومتر)؛ أمّا المسافة Br···Br بين الجزيئات فهي 331 بيكومتر داخل الطبقة نفسها، في حين أنّها تبلغ 399 بيكومتر بين الطبقات. تعني هذه البنية أنّ البروم هو موصل سيئ للكهرباء، حيث تبلغ قيمة الموصلية 5 × 10−13 −1Ω سم−1 وهي مقيسة بالقرب من نقطة الانصهار، ورغم ذلك فإنّها أفضل من قيمة موصلية الكلور التي يصعب عملياً قياسها من أصلها.[23] عند قيمة ضغط تبلغ 55 غيغاباسكال (GPa) فإنّ البروم يخضع لظاهرة تحوّل من عازل إلى فلزّ؛ أمّا عند ضغط مطبّق مقداره 75 غيغاباسكال فإنّ البنية البلّورية تتغيّر إلى نظام بلّوري معيني قائم مركزيّ الوجه؛ في حين أنّ تطبيق ضغط مقداره 100 غيغاباسكال يغيّر البنية البلورية إلى نظام بلّوري معيني قائم أحادي الذرّة مركزي الجسم.[27]
الخواص الكيميائية
[عدل]| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
البروم هو العنصر الثالث في الترتيب في مجموعة الهالوجينات، بالتالي فهو لا فلز، وهو يقع في المجموعة السابعة عشر (المجموعة السابعة وفق ترقيم المجموعات الرئيسية) في الجدول الدوري. للبروم خواصٌ كيميائية مشابهة لباقي الهالوجينات، وهي عادةً ما تميل لأن تكون وسطاً بين مجاوريه من العنصرين الأعلى (الكلور) والأسفل (اليود) منه. يحوي البروم مثل باقي الهالوجينات على سبعة إلكترون تكافؤ في الغلاف الإلكتروني الخارجي، بالتالي ينقصه إلكترون واحد ليحقّق قاعدة الثمانيات؛ ولذلك فإنّه من المؤكسدات القويّة، وهو نشيطٌ كيميائياً ويتفاعل مع العديد من العناصر الكيميائية الأخرى.[23] ترفع الرطوبة من تفاعلية البروم بشكلٍ كبير؛ ولا يقاوم البروم الرطب إلا عددٌ قليلٌ من الفلزّات، من ضمنها التانتالوم والبلاتين.[28]

وفقاً للاتجاهات الدورية فإنّ قيم الكهرسلبية للبروم هي واقعةٌ أيضاً بين تلك التي لقيم الكلور واليود: (F: 3.98, Cl: 3.16, Br: 2.96, I: 2.66)؛ بالتالي من حيث النشاط الكيميائي هو أضعف من الكلور وأقوى من اليود. بشكلٍ معاكس، فإنّ أيون البروميد هو مختزل أضعف من اليوديد، ولكنّه أقوى من الكلوريد.[23] يقع نصف القطر الذرّي للبروم أيضاً بين قيم الكلور واليود، وهذا ينسحب أيضاً على قيمة طاقة التأيّن الأولى، والألفة الإلكترونية، وكذلك على حرارة التفكّك لجزيء X2، ونصف القطر الأيوني، وعلى طول الرابطة X–X.[23] تميل طاقات الروابط لدى مركّبات البروم لأن تكون أقلّ من نظيرتها لدى مركّبات الكلور وأعلى من التي لدى مركّبات اليود؛ كما تظهر حقيقة أنّ البروم مؤكسدٌ أضعف من الكلور وأقوى من اليود من خلال قيم الكمون القياسي للزوج X2/X− حيث أنّها في الفلور F بمقدار +2.866 V وفي الكلور +1.395 V وفي البروم +1.087 V وفي اليود +0.615 V. تؤدّي البَرْوَمة إلى حالات أكسدة أعلى من اليَودَدة، ولكنّها أقلّ مِنْ أو مكافئة لحالات الأكسدة في الكَلْورة. يتفاعل البروم مع الهيدروجين، ولكن على العكس من الكلور عند درجات حرارة مرتفعة، ليشكّل غاز بروميد الهيدروجين:
على العموم يميل البروم إلى التفاعل مع مركّبات من النمط M–M أو M–H أو M–C ليشكّل البروميد الموافق M–Br.[26]
المركبات الكيميائية
[عدل]يشكّل البروم العديد من المركّبات الكيميائية بحالات أكسدة تتراوح بين -1 إلى +7؛ مع العلم أنّ حالة الأكسدة -1 هي الأكثر استقراراً وشيوعاً، ويشكّلها على هيئة أنيون بروميد. أمّا حالات الأكسدة المرتفعة فيشكلّها فقط في مركّبات تكون حاويةً على عناصر ذات كهرسلبية مرتفعة مثل الأكسجين أو الفلور أو الكلور، وفيها تكون حالات الأكسدة الفردية +1 و +3 و +5 و +7 أكثر استقراراً من الزوجية.
- البروميدات

إنّ أبسط مركّبات البروميدات هو مركّب بروميد الهيدروجين HBr، والذي يُحضَّر صناعياً من تفاعل الهيدروجين والبروم عند درجات حرارة مرتفعة بوجود حفّاز من البلاتين؛ أمّا مخبرياً فيمكن الحصول عليه من اختزال البروم بالفوسفور الأحمر.[29] بروميد الهيدروجين هو غازٌ حمضي، يسهل عليه التخلّي عن بروتون في الأوساط المائية مشكّلاً بذلك حمض الهيدروبروميك، وهو حمض قوي،[ملاحظة 8] وهو يشكّل العديد من الهيدرات HBr·nH2O، حيث تأخذ n القيم التالية 1 أو 2 أو 3 أو 4 أو 6.[30]
تعدّ البروميدات اللاعضوية من الناحية الكيميائية أملاحاً لحمض الهيدروبروميك، وهي متوفّرة لأغلب العناصر في الجدول الدوري، والاستثناءات هي بسبب الخمول الكيميائي كما هو الحال في الغازات الخاملة، أو بسبب عدم الاستقرار كما في العناصر الثقيلة بعد البزموت، أو بسبب الارتباط مع عناصر مرتفعة الكهرسلبية مثل الأكسجين أو الفلور أو الكلور أو النتروجين.[ملاحظة 9][31] عادةً ما يُستحصَل على البروميدات من تفاعل الفلزّ الموافق مع حمض الهيدروبروميك، ثمّ بإجراء تجفيفٍ عند درجات حرارة معتدلة، وبشكلٍ مثاليّ بوجود غاز بروميد الهيدروجين اللامائي. أمّا إذا كان البروميد غير ثابتاً تجاه الحلمهة فتُجرَى البَرْوَمة عند درجات حرارة مرتفعة باستخدام البروم أو بروميد الهيدروجين أو بروميدات اللافلزّات مثل ثلاثي بروميد البورون BBr3 أو رباعي بروميد الكربون CBr4، والتي تعدّ من العوامل المُبَرْوِمة الجيّدة؛ كما يمكن أيضاً الحصول على البروميدات الدنيا من اختزال البروميدات العليا باستخدام مختزل قويّ مثل الألومنيوم.[31]
إنّ أغلب بروميدات فلزّات العناصر قبل الانتقالية (المجموعات الأولى والثانية والثالثة بالإضافة إلى اللانثانيدات والأكتينيدات في حالات الأكسدة +2 و +3) هي مركّبات أيونية؛ في حين أنّ بروميدات اللافلزات فتكون فيها الرابطة الكيميائية ذات سمة تساهمية، وكذلك هو الحال مع بروميدات الفلزّات في حالات الأكسدة العليا. عادةً ما تكون البروميدات ذات انحلالية جيّدة في الماء، ومن الاستثناءات كلّ من بروميد الفضة وبروميد الرصاص الثنائي.[31]
- مركبات بين هالوجينية
للبروم عددٌ معتبرٌ من المركّبات بين الهالوجينية، وخاصّةً مع الفلور والكلور، والتي يمكن أن تكون فيها صيغ قياس اتحادية العناصر على الشكل XY أو XY3 أو XY5؛ كما تُعرَف مشتقّات أيونية موجبة (مثل الكاتيونات +BrF2 و+BrF4 و+BrF6) وسالبة (مثل الأنيونين -BrF2 و-BrCl2) لتلك المركّبات. كما تُعرَف أيضاً مركّبات هالوجينية زائفة للبروم، مثل مركّبات السيانيد BrCN والثيوسيانات BrSCN والأزيد BrN3.[32]
من الفلوريدات المعروفة للبروم كلّ من أحادي فلوريد البروم BrF وهو مركّب غير مستقرّ؛[32] وثلاثي فلوريد البروم BrF3 وهو سائل ذو لون أصفر فاتح ويتفاعل مع الماء وهو من المذيبات اللامائية الأيونية؛[33] وخماسي فلوريد البروم BrF5 وهو قادر على فَلورة السيليكات عند درجات حرارة تراوح 450 °س.[34] تعدّ جميع الفلوريدات المذكورة للبروم من المُفَلْورات والمؤكسدات القويّة. أمّا بالنسبة للكلوريدات فأشهرها هو أحادي كلوريد البروم BrCl، وهو مؤكسد قويّ ويتفكّك بشكلٍ عكوس إلى الكلور والبروم عند درجة حرارة الغرفة.[31] للبروم حالة أكسدة موجبة في الفلوريدات والبروميدات، بالمقابل فإنّ حالة أكسدة البروم تكون سالبة في يوديدات البروم، وأشهر تلك المركّبات هي أحادي بروميد اليود IBr وثلاثي بروميد اليود IBr3.
- الأكاسيد
هناك عددٌ جيّدٌ من المركّبات الكيميائية بين البروم والأكسجين، والتي توصَف أنّها أكاسيد للبروم، وتحمل الصيغة العامّة BrOx (حيث تتراوح قيمة x من 1–4) أو Br2Ox (حيث تتراوح قيمة x من 1–7). من تلك الأكاسيد مركّب أحادي أكسيد ثنائي البروم Br2O وهو مركّب غير مستقرّ، ويُستخدَم لأغراض البَرْوَمة عند درجات حرارة منخفضة،[35] وهو مؤكسدٌ جيّدٌ حيث أنّه مثلاً قادرٌ على أكسدة البنزين إلى 4،1-بنزوكينون في الأوساط القلوية، حيث يتشكّل أنيون الهيبوبروميت؛ وهناك أيضاً ثنائي أكسيد البروم BrO2، وهو مركّب غير مستقرّ، ويتفكّك إلى العناصر المكوّنة له بسهولة. بالمقابل، يمكن عزل الأكسيدَين ثلاثي أكسيد ثنائي البروم Br2O3 وخماسي أكسيد ثنائي البروم Br2O5 على شكل مركّبات صلبة.[28]
- الأحماض
هناك أربعة أحماض أكسجينية معروفة للبروم، وهي حمض الهيبوبروموز HOBr، وحمض البروموز HBrO2، وحمض البروميك HBrO3، وحمض البيربروميك HBrO4، وهي مدروسة بشكلٍ كافٍ، وتوجد على شكل محاليل فقط.
| حالة أكسدة ذرّة البروم |
البنية الجزيئية | اسم الحمض | اسم الملح الموافق |
|---|---|---|---|
| +I | حمض الهيبوبروموز (أو حمض تحت البروموز) HBrO |
هيبوبروميت (أو تحت بروميت) | |
| +III | حمض البروموز HBrO2 |
بروميت | |
| +V | حمض البروميك HBrO3 |
برومات | |
| +VII |  |
حمض البيربروميك (أو حمض فوق البروميك) HBrO4 |
بيربرومات (أو فوق برومات) |
عندما ينحلّ البروم في الماء يتشكّل أولاً أنيون البروميد والهيبوبروميت:[36]
ثم يتفكّك أيون الهيبوبروميت إلى البروميد والبرومات:
إنّ حمض البروموز غير مستقرّ، وأشهر أملاح البروميت الموافقة هي التي للسترونتيوم وللباريوم.[37] تعدّ أملاح البرومات أكثر أهمية، وهي أملاح حمض البروميك، وهي أملاح مستقرّة في الوَسَطين الحمضي والقاعدي. يمكن أن يحدث تفاعل تناسب مشترك بين البروميد والبرومات للحصول على عنصر البروم:[37]
تُحضَّر أملاح البيربرومات من أكسدة محاليل البرومات القلوية بغاز الفلور، ثم تُفصَل أملاح البرومات والفلوريد الفائضة على هيئة ملحَي برومات الفضة وفلوريد الكالسيوم، على الترتيب. يعدّ حمض البيربروميك وأملاح البيربرومات الموافقة من المؤكسدات القوية، حيث أنّ الرابطة Br–O فيها ضعيفة ويسهل فصمُها.[38]
- مركبات البروم العضوية

تعدّ الرابطة C–Br شائعةً جدّاً في الكيمياء العضوية، حيث يوجد عددٌ معتبرٌ من المشتقّات البروميدية للمركّبات العضوية.[39] بسبب فرق الكهرسلبية بين الكربون (2.55) والبروم (2.96) فإنّ الرابطة C–Br فقيرة بالإلكترونات، بالتالي فهي محبّة للإلكترونات (إلكتروفيلية). تُحضَّر مركّبات البروم العضوية عادةً من البَرْوَمة، سواءً من تفاعل إضافة إلى الرابطة الثنائية أو من تفاعل استبدال. يمكن أن يُستخدَم البروم لتفاعلات البرومة، إلّا أنّه بسبب سمّيته وتطايره فإنّه عادةً ما يستعان بكواشف مُبَرْومة، مثل N-بروموسكسينيميد. تتضمّن التفاعلات الرئيسية لمركّبات البروم العضوية كلّ من تفاعلات نزع بروميد الهيدروجين وتفاعل غرينيار وتفاعل ازدواج اختزالي وتفاعل استبدال نكليوفيلي.[39]
مقارنةً بباقي مركّبات الهالوجين العضوية فإنّ مركّبات البروم العضوية هي الأكثر انتشاراً في الطبيعة، فعلى سبيل المثال تطلق المحيطات حوالي 1–2 مليون طنّ من البروموفورم و56 ألف طنّ من برومو الميثان.[40] ولكن على الرغم من ذلك فإنّ تركيز أيون البروميد في مياه البحر هو حوالي 0.3% من تركيز الكلوريد؛ وذلك عائدٌ بسبب سهولة أكسدة أنيون البروميد إلى الكاتيون +Br؛ وهو إلكتروفيل قوي، ويقوم الإنزيم بروموبيروكسيداز بتحفيز ذلك التفاعل.[41]
يُستخدَم اختبار نوعي تقليدي من أجل الكشف عن مجموعة الألكينات الوظيفية، وذلك بأنّها تحوّل محاليل البروم المائية البنّية إلى عديمة اللون، حيث تشكّل مركب هالوهيدرين الموافق، بالإضافة إلى ثنائي برومو الألكانات الموافقة. يتشكّل في هذا التفاعل أيضاً ولفترة قصيرة جدّاً مركب وسطي من البرومونيوم؛ وذلك مثالٌ نمطيّ على تفاعل إضافة هالوجين.[42]
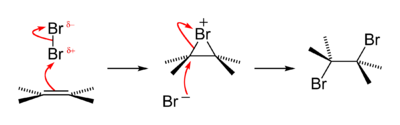
الكشف عن البروم
[عدل]يمكن الكشف عن أيون البروميد نوعياً باستخدام أسلوب الأكسدة بالكلور ثم الاستخلاص بالهكسان؛ ثم يتفاعل الكلور مع البروم ليعطي لونٌ أصفر محمرّ من أحادي كلوريد البروم.[43]
كما يمكن فعل الكشف النوعي أيضاً باستخدام تفاعل ترسيب على هيئة بروميد الفضة؛ أو بواسطة المعايرة بالفضة إمّا بطريقة مور أو فولهارد أو فايانز. يُستخدَم أسلوب استشراب التبادل الأيوني للكشف عن أيونات البروميد والبرومات؛ أمّا وفق أسلوب قياس الاستقطابية فتعطي البرومات عتبة مهبطية عند −1,78 V، وذلك مقابل قطب كالومل المشبع في وسط من 0.1 مول/الليتر من كلوريد البوتاسيوم؛ حيث يُختزَل أيون البرومات إلى البروميد.
الدور الحيوي
[عدل]
أشارت دراسةٌ في 2014 أنّ أيون البروميد هو عامل مرافق ضروريٌ من أجل الاصطناع الحيوي للكولاجين من النمط الرابع[ملاحظة 10]، ممّا يجعل البروم وفق تلك الدراسة عنصراً مغذّياً رئيسياً من أجل النمو البنائي عند الحيوانات.[44] بالرغم من ذلك، لا يوجد هناك توثيق على وجود دلائل واضحة تشير إلى حدوث أعراض أو متلازمات نتيجة عوز البروم.[45] في وظائف حيوية أخرى قد يكون البروم غير أساسياً، ولكنّه قد يكون من المفيد وجوده بديلاً عن الكلور؛ فعلى سبيل المثال يقوم بيروكسيداز الخلايا الحمضية، والذي يوفّر آلية قوية للقضاء على الطفيليات متعدّدة الخلايا وبعض أنواع البكتريا، بتفضيل البروميد على الكلوريد لذلك الغرض، مشكّلاً أيون هيبوبروميت في تلك العملية.[46] عادةً ما تكون α-هالو الإسترات في الاصطناع العضوي مركّبات ذات نشاط كبير؛ إلّا أنّ بعض الثديّيات قادرٌ على الاصطناع الحيوي لآثار من α-برومو إستر، وهو 2-أوكتيل 4-برومو-3-أوكسوبوتانوات، والذي عثر عليه في السائل الدماغي الشوكي لديها، وقد يكون لهذا المركّب دورٌ وظيفي في نوم حركة العين السريعة.[40]
تحوي الكائنات البحرية على عددٍ معتبرٍ من مركّبات البروم العضوية؛ وقد جرى تمييز حوالي 1600 مركّب مختلف فيها؛ وأكثرُها وفرةً هو مركّب برومو الميثان، والذي يُقدّر أنّ حوالي 56 ألف طن ينتج من الطحالب سنوياً.[40] يتألّف الزيت العطري المستخرج من نوع من أنواع الطحالب الحمراء [ملاحظة 11] بحوالي 80% من البروموفورم.[47] إنّ أغلب أمثال مركّبات البروم العضوية تلك الموجودة في البحر تُصطنَع حيوياً بوجود إنزيم بروموبيروكسيداز، والذي يحوي موقعه النشط على ذرّة فاناديوم.[48]
الاستخدامات
[عدل]لا توجد تطبيقات عملية كبيرة لعنصر البروم، ولكن لمركّباته الكيميائية استخدامات كثيرة؛ فلمركّبات البروم العضوية عددٌ كبير من التطبيقات في الصناعة، والتي يُحضّر بعضها عن طريق البروم مباشرةً، والبعض الآخر عن طريق بروميد الهيدروجين، والذي يُحضَّر صناعياً من حرق الهيدروجين في البروم.[49]
مثبطات اللهب والحريق
[عدل]
تمثّل مثبّطات اللهب المُبَرْوَمة واحدةً من المنتجات ذات التطبيق الواسع في السوق، وهي تمثّل أكبر تطبيق تجاري للبروم. عندما تحترق أيّ مادّة على مثبّط لهب مُبَرْوَم، ينطلق بالتالي حمض الهيدروبروميك، والذي يتدخّل في آلية التفاعل التسلسلي الجذري في تفاعل الأكسدة المسيطر في الحريق؛ حيث تتفاعل الجذور الحرّة للهيدروجين والأكسجين والهيدروكسيل ذات التفاعلية الكبيرة مع حمض الهيدروبروميك لتشكّل جذور حرّة من البروم ذات تفاعلية أقلّ من السابقة. يمكن لذرّات البروم أيضاً أن تتفاعل مباشرةً مع الجذور الحرّة الأخرى وذلك يساعد على إنهاء وتثبيط التفاعلات التسلسلية المميّزة لتفاعل الاحتراق.[50][51]
من أجل الحصول على اللدائن المُبَرْوَمة تضاف المركّبات الحاوية على البروم إلى تركيبة البوليمر أثناء عملية البلمرة. فعلى سبيل المثال يضاف أحادي القسيمة (المونومير) مثل بروميد الفاينيل أثناء إنتاج بوليميرات مختلفة مثل متعدد الإيثيلين وكلوريد متعدد الفاينيل ومتعدد البروبيلين؛ كما يمكن أن يضاف مركّب مُبرْوَم بشكل مرتفع مثل مركّب رباعي برومو بيسفينول A، والذي يضاف إلى البوليستر أو راتنجات الإيبوكسي، حيث يندمج ذلك المركب في بنية البوليمير؛ بالإضافة إلى مركّبات ثنائي الفينيل متعدد البروم[ملاحظة 12] ومركّبات إيثرات ثنائي الفينيل متعدد البروم.[ملاحظة 13] في بعض الأحيان يضاف المركّب الحاوي على البروم بعد عملية البلمرة، كما هو الحال في مركّب عشاري برومو ثنائي فينيل الإيثر، الذي يضاف إلى المنتج النهائي بعملية إضافية لاحقة.[52] في سنة 2000 كان حوالي 38% من البروم المنتَج عالمياً مستخدماً في مجال إنتاج مثبّطات اللهب المُبروَمة.[53]
هناك عددٌ من مركّبات برومو الميثان الغازية أو ذات تطايرية مرتفعة غير السامّة، والتي تتميّز بأنّها ذات قدرة كبيرة على تثبيط وتحجيم الحرائق، ولكن ضمن أماكن مغلقة مثل الغوّاصات والطائرات والمركبات الفضائية. ولكن من جهةٍ أخرى، فإنّ تلك المركّبات مرتفعة الثمن، إذ توقّف إنتاجها لأنّها عوامل تساعد في نضوب الأوزون؛ ولذلك فإنّها غير مستخدمة في مطافئ الحريق النمطية، واستخدامها محدود وينحصر في مجال الفضاء وبعض التطبيقات العسكرية، ومن تلك المركّبات كل من برومو كلورو الميثان CH2BrCl (هالون 1011)[ملاحظة 14] وبرومو كلورو ثنائي فلورو الميثان CBrClF2 (هالون 1211)[ملاحظة 15] وبرومو ثلاثي فلورو الميثان CBrF3 (هالون 1301).[ملاحظة 16][54]
تطبيقات أخرى
[عدل]يستخدَم بروميد الفضة إمّا لوحده أو بالتشارك مع كلوريد الفضة أو يوديد الفضة في تركيب المكوّنات الحسّاسة للضوء في مستحلب التصوير الفوتوغرافي.[22] كان مركب 2،1-ثنائي برومو الإيثان يضاف إلى وقود السيارات الحاوية عوامل الرصاص المضادّة لخبط المحرك، حيث كان يعمل على التقاط الرصاص مشكّلاً بروميد الرصاص، والذي كان يطلق من عادم السيارة. كان ذلك التطبيق يمثّل حوالي 77% من استخدامات البروم في أواسط ستينيات القرن العشرين في الولايات المتّحدة؛ إلّا أنّ ذلك التطبيق تناقص منذ سبعينيات القرن العشرين بسبب الضوابط البيئية.[55] كما كان برومو الميثان واسع الاستخدام في الماضي في تركيب مبيدات الآفات من أجل تعقيم التربة؛ إلّا أن تلك التطبيقات لم تعدْ مستخدمة، لأن مركّبات البروم العضوية هي عوامل مساعدة على نضوب الأوزون؛ بالتالي ووفق توصيات بروتوكول مونتريال توقّف الإنتاج العالمي من مبيدات البروم العضوية منذ سنة 2005، واستبدلت بمركّبات أخرى مثل فلوريد السلفوريل. من أجل المقارنة فإنّه في سنة 1991، وذلك قبل التطبيق الكامل لبروتوكول مونتريال، أنتج حوالي 35 ألف طن في مجال مكافحة الآفات.[56][57]
تتضمّن التطبيقات الأخرى لمركّبات البروم العضوية استخدامه في مجال سوائل الحفر ودخوله في تركيب الأصبغة (مثل أرجوان صور وأزرق البروموثيمول). يعدّ برومو الأسيتون من مسيّلات الدموع. يستخدم البروم ذاته وبعض مركّباته في مجال معالجة المياه، ولكن سمّيّة البروم تحدّ من انتشار هذا التطبيق. تعدّ بطارية زنك-بروم من بطاريات التدفق الهجينة المستخدمة من أجل تخزين ودعم الطاقة الكهربائية على الصعيد المنزلي والصناعي. في مجال علم الأدوية كانت مركّبات البروم اللاعضوية، وخاصّةً بروميد البوتاسيوم، مستخدمةً كمهدّئات في أواخر القرن التاسع عشر وأوائل القرن العشرين. في بعض الدول لا تزال البروميدات على شكل أملاح بسيطة كمضادّات للاختلاج في الطبّ البشري والبيطري. تُستخدَم بعض مركّبات عضوية للبروم المرخّصة في المجال الدوائي، من ضمنها الموسع الوعائي نيسرغولين[ملاحظة 17] والمهدّئ بروتيزولام[ملاحظة 18] ومضادّ السرطان بيبوبرومان[ملاحظة 19] والمعقّم ميربرومين[ملاحظة 20] ولكن بالمقارنة مع مركّبات الفلور العضوية المستخدمة في المجال الدوائي يعدّ استخدام مركّبات البروم في ذلك المجال قليل نسبياً. تُنتَج العديد من الأدوية على شكل بروميدات (أو على شكل هيدروبروميد)، ولكن في تلك الحالات يكون البروميد على شكل أيون مقابل غير ضارّ وليس له أهميّة حيوية.[39]
المخاطر
[عدل]| بروم | |
|---|---|
| المخاطر | |
| رمز الخطر وفق GHS |    |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H314, H330, H400 |
| بيانات وقائية وفق GHS | P260, P273, P280, P284, P305+351+338, P310[58] |
| NFPA 704 |
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
لكون البروم من المؤكسدات القويّة، فإنّه ينبغي أن يُعزَل عن أغلب المواد العضوية واللاعضوية.[59] ينبغي اتخاذ الحيطة والحذر عند التعامل مع البروم أو عند نقله؛ وعادةً ما يُنقَل البروم في حاويات مصنوعة من الفولاذ المبطـّن بالرصاص، والمدعّمة بهياكل معدنية متينة.[22]
لا يعدّ أنيون البروميد سامّاً بشكل كبير، وتبلغ الكمية الغذائية اليومية المرجعية منه 2-8 ميليغرام.[45] ولكنّ المستويات المرتفعة من البروميد توهن من أغشية العصبونات، ممّا يوهن من النقل العصبي، ممّا يؤدّي إلى مرض التسمّم بالبروم. يبلغ عمر النصف الحيوي للبروميد من 9 إلى 12 يوم، ممّا قد يؤدّي إلى التراكم في الجسد؛ بالتالي فإنّ جرعات من 0.5 إلى 1 غرام من البروميد يومياً قد تؤدّي إلى الإصابة بالتسمّم. تاريخياً كانت الجرعة العلاجية من البروميد من 3 إلى 5 غرام، وهذا ما يشرح انتشار التسمّم بالبروم المزمن في الماضي؛ على الرغم من أنّ الوفيات بذلك المرض نادرة.[60] تحدث الإصابة بمرض التسمّم بالبروم نتيجةً لأثر عصبي سمّي على الدماغ، ممّا يؤدّي إلى النعاس والذهان ونوبات والهذيان.[61]
لعنصر البروم تأثير سمّي على الإنسان وهو يسبب حروقاً كيميائية للجلد؛ كما يؤدّي استنشاق غاز البروم إلى تهييج في الجهاز التنفسي، ممّا يؤدّي إلى السعال والاختناق وضيق في التنفس؛ وفي حال استنشاق كمّيّات كبيرة قد يتسبّب في الوفاة. قد يؤدّي التعرّض المزمن إلى البروم إلى حدوث التهاب القصبات الحاد وتدهور في الصحّة. وضعت إدارة السلامة والصحّة المهنية في الولايات المتّحدة[ملاحظة 21] حدّ التعرّض المسموح[ملاحظة 22] من البروم في متوسّط زمني مُثَقّل[ملاحظة 23] بمقدار 0.1 جزء في المليون (ppm). وهو نفس المقدار الذي وضعه المعهد الوطني للسلامة والصحّة المهنية[ملاحظة 24] حدّاً للتعرّض الموصى به[ملاحظة 25] في متوسّط زمني مُثَقّل، كما وُضع حدّ التعرّض القصير بمقدار 0.3 جزء في المليون. أمّا المقدار الذي يسبّب خطورةً فوريةً للحياة أو الصحّة[ملاحظة 26] فهو 3 جزء في المليون.[62]
انظر أيضاً
[عدل]الهوامش
[عدل]- ^ Carl Jacob Löwig
- ^ Antoine Jérôme Balard
- ^ يُسمَّى أيضاً «مرض البرومية» Bromism
- ^ Annales de Chimie et Physique
- ^ Brôme
- ^ M. Anglada
- ^ daguerreotype
- ^ pKa = −9
- ^ يُسمّى ثلاثي بروميد النتروجين بروميداً رغم أنّه عملياً نتريد للبروم.
- ^ collagen IV
- ^ (الاسم العلمي: Asparagopsis taxiformis)
- ^ Polybrominated biphenyl (PBBs)
- ^ Polybrominated diphenyl ethers (PBDEs)
- ^ Halon 1011
- ^ Halon 1211
- ^ Halon 1301
- ^ Nicergoline
- ^ Brotizolam
- ^ Pipobroman
- ^ Merbromin
- ^ OSHA
- ^ PEL
- ^ time-weighted average (TWA)
- ^ NIOSH
- ^ REL
- ^ IDLH
المراجع
[عدل]فهرس المراجع
[عدل]- ^ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^
Löwig, Carl Jacob (1829). "Das Brom und seine chemischen Verhältnisse" [Bromine and its chemical relationships] (بالألمانية). Heidelberg: Carl Winter. Archived from the original on 2020-08-01.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(help) - ^ ا ب Vauquelin, L. N.; Thenard, L.J.; Gay-Lussac, J.L. (1826). "Rapport sur la Mémoire de M. Balard relatif à une nouvelle Substance" [Report on a memoir by Mr. Balard regarding a new substance]. Annales de Chimie et de Physique. 2nd series (بالفرنسية). 32: 382–384. Archived from the original on 2021-08-09.
- ^ ا ب Balard، Antoine (1826). "Memoir on a peculiar Substance contained in Sea Water". Annals of Philosophy. ج. 28: 381–387 and 411–426. مؤرشف من الأصل في 2021-07-17.
- ^ Weeks، Mary Elvira (1932). "The discovery of the elements: XVII. The halogen family". Journal of Chemical Education. ج. 9 ع. 11: 1915. Bibcode:1932JChEd...9.1915W. DOI:10.1021/ed009p1915.
- ^ W. H. Brock: Justus von Liebig: eine Biografie des großen Wissenschaftlers und Europäers. Vieweg Verlag, Braunschweig 1999.
- ^ J. Liebig: Über Laurent's Theorie der organischen Verbindungen. 1838, S. 554.
- ^ Landolt، Hans Heinrich (1890). "Nekrolog: Carl Löwig". Berichte der deutschen chemischen Gesellschaft. ج. 23 ع. 3: 905–909. DOI:10.1002/cber.18900230395. مؤرشف من الأصل في 2021-07-17.
- ^ ا ب "bromine". etymonline.com. مؤرشف من الأصل في 14 فبراير 2021. اطلع عليه بتاريخ 2021.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Perseus Digital Library Project. "Charlton T. Lewis, Charles Short, A Latin Dictionary". Perseus Digital Library Project. مؤرشف من الأصل في 14 أكتوبر 2021. اطلع عليه بتاريخ 2021.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ ا ب Balard, A. J. (1826). "Mémoire sur une substance particulière contenue dans l'eau de la mer" [Memoir on a peculiar substance contained in sea water]. Annales de Chimie et de Physique. 2nd series (بالفرنسية). 32: 337–381. Archived from the original on 2021-08-20.
- ^ A. J. Balard (1826) "Mémoire sur une substance particulière contenue dans l'eau de la mer" [Memoir on a peculiar substance contained in sea water], Annales de Chimie et de Physique, 2nd series, vol. 32, pp. 337–381 & "Rapport sur la Mémoire de M. Balard relatif à une nouvelle Substance" [Report on a memoir by Mr. Balard regarding a new substance], Annales de Chimie et de Physique, series 2, vol. 32, pp. 382–384.. نسخة محفوظة 2021-08-20 على موقع واي باك مشين.
- ^ Wisniak، Jaime (2004). "Antoine-Jerôme Balard. The discoverer of bromine" (PDF). Revista CENIC Ciencias Químicas. ج. 35 ع. 1: 35–40. مؤرشف من الأصل (PDF) في 2016-03-25.
- ^ Greenwood & Earnshaw 1997، صفحات 790.
- ^ Barger، M. Susan؛ White, William Blaine (2000). "Technological Practice of Daguerreotypy". The Daguerreotype: Nineteenth-century Technology and Modern Science. JHU Press. ص. 31–35. ISBN:978-0-8018-6458-2.
- ^ Shorter، Edward (1997). A History of Psychiatry: From the Era of the Asylum to the Age of Prozac. John Wiley and Sons. ص. 200. ISBN:978-0-471-24531-5. مؤرشف من الأصل في 2021-09-09.
- ^ Corey J Hilmas, Jeffery K Smart, Benjamin A Hill (2008). "Chapter 2: History of Chemical Warfare (pdf)" (PDF). Medical Aspects of Chemical Warfare. Borden Institute. ص. 12–14. مؤرشف من الأصل (PDF) في 2012-08-26. اطلع عليه بتاريخ 2021-07-17.
- ^ Greenwood & Earnshaw 1997، صفحات 795–796.
- ^ ا ب "Bromine Statistics and Information" (PDF). USGS. مؤرشف من الأصل (PDF) في 17 يوليو 2021. اطلع عليه بتاريخ 2021.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ Tallmadge، John A.؛ Butt, John B.؛ Solomon Herman J. (1964). "Minerals From Sea Salt". Ind. Eng. Chem. ج. 56 ع. 7: 44–65. DOI:10.1021/ie50655a008.
- ^ Al-Weshah، Radwan A. (2008). "The water balance of the Dead Sea: an integrated approach". Hydrological Processes. ج. 14 ع. 1: 145–154. Bibcode:2000HyPr...14..145A. DOI:10.1002/(SICI)1099-1085(200001)14:1<145::AID-HYP916>3.0.CO;2-N.
- ^ ا ب ج Greenwood & Earnshaw 1997، صفحات 798–799.
- ^ ا ب ج د ه و ز ح Greenwood & Earnshaw 1997، صفحات 800–804.
- ^ Audi، Georges؛ Bersillon، Olivier؛ Blachot، Jean؛ Wapstra، Aaldert Hendrik (2003)، "The NUBASE evaluation of nuclear and decay properties"، Nuclear Physics A، ج. 729، ص. 3–128، Bibcode:2003NuPhA.729....3A، DOI:10.1016/j.nuclphysa.2003.11.001، مؤرشف من الأصل في 2017-08-09
- ^ Greenwood & Earnshaw 1997، صفحات 793–794.
- ^ ا ب ج Greenwood & Earnshaw 1997، صفحات 804–809.
- ^ Duan, Defang؛ وآخرون (26 سبتمبر 2007). "Ab initio studies of solid bromine under high pressure". Physical Review B. ج. 76 ع. 10: 104113. Bibcode:2007PhRvB..76j4113D. DOI:10.1103/PhysRevB.76.104113.
- ^ ا ب A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 440.
- ^ Greenwood & Earnshaw 1997، صفحات 809–812.
- ^ Greenwood & Earnshaw 1997، صفحات 812–816.
- ^ ا ب ج د Greenwood & Earnshaw 1997، صفحات 821–824.
- ^ ا ب Greenwood & Earnshaw 1997، صفحات 824–828.
- ^ Greenwood & Earnshaw 1997، صفحات 828–831.
- ^ Greenwood & Earnshaw 1997، صفحات 832–835.
- ^ Perry، Dale L.؛ Phillips، Sidney L. (1995)، Handbook of Inorganic Compounds، CRC Press، ص. 74، ISBN:978-0-8493-8671-8، مؤرشف من الأصل في 2021-05-05، اطلع عليه بتاريخ 2015-08-25
- ^ Greenwood & Earnshaw 1997، صفحات 853–859.
- ^ ا ب Greenwood & Earnshaw 1997، صفحات 862–865.
- ^ Greenwood & Earnshaw 1997، صفحات 871–872.
- ^ ا ب ج Ioffe, David and Kampf, Arieh (2002) "Bromine, Organic Compounds" in Kirk-Othmer Encyclopedia of Chemical Technology. John Wiley & Sons. دُوِي: 10.1002/0471238961.0218151325150606.a01.
- ^ ا ب ج Gribble, Gordon W. (1999). "The diversity of naturally occurring organobromine compounds". Chemical Society Reviews. ج. 28 ع. 5: 335–346. DOI:10.1039/a900201d.
- ^ Carter-Franklin، Jayme N.؛ Butler، Alison (2004). "Vanadium Bromoperoxidase-Catalyzed Biosynthesis of Halogenated Marine Natural Products". Journal of the American Chemical Society. ج. 126 ع. 46: 15060–6. DOI:10.1021/ja047925p. PMID:15548002.
- ^ Clayden، Jonathan؛ Greeves، Nick؛ Warren، Stuart (2012). Organic Chemistry (ط. 2nd). Oxford University Press. ص. 427–9. ISBN:978-0-19-927029-3.
- ^ Dirk Häfner: Arbeitsbuch qualitative anorganische Analyse, 2. überarbeitete Auflage, Govi-Verlag, Eschborn 2003, S. 124, ISBN 3-7741-0997-4.
- ^ McCall AS؛ Cummings CF؛ Bhave G؛ Vanacore R؛ Page-McCaw A؛ وآخرون (2014). "Bromine Is an Essential Trace Element for Assembly of Collagen IV Scaffolds in Tissue Development and Architecture". Cell. ج. 157 ع. 6: 1380–92. DOI:10.1016/j.cell.2014.05.009. PMC:4144415. PMID:24906154.
- ^ ا ب Nielsen، Forrest H. (2000). "Possibly Essential Trace Elements". Clinical Nutrition of the Essential Trace Elements and Minerals. ص. 11–36. DOI:10.1007/978-1-59259-040-7_2. ISBN:978-1-61737-090-8.
- ^ Mayeno AN؛ Curran AJ؛ Roberts RL؛ Foote CS (1989). "Eosinophils preferentially use bromide to generate halogenating agents". J. Biol. Chem. ج. 264 ع. 10: 5660–8. DOI:10.1016/S0021-9258(18)83599-2. PMID:2538427.
- ^ Burreson، B. Jay؛ Moore, Richard E.؛ Roller, Peter P. (1976). "Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta)". Journal of Agricultural and Food Chemistry. ج. 24 ع. 4: 856–861. DOI:10.1021/jf60206a040.
- ^ Butler، Alison؛ Carter-Franklin, Jayme N. (2004). "The role of vanadium bromoperoxidase in the biosynthesis of halogenated marine natural products". Natural Product Reports. ج. 21 ع. 1: 180–8. DOI:10.1039/b302337k. PMID:15039842. S2CID:19115256.
- ^ Mills, Jack F. (2002). "Bromine". Bromine: in Ullmann's Encyclopedia of Chemical Technology. Weinheim: Wiley-VCH Verlag. DOI:10.1002/14356007.a04_391. ISBN:978-3527306732.
- ^ Green، Joseph (1996). "Mechanisms for Flame Retardancy and Smoke suppression – A Review". Journal of Fire Sciences. ج. 14 ع. 6: 426–442. DOI:10.1177/073490419601400602. S2CID:95145090.
- ^ Kaspersma، Jelle؛ Doumena, Cindy؛ Munrob Sheilaand؛ Prinsa, Anne-Marie (2002). "Fire retardant mechanism of aliphatic bromine compounds in polystyrene and polypropylene". Polymer Degradation and Stability. ج. 77 ع. 2: 325–331. DOI:10.1016/S0141-3910(02)00067-8.
- ^ Weil، Edward D.؛ Levchik, Sergei (2004). "A Review of Current Flame Retardant Systems for Epoxy Resins". Journal of Fire Sciences. ج. 22: 25–40. DOI:10.1177/0734904104038107. S2CID:95746728.
- ^ Linda S. Birnbaum, Daniele F. Staskal: Brominated Flame Retardants: Cause for Concern? In: Environ Health Perspect. 112, 2004, S. 9–17. doi:10.1289/ehp.6559.
- ^ Günter Siegemund, Werner Schwertfeger, Andrew Feiring, Bruce Smart, Fred Behr, Herward Vogel, Blaine McKusick "Fluorine Compounds, Organic" Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. دُوِي:10.1002/14356007.a11_349
- ^ Alaeea، Mehran؛ Ariasb, Pedro؛ Sjödinc, Andreas؛ Bergman, Åke (2003). "An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release". Environment International. ج. 29 ع. 6: 683–9. DOI:10.1016/S0160-4120(03)00121-1. PMID:12850087.
- ^ Messenger، Belinda؛ Braun, Adolf (2000). "Alternatives to Methyl Bromide for the Control of Soil-Borne Diseases and Pests in California" (PDF). Pest Management Analysis and Planning Program. مؤرشف من الأصل (PDF) في 2010-04-21. اطلع عليه بتاريخ 2008-11-17.
- ^ Decanio، Stephen J.؛ Norman, Catherine S. (2008). "Economics of the "Critical Use" of Methyl bromide under the Montreal Protocol". Contemporary Economic Policy. ج. 23 ع. 3: 376–393. DOI:10.1093/cep/byi028.
- ^ "Bromine 207888". مؤرشف من الأصل في 2021-07-25.
- ^ Science Lab.com. "Material Safety Data Sheet: Bromine MSDS". sciencelab.com. مؤرشف من الأصل في 2017-11-15. اطلع عليه بتاريخ 2016-10-27.
- ^ Olson، Kent R. (1 نوفمبر 2003). Poisoning & drug overdose (ط. 4th). Appleton & Lange. ص. 140–141. ISBN:978-0-8385-8172-8. مؤرشف من الأصل في 2021-07-05.
- ^ Galanter، Marc؛ Kleber، Herbert D. (1 يوليو 2008). The American Psychiatric Publishing Textbook of Substance Abuse Treatment (ط. 4th). United States of America: American Psychiatric Publishing Inc. ص. 217. ISBN:978-1-58562-276-4. مؤرشف من الأصل في 2021-04-27.
- ^ "NIOSH Pocket Guide to Chemical Hazards #0064". المعهد الوطني للسلامة والصحة المهنية (NIOSH).
المعلومات الكاملة للمراجع
[عدل]- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||












