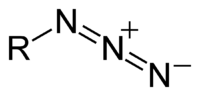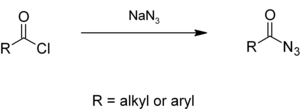أزيد
الأزيد[1] عبارة عن أنيون له الصيغة −N3، وهو ملح حمض الهيدرازويك. تكون للأزيد بنية خطية وهي متساوية الإلكترونات مع جزيئات ثنائي أكسيد الكربون وأكسيد النيتروس وذلك حسب نظرية رابطة التكافؤ. الأزيدات يمكن أن تشكل أملاح لا عضوية كما أنها في الوقت نفسه من المجموعات الوظيفية في الكيمياء العضوية.[2] تعد الأزيدات من الهالوجينات الزائفة.
التحضير
[عدل]يعد أزيد الصوديوم المصدر الرئيسي للأزيدات العضوية واللاعضوية على حد سواء. بالنسبة للأزيدات اللاعضوية مثل أزيد الرصاص فإن ذلك يحصل من خلال تفاعل تبادل بين نترات الرصاص وأزيد الصوديوم.
أما بالنسبة للأزيدات العضوية مثل أزيد الأريل فإن ملح الديازونيوم يفاعل مع أزيد الصوديوم، أو أزيد ثلاثي ميثيل السيليل، كما يمكن تحضيرها عن طريق تفاعل استبدال عطري شغوف بالنواة. بالنسبة للمركبات الأليفاتية المستبدلة بشكل ملائم فإن عملية استبدال شغوفة بالنوى تحدث من خلال التفاعل مع أزيد الصوديوم. فعلى سبيل المثال تعطي الكحولات الأليفاتية الأزيدات الموافقة عن طريق تفاعل ميتسونوبو Mitsunobu reaction بوجود حمض الهيدرازويك.[2]
يمكن للهيدرازينات أن تشكل الأزيدات وذلك من خلال التفاعل مع نتريت الصوديوم:[3] كما تحضر الأزيدات من خلال تفاعل دوت-ورمال Dutt-Wormall reaction التقليدي، [4] حيث يتفاعل ملح ديازونيوم مع السلفوناميد مشكلاً ملح ديازوأمينوسلفينات، والذي يتحلمه إلى الأزيد وحمض السلفينيك.[5]
تتفاعل مركبات كلوريد الأسيل الأريلية والأليفاتية مع أزيد الصوديوم في محاليل مائية لتعطي أسيل الأزيد، [6][7] والذي يعطي الإيزوسيانات من خلال إعادة ترتيب كورتيوس Curtius rearrangement:
التفاعلات
[عدل]الأزيدات اللاعضوية
[عدل]تتفكك أغلب أملاح الأزيدات اللاعضوية بعنف محررة غاز النيتروجين، كما يحدث مغ أزيد الصوديوم وأزيد الفضة:
- 2 NaN3 → 2 Na + 3 N2
- 2 AgN3 → 2 Ag + 3 N2
كما أنها تحرر حمض الهيدرازويك السام عند التماس مع الأحماض القوية:
- H+ + N3− → HN3

يمكن إجراء عملية التفكك بأسلوب ألطف وذلك بالتفاعل مع نتريت الصوديوم في وسط حمضي، وهي الطريقة للتخلص من الأزيدات قبل طرحها:[8]
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH
تتصرف الأزيدات كأنواع شغوفة بالنوى، حيث تدخل في تفاعلات استبدال شغوف بالنواة بالنسبة للمركبات الأليفاتية والعطرية. فهي مثلاً تتفاعل مع الإيبوكسيدات مسببة فتح الحلقة، كما يحدث لها تفاعل إضافة مترافقة شغوفة بالنواة Nucleophilic conjugate addition بشكل مشابه لإضافة مايكل حيث تعطي مركبات 4,1-الكربونيل غير المشبعة. .[2]
الأزيدات العضوية
[عدل]بما أن النيتروجين الطرفي للأزيدات شغوف بالنواة، لذلك فإن الأزيدات العضوية تدخل في العديد من التفاعلات العضوية، محررة غاز النيتروجين خلالها، وتظهر هذه الحالة في تفاعلات مثل تفاعل شتاودنغر وإعادة ترتيب كورتيوس أثناء تحضير مركبات γ-إيمينو-β-إينامينو الاسترات.[9]
يمكن اختزال الأزيدات إلى أمينات من خلال عملية تحلل هيدروجيني، [10] أو بالفسفينات مثل ثلاثي فينيل الفسفين في تفاعل شتاودنغر.
السلامة
[عدل]مركبات الأزديات سامة، حيث أنها تحجب وبشكل غير عكوس الإنزيم سيتوكروم-سي-أكسيداز Cytochrom-c-Oxidase في الخلايا أثناء سلسلة نقل الإلكترون في الخلايا. كما أن الأزيدات اللاعضوية متفجرة، وهي حساسة للحرارة وللصدمة.
المراجع
[عدل]- ^ محمد الصاوي محمد مبارك (2003)، معجم المصطلحات العلمية في الأحياء الدقيقة والعلوم المرتبطة بها (بالعربية والإنجليزية)، القاهرة: مكتبة أوزوريس، ص. 62، OCLC:4769982658، QID:Q126042864
- ^ ا ب ج S. Bräse, C. Gil, K. Knepper and V. Zimmermann (2005). "Organic Azides: An Exploding Diversity of a Unique Class of Compounds". Angewandte Chemie International Edition. ج. 44 ع. 33: 5188–5240. DOI:10.1002/anie.200400657. PMID:16100733.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ R. O. Lindsay and C. F. H. Allen(1955)."Phenyl azide". Org. Synth.; Coll. Vol. 3: 710.
- ^ Pavitra Kumar Dutt, Hugh Robinson Whitehead and Arthur Wormall (1921). "CCXLI.—The action of diazo-salts on aromatic sulphonamides. Part I". J. Chem. Soc., Trans. ج. 119: 2088. DOI:10.1039/CT9211902088.
- ^ Name Reactions: A Collection of Detailed Reaction Mechanisms By Jie Jack Li Published 2003 Springer ISBN 3-540-40203-9
- ^ C. F. H. Allen and Alan Bell."Undecyl isocyanate". Org. Synth.; Coll. Vol. 3: 846.
- ^ Jon Munch-Petersen(1963)."m-Nitrobenzazide". Org. Synth.; Coll. Vol. 4: 715.
- ^ Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council. (1995). Prudent practices in the laboratory: handling and disposal of chemicals. National Academy Press. مؤرشف من الأصل في 2015-03-25.
{{استشهاد بكتاب}}: الوسيط غير المعروف|المدينة=تم تجاهله يقترح استخدام|location=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Mangelinckx, S.; Van Vooren, P.; De Clerck, D.; Fülöp, F.; De Kimpea, N. (2006). "An efficient synthesis of γ-imino- and γ-amino-β-enamino esters". Arkivoc ع. iii: 202–209. مؤرشف من الأصل في 2011-06-06.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Amine synthesis by azide reduction نسخة محفوظة 21 أكتوبر 2017 على موقع واي باك مشين.