بايرازين
| بايرازين | |
|---|---|
 |
 |
 |
 |
| الاسم النظامي (IUPAC) | |
البايرازين |
|
| أسماء أخرى | |
1,4-دايازابينزين، p-دايازين، 1,4-دايازين، باراديازين، بايازين، UN 1325 |
|
| المعرفات | |
| رقم CAS | 290-37-9 |
| بوب كيم (PubChem) | 9261 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| الصيغة الجزيئية | C4H4N2 |
| الكتلة المولية | 80.09 غرام\مول |
| المظهر | بلورات بيضاء |
| الكثافة | 1.031 غرام\سم3 |
| نقطة الانصهار | 52 °س، 325 °ك، 126 °ف |
| نقطة الغليان | 115 °س، 388 °ك، 239 °ف |
| الذوبانية في الماء | قابل للذوبان |
| حموضة (pKa) | 0.37[1] (protonated pyrazine) |
| المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| NFPA 704 |
|
| نقطة الوميض | 55 °C c.c. |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
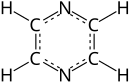
بايرازين (أو بيرازين) هو مركب حلقي غير متجانس، عضوي عطري، وصيغته الكيميائية هي C4H4N2؛ وهو ينتمي إلى مجموعة مركبات الديازينات.
والبايرازين جزيء متناظر، مجموعة التناظر له هي D2h. تشتهر مشتقاته كالفينازين بسبب نشاطها كمضادات حيوية، ومضادات للورم ومدرة للبول. يعتبر تواجد البايرازين في الطبيعة أقل من تواجد البيريدين والبايريدازين وبيريميدين.
التركيب
[عدل]توجد طرق عديدة لتخليق المركب ومشتقاته عضوياً؛ وتعتبر بعض هذه الطرق من بين أقدم طرق التخليق العضوي التي لا تزال قيد الاستخدام.
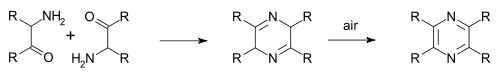
في «مركب بايرازين ستايديل-روغميير» (1876)، يتفاعل غاز سي إن مع الأمونياك وينتج أمينو كيتون، ثم يتكثف ويتأكسد ليصبح بايرازين.[2] أما «مركب بايرازين غاتكنخت» (1879) فيرتكز على مبدأ التكثيف الذاتي، لكنه يختلف في طريقة تخليق كيتوأمين ألفا.[3][4]
مركب غاستالدي (1921) هو تباين آخر[5][6]
طالع أيضاً
[عدل]- بيريميدين، وهو نظير مع ذرة النيتروجين الثانية في الموقع الثالث
- باريدازين، نظير مع ذرة النيتروجين الثانية في الموقع الثاني
- بيريدين، نظير بذرة نيتروجين واحدة فقط
- بنزين (حلقة)، نظير دون ذرات النيتروجين
- حلقة عطرية بسيطة
روابط خارجية
[عدل]المراجع
[عدل]- ^ Brown, H.C., et al., in Baude, E.A. and Nachod, F.C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- ^ Ueber die Einwirkung von Ammoniak auf Chloracetylbenzol (p 563-564) W. Staedel, L. Rügheimer دُوِي:10.1002/cber.187600901174 Berichte der deutschen chemischen Gesellschaft Volume 9, Issue 1 , Pages 563 - 564 1876
- ^ Mittheilungen Ueber Nitrosoäthylmethylketon H. Gutknecht Berichte der deutschen chemischen Gesellschaft Volume 12, Issue 2 , Pages 2290 - 2292 1879 دُوِي:10.1002/cber.187901202284
- ^ Heterocyclic chemistry T.L. Gilchrist ISBN 0-582-01421-2
- ^ G. Gastaldi, Gazz. Chim. Ital. 51, (1921) 233
- ^ الأمينات: مركباتها، خصائصها، وتطبيقاتها ، ستيفن لورنس، 2004، مطبعة جامعة كامبردج ISBN 0-521-78284-8
بايرازين