تسمم التولوين
| تسمم التولوين | |
|---|---|
| معلومات عامة | |
| الاختصاص | طب الطوارئ |
| من أنواع | خطر كيميائي، والتعرض لكيماويات خطرة |
| الأسباب | |
| الأسباب | تسمم، وتولوين[1] |
| المظهر السريري | |
| الأعراض | تهيج العين [1]، واعتلال الكلية[1]، وتسمم الكبد[1]، والتهاب الجلد[1]، ومذل[1]، وأرق[1]، وإعياء عضلي[1]، وقلق[1]، وإفراز الدموع [1]، وتوسع الحدقة[1]، وصداع[1]، ودوخة[1]، وابتهاج[1]، وتشوش ذهني[1]، وإعياء[1]، وتهيج أنفي [1] |
| تعديل مصدري - تعديل | |
يشير مصطلح التسمم بالتولوين إلى الآثار الضارة للتولوين على الجسم
الأيض في الإنسان
[عدل]في حين يتم إخراجه كمية كبيرة من التولوين (25٪ -40٪) عن طريق الرئتين دون تغيير، يتم أيض نسبة أكبر وإخراجها عبر مسارات أخرى. الطريق الرئيسي لأيض التولوين هو عن طريق إضافة الهيدروكسيل وتحويله إلى كحول بنزيلي من قبل أعضاء فصيلة سيتوكروم بي 450.[2] يلعب 5 أعضاء من فصيلة سيتوكروم بي 450 دورًا مهمًا في عملية أيض التولوين، وهم CYP1A2، CYP2B6، CYP2E1، CYP2C8، و CYP1A1.[3] ويبدو أن الأربعة الأولى تشارك في إضافة مجموعات الهيدروكسيل إلى التولوين وتحويله إلى كحول بنزيلي. كما يبدو أن CYP2E1 هو الإنزيم الأساسي في إضافة مجموعات الهيدروكسيل إلى التولوين، وهو ما يمثل حوالي 44٪ من عملية أيض التولوين؛[2] ومع ذلك، يوجد قدر كبير من التباين العرقي، ففي السكان الفنلنديين على سبيل المثال يعتبر CYP2B6هو الإنزيم الأساسي لتلك العملية. ويحفز CYP2E1 تشكيل الكحول البنزيلي و p- كريسول، [2][3] في حين ينتج CYP2B6 كمية قليلة نسبيًا من p- كريسول.[3]
ويعتقد أن استقلاب الكحول البنزيلي إلى البنزالديهايد في البشر يتم بواسطة سيتوكروم بي 450 بدلًا من نازعة هيدروجين الكحول؛[4] ومع ذلك، لا ينتشر هذا الاعتقاد عالميًا.[5][6] يُستقلب البينزالدهيد بدوره إلى حمض البنزويك، في المقام الأول عن طريق نازعة الألدهيد-2 في الميتوكوندريا، في حين يتم استقلاب نسبة صغيرة فقط من نازعة الألدهيد-1 الخلوية.[6]
يتم استقلاب حمض البنزويك إما إلى بنزويل غلوكورونيد أو حمض الهيبوريك. .[5][7] وينتج بنزويل غلوكورونيد من تفاعل حمض البنزويك مع حمض الغلوكورونيك، والذي يمثل 10-20٪ من التخلص من حمض البنزويك. يُعرف حمض الهيبوريك أيضًا باسم بنزويل غليسين ويتم إنتاجه من حمض البنزويك في خطوتين:
- تحويل حمض البنزويك إلى بنزويل مساعد الإنزيم أ من قبل إنزيم مخلق البنزويل مساعد الإنزيم أ.
- ثم يتم تحويل بنزويل- مساعد الإنزيم أ إلى حمض الهيبوريك بواسطة بنزويل مساعد الإنزيم أ: ناقل مجموعة الأسيل على موقع النيتروجين N.[8]
يعتبر حمض الهيبوريك هو المستقلب البولي الرئيسي للتولوين.[5]

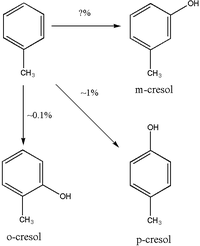
يعتبر إضافة مجموعة الهيدروكسيل إلى حلقة التولوين وتحويله إلى الكريسولات هو مسار فرعي في عملية التمثيل الأيضي للتولوين. تُفرز معظم الكريسولات دون تغيير في البول. ومع ذلك، تُفرز بعضًا من p- كريسول و o- كريسول كمواد مرتبطة. أظهرت الدراسات التي أجريت على الفئران أن p-كريسول يرتبط مع الغلوكورونيد لإنتاج p- كريسيل غلوكورونيد، على الرغم من كون هذا غير قابل للتطبيق على البشر.[9] كما تُفرز o-كريسول في الغالب في البول دون تغيير أو كمواد مرتبطة بالغلوكورونيد أو الكبريتات.[10] يبدو أن هناك بعض الخلاف حول ما إذا كان يتم إنتاج M-كريسول كمستقلب من التولوين أم لا.[5][11]
التأثيرات البيئية
[عدل]عند التعرض للتولوين، فإن الشخص لا يتعرض له وحده، يل يكون هناك تعرض متزامن لعدة مواد كيميائية أخرى.[5] في كثير من الأحيان يحدث التعرض التولوين بالتزامن مع البنزين، وحيث أن كلا المركبين يسلكان نفس المسار الأيضي من قبل نفس الإنزيمات إلى حدٍ ما، فإن التركيزات النسبية لكل منهما تحدد معدل القضاء عليها.[5] وبطبيعة الحال، كلما استغرق الأمر وقتًا أطول للتخلص من التولوين، كلما زاد ضرره.
تحدد عادات التدخين والشرب للمعرضين للتولوين طريقة التخلص من التولوين جزئيًا. وقد أظهرت الدراسات أن حتى كمية متواضعة من استهلاك الإيثانول الحاد يمكن أن تقلل بشكل كبير من التوزيع البدني أو تخلص الجسم من كمية التولوين في الدم مما يؤدي إلى زيادة تعرض الأنسجة للتولوين.[12] وقد أظهرت دراسات أخرى أن استهلاك الإيثانول المزمن يمكن أن يعزز أيض التولوين عن طريق تحفيز إنزيم CYP2E1.[13] كما تبين أن التدخين يعزز من معدل تخلص الجسم من التولوين، وربما يكون هذا نتيجةً لتحفيز إنزيمات الأيض.[14]
يمكن أن يؤثرالنظام الغذائي أيضًا على تخلص الجسم من التولوين. تبين أن النظام الغذائي منخفض الكربوهيدرات والصيام يحفزان إنزيم CYP2E1 ونتيجةً لذلك زيادة معدل أيض التولوين.[13] قد يؤدي اتباع نظام غذائي منخفض البروتين إلى انخفاض إجمالي محتوى سيتوكروم بي 450 وبالتالي تقليل معدل تخلص الجسم من التولوين.[13]
قياس التعرض للتولوين
[عدل]استخدم حمض الهيبوريك منذ فترة طويلة كمؤشر للتعرض للتولوين؛[15] ومع ذلك، توجد بعض الشكوك حول صلاحيته.[16] ينتج البشر كميات ملحوظة من حمض الهيبوريك، والتي تختلف بين الأفراد وفي الفرد الواحد طبقًا لعوامل عدة مثل النظام الغذائي، والعلاج الطبي، واستهلاك الكحول، وما إلى ذلك.[16] يشيرهذا إلى أن حمض الهيبوريك قد يكون مؤشرًا لا يمكن الاعتماد عليه لقياس التعرض للتولوين.[16][17] وقد اقترح أن حمض الهيبوريك المفرز في البول، المؤشر التقليدي لقياس التعرض للتولوين ليس حساسًا بما فيه الكفاية لفصل المتعرضين للتولوين عن غير المتعرضين.[18] وقد أدى ذلك إلى التحقيق في نواتج الأيض الأخرى كعلامات للتعرض للتولوين.[17]
قد يكون كريسول- O المُفرز في البول أكثر موثوقية لقياس التعرض للتولوين لأنه، على عكس حمض الهيبوريك، لم يتم العثور عليه في مستويات ملحوظة في الغير مُعرضين.[17] قد يكون كريسول-o مؤشرًا أقل حساسية لقياس التعرض للتولوين من حمض الهيبوريك. [18] كما أن إفراز الكريسول لا يمكن الاعتماد عليه لقياس التعرض للتولوين لأن o-كريسول يشكل أقل من 1٪ من مجموع التولوين المُستخرج من الجسم.[15]
حمض البنزيل ميركابتوريك، وهو ناتج أيضي غير أساسي للتولوين، ينتج من البنزالدهايد.[19] في السنوات الأخيرة، قد اقترحت الدراسات استخدام حمض البنزيل مركابتوريك البولية كأفضل علامة لقياس التعرض للتولوين، لأنه لم يتم الكشف عنه في غير المعرضين؛ كما أنه أكثر حساسية من حامض الهيبوريك عند التركيزات المنخفضة، كما أنه لا يتأثر بالأكل أو الشرب. يمكن الكشف عن التعرض للتولوين في تركيزات منخفضة تصل إلى حوالي 15 جزء في المليون باستخدام حمض البنزيل ميركابتوريك، كما يظهر علاقة كمية أفضل مع التولوين من حمض الهيبوريك أو كريسول- o.[20][21]
آثار التعرض على المدى الطويل
[عدل]غالبًا ما ترتبط الآثار السلوكية السلبية الخطيرة بالتعرض المهني المزمن[22] وتعاطي التولوين المرتبط بالاستنشاق المتعمد للمذيبات.[23] وغالبًا ما يرتبط التعرض التولويني الطويل الأمد بآثار مثل: متلازمة الأمراض الحسية والعضوية؛[24] اضطرابات الجهد البصري المُستحث؛[24] اعتلال الأعصاب المحيطية ، والمخيخ، والاضطرابات المعرفية، والخلل الهرمي؛[23][24]والضمور البصري؛ وآفات الدماغ.[23]
قد تسبب الآثار السمية العصبية للاستخدام طويل الأمد (على وجه الخصوص الانسحاب المتكرر) للتولوين هزات وضعية عن طريق إعادة تنظيم مستقبلات جابا داخل القشرة المخيخية.[23] العلاج باستخدام منبهات حمض الغاما-أمينوبيوتيريك مثل البنزوديازيبينات يزيل بعض آثار الرعاش والترنح الناجمة عن التسمم بالتولوين.[23] البديل الطبي لهذا العلاج الدوائي هو عملية فغر المهاد الجراحية.[23] لا يبدو أن الرعاش المرتبط بإساءة استعمال التولوين عرض عابر، ولكنه عرض لا رجعة فيه وتدريجي يستمر حتى بعد توقف تعاطي المذيبات.[23]
وهناك بعض الأدلة على أن التعرض المنخفض للتولوين قد يسبب اختلالا في تمايز وانقسام الخلايا النجمية.[25] ولا يبدو أن يشكل هذا خطرًا كبيرًا على البالغين؛ ومع ذلك، فإن تعرض النساء الحوامل للتولوين خلال المراحل الحرجة من تطور الجنين يمكن أن يسبب خللًا خطيرًا في تطوير الخلايا العصبية.[25]
مراجع
[عدل]- ^ ا ب http://www.cdc.gov/niosh/npg/npgd0619.html.
{{استشهاد ويب}}:|url=بحاجة لعنوان (مساعدة) والوسيط|title=غير موجود أو فارغ (من ويكي بيانات) (مساعدة) - ^ ا ب ج Shou، M؛ Lu T؛ Krausz KW؛ Sai Y؛ Yang T؛ Korzekwa KR؛ Gonzalez FJ؛ Gelboin HV (14 أبريل 2000). "Use of inhibitory monoclonal antibodies to assess the contribution of cytochromes P450 to human drug metabolism". European Journal of Pharmacology. ج. 394 ع. 2–3: 199–209. DOI:10.1016/S0014-2999(00)00079-0. PMID:10771285.
- ^ ا ب ج Nakajima، T؛ Wang RS؛ Elovaara E؛ Gonzalez FJ؛ Gelboin HV؛ Raunio H؛ Pelkonen O؛ Vainio H؛ Aoyama T (7 فبراير 1997). "Toluene metabolism by cDNA-expressed human hepatic cytochrome P450". Biochemical Pharmacology. ج. 53 ع. 3: 271–7. DOI:10.1016/S0006-2952(96)00652-1. PMID:9065730.
- ^ Chapman، DE؛ Moore TJ؛ Michener SR؛ Powis G (نوفمبر–ديسمبر 1990). "Metabolism and covalent binding of [14C]toluene by human and rat liver microsomal fractions and liver slices". Drug Metabolism and Disposition. ج. 18 ع. 6: 929–36. PMID:1981539.
- ^ ا ب ج د ه و وكالة تسجيل المواد السامة والأمراض (September 2000). Toxicological profile for toluene. أتلانتا (جورجيا)، جورجيا (ولاية أمريكية): Agency for Toxic Substances and Disease Registry. OCLC:47129207. مؤرشف من الأصل في 2017-04-12. اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - ^ ا ب Kawamoto، T؛ Matsuno K؛ Kodama Y؛ Murata K؛ Matsuda S (سبتمبر–أكتوبر 1994). "ALDH2 polymorphism and biological monitoring of toluene". Archives of Environmental Health. ج. 49 ع. 5: 332–6. DOI:10.1080/00039896.1994.9954983. PMID:7944563.
- ^ منظمة الصحة العالمية (1985). Environmental Health Criteria No. 52 (Toluene). جنيف: World Health Organization. ISBN:92-4-154192-X. مؤرشف من الأصل في 2019-05-31.
- ^ Gregus، Z؛ Fekete T؛ Halászi E؛ Klaassen CD (يونيو 1996). "Lipoic acid impairs glycine conjugation of benzoic acid and renal excretion of benzoylglycine". Drug Metabolism and Disposition. ج. 24 ع. 6: 682–8. PMID:8781786.
- ^ Lesaffer G، De Smet R، D'Heuvaert T، Belpaire FM، Lameire N، Vanholder R (أكتوبر 2003). "Comparative kinetics of the uremic toxin p-cresol versus creatinine in rats with and without renal failure". Kidney International. ج. 64 ع. 4: 1365–73. DOI:10.1046/j.1523-1755.2003.00228.x. PMID:12969155.
- ^ Wilkins-Haug، L (فبراير 1997). "Teratogen update: toluene". علم المسوخ. ج. 55 ع. 2: 145–51. DOI:10.1002/(SICI)1096-9926(199702)55:2<145::AID-TERA5>3.0.CO;2-2. PMID:9143096.
- ^ Tassaneeyakul، W؛ Birkett DJ؛ Edwards JW؛ Veronese ME؛ Tassaneeyakul W؛ Tukey RH؛ Miners JO (يناير 1996). "Human cytochrome P450 isoform specificity in the regioselective metabolism of toluene and o-, m- and p-xylene". Journal of Pharmacology and Experimental Therapeutics. ج. 276 ع. 1: 101–8. PMID:8558417.
- ^ Wallen، M؛ Näslund PH؛ Nordqvist MB (ديسمبر 1984). "The effects of ethanol on the kinetics of toluene in man". Toxicology and Applied Pharmacology. ج. 76 ع. 3: 414–9. DOI:10.1016/0041-008X(84)90345-4. PMID:6506069.
- ^ ا ب ج Nakajima، T؛ Wang RS؛ Murayama N (1993). "Immunochemical assessment of the influence of nutritional, physiological and environmental factors on the metabolism of toluene". International Archives of Occupational and Environmental Health. ج. 65 ع. 1 Supplement: S127–30. DOI:10.1007/BF00381323. PMID:8406908.
- ^ Hjelm، EW؛ Näslund PH؛ Wallén M (1988). "Influence of cigarette smoking on the toxicokinetics of toluene in humans". مجلة علم السموم والصحة البيئية. ج. 25 ع. 2: 155–63. DOI:10.1080/15287398809531197. PMID:3172270.
- ^ ا ب Duydu، Y؛ Süzen S؛ Erdem N؛ Uysal H؛ Vural N (يوليو 1999). "Validation of hippuric acid as a biomarker of toluene exposure". Bulletin of Environmental Contamination and Toxicology. ج. 63 ع. 1: 1–8. DOI:10.1007/s001289900940. PMID:10423476.
- ^ ا ب ج Angerer، J (1985). "Occupational chronic exposure to organic solvents. XII. O-cresol excretion after toluene exposure". International Archives of Occupational and Environmental Health. ج. 56 ع. 4: 323–8. DOI:10.1007/BF00405273. PMID:4066055.
- ^ ا ب ج Angerer، J؛ Krämer A (1997). "Occupational chronic exposure to organic solvents. XVI. Ambient and biological monitoring of workers exposed to toluene". International Archives of Occupational and Environmental Health. ج. 69 ع. 2: 91–6. DOI:10.1007/s004200050121. PMID:9001914.
- ^ Inoue، O؛ Seiji K؛ Watanabe T؛ Nakatsuka H؛ Jin C؛ Liu SJ؛ Ikeda M (1993). "Effects of smoking and drinking on excretion of hippuric acid among toluene-exposed workers". International Archives of Occupational and Environmental Health. ج. 64 ع. 6: 425–30. DOI:10.1007/BF00517948. PMID:8458658.
- ^ Laham، S؛ Potvin M (1987). "Biological conversion of benzaldehyde to benzylmercapturic acid in the Sprague-Dawley rat". Drug and Chemical Toxicology. ج. 10 ع. 3–4: 209–25. DOI:10.3109/01480548709042983. PMID:3428183.
- ^ Inoue، O؛ Kanno E؛ Kasai K؛ Ukai H؛ Okamoto S؛ Ikeda M (1 مارس 2004). "Benzylmercapturic acid is superior to hippuric acid and o-cresol as a urinary marker of occupational exposure to toluene". Toxicology Letters. ج. 147 ع. 2: 177–86. DOI:10.1016/j.toxlet.2003.11.003. PMID:14757321.
- ^ Inoue، O؛ Kanno E؛ Yusa T؛ Kakizaki M؛ Ukai H؛ Okamoto S؛ Higashikawa K؛ Ikeda M (يونيو 2002). "Urinary benzylmercapturic acid as a marker of occupational exposure to toluene". International Archives of Occupational and Environmental Health. ج. 75 ع. 5: 341–7. DOI:10.1007/s00420-002-0322-8. PMID:11981673.
- ^ Feldman RG, Ratner MH, Ptak T. Chronic toxic encephalopathy in a painter exposed to mixed solvents. Environ Health Perspect. 1999 May; 107(5):417-22. PMID 10210698.
- ^ ا ب ج د ه و ز Miyagi، Y؛ Shima F؛ Ishido K؛ Yasutake T؛ Kamikaseda K (يونيو 1999). "Tremor induced by toluene misuse successfully treated by a Vim thalamotomy". Journal of Neurology Neurosurgery and Psychiatry. ج. 66 ع. 6: 794–6. DOI:10.1136/jnnp.66.6.794. PMC:1736379. PMID:10329759.
- ^ ا ب ج Urban، P؛ Lukáš E؛ Pelclová D؛ وآخرون (2003). "Neurological and neurophysiological follow-up on workers with severe chronic exposure to toluene". سمية عصبية. ج. P25 ع. s130.
- ^ ا ب Yamaguchi، H؛ Kidachi Y؛ Ryoyama K (مايو–يونيو 2002). "Toluene at environmentally relevant low levels disrupts differentiation of astrocyte precursor cells". Archives of Environmental Health. ج. 57 ع. 3: 232–8. DOI:10.1080/00039890209602942. PMID:12507177.
