ثنائي فلوريد الأكسجين
| ثنائي فلوريد الأكسجين Oxygen difluoride | |
|---|---|
| أسماء أخرى | |
oxygen fluoride |
|
| المعرفات | |
| رقم CAS | 7783-41-7 |
| بوب كيم (PubChem) | 24547 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | OF2 |
| الكتلة المولية | 54.00 غ/مول |
| المظهر | غاز عديم اللون له رائحة كريهة |
| الكثافة | 2.42 غ/سم3 (عند الدرجة 0 °س) |
| نقطة الانصهار | −223.8 °س |
| نقطة الغليان | −144.8 °س |
| الذوبانية في الماء | يتفكك ببطء |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
ثنائي فلوريد الأكسجين هو مركب كيميائي من الفلور والأكسجين له الصيغة OF2 ويكون على شكل غاز عديم اللون.
التحضير
[عدل]حضّر ثنائي فلوريد الأكسجين في أواخر عشرينات القرن العشرين من قبل عدة علماء من بينهم بول لوبو، والذي قام بتحضير المركب من التحليل الكهربائي لمصهور فلوريد البوتاسيوم وفلوريد الهيدروجين في الماء.[3][4]
في الوقت الحالي، يحضّر ثنائي فلوريد الأكسجين من تمرير غاز الفلور في محلول هيدروكسيد الصوديوم أو هيدروكسيد البوتاسيوم:[5]
الخصائص
[عدل]إن أكثر ما يميز OF2 هو أنه من المؤكسدات القوية، حيث أن ذرة الفلور لها كهرسلبية مرتفعة بشكل يجعل الأكسجين ذو حالة أكسدة موجبة، وهو أمر نادر الحدوث في باقي المركبات الكيميائية.
يمكن أن تبرز القوة المؤكسدة لثنائي فلوريد الأكسجين بقدرته على أكسدة الغاز الخامل زينون إلى رباعي فلوريد الزينون XeF4 كما في المعادلة:
عند انحلاله في الماء يتفكك ثنائي فلوريد الأكسجين ببطء إلى فلوريد الهيدروجين وغاز الأكسجين:
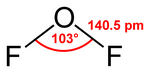
حسب نظرية تنافر أزواج إلكترونات غلاف التكافؤ (VSEPR) فإن لجزيء ثنائي فلوريد الأكسجين بنية منحنية بشكل مشابه للماء. تبلغ زاوية الرابطة بين ذرتي الفلور 103°، أما طول الرابطة O-F فيبلغ 140.5 بيكومتر.
الاستخدامات
[عدل]للمركب القليل من الاستخدامات العملية. اقترح في السابق استخدام ثنائي فلوريد الأكسجين كمؤكسد لوقود الصواريخ.
المراجع
[عدل]- ^ ا ب ج Oxygen difluoride (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Lebeau, P.; Damiens, A. (1929). "Sur un nouveau mode de préparation du fluorure d'oxygène" [A new method of preparation of oxygen fluoride]. Comptes rendus hebdomadaires des séances de l’Académie des sciences (بالفرنسية). 188: 1253–1255. Archived from the original on 2017-12-08. Retrieved 2013-02-21.
- ^ Lebeau, P.; Damiens, A. (1927). "Sur l'existence d'un composé oxygéné du fluor" [The existence of an oxygen compound of fluorine]. Comptes rendus hebdomadaires des séances de l’Académie des sciences (بالفرنسية). 185: 652–654. Archived from the original on 2020-04-14. Retrieved 2013-02-21.
- ^ موسوعة رومب الكيميائية Römpp Lexikon Chemie, Georg Thieme Verlag