ثنائي كلوريد التيتانوسين
| ثنائي كلوريد التيتانوسين | |
|---|---|
| الاسم النظامي (IUPAC) | |
Dichloridobis(η5-cyclopentadienyl)titanium |
|
| أسماء أخرى | |
titanocene dichloride, dichlorobis(cyclopentadienyl)titanium(IV) |
|
| المعرفات | |
| CAS | 1271-19-8 |
| بوب كيم | 5284468، و129728770، و53384597، و76030824 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C10H10Cl2Ti |
| الكتلة المولية | 248.96 غ/مول |
| المظهر | صلب أحمر |
| الكثافة | 1.60 غ/سم3 |
| نقطة الانصهار | 289 °س |
| الذوبانية في الماء | يتفكك |
| المخاطر | |
| رمز الخطر وفق GHS |  |
| وصف الخطر وفق GHS | انتباه |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
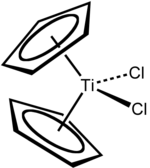
ثنائي كلوريد التيتانوسين هو مركب تيتانيوم عضوي صيغته C10H10Cl2Ti، ويوجد على هيئة صلب بلوري أحمر.
ينتمي المركب إلى الميتالوسينات، وهو يتألف بنيوياً من ذرة تيتانيوم مركزية مرتبطة إلى ربيطتين من أنيون حلقي البنتاديينيل (وحدة تيتانوسين) وربيطتين من الكلوريد.
التحضير
[عدل]يحضر المركب انطلاقاً من كلوريد التيتانيوم الرباعي بالتفاعل مع حلقي بنتاديينيد الصوديوم:[2]
كما يمكن التحضير أيضاً بالتفاعل مع حلقي البنتاديين:[3]
الخواص
[عدل]يوجد المركب في الشروط القياسية على هيئة صلب بلوري أحمر، وهو يتحلمه عند التعرض للهواء أو الرطوبة.[4]
الاستخدامات
[عدل]يستخدم المركب في العلاج الكيميائي للسرطان.[5][6]
طالع أيضاً
[عدل]المراجع
[عدل]- ^ https://pubchem.ncbi.nlm.nih.gov/compound/5284468. اطلع عليه بتاريخ أبريل 2018.
{{استشهاد ويب}}:|url=بحاجة لعنوان (مساعدة)، الوسيط|title=غير موجود أو فارغ (من ويكي بيانات) (مساعدة)، وتحقق من التاريخ في:|accessdate=(مساعدة) - ^ Wilkinson، G.؛ Birmingham، J.G. (1954). "Bis-cyclopentadienyl Compounds of Ti, Zr, V, Nb and Ta". Journal of the American Chemical Society. ج. 76 ع. 17: 4281–4284. DOI:10.1021/ja01646a008.
- ^ Birmingham، J. M. (1965). "Synthesis of Cyclopentadienyl Metal Compounds". Adv. Organometal. Chem. Advances in Organometallic Chemistry. ج. 2: 365–413. DOI:10.1016/S0065-3055(08)60082-9. ISBN:9780120311026.
- ^ Budaver، S.، المحرر (1989). The Merck Index (ط. 11th). Merck & Co., Inc.
- ^ Roat-Malone، R. M. (2007). Bioinorganic Chemistry: A Short Course (ط. 2nd). John Wiley & Sons. ص. 19–20. ISBN:978-0-471-76113-6. مؤرشف من الأصل في 2022-03-01.
- ^ Cini, M.; Bradshaw, T. D.; Woodward, S. (2017). "Using titanium complexes to defeat cancer: the view from the shoulders of Titans" (PDF). Chem. Soc. Rev. ج. 46 ع. 4: 1040–1051. DOI:10.1039/C6CS00860G. PMID:28124046. مؤرشف من الأصل (PDF) في 2018-07-19.