حمض الكبريتيك
| حمض الكبريتيك | |
|---|---|
| الاسم النظامي (IUPAC) | |
حمض الكبريتيك |
|
| أسماء أخرى | |
حمض الكبريت |
|
| المعرفات | |
| رقم CAS | 7664-93-9 |
| بوب كيم | 1118[1]، و22066174، و5152822 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | H2SO4 |
| الكتلة المولية | 98.08 غ/مول |
| المظهر | سائل عديم اللون |
| الكثافة | 1.83 غ/سم3 (سائل).[3] |
| نقطة الانصهار | 10.31 °س [3] |
| نقطة الغليان | 290 °س (حمض الكبريتيك المركز الخالي من الماء) ما يقارب 335 °س لحمض كبريتيك تركيزه 98% (مزيج أزيوتروبي ثابت الغليان).[3] |
| الذوبانية في الماء | يمتزج مع الماء بكافة النسب بتفاعل ناشر للحرارة.[4] |
| حموضة (pKa) | pKa1 = −2.8 pKa2 = 1.99 |
| البنية | |
| البنية البلورية | نظام بلوري أحادي الميل |
| زمرة فراغية | C2/c |
| كيمياء حرارية | |
| الحرارة القياسية للتكوين ΔfH |
−814 كيلوجول/مول[5] |
| إنتروبيا مولية قياسية S |
157 جول/(مول·كلفن)[5] |
| المخاطر | |
| رمز الخطر وفق GHS |   |
| وصف الخطر وفق GHS | خطر |
| بيانات الخطر وفق GHS | H314 |
| بيانات وقائية وفق GHS | P260, P264, P280, P301+330+331, P303+361+353, P363, P304+340, P305+351+338, P310, P321, P405, P501 |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
حمض الكبريتيك هو حمضُ معدنيّ صيغته الكيميائية H2SO4 ويوجد على هيئة سائلٍ لزجٍ عديم اللون مرتفع الكثافة. يمتزج حمض الكبريتيك مع الماء بجميع التراكيز. كان حمض الكبريتيك من أوائل الأحماض التي حُضّرت في تاريخ علم الكيمياء، إذ يعود الفضل إلى العالم جابر بن حيان في تحضيره أوّل مرّة في القرن الثامن الميلادي.
يُصنّف هذا الحمض من الأحماض الأكّالة جدّاً تجاه المواد المختلفة، فهو مؤكسد جيّد؛ كما يتميّز حمض الكبريتيك المركّز بقدرته الكبيرة على نزع الماء من المركّبات الحاوية على مجموعات هيدروكسيل في بنيتها، ويتميّز بقدرته الكبيرة أيضاً على الاسترطاب، إذ يمتزّ بخار الماء من الهواء. عند إجراء عملية تمديد (تخفيف) للحمض بإضافته إلى الماء، تنتشر كمّيّة محسوسة من الحرارة، ولا ينبغي عند التمديد إضافة الماء إلى الحمض، إذ قد يرافق ذلك خطورة تناثر قطيرات من الحمض الساخن، مما قد يؤدّي إلى حدوث حروق كيميائية، وحتّى حروق حرارية من الدرجة الثانية.
لحمض الكبريتيك العديد من التطبيقات المهمّة في الحياة اليومية وكذلك في الصناعات الكيميائية، لذا يعدّ معدّل الإنتاج من حمض الكبريتيك مؤشّراً جيّداً على القوّة الصناعية للبلدان.[6] يمكن إنتاج حمض الكبريتيك بعدّة أساليب وطرائق، وأكثرها انتشاراً وشيوعاً في العصر الحاضر هي عملية التلامس وعملية حمض الكبريتيك الرطب؛ أمّا تاريخياً فقد كانت عملية غرف الرصاص هي العملية الشائعة في إنتاج هذا الحمض في القرن الثامن عشر. يستخدم حمض الكبريتيك بشكلٍ واسعٍ في تحضير الأسمدة وفي معالجة المعادن وفي مصافي النفط ومعالجة المياه العادمة وفي الاصطناع الكيميائي؛ كما يدخل حمض الكبريتيك أيضاً في تركيب بطّاريات السيّارات.
التسمية
[عدل]يعرف هذا الحمض تحت اسم حمض الكبريتيك [ar 1] أو حمض الكبريت [ar 2] أو زيت الزاج أو الحمض الكبريتي أو حمض السلفوريك [ar 3]
التاريخ
[عدل]يرتبط تاريخ حمض الكبريتيك باكتشاف أملاح الزاج والتجارب عليها منذ تاريخ تطور الكيمياء.
التاريخ القديم
[عدل]بدأت دراسة الزاج في العصور القديمة، وكان لدى السومريين قائمة بأنواع الزاج التي صنفوها حسب لون المادة. حوت أعمال الطبيب اليوناني ديوسقوريدس [ط 1] (عاش في القرن الأول الميلادي) وعالم الطبيعة الروماني بلينيوس الأكبر [ط 2] (23-79 م) على بعض المناقشات المبكرة عن أصل وخصائص الزاج؛ وناقش جالينوس [ط 3] أيضًا استخداماته الطبية. كما وثقت الاستخدامات المعدنية للزاج في عدد من الأعمال والكتب الخيميائية في العصر الهلنستي، مثل أعمال زوسيموس من بانوبوليس [ط 4]، وفي النصوص المنسوبة إلى ديمقريطس [ط 5] [ملاحظة 1]، وكذلك بردية ليدن X [ط 6].[7]
عصر الحضارة الإسلامية
[عدل]
استمرت الأبحاث والتجارب على أملاح الزاج في عصر الحضارة الإسلامية، ويعود الفضل إلى عدد من العلماء المسلمين في توثيق نتائج تلك التجارب، أمثال جابر بن حيان (توفي حوالي 806 - 816 م)، وأبو بكر الرازي (865 - 925 م)، وابن سينا (980 - 1037 م)، ومحمد بن إبراهيم الوطواط (1234 - 1318 م) الذين أدرجوا الزاج في قوائم تصنيف المعادن الخاصة بهم.[8]
يرد في أغلب الأدبيات العربية على أن العالم جابر بن حيان كان أول من حضر «زيت الزاج»؛ وهو الاسم الذي كان يطلق على ناتج تقطير أملاح الزاج. ولكن على العموم هناك عدة فرضيات مبنية على تحليل المتوفر من المخطوطات والتي حاولت تحديد من كان أول من تمكن من تحضير زيت الزاج والفترة الزمنية لذلك.[9][10] فقد جرب العلماء المسلمون مثل ابن حيان والرازي تقطير مختلف المواد، بما في ذلك أملاح الزاج؛[11] وفي إحدى الوصفات المسجلة في كتاب سر الأسرار، قد يكون الرازي قد حضر حمض الكبريتيك دون أن يدرك ذلك:[12][ملاحظة 2]
وفي عمل مجهول مكتوب باللغة اللاتينية نُسب تارةً إلى أرسطو [ملاحظة 3]،[14] وتارةً إلى الرازي [ملاحظة 4]، أو إلى ابن سينا،[15] [ملاحظة 5] والذي يتحدث فيه المؤلف عن زيت [ط 10] يستحصل من عملية تقطير الزاج الأخضر (كبريتات الحديد الثنائي)، ومن المرجح أن المقصود هو زيت الزاج (حمض الكبريتيك).[17] يشير العمل عدة مرات إلى كتاب جابر بن حيان كتاب السبعين [ط 11]، وهو أحد الأعمال القليلة المترجمة لجابر إلى اللاتينية.[18] يُشير مؤلف النسخة المنسوبة إلى الرازي إلى كتاب السبعين على أنه عمله الخاص، مما يُظهر أنه اعتقد خطأً أنه كان عملًا للرازي.[19] هناك فرضيات تشير أن العمل المجهول كان تأليفًا أصليًا باللاتينية،[20] على الرغم من أن أحد المخطوطات يشير إلى أنه ترجمهُ شخص يُدعى ريمون المرسيلي [ط 12]، مما يعني أنه قد يكون أيضًا تُرجم من العربية.[21] [ملاحظة 6]
العصور الوسطى المتأخرة والحديثة المبكرة
[عدل]تظهر أولى الإشارات إلى زيت الزاج في الأعمال الأوروبية في أعمال القرن الثالث عشر الميلادي، كما هو الحال في أعمال فنسنت دي بوفيه [ط 15] [ملاحظة 7] و جابر الزائف [ط 17][ملاحظة 8].[26]

ظهر في أوروبا في القرن السادس عشر أسلوب تحضير عرف باسم زيت الكبريت بواسطة الجرس [ط 18]، والذي كان يتضمن حرق الكبريت تحت جرس زجاجي في وسط رطب (أو لاحقاً تحت جرس مبلل). ومع ذلك، كانت هذه الطريقة غير فعالة للغاية، إذ كانت وفقًا لغيسنر [ط 19]، وكان المنتج النهائي ملوثًا بحمض الكبريتوز (أو بالأحرى محلول ثنائي أكسيد الكبريت)؛ لذلك فإن معظم الكيميائيين لم يعتبروه معادلاً لـ "زيت الزاج". وفي القرن السابع عشر، اكتشف يوهان رودولف غلاوبر [ط 20] أن إضافة ملح البارود (نترات البوتاسيوم KNO3) يحسن الإنتاج بشكل كبير، واستبدال الرطوبة بالبخار. إذ عند تفكك نترات البوتاسيوم حرارياً، فإنها تؤكسد الكبريت إلى SO3 الذي يتحد مع الماء لينتج حمض الكبريتيك. في سنة 1736، استخدم جوشوا وارد [ط 21]، وهو صيدلي من لندن، هذه الطريقة لبدء أول إنتاج واسع النطاق من حمض الكبريتيك.
الأساليب الحديثة في الإنتاج
[عدل]- عملية غرف الرصاص
في سنة 1746 تمكن جون روبوك [ط 22] في مدينة برمنغهام من تحوير طريقة حرق الكبريت من أجل إنتاج حمض الكبريتيك في غرف مبطنة بالرصاص، وكانت أكثر فعالية وإنتاجية وأقل تكلفة من طريقة الحاويات الزجاجية المستخدمة سابقًا. سمحت هذه العملية بتصنيع حمض الكبريتيك على نطاق صناعي فعال؛ وبعد عدة تحسينات، ظلت هذه الطريقة، المعروفة باسم عملية غرف الرصاص أو "عملية الغرفة"، هي المعيار لإنتاج حمض الكبريتيك لمدة تقارب القرنين من الزمن.[5]
- تقطير البيريت
وصل تركيز حمض الكبريتيك الناتج عن عملية جون روبوك إلى حوالي 65%. وأدت تحسينات لاحقة على عملية غرف الرصاص من قبل الكيميائي الفرنسي جوزيف لويس جاي لوساك [ط 23] والكيميائي البريطاني جون جلوفر [ط 24] إلى تحسين التركيز ليصل إلى 78%. ومع ذلك، تطلب تصنيع بعض الأصباغ والعمليات الكيميائية الأخرى حمضاً أكثر تركيزًا؛ وطوال القرن الثامن عشر، لم يكن بالإمكان إنتاج هذا التركيز العالي إلا من خلال التقطير الجاف للمعادن في تقنية مشابهة للعمليات الخيميائية الأصلية. فقد كان يُسخن البيريت (كبريتيد الحديد الثنائي FeS2) في الهواء لينتج كبريتات الحديد الثنائي FeSO4، والذي كان يتأكسد بتسخينه مجددًا في الهواء ليشكل كبريتات الحديد الثلاثي Fe2(SO4)3، وعند تسخينه إلى درجة 480 مئوية، يتفكك إلى أكسيد الحديد الثلاثي وثلاثي أكسيد الكبريت، والذي كان يُخفف بالماء لإنتاج حمض الكبريتيك بأي تركيز؛ لكن ارتفاع تكاليف هذه العملية منعت الاستخدام الواسع النطاق لحمض الكبريتيك المركز.[5]
- عملية التلامس
في سنة 1831، حصل تاجر الخل البريطاني بيريجرين فيليبس [ط 25] على براءة اختراع لعملية التلامس، وهي عملية أكثر اقتصاية في إنتاج ثلاثي أكسيد الكبريت وحمض الكبريتيك المركز. واليوم، يُنتج تقريبًا أغلب حمض الكبريتيك في العالم باستخدام هذه الطريقة.[27]
الخواص الفيزيائية
[عدل]يوجد حمض الكبريتيك المركز على هيئة سائل عديم اللون زيتي القوام مرتفع الكثافة. من الشائع أن تتلون الأشكال التجارية من حمض الكبريتيك بلون بني فاتح، وذلك يعود إلى الشوائب العضوية التي تخضع إلى تفاعل نزع ماء [ط 26] مما يؤدي إلى تفحمها. تبلغ قيمة ضغط البخار لحمض الكبريتيك <0.001 مم زئبقي عند 25 °س، ومقدار 1 مم زئبقي عند 145.8 °س.[28][29]
يبدأ حمض الكبريتيك المركز الخالي من الماء (اللامائي) بالتجمد عند درجات حرارة أدنى من 10.37 °س؛ وتنخفض نقطة التجمد بشكل واضح عند وجود آثار من الماء، إذ تكون لحمض تركيزه 98% قريبة من 3.0 °س. بالمقابل، عند درجات حرارة أعلى من نقطة الغليان البالغ مقدارها 279.6 °س لحمض الكبريتيك المركز اللامائي تبدأ الأبخرة بالتشكل، ويبدأ ثلاثي أكسيد الكبريت بالتركز في الأبخرة، في حين ييقى الماء المتشكل من العملية في حمض الكبريتيك المتبخر. بالتالي يتحول حمض الكبريتيك اللامائي إلى حمض كبريتيك ذي تركيز 98.33%، والذي ترتفع نقطة الغليان فيه إلى درجة حرارة ثابتة مقدارها 338 °س. عند درجة الحرارة تلك، تحوي الأبخرة على تركيز من الحمض مقداره 98.33%، وبالتالي يكون النظام من مزيج متكون من الماء وحمض الكبريتيك في حالة توازن ثابت الغليان (نظام أزيوتروبي) [ط 27]. يستحصل على حمض كبريتيك بالتركيز ذاته وبذات نقطة الغليان عند تقطير حمض كبريتيك ممدد، بالتالي لا يمكن الحصول على حمض الكبريتيك 100% المركز اللامائي من تقطير حمض الكبريتيك الممدد، ولكن بحل كميات محددة من ثلاثي أكسيد الكبريت في حمض الكبريتيك المركز. باستمرار التسخين إلى درجات حرارة أعلى من 338 °س يبدأ حمض الكبريتيك بالتفكك إلى الماء وثلاثي أكسيد الكبريت، ويتفكك بشكل كامل عند درجة حرارة مقدارها 450 °س.[30]
يوجد حمض الكبريتيك في حالة توازن كيميائي مع العديد من الأنواع الكيميائية، كما هو موضح في الجدول:[31]
| الأنواع | ميلي مول/كغ |
|---|---|
| -HSO4 | 15.0 |
| +H3SO4 | 11.3 |
| +H3O | 8.0 |
| −HS2O7 | 4.4 |
| H2S2O7 | 3.6 |
| H2O | 0.1 |
يشكل حمض الكبريتيك العديد من الهيدرات [ط 28] المعروفة H2SO4·nH2O حيث n تعادل 1 أو 2 أو 3 أو 4 أو 6.5 أو 8؛[32] وتكون أغلب الهيدرات الوسطية ثابنة ومستقرة تجاه تفاعل عدم التناسب [ط 29].[33]
أما في الطور الصلب، فإن حمض الكبريتيك يوجد على هيئة بلورات بنيتها ذات نظام بلوري أحادي الميل تتبع الزمرة الفراغية C2/c، وتبلغ قيم ثوابت الشبكة البلورية: a مقدار 814 بيكومتر، وb مقدار 470 بيكومتر، وc مقدار 854 بيكومتر، وβ مقدار 111°.[34] تتألف البنية من طبقات موازية، بحيث يكون فيها كل جزيء متصلاً عبر روابط هيدروجينية إلى جزيئين آخرين.[35]
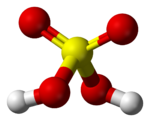
في الطور الغازي توجد جزيئات حمض الكبريتيك بحالة منفردة، وتكون بنيتها على هيئة رباعيات سطوح، تكون فيها زاوية الرابطة مقدار 101.3° بين مجموعات OH- ومقدار 123.3° بين ذرات الأكسجين. تبلغ قيمة طول الرابطة بين الكبريت والأكسجين في الروابط S-OH مقدار 157.4 بيكومتر، أما الرابطة بين الكبريت وذرات الأكسجين الأخرى مقدار 142.2 بيكومتر.[36] على العموم، تحضع الروابط الكيميائية في حمض الكبريتيك إلى حالات رنين [ط 30] متعددة كما بينت الحسابات النظرية.[37]
القطبية والموصلية
[عدل]يتميز حمض الكبريتيك اللامائي (المركز) بأنه سائل ذو قطبية كيميائية مرتفعة، وتبلغ قيمة ثابت العازل [ط 31] ما يقارب 100؛ ولديه موصلية كهربائية مرتفعة، نتيجة انتقال البروتونات بسبب البرتنة الذاتية [ط 32]، التي تؤمن انتقال الشحنة الكهربائية.[31]
وتبلغ قيمة ثابت التوازن في البرتنة الذاتية عند 25 °س مقدار 2.7 × 10−4؛ وللمقارنة، تبلغ قيمة ثابت التوازن Kw في التأين الذاتي للماء مقدار 10−14، وذلك مقدار أقل ب10 بلايين مرة.
لحمض الكبريتيك لزوجة مرتفعة نسبياً، وتبلغ مقدار 24.6 ميلي باسكال.ثانية عند 25 °س.[38] وللمقارنة، فإن لزوجة الماء تبلغ 0.89 ميلي باسكال.ثانية عند 25 °س. وعلى الرغم من الارتفاع النسبي للزوجة الحمض، فإن الموصلية المولية [ط 33] لأيونات +H3SO4 و -HSO4 مرتفعة بسبب آلية تبادل البروتونات بين الجزيئية (بشكل مشابه لآلية جروتاس في الماء)، مما يجعل من حمض الكبريتيك موصلاً جيداً للكهرباء، وتبلغ قيمة الموصلية النوعية مقدار 1.044 · 10−2 سيمنز/سم.[38]
درجات حمض الكبريتيك
[عدل]يقصد بالدرجة في هذا السياق درجة التركيز في تصنيف حمض الكبريتيك. على الرغم من أنه من الممكن الحصول على محلول يقارب 100% من حمض الكبريتيك، إلا أن فقدان ثلاثي أكسيد الكبريت SO3 يجعل من التركيز 98.3% الأكثر ثباتية واستقراراً في التخزين، وهو الشكل النهائي المسوق تجارياً تحت حمض الكبريتيك المركز. توجد عدة درجات من تراكيز حمض الكبريتيك الشائعة والمستخدمة في تطبيقات مختلفة، منها:[39][40]
| الكسر الكتلي H2SO4 |
الكثافة (كغ/ل) |
التركيز (مول/ل) |
الاسم الشائع |
|---|---|---|---|
| <29% | 1.00-1.25 | <4.2 | حمض الكبريتيك الممدد |
| 29–32% | 1.25–1.28 | 4.2–5.0 | حمض البطارية (المستخدم في بطارية الرصاص) |
| 62–70% | 1.52–1.60 | 9.6–11.5 | حمض غرف الرصاص حمض الأسمدة |
| 78–80% | 1.70–1.73 | 13.5–14.0 | حمض الأبراج حمض غلوفر |
| 93.2% | 1.83 | 17.4 | حمض 66 درجة بوميه |
| 98.3% | 1.84 | 18.4 | حمض الكبريتيك المركز |
إن تسميتا حمض غرف الرصاص [ط 34] وحمض الأبراج [ط 35] هي تسميات تاريخية، إذ كلاهما كانا يستحصلان من عملية غرف الرصاص، فحمض غرف الرصاص هو الحمض المنتج في الغرف ذاتها بتركيز أقل من 70% من أجل تجنب الإشابة بحمض نتروزيل الكبريتيك؛ أما حمض الأبراج فهو المسترجع من أسفل أبراج غلوفر [ط 36] (وهي أبراج مرتفعة درجة الحرارة كانت تستخدم في غرف الرصاص لاسترجاع أكاسيد النتروجين).[39][40] في الوقت الحالي يمكن الحصول على درجات التركيز تلك بالتمديد عند الحاجة، مثل درجة التركيز 10 مولار، والمقاربة لتركيز حمض غرف الرصاص، والمستخدمة بكثرة في المعايرة.[40]
الخواص الكيميائية
[عدل]
الحموضة
[عدل]إن تفاعل إماهة [ط 38] حمض الكبريتيك هو تفاعل طارد للحرارة [ط 39] بشكل كبير، لذا يرافق تمديد (أو تخفيف) حمض الكبريتيك بالماء ارتفاع درجة حرارة الوسط.[41]
إن حمض الكبريتيك هو حمض متعدد البروتون [ط 40]؛ ويتأين في خطوتين،[ar 4] في المرحلة الأولى يعطي تأيّن الحمض في الماء أنيون البيكبريتات -HSO4، وهذا الأيون المرافق حمض أضعف بكثير من حمض الكبريتيك.
- H2SO4 → H3O+ + HSO−4 Ka1 = 1000 (pKa1 = −3)
إن ناتج التفكك الثاني لحمض الكبريتيك هو أنيون الكبريتات 2-SO4.
- HSO−4 + H2O → H3O+ + SO2−4 Ka2 = 0.01 (pKa2 = 2) [42]
تشير قيمة ثابت تفكك الحمض [ط 41] (pKa1 = −3) بشكل واضح إلى أن حمض الكبريتيك حمض قوي، وذلك واضح أيضاً وفق دالة هاميت للحموضة [ط 42]، إذ تعادل H0 فيمة مقدارها −11.9 بالنسبة للتفكك الأول لحمض الكبريتيك إلى البيكبريتات.[30] لذلك لا يصنف حمض الكبريتيك من الأحماض الفائقة [ط 43]، ولكن بالرغم من ذلك، فهو يعد معياراً يقاس عليه تعريف تلك الأحماض؛[43] إذ الأحماض الفائقة هي المحاليل الحمضية الأكثر حموضة من حمض الكبريتيك المركز (تركيز 100%).[ar 5]
نزع الماء
[عدل]لحمض الكبريتيك المركز ألفة كيميائية [ط 44] كبيرة تجاه الماء، فهو يتميز بقدرته الكبيرة على القيام بتفاعل نزع الماء (البلمهة)، إذ هو قادر على إزالة جزيئات الماء H2O من المركبات الكيميائية الأخرى، وخاصة تلك الحاوية على مجموعات هيدروكسيل كثيرة في بنيتها، مثل السكروز (السكر الأبيض) وكذلك السكريات الأخرى، لينتج الكربون وبخار الماء بتفاعل طارد للحرارة. يعد هذا تفاعل نزع الماء من السكر من الأمثلة النمطية في المختبرات التعليمية لإظهار مقدرة حمض الكبريتيك على نزع الماء.[44][45] يتفحم السكر في هذا التفاعل، ويتشكل عمود صلب من الفحم الأسود المسامي، الذي يطلق عليه في بعض الأحيان اسم الثعبان الكربوني [ط 45].[46]
بشكل مشابه، فإن حمض الكبريتيك قادر على نزع الماء من النشا أو السليولوز. ويمكن مشاهدة ذلك بشكل واضح في المثال الأخير عند سكب حمض الكبريتيك على الورق، إذ يترك آثار احتراق وسناج بشكل واضح. بشكل مشابه أيضاً ولكن بشكل أقل وضوحاً، يتفاعل حمض الكبريتيك مع القطن، مما يؤدي إلى تدمير بنية النسيج.

هناك استثناء ملفت للانتباه، إذ يعد خماسي أكسيد الفوسفور من المواد الكيميائية القلائل القادرة على نزع الماء من حمض الكبريتيك، وتحويله إلى ثلاثي أكسيد الكبريت.
التفاعل مع الأملاح
[عدل]يتفاعل حمض الكبريتيك مع أغلب القواعد الكيميائية وكذلك الأملاح ليعطي أملاح الكبريتات أو البيكبريتات الموافقة. فيتفاعل حمض الكبريتيك مع كلوريد الصوديوم ليعطي غاز كلوريد الهيدروجين وبيكبريتات الصوديوم:
يحضر كبريتات الألومنيوم من مفاعلة البوكسيت مع حمض الكبريتيك:
يستطيع حمض الكبريتيك أن يزيح الأحماض الأضعف من أملاحها، فعلى سبيل المثال عند تفاعل حمض الكبريتيك مع أسيتات الصوديوم يقوم حمض الكبريتيك بإزاحة حمض الخليك (حمض الأسيتيك) من الملح ويتشكل بيكبريتات الصوديوم:
بشكل مشابه، فإن تفاعل حمض الكبريتيك مع نترات البوتاسيوم يحرر حمض النتريك. وعند مزج حمض الكبريتيك مع حمض النتريك فإن المزيج يكون ذو خواص مؤكسدة قوية، وقادر على تشكيل أيون النترونيوم +NO2، والذي يقوم بدور مهم في تفاعلات النترتة، وخاصة تفاعلات الاستبدال العطري محب للإلكترونات. يعد هذا النوع من التفاعلات، حيث تحدث تفاعلات إضافة بروتون (بروتون) على ذرة الأكسجين، من التفاعلات المهمة في الكيمياء العضوية مثل تفاعل أسترة فيشر [ط 46] وتفاعل نزع الماء (بلمهة) من الكحولات.

عند التفاعل مع الأحماض الفائقة يقوم حمض الكبريتيك بدور قاعدة ويمكن برتنته، مما يؤدي إلى الحصول على الأيون +[H3SO4]، والذي يمكن تحضير أملاح منه، مثل ملح ثلاثي هيدروكسي أوكسو سلفونيوم سداسي فلورو الأنتيموانات (V) [ط 47] والذي يحضر وفق التفاعل التالي في فلوريد الهيدروجين HF السائل:
إن التفاعل أعلاه مفضل من حيث الديناميكية الحرارية بسبب ارتفاع قيمة طاقة تفكك الرابطة Si–F في المنتج الثانوي ثلاثي ميثيل فلوريد السيليكون. أما البرتنة باستخدام حمض فلوريد الأنتيمون لوحده فلا تعطي النتائج المرجوة، لأن حمض الكبريتيك النقي يخضع لتفاعل تأين تلقائي جزيئي ليعطي أيون الهيدرونيوم:
والذي يحول دون التحول إلى أيون +[H3SO4].[47]
التفاعل مع الفلزات
[عدل]يتفاعل حمض الكبريتيك الممدد (المخفف) مع العديد من الفلزات عن طريق تفاعل إزاحة [ط 48]، مثله مثل باقي الأحماض الأخرى، منتجاً بذلك غاز الهيدروجين وأملاح الكبريتات الموافقة؛ فهو قادر على مهاجمة الفلزات النشيطة الفعالة (الموجودة أعلى من النحاس في سلسلة النشاط الكيميائي) [ط 49] مثل الحديد والألومنيوم والزنك والمنغنيز والمغنيسيوم والنيكل، وغيرها.
يقوم حمض الكبريتيك المركز بدور مؤكسد عند التفاعل مع الفلزات في أسفل سلسلة النشاط الكيميائي، محرراً غاز ثنائي أكسيد الكبريت:[48]
ولكن من جهة أخرى، توجد هناك بعض الفلزات المقاومة لأثر حمض الكبريتيك المركز، مثل الرصاص والتنغستن.
التفاعل مع اللافلزات
[عدل]يتفاعل حمض الكبريتيك المركز مع اللافلزات، إذ يستطيع أن يؤكسد الكربون:[49]
وكذلك يستطيع أكسدة الكبريت:
تفاعلات السلفنة
[عدل]يستطيع حمض الكبريتيك أن يقوم بتفاعلات سلفنة للمركبات العطرية مثل البنزين وفق آلية استبدال عطري محب للإلكترونات [ط 50] لينتج أحماض السلفونيك.[50]
دورة الكبريت-اليود
[عدل]يدخل حمض الكبريتيك في دورة الكبريت-اليود [ط 51] التي تمكّن من إنتاج غاز الهيدروجين من الماء وفق التفاعلات التالية:
(120 °C) تفاعل بنزن (830 °C) (320 °C)
طرحت هذه الدورة ضمن الحلول المقترحة من أجل إنتاج الهيدروجين بدلاً من التحليل الكهربائي للماء، ودون الحاجة لاستخدام الوقود الأحفوري عن طريق الإصلاح بالبخار للهيدروكربونات؛ لكن هذه العملية هي عملية ماصة للحرارة، وليست مغرية للدول المعتمدة على الهيدروجين اقتصادياً.[51][52]
الوفرة والجوانب البيئية
[عدل]
نادرًا ما يوجد حمض الكبريتيك في شكله اللامائي بشكل طبيعي على الأرض، وذلك بسبب ارتفاع درجة استرطابه [ط 53]. ويُعتبر حمض الكبريتيك المخفف مكونًا من مكونات الأمطار الحمضية [ط 54]، والتي تتشكل عن طريق الأكسدة الهوائية لثنائي أكسيد الكبريت بوجود الماء (الرطوبة) - أي أكسدة حمض الكبريتوز. عندما يُحرق الوقود المحتوي على الكبريت مثل الفحم أو النفط، يكون ثاني أكسيد الكبريت هو المنتج الثانوي الرئيسي (إلى جانب المنتجات الرئيسية أكاسيد الكربون والماء).[ar 6]
تؤدي الأمطار الحمضية المتهاطلة على الأرض إلى تخفيض قيمة pH الوسط، مما يؤدي إلى تحمض التربة [ط 55] وكذلك إلى تحمض المحيطات [ط 56]، وذلك يؤدي بدوره إلى تدمير الموئل الحيوي [ط 57] للعديد من الكائنات الحية، كما يعد مسؤولاً عن سقام الغابات وموتها [ط 58] وكذلك تلف المحاصيل الزراعية. وبسبب حموضته المرتفعة يؤثر حمض الكبريتيك على الحياة البحرية مثل الأسماك وغيرها بشكل سام. وتبلغ قيمة الجرعة المميتة LC50 للأسماك 100–330 مغ/ل، وذلك بشكل مشابه للاحماض المعدنية الأخرى. يمكن التخفيف من تلك الآثار بإجراء عمليات نزع كبريت غاز العادم في محطات الطاقة الفحمية ومن خلال استخدام المشتقات النفطية الخالية من الكبريت.
يتكون حمض الكبريتيك طبيعياً عن طريق أكسدة معادن الكبريتيد، مثل البيريت:
يكون الماء الناتج عن هذه العملية مرتفع الحموضة،[ar 7] ويسمى تصريف المناجم الحمضي [ط 59] [ملاحظة 9].
يمكن أكسدة Fe2+ بشكل لاحق إلى Fe3+ :
بعد ذلك يمكن ترسيب Fe3+ المنتج على شكل هيدروكسيد أو أكسيد الحديد المائي:
يمكن لأيون الحديد الثلاثي ("الحديديك") أيضًا أكسدة البيريت:
عند أكسدة البيريت بواسطة الحديد الثلاثي، يمكن أن تصبح العملية سريعة.
يمكن لتصريف الصخور الحمضي أيضًا إنتاج حمض الكبريتيك بمعدل أبطأ، بحيث تستطيع سعة معادلة الحمض [ط 61] للحوض المائي [ط 62] معادلة الحمض الناتج. في مثل هذه الحالات، يمكن زيادة تركيز المواد الصلبة الذائبة الكلية [ط 63] للماء نتيجة انحلال المعادن من تفاعل معادلة الحمض مع المعادن.
يستخدم حمض الكبريتيك وسيلةً دفاعية من قبل بعض الأنواع البحرية، على سبيل المثال، الطحلب البني (الاسم العلمي: Desmarestia munda) والذي يركز في فجوات الخلايا.[53]
الهباء الجوي في طبقة الستراتوسفير
[عدل]في الستراتوسفير [ط 64]، الطبقة الثانية من الغلاف الجوي الواقعة بين 10 و 50 كيلومترًا فوق سطح الأرض، يتكون حمض الكبريتيك نتيجة أكسدة ثنائي أكسيد الكبريت البركاني بواسطة جذر الهيدروكسيل [ط 65]:[54]
لأن حمض الكبريتيك يصل إلى درجة التشبع الفائق [ط 66] في الستراتوسفير، فإنه يمكن أن يُنوّي جزيئات الهباء الجوي ويوفر سطحًا لنمو الهباء الجوي عبر التكاثف والتجمع مع قطيرات الهباء الجوي الأخرى المكونة من الماء وحمض الكبريتيك، مما ينتج عن ذلك طبقة الهباء الجوي [ط 67].[54]
خارج الأرض
[عدل]تنتج السحب الدائمة في كوكب الزهرة أمطاراً حمضية مركزة، كما تنتج السحب في الغلاف الجوي للأرض أمطارًا مائية.[55] يُعتقد أيضًا أن قمر المشتري "أوروبا" يحتوي على غلاف جوي يحتوي على هيدرات حمض الكبريتيك.[56]
الإنتاج والتصنيع
[عدل]ازداد الإنتاج العالمي من حمض الكبريتيك بشكل مطرد منذ بداية القرن الحادي والعشرين، وخاصة في الصين، في حين أن إنتاجه تراجع في بعض الدول الأوروبية التي كانت سابقاً رائدة في إنتاجه، مثل ألمانيا وإنجلترا. لتصنيع وإنتاج حمض الكبريتيك أهمية اقتصادية كبيرة، وخاصة في حال الاستفادة من الحرارة المنتشرة في خطوات التصنيع، والتي يمكن استغلالها في توليد البخار وإنتاج الكهرباء والصناعات الكيميائية.[30]
يحضر حمض الكبرتيك صناعياً بأسلوبين حالياً، إما وفق عملية التلامس [ط 68] أو العملية الرطبة [ط 69]؛[57] أما تاريخياً فقد كان يحضر في السابق وفق عملية غرف الرصاص [ط 70]. يعد عنصر الكبريت المادة الأولية الخام الأساسية في إنتاج وتصنيع حمض الكبريتيك، وذلك إلى جانب الأكسجين والماء. يستحصل على الكبريت بشكل أساسي من عملية نزع الكبريت المهدرج [ط 71] من الغاز الطبيعي أو النفط الخام والمعالجات الصناعية اللاحقة وفق عملية كلاوس [ط 72]؛ أو بشكل ثانوي من عملية فراش [ط 73].
عملية التلامس
[عدل]طورت هذه العملية في سنة 1831، ويمكن من خلالها إنتاج حمض الكبريتيك بتراكيز مرتفعة وبتكلفة قليلة نسبياً وبكميات كبيرة تلبي احتياجات وطلب السوق. تعتمد العملية على أكسدة الكبريت باستخدام حفاز من أكسيد الفاناديوم الخماسي V2O5. في الخطوة الأولى يحرق الكبريت بوجود كمية وفيرة من الأكسجين من أجل الحصول على ثنائي أكسيد الكبريت SO2:
بأسلوب آخر يمكن استحصال غاز SO2 من عمليات تعدين الخامات الكبريتيدية لعدد من الفلزات، مثل الزنك أو النحاس أو الرصاص:[58]
أما بالنسبة للدول الفقيرة بالخامات فيمكن اللجوء إلى عملية اختزال الجص (الجبس) باستخدام فحم الكوك في فرن دوّار [ط 74].[59]

بعد الحصول على غاز ثنائي أكسيد الكبريت تمر الحطوة التالية بعملية أكسدة إلى ثلاثي أكسيد الكبريت SO3. لا يمكن الوصول إلى ثلاثي أكسيد الكبريت من التفاعل المباشر بين عنصري الكبريت والأكسجين؛ كما أن تفاعل الأكسدة من ثنائي أكسيد الكبريت إلى ثلاثي أكسيد الكبريت هو تفاعل عكوس، ويرافق العملية انتشار للحرارة، إذ أن العملية طاردة للحرارة. بالتالي يجب وفق مبدأ انزياح التوازن تخفيض درجة الحرارة، كي ينزاح التوازن جهة ثلاثي الأكسيد، وذلك أمر غير محبذ صناعياً، إذ تكون حركية التفاعل بطيئة. لذلك تجرى عملية الأكسدة اللاحقة بوجود حفّاز من أكسيد الفاناديوم الخماسي (أو خماسي أكسيد الفاناديوم):
يقوم أكسيد الفاناديوم الخماسي بدور مهم في عملية نقل الأكسجين بتشكيله معقداً تناسقياً [ط 75]؛[60] وتجرى تفاعلات الأكسدة بوجود الحفاز عند درجات حرارة تتراوح بين 420-620 °س؛ ويعد ذلك المجال ملائماً، إذ عند درجات حرارة أخفض يكون الحفاز غير نشطاً، وعند درجات حرارة أعلى يتفكك.[60] في الخطوة اللاحقة يُتخَلّص من المتبقي من ثنائي أكسيد الكبريت بالمعالجة مع الأمونيا أو ثيوكبريتات الصوديوم؛ ثم يُحوَل غاز ثلاثي أكسيد الكبريت إلى الحمض. بما أن التفاعل بين ثلاثي أكسيد الكبريت والماء بطيء جداً، لذلك يُعمَد إلى تمرير غاز SO3 على حمض كبريتيك ذي تركيز بين 97–98%، فتحدث عملية امتصاص [ط 76]، ويتشكل الأوليوم [ط 77] H2S2O7 (أو حمض الكبريتيك المدخن أو حمض البيروكبريتيك):
والذي يمدد (يخفف) لاحقاً بالماء من أجل الحصول على حمض الكبريتيك المركز.
عملية حمض الكبريتيك الرطب
[عدل]تجرى خطوات هذه العملية بشكل مقارب لعملية التلامس، وتتكون من أربعة مراحل رئيسية:
عملية غرف الرصاص
[عدل]تعتمد العملية على التفاعل بين الكبريت مع غاز ثنائي أكسيد النتروجين بوجود أكسجين الهواء؛ وكانت تجرى في غرف وحجرات كبيرة مصنوعة من الرصاص لمقاومته الكيميائية لتلك المزائج الحمضية.
يتأكسد أحادي أكسيد النتروجين ليعطي ثنائي أكسيد النتروجين، والذي يعاد مرة أخرى لبرج التفاعل ليتفاعل مع الماء وثنائي أكسيد الكبريت للحصول على حمض الكبريتيك. كانت هذه العملية سائدة من أجل إنتاج حمض الكبريتيك قبل بداية القرن التاسع عشر.[61]
التحضير المخبري
[عدل]هناك عدة وسائل من أحل تحضير حمض الكبريتيك على نطاق مخبري صغير، منها:
- عملية الميتابيكبريتيت [ط 80]: هي عملية غير واسعة الانتشار في إنتاج حمض الكبريتيك على صعيد مخبري، إذ توضع أملاح ثنائي الكبريتيت (ميتابيكبريتيت أو ميتابيسلفيت) مع حمض الهيدروكلوريك المركز؛ ثم يفاعل غاز ثنائي أكسيد الكبريت الناتج مع حمض النتريك، ويرافق ذلك انطلاق أبخرة غاز ثنائي أكسيد اليتروجين، والذي يعد مؤشراً على سير التفاعل.
- من إحدى الطرق التاريخية القديمة للتحضير إجراء تفاعل احتراق الكبريت مع نترات البوتاسيوم بوجود البخار، مما يؤدي إلى الأكسدة إلى ثلاثي أكسيد الكبريت، والذي يتميه إلى حمض الكبريتيك في النهاية.
- من الأساليب الجديدة للتحضير، عملية البروم الكهربائية [ط 81]، التي تتضمن إجراء تحليل كهربائي [ط 82] لمزيج كهرلي من الكبريت والماء وحمض الهيدروبروميك باستخدام مهبط من النحاس ومصعد من البلاتين والغرافيت.
الاستخدامات
[عدل]
يعد حمض الكبريتيك مادة كيميائية سلعية مهمة جدًا، ويعد إنتاجه في أي دولة مؤشرًا جيدًا لقوتها الصناعية.[62] بلغ الإنتاج العالمي عام 2004 حوالي 180 مليون طن، موزعاً جغرافياً كما في الرسم البياني المرفق.[63]
التوزع الجغرافي للإنتاج العالمي لحمض الكبريتيك في عام 2004
تستهلك معظم الكمية المنتجة من حمض الكبريتيك عالمياً (≈60%) في مجال صناعة الأسمدة، وخاصة السوبرفوسفات وفوسفات الأمونيوم وكبريتات الأمونيوم.[ar 8] يُستخدم حوالي 20٪ في الصناعة الكيميائية لإنتاج المنظفات والراتنجات الاصطناعية [ط 83] والأصباغ والأدوية والمحفزات البترولية ومضادات التجمد [ط 84]؛ كما يستخدم في صناعة المبيدات؛[ar 9] بالإضافة إلى عمليات صناعية مختلفة أخرى مثل الصناعة النفطية وإنتاج الألومنيوم وصناعة اللب والورق ومعالجة المياه. أما حوالي 6% من الاستخدامات، فهي متعلقة في مجال صناعة الأصباغ والدهانات ووالمينا وأحبار الطباعة؛ في حين يوزع الباقي في العديد من التطبيقات المتنوعة مثل إنتاج المتفجرات والسيلوفان والأنسجة ومواد التشحيم والبطاريات؛ ويستخدم كذلك في تركيب خلايا الوقود [ط 85].[ar 10]
الإنتاج الصناعي للكيماويات
[عدل]الاستخدام السائد لحمض الكبريتيك هو "الطريقة الرطبة" [ar 11] في إنتاج حمض الفسفوريك المستخدم في صناعة الأسمدة الفوسفاتية عن طريق معالجة صخور الفوسفات؛[64] إذ تُعالج المواد الخام على شكل فلورأباتيت بحمض الكبريتيك بنسبة 93٪ لإنتاج كبريتات الكالسيوم وفلوريد الهيدروجين وحمض الفسفوريك، ويمكن تمثيل العملية بالمعادلة الكيميائية:
يُنتج كبريتات الأمونيوم، وهو سماد نيتروجيني مهم، منتجاً ثانوياً من مصانع فحم الكوك التي تزود مصانع صناعة الحديد والصلب. ويستحصل على هذه المادة من معالجة الأمونيا الناتجة عن التحلل الحراري للفحم مع نفايات حمض الكبريتيك، الأمر الذي يسمح بتبلور الأمونيا لملح (غالبًا ما يكون بنيًا بسبب التلوث بالحديد) وبيعه في صناعة الكيماويات الزراعية. كما يستخدم حمض الكبريتيك بشكل مهم في صناعة محاليل الأصباغ. كما يُستخدم حمض الكبريتيك لصنع حمض الهيدروكلوريك من ملح الطعام عبر عملية مانهايم [ط 86].
التنظيف الصناعي
[عدل]يستخدم حمض الكبريتيك في مجال إنتاج الصلب والصناعات المعدنية من أجل عمليات التنظيف بالحمض [ط 87] من أجل إزالة الصدأ والاتساخ [ط 88]. وعادة ما يعاد تدوير الحمض، ويضاف إليه حمض جديد مستحصل من معالجة أكاسيد الكبريت الناتجة من عمليات الاحتراق. كما يستخدم حمض الكبريتيك في المختبرات لتنظيف الأسطح والأواني الزجاجية.[ar 12]
يمكن إضافة بيروكسيد الهيدروجين (H2O2) إلى حمض الكبريتيك لإنتاج محلول بيرانا [ط 89]، وهو محلول تنظيف قوي ولكنه شديد السمية، ويُستخدم عادةً في مجال الإلكترونيات الدقيقة [ط 90] والأواني الزجاجية.[65]
التحفيز
[عدل]يُستخدم حمض الكبريتيك لمجموعة متنوعة من الصناعات الكيميائية الأخرى على هيئة حفاز (محفّز)، إذ يستخدم لتحويل أوكسيم الهكسانون الحلقي [ط 91] إلى كابرولاكتام [ط 92]، المستخدم لصنع النايلون.
يُستخدم أيضاً في عمليات تكرير النفط، فعلى سبيل المثال، يستخدم على هيئة محفز لتفاعل إيزوبوتان [ط 93] مع إيزوبوتيلين [ط 94] لإنتاج الأيزوأوكتان [ط 95]، وهو مركب يرفع رقم الأوكتان [ط 96] للبنزين (وقود السيارات). كما يستخدم حمض الكبريتيك في كثير من الأحيان كعامل تجفيف أو مؤكسد في التفاعلات الصناعية، مثل تجفيف السكريات المختلفة لتكوين الكربون الصلب.
بطارية الرصاص
[عدل]
يدخل حمض الكبريتيك في تركيب بطاريات الرصاص الحمضية على هيئة كهرل (إلكتروليت [ط 97]):[ar 13]
التفاعل الإجمالي:
استخدامات متفرقة
[عدل]يُستخدم حمض الكبريتيك بتركيزات مرتفعة في تركيب مستحضرات منظفات الصرف الحمضية المنزلية [ط 100] والتي تستخدم لإزالة الدهون والشعر والمناديل الورقية وغير ذلك، إذ تستطيع إذابة الدهون والبروتينات عن طريق التحلل المائي. كما يستخدم حمض الكبريتيك في المختبرات الكيميائية من أجل إذابة المواد العضوية.[ar 14]
المخاطر
[عدل]مخاطر المختبر
[عدل]


حمض الكبريتيك قادر على التسبب بحروق شديدة للغاية، خاصةً عندما يكون بتركيزات عالية. كما هو الحال مع الأحماض والقلويات الأخرى المسببة للتآكل، فهو قادر بسهولة على تفكيك البروتينات والدهون من خلال التحلل المائي للأميدات والإسترات عند ملامسته للأنسجة الحية، مثل الجلد واللحم. بالإضافة إلى ذلك، فهو يُظهر قدرة كبيرة على نزع الماء من الكربوهيدرات، مما يؤدي إلى تحرير الحرارة الزائدة والتسبب في حروق ثانوية.[66][67]
في حال ملامسته للعين، فإن حمض الكبريتيك يهاجم القرنية [ط 101] ويمكن أن يسبب العمى الدائم [ط 102] إذا لامس العين. وفي حالة تناوله، فإنه يلحق الضرر بالأعضاء الداخلية بشكل لا رجعة فيه (غير عكوس) وقد يكون مميتًا. لذلك ينبغي دائمًا استخدام معدات الوقاية [ط 103] عند التعامل معه، وإن الأكسدة القوية التي يتمتع بها تجعله شديد التآكل للعديد من الفلزات وقد يمتد التآكل إلى مواد أخرى.[48] ولهذه الأسباب، من المحتمل أن يكون الضرر الناتج عن حمض الكبريتيك أكثر خطورة من الضرر الذي تسببه الأحماض القوية [ط 104] الأخرى المماثلة، مثل حمض الهيدروكلوريك وحمض النيتريك.
تُعالج الإسعافات الأولية لانسكابات الأحماض على الجلد بسكب كميات كبيرة من الماء والصابون،[ar 15] كما هو الحال مع العوامل الأكّالة [ط 105] الأخرى. يستمر الغسيل لمدة لا تقل عن عشر دقائق إلى خمس عشرة دقيقة لتبريد الأنسجة المحيطة بمكان الحرق الحمضي ولمنع حدوث أضرار ثانوية، تُنزع أو تُزال الملابس الملوثة على الفور ويُغسل الجلد تحتها جيدًا. تُصنّف المحاليل التي تعادل أو تزيد عن 1.5 مولار على أنها "مسببة للتآكل"، بينما تُصنّف المحاليل التي تزيد عن 0.5 مولار ولكن أقل من 1.5 مولار على أنها "مهيجة". ومع ذلك، حتى الدرجة المخففة العادية في المختبر (تقريبًا 1 مولار، 10%) ستحرق الورق إذا تُركت على تماس لفترة كافية. يجب تخزين حمض الكبريتيك بعناية في حاويات مصنوعة من مواد غير نشيطة كيميائياً (مثل الزجاج)، ويجب وضعها في أماكن معزولة ومهواة وبعيدة عن المصادر الحرارية، ويجب ان تكون الحاويات مغلقة بإحكام وعليها بطاقات التوصيف.[ar 16]
مخاطر التخفيف
[عدل]يمكن أن يكون تحضير الحمض المخفف خطيرًا بسبب الحرارة المنبعثة والمنتشرة أثناء عملية التخفيف. ولتجنب تناثر الحمض، عادة ما يُضاف الحمض المركز إلى الماء وليس العكس، وهناك قول مأثور يستخدم لتذكير وهو (بالإنجليزية: Do like you oughta, add the acid to the water) والذي يُترجم إلى "افعل كما ينبغي، أضف الحمض إلى الماء".[68] يتمتع الماء بسعة حرارية أعلى من الحمض، وبالتالي فإن وعاء من الماء البارد سوف يمتص الحرارة عند إضافة الحمض.
| الخاصية الفيزيائية | H2SO4 | H2O | الوحدات |
|---|---|---|---|
| الكثافة | 1.84 | 1.0 | كغ/لتر |
| السعة الحرارية الحجمية | 2.54 | 4.18 | كيلوجول/لتر |
| نقطة الغليان | 337 | 100 | درجة مئوية |
وأيضًا، لأن الحمض أكثر كثافة من الماء، فإنه ينزل إلى قاع الوعاء، وتتولد الحرارة عند السطح البيني بين الحمض والماء، الموجود في قاع الوعاء. الحمض لا يغلي بسبب ارتفاع درجة غليانه، وان ارتفاع الماء الدافئ بالقرب من السطح بسبب الحمل الحراري [ط 106] يعمل على تبريد السطح، ويمنع غليان الحمض أو الماء. على العكس من ذلك، إضافة الماء إلى حمض الكبريتيك المركز يؤدي إلى تكون طبقة رقيقة من الماء على سطح الحمض. تتولد الحرارة في هذه الطبقة الرقيقة من الماء ويمكن أن تغلي، مما يؤدي إلى انتشار رذاذ حمض الكبريتيك أو قد يسبب انفجار.
إن تحضير محاليل بتركيز أكبر من 6 مولار (35%) يعتبر خطيرًا، ما لم يُضاف الحمض ببطء كافٍ للسماح للخليط بوقت كافٍ لكي يبرد. وإلا، فإن الحرارة الناتجة قد تكون كافية لغليان الخليط. وإن التحريك الميكانيكي الفعال والتبريد الخارجي (مثل الحمام الثلجي [ط 107]) ضروريان في عملية التخفيف. وتتضاعف معدلات التفاعل عند كل زيادة قدرها 10 درجات مئوية في درجة الحرارة.[69] لذلك، سيصبح التفاعل أكثر عنفًا مع استمرار عملية التخفيف، ما لم يُعطَ الخليط وقتًا كافياً ليبرد. إن إضافة الحمض إلى الماء الدافئ سيسبب تفاعلًا عنيفًا. في المختبر، يمكن تخفيف حمض الكبريتيك عن طريق سكب الحمض المركز على الثلج المسحوق المُجمد من الماء منزوع الأيونات. يذوب الثلج في عملية ماصة للحرارة أثناء إذابة الحمض، وكمية الحرارة اللازمة لإذابة الثلج في هذه العملية أكبر من كمية الحرارة المتولدة من إذابة الحمض، وبالتالي تبقى المحلول باردًا. بعد ذوبان كل الثلج، يمكن إجراء المزيد من التخفيف باستخدام الماء.
المخاطر الصناعية
[عدل]إن حمض الكبريتيك غير قابل للاشتعال. أما بالنسبة للمخاطر المهنية الرئيسية التي يشكلها هذا الحمض هي ملامسة الجلد التي تؤدي إلى حروق، أو استنشاق الرذاذ. في الولايات المتحدة، يبلغ التعرض المسموح [ط 108] للحمض بمقدار 1 مغ/م3، والحدود في البلدان الأخرى مقاربة.
يؤدي ابتلاع حمض الكبريتيك إلى نقص فيتامين بي12. وقد يتأثر الحبل الشوكي في معظم الحالات، أو قد تظهر الأعصاب البصرية وهو من أعراض داء مزيل للميالين، وفقدان المحاور العصبية، أو الإصابة بالتليف الدبقي. يؤدي التعرض للرذاذ بتركيزات عالية إلى تهيج شديد وفوري للعينين، والجهاز التنفسي، والأغشية المخاطية؛ بالإضافة إلى وجود خطر حدوث وذمة رئوية لاحقة إذا كان الضرر النسيجي أكثر شدة. أما في التركيزات المنخفضة، فإن الأعراض الأكثر شيوعًا للتعرض المزمن لرذاذ حمض الكبريتيك هو تآكل الأسنان، والذي وجد في جميع الدراسات تقريبًا؛ كما يؤدي التعرض المتكرر لرذاذ حمض الكبريتيك إلى تهيج تعرض الجهاز التنفسي وتزيد احتمالية الإصابة بسرطان الرئة بنسبة تصل إلى 64%.[70]
القيود القانونية
[عدل]تخضع تجارة حمض الكبريتيك الدولية للرقابة بموجب اتفاقية الأمم المتحدة ضد الاتجار غير المشروع في المخدرات والمؤثرات العقلية [ط 109] لعام 1988، والتي تدرجه ضمن الجدول الثاني من الاتفاقية باعتباره مادة كيميائية تستخدم بشكل متكرر في التصنيع غير المشروع للمخدرات أو المؤثرات العقلية.[71]
طالع أيضاً
[عدل]الهوامش
[عدل]- ملاحظات
- ^ مثل Physica et Mystica
- ^ اقتباس من الصفحة 393: إن الأمر المثير لغاية الفضول كيف أن الرازي كان قريباً جداً من اكتشاف حمض الكبريتيك، من غير التعرّف حقيقةً على الخواص المذيبة القوية لقطارة زيت الزاج والشب. وما يثير الدهشة بشكل أكبر، كيف أيقن أن القوى التفاعلية لكل من كبريتيد الزرنيخ وملح الأمونيا، على أنها الأرواح الناتجة عن تقطير أملاح الشب
- ^ Liber Aristotilis
- ^ (تحت عنوان Lumen luminum magnum، 'نور الأنوار العظيم')
- ^ ذكر موريو [ط 7] في بحثه أن العمل كان أحياناً يرد من غير ذكر اسم؛ وورد في مستهل [ط 8] العمل باللغة اللاتينية cum de sublimiori atque precipuo rerum effectum ... ونشرت أقسام من العمل في منشور للباحث يوليوس روسكا [ط 9].[16] pp. 56–65
- ^ ذكر موريو أن ريمون المرسيلي المذكور ربما قد كان الفلكي (الذي ازدهر في سنة 1141)؛ أما فرديناند هوفر [ط 13] فلم يزل موقناً [22] أن العمل يعود إلى الرازي؛ إلا أن ذلك الادعاء لم يجد مناصراً له وترك بعد الأبحاث التي قام بها روسكا [23] وباتين [ط 14] [24] وموريو [25]
- ^ مثل عمل Compositum de Compositis المنسوب إلى ألبيرتوس ماغنوس [ط 16]
- ^ مثل عمل Summa perfectionis
- ^ أو تصريف الصخور الحمضي [ط 60]
- مصطلحات
- ^ Pedanius Dioscorides
- ^ Pliny the Elder
- ^ Galen
- ^ Zosimos of Panopolis
- ^ Democritus
- ^ Leyden papyrus X
- ^ Moureau
- ^ incipit
- ^ Julius Ruska
- ^ oleum
- ^ Liber de septuaginta
- ^ Raymond of Marseilles
- ^ Ferdinand Hoefer
- ^ Pattin
- ^ Vincent de Beauvais
- ^ Albertus Magnus
- ^ pseudo-Geber
- ^ oleum sulphuris per campanam
- ^ Conrad Gessner
- ^ Johann Rudolf Glauber
- ^ Joshua Ward
- ^ John Roebuck
- ^ Joseph Louis Gay-Lussac
- ^ John Glover
- ^ Peregrine Phillips
- ^ Dehydration reaction
- ^ Azeotrope
- ^ Hydrate
- ^ Disproportionation
- ^ Resonance
- ^ dielectric constant
- ^ Autoprotolysis
- ^ Molar conductivity
- ^ chamber acid
- ^ tower acid
- ^ Glover tower
- ^ Bjerrum plot
- ^ Hydration reaction
- ^ Exothermic reaction
- ^ polyprotic acid
- ^ Acid dissociation constant
- ^ Hammett acidity function
- ^ Superacid
- ^ Chemical affinity
- ^ Carbon snake
- ^ Fischer esterification
- ^ trihydroxyoxosulfonium hexafluoroantimonate(V)
- ^ displacement reaction
- ^ Reactivity series
- ^ Electrophilic aromatic substitution
- ^ Sulfur–iodine cycle
- ^ Rio Tinto
- ^ Hygroscopy
- ^ Acid rain
- ^ Soil acidification
- ^ Ocean acidification
- ^ Biotope
- ^ Forest dieback
- ^ Acid mine drainage (AMD)
- ^ acid rock drainage (ARD)
- ^ acid neutralizing capacity (ANC)
- ^ aquifer
- ^ Total dissolved solids (TDS)
- ^ stratosphere
- ^ Hydroxyl radical
- ^ Supersaturation
- ^ stratospheric aerosol layer
- ^ Contact process
- ^ Wet sulfuric acid process
- ^ lead chamber process
- ^ Hydrodesulfurization
- ^ Claus process
- ^ Frasch process
- ^ Rotary kiln
- ^ Coordination complex
- ^ Absorption
- ^ Oleum
- ^ Hydration reaction
- ^ Condensation
- ^ metabisulfite method
- ^ electrobromine method
- ^ Electrolysis
- ^ synthetic resins
- ^ Antifreeze
- ^ Fuel cell
- ^ Mannheim process
- ^ pickling agent
- ^ Fouling
- ^ Piranha solution
- ^ microelectronics industry
- ^ Cyclohexanone oxime
- ^ Caprolactam
- ^ Isobutane
- ^ Isobutylene
- ^ isooctane
- ^ octane number
- ^ Electrolyte
- ^ anode
- ^ cathode
- ^ domestic acidic drain cleaners
- ^ Cornea
- ^ Visual impairment
- ^ Personal protective equipment
- ^ strong acid
- ^ corrosive agents
- ^ Convection
- ^ Ice bath
- ^ permissible exposure limit (PEL)
- ^ United Nations Convention Against Illicit Traffic in Narcotic Drugs and Psychotropic Substances
المراجع
[عدل]فهرس المراجع
[عدل]- بالعربية
- ^ قاموس المورد، البعلبكي، بيروت، لبنان
- ^ قاموس مصطلحات الفلاحة (بالعربية والفرنسية). الجزائر العاصمة: المجلس الأعلى للغة العربية بالجزائر. 2018. ص. 16. ISBN:978-9931-681-42-7. OCLC:1100055505. QID:Q121071043.
- ^ المعجم الطبي الموحد نسخة محفوظة 31 ديسمبر 2017 على موقع واي باك مشين.
- ^ أ. د. صلاح مصطفى سلطان (2003). الكيمياء العامة. جامعة الملك فهد - المملكة العربية السعودية: مكتبة العبيكان - الرياض. ص. 346. ISBN:9789960402307. مؤرشف من الأصل في 2024-09-16.
- ^ جاري ميسلر و دونالد تار (2014). الكيمياء غير العضوية - سلسلة الكتب الجامعية المترجمة (العلوم الأساسية). المملكة العربية السعودية - وزارة التعليم العالي: العبيكان للنشر. ص. 203. ISBN:9786035031943.
- ^ د. رضا أحمد عبد المجيد بيومي (2007). أسس علم الأحياء الدقيقة. جامعة الأزهر - القاهرة: مكتبة الأنجلو المصرية. ص. 369. ISBN:9789770523360.
- ^ إدوارد كيلر (Edward A. Keller) (2014). الجيولوجيا البيئية - سلسلة الكتب الجامعية المترجمة (العلوم الأساسية). المملكة العربية السعودية - وزارة التعليم العالي: العبيكان للنشر. ص. 385. ISBN:9786035032070.
- ^ د. عبد الملك عبد الرحمن (2024). الكيمياء في خدمة الإنسان. وكالة الصحافة العربية. ص. 111.
- ^ شريف الحمضي ونور الهدى زيدان (2016). التقنيات الحديثة في تجهيز وتعبئة المبيدات. بيروت - لبنان: دار الكتب العلمية. ص. 20. ISBN:9782745186249.
- ^ أ.د. يسري مصطفى؛ أ. د. الحسيني الطاهر (2020). خلايا الوقود وتحديات تخزين الطاقة (ط. الأولى). المنوفية - جمهورية مصر العربية: مؤسسة الأمة للنشر والتوزيع. ص. 26.
- ^ جورج قنواتي (2019). تاريخ الصيدلة والعقاقير: في العهد القديم والعصر الوسيط. القاهرة: مؤسسة هنداوي. ص. 72. ISBN:978-1-5273-1735-2. QID:Q127608476.
- ^ عثمان عبد الرحمن الصقير، أشرف عبد الرحمن محمد، كامل محمود الموجي (2005). تقنية المجاهر الضوئية والإلكترونية. الرياض - المملكة العربية السعودية: العبيكان للنشر. ص. 190. ISBN:9789960408439.
- ^ سي جوليان تشن (C. Julian Chen) - المترجم: محمد فتحي خضر (2021). فيزياء الطاقة الشمسية. المملكة المتحدة: مؤسسة هنداوي. ص. 403. ISBN:9781527319738.
- ^ د. عبدالله محمود أبو الكباش (2012). الكيمياء التحليلية. الرياض - المملكة العربية السعودية: العبيكان للنشر. ص. 29. ISBN:9789960549422.
- ^ أ. د. جابر بن سالم بن موسى القحطاني (2019). السموم : داء ودواء. الرياض - المملكة العربية السعودية: العبيكان للنشر. ص. 440. ISBN:9786035092555.
- ^ إبراهيم علي الجندي (2007). الأمن الصناعي. كتب عربية.
- بلغات أجنبية
- ^ SULFURIC ACID (بالإنجليزية), QID:Q278487
- ^ ا ب ج sulfuric acid، معهد المعلوماتية الحيوية الأوروبي، QID:Q902623
- ^ ا ب ج Haynes, William M. (2014). CRC Handbook of Chemistry and Physics (بالإنجليزية) (95 ed.). CRC Press. pp. 4–92. ISBN:9781482208689. Archived from the original on 2023-12-21. Retrieved 2018-11-18.
- ^ "Sulfuric acid safety data sheet" (PDF). arkema-inc.com. مؤرشف من الأصل (PDF) في 2012-06-17.
Clear to turbid oily odorless liquid, colorless to slightly yellow.
- ^ ا ب ج د Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ص. A23. ISBN:978-0-618-94690-7.
- ^ Chenier، Philip J. (1987). Survey of Industrial Chemistry. New York: John Wiley & Sons. ص. 45–57. ISBN:978-0-471-01077-7.
- ^ Karpenko، Vladimír؛ Norris، John A. (2002). "Vitriol in the History of Chemistry". Chemické listy. ج. 96 ع. 12: 997–1005. مؤرشف من الأصل في 2024-02-08.
- ^ Karpenko & Norris 2002، صفحات 999–1000.
- ^ Al-Hassan، Ahmad Y. (2001). Science and Technology in Islam: Technology and applied sciences. UNESCO. ISBN:978-92-3-103831-0. مؤرشف من الأصل في 2023-11-13.
- ^ Williams، Alan (2012). The Sword and the Crucible: A History of the Metallurgy of European Swords Up to the 16th Century. Leiden: Brill. ISBN:978-90-04-22783-5. مؤرشف من الأصل في 2023-11-18. p. 104. p. 60.
- ^ Multhauf، Robert P. (1966). The Origins of Chemistry. London: Oldbourne. pp. 140-142.
- ^ Needham، Joseph؛ Ping-Yü، Ho؛ Gwei-Djen، Lu؛ Sivin، Nathan (1980). Science and Civilisation in China. Volume 5, Chemistry and Chemical Technology. Part IV, Spagyrical Discovery and Invention: Apparatus, Theories and Gifts. Cambridge: Cambridge University Press. ISBN:978-0-521-08573-1. مؤرشف من الأصل في 2023-08-11. p. 195, note d. Stapleton، Henry E.؛ Azo، R.F.؛ Hidayat Husain، M. (1927). "Chemistry in Iraq and Persia in the Tenth Century A.D." Memoirs of the Asiatic Society of Bengal. ج. VIII ع. 6: 317–418. OCLC:706947607. مؤرشف من الأصل في 2014-09-23. pp. 333 (on the Liber Bubacaris, cf. p. 369, note 3), 393.
- ^ Needham et al. 1980، p. 195, note d.
- ^ Pattin، Adriaan (1972). "Un recueil alchimique: le manuscrit Firenze, Bibl. Riccardiana, L. III. 13. 119 - Description et documentation". Bulletin de Philosophie Médiévale. ج. 14: 89–107. DOI:10.1484/J.BPM.3.143. pp. 93–94.
- ^ Moureau، Sébastien (2020). "Min al-kīmiyāʾ ad alchimiam. The Transmission of Alchemy from the Arab-Muslim World to the Latin West in the Middle Ages". Micrologus. ج. 28: 87–141. hdl:2078.1/211340. مؤرشف من الأصل في 2023-03-06. p. 114 (no. 20).
- ^ Ruska، Julius (1939). "Pseudepigraphe Rasis-Schriften". Osiris. ج. 7: 31–94. DOI:10.1086/368502. S2CID:143373785.
- ^ Hoefer، Ferdinand (1866). Histoire de la chimie (ط. 2nd). Paris: Librairie de Firmin Didot. مؤرشف من الأصل في 2023-11-14. p. 341.
- ^ Ruska 1939، صفحة 58; Pattin 1972، صفحة 93; Halleux، Robert (1996). "The Reception of Arabic Alchemy in the West". في Rashed، Roshdi (المحرر). Encyclopedia of the History of Arabic Science. London: Routledge. ج. 3. ص. 886–902. ISBN:9780415020633. مؤرشف من الأصل في 2023-11-13. p. 892. طالع أيضاً الأعمال المترجمة لجابر إلى اللاتينية في Moureau 2020، صفحات 111–112.
- ^ Ruska 1939، صفحة 58.
- ^ Ruska 1939، صفحات 58–61.
- ^ Halleux 1996، صفحة 892، Moureau 2020، صفحة 114.
- ^ Hoefer 1866، صفحة 343
- ^ Ruska 1939
- ^ Pattin 1972
- ^ Moureau 2020
- ^ Karpenko & Norris 2002، صفحات 1002–1004.
- ^ Philip J. Chenier (1 أبريل 2002). Survey of industrial chemistry. Springer. ص. 28–. ISBN:978-0-306-47246-6. مؤرشف من الأصل في 2023-11-14. اطلع عليه بتاريخ 2011-12-23.
- ^ "Sulfuric acid" (PDF). Determination of Noncancer Chronic Reference Exposure Levels Batch 2B December 2001. 2001. مؤرشف من الأصل (PDF) في 2003-05-22. اطلع عليه بتاريخ 2012-10-01.
- ^ "Sulfuric Acid 98%" (PDF). rhodia.com. 2009. مؤرشف من الأصل (PDF) في 2011-01-07. اطلع عليه بتاريخ 2014-07-02.
- ^ ا ب ج A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 583.
- ^ ا ب Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (بالإنجليزية) (2 ed.). Butterworth-Heinemann. ISBN:0-08-037941-9.
- ^ Inger Taesler, Ivar Olovsson: Hydrogen Bond Studies. XXXVII. The Crystal Structure of Sulfuric Acid Dihydrate (H3O+)2SO42−, in: J. Chem. Phys., 1969, 51, S. 4213; doi:10.1063/1.1671781.
- ^ Giauque، W. F.؛ Hornung، E. W.؛ Kunzler، J. E.؛ Rubin، T. R. (يناير 1960). "The Thermodynamic Properties of Aqueous Sulfuric Acid Solutions and Hydrates from 15 to 300K. 1". Journal of the American Chemical Society. ج. 82 ع. 1: 62–70. DOI:10.1021/ja01486a014.
- ^ C. Pascard-Billy: Structure Précise de l'Acide Sulfurique, in: Acta Cryst., 1965, 18, S. 827–829; doi:10.1107/S0365110X65002037.
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعkemnitz - ^ Robert L. Kuczkowski, R. D. Suenram, und Frank J. Lovas: Microwave Spectrum, Structure, and Dipole Moment of Sulfuric Acid, in: J. Am. Chem. Soc., 1981, 103, S. 2561–2566; doi:10.1021/ja00400a013.
- ^ Thorsten Stefan and Rudolf Janoschek: How relevant are S=O and P=O Double Bonds for the Description of the Acid Molecules H2SO3, H2SO4, and H3PO4, respectively? in: J. Mol. Model., 2000, 6, S. 282–288, doi:10.1007/PL00010730
- ^ ا ب Th. M. Klapötke, I. C. Tornieporth-Oetting: Nichtmetallchemie, Wiley-VCH, Weinheim, 1994, ISBN 3-527-29052-4.
- ^ ا ب "Sulfuric Acid". The Columbia Encyclopedia (ط. 6th). 2009. اطلع عليه بتاريخ 2010-03-16.
- ^ ا ب ج "Sulphuric acid". Encyclopædia Britannica (ط. 11th). ج. 26. 1910–1911. ص. 65–69.
- ^ "Consortium of Local Education Authorities for the Provision of Science Equipment -STUDENT SAFETY SHEETS 22 Sulfuric(VI) acid" (PDF). مؤرشف من الأصل (PDF) في 2013-03-31.
- ^ "Ionization Constants of Inorganic Acids". .chemistry.msu.edu. مؤرشف من الأصل في 2024-08-26. اطلع عليه بتاريخ 2011-05-30.
- ^ Hall NF، Conant JB (1927). "A Study of Superacid Solutions". Journal of the American Chemical Society. ج. 49 ع. 12: 3062–70. DOI:10.1021/ja01411a010.
- ^ Shakhashiri، Bassam Z.؛ Shreiner، Rodney؛ Bell، Jerry A. (2011). "1.32 Dehydration of Sugar by Sulfuric Acid". Chemical Demonstrations a handbook for teachers of chemistry volume 1. University of Wisconsin Press. ص. 77–78. ISBN:978-0-299-08890-3.
- ^ Dolson، David A.؛ وآخرون (1995). "Carbohydrate Dehydration Demonstrations". J. Chem. Educ. ج. 72 ع. 10: 927. Bibcode:1995JChEd..72..927D. DOI:10.1021/ed072p927. ISSN:0021-9584.
- ^ Helmenstine، Anne (18 فبراير 2020). "Carbon Snake Demo (Sugar and Sulfuric Acid)". Science Notes and Projects. اطلع عليه بتاريخ 2022-07-05.
- ^ Housecroft, Catherine E.؛ Sharpe, Alan G. (2008). "Chapter 16: The group 16 elements". Inorganic Chemistry, 3rd Edition. Pearson. ص. 523. ISBN:978-0-13-175553-6.
- ^ ا ب "Sulfuric acid – uses". dynamicscience.com.au. مؤرشف من الأصل في 2013-05-09.
- ^ Kinney, Corliss Robert؛ Grey, V. E. (1959). Reactions of a Bituminous Coal with Sulfuric Acid (PDF). Pennsylvania State University. مؤرشف من الأصل (PDF) في 2017-04-28.
- ^ Carey, F. A. "Reactions of Arenes. Electrophilic Aromatic Substitution". On-Line Learning Center for Organic Chemistry. University of Calgary. مؤرشف من الأصل في 2008-07-06. اطلع عليه بتاريخ 2008-01-27.
{{استشهاد ويب}}: صيانة الاستشهاد: مسار غير صالح (link) - ^ Ngo، Christian؛ Natowitz، Joseph (2016). Our Energy Future: Resources, Alternatives and the Environment. John Wiley & Sons. ص. 418–419. ISBN:9781119213369.
- ^ Pickard، Paul (25 مايو 2005). "2005 DOE Hydrogen Program Review: Sulfur-Iodine Thermochemical Cycle" (PDF). Sandia National Labs. اطلع عليه بتاريخ 2021-10-08.
- ^ Pelletreau، K.؛ Muller-Parker, G. (2002). "Sulfuric acid in the phaeophyte alga Desmarestia munda deters feeding by the sea urchin Strongylocentrotus droebachiensis". Marine Biology. ج. 141 ع. 1: 1–9. Bibcode:2002MarBi.141....1K. DOI:10.1007/s00227-002-0809-6. S2CID:83697676.
- ^ ا ب Kremser، S.؛ Thomson, L.W. (2016). "Stratospheric aerosol—Observations, processes, and impact on climate" (PDF). Reviews of Geophysics. ج. 54 ع. 2: 278–335. Bibcode:2016RvGeo..54..278K. DOI:10.1002/2015RG000511.
- ^ Krasnopolsky، Vladimir A. (2006). "Chemical composition of Venus atmosphere and clouds: Some unsolved problems". Planetary and Space Science. ج. 54 ع. 13–14: 1352–1359. Bibcode:2006P&SS...54.1352K. DOI:10.1016/j.pss.2006.04.019.
- ^ Orlando، T. M.؛ McCord، T. B.؛ Grieves، G. A. (2005). "The chemical nature of Europa surface material and the relation to a subsurface ocean". Icarus. ج. 177 ع. 2: 528–533. Bibcode:2005Icar..177..528O. DOI:10.1016/j.icarus.2005.05.009.
- ^ Hermann Müller "Sulfuric Acid and Sulfur Trioxide" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. 2000 دُوِي:10.1002/14356007.a25_635
- ^ E. R. Riegel und J. A. Kent: Riegel's Handbook of Industrial Chemistry. Springer 2003. ISBN 0-306-47411-5, S. 503.
- ^ Hans Kühne, "Entwicklung des Gips-Schwefelsäure-Verfahrens nach Müller-Kühne" (in German), Chemie Ingenieur Technik – CIT 21 (11-12): pp. 227–229, doi:10.1002/cite.330211105
- ^ ا ب O.B. Lapina, B.S. Bal'zhinimaev, S. Boghosian, K.M. Eriksen, R. Fehrmann: Progress on the mechanistic understanding of SO2 oxidation catalysts, in: Catalysis Today, 1999, 51, S. 469–479, doi:10.1016/S0920-5861(99)00034-6.
- ^ Jones، Edward M. (1950). "Chamber Process Manufacture of Sulfuric Acid". Industrial and Engineering Chemistry. ج. 42 ع. 11: 2208–2210. DOI:10.1021/ie50491a016.
- ^ Chenier، Philip J. (1987). Survey of Industrial Chemistry. New York: John Wiley & Sons. ص. 45–57. ISBN:978-0-471-01077-7.Chenier, Philip J. (1987).
- ^ Davenport, William George؛ King, Matthew J. (2006). Sulfuric acid manufacture: analysis, control and optimization. Elsevier. ص. 8, 13. ISBN:978-0-08-044428-4. اطلع عليه بتاريخ 2011-12-23.
- ^ "Sulfuric acid". essentialchemicalindustry.org. مؤرشف من الأصل في 2024-09-04.
- ^ "16. Laboratory Procedures". Sci.chem FAQ. اطلع عليه بتاريخ 2008-01-11.
- ^ "BASF Chemical Emergency Medical Guidelines – Sulfuric acid (H2SO4)" (PDF). BASF Chemical Company. 2012. مؤرشف من الأصل (PDF) في 2019-06-14. اطلع عليه بتاريخ 2014-12-18.
- ^ "Sulfuric acid – uses". dynamicscience.com.au. مؤرشف من الأصل في 2013-05-09. اطلع عليه بتاريخ 2024-07-16..
- ^ Snyder, Lucy A. (4 Nov 2005). "Do like you oughta, add acid to water". Lucy A. Snyder (بالإنجليزية الأمريكية). Retrieved 2022-01-23.
- ^ لينوس باولنغ (1988) General Chemistry, Dover Publications
- ^ Beaumont، JJ؛ Leveton، J؛ Knox، K؛ Bloom، T؛ McQuiston، T؛ Young، M؛ Goldsmith، R؛ Steenland، NK؛ Brown، DP؛ Halperin، WE (1987). "Lung cancer mortality in workers exposed to sulfuric acid mist and other acid mists". J Natl Cancer Inst. ج. 79 ع. 5: 911–21. DOI:10.1093/jnci/79.5.911. PMID:3479642.
- ^ "Annex to Form D ("Red List"), 11th Edition" (PDF). Vienna, Austria: International Narcotics Control Board. يناير 2007. ص. 4. مؤرشف (PDF) من الأصل في 2008-02-27.




![{\displaystyle {\underset {\text{polysaccharide}}{{\ce {[C6H10O5]}}_{n}}}\longrightarrow 6n\ {\ce {C}}+5n\ {\ce {H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fc5b432fe56cddc7fd4e08fda4502ba801cd3d07)



![{\displaystyle {\ce {{[(CH3)3SiO]2SO2}+ 3 HF + SbF5 -> {[H3SO4]}^{+}{[SbF6]}^{-}+ 2 (CH3)3SiF}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e9ce7cfb6b9905bce2c4f7c475308c65db3c1c3)































