حمض النتريك
| حمض النتريك | |
|---|---|
 |
|
| الخواص | |
| الصيغة الجزيئية | HNO₃[1] |
| الكثافة | 1.5 غرام لكل سنتيمتر مكعب[2] |
| نقطة الانصهار | -44 درجة فهرنهايت[2]، و-41.6 درجة حرارة مئوية[3] |
| نقطة الغليان | 181 درجة فهرنهايت[2]، و83 درجة حرارة مئوية[3] |
| حموضة (pKa) | -1.64 |
| المعرفات | |
| CAS | 7697-37-2، و12507-77-6 |
| بوب كيم | 944 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
حمض النتريك (HNO3) أو الماء القوي (من اللاتينية aqua fortis) أو روح النتر، أو حمض الآزوت[5] هو حمض معدني أكال جدًّا. حمض النتريك النقي عديم اللون، ولكن النماذج القديمة منه تميل إلى اكتساب لون أصفر بسبب تفكّكه إلى أكاسيد النيتروجين والماء. يتوفر حمض النتريك تجاريًا بتراكيز تصل إلى 68% في الماء. إذا احتوى محلول على نسبة أعلى من 86% من حمض النتريك فيسمى حينئذٍ بحمض النتريك المدخن، وهو على نوعين بالاعتماد على كمية ثنائي أكسيد النيتروجين الموجودة فيه، فإن تجاوزت نسبة حمض النتريك 86% يسمى بحمض النتريك المدخن الأحمر، أما إذا تجاوزت النسبة 95% فيسمى حينئذٍ بحمض النتريك المدخن الأبيض.
حمض النتريك هو العامل الأساسي في عملية النترتة (إضافة مجموعة النيترو إلى المركبات العضوية). تنتج من هذه العملية بعض المركبات المتفجرة التي تكون حساسة للصدمة والحرارة، ومركبات أخرى تكون مستقرة إلى درجة معينة لتستخدم في الذخائر وعمليات التفجير، ومركبات أخرى تكون أكثر استقرارًا وتستخدم كملونات في الأصباغ والأحبار.
يشيع استخدام حمض النتريك كعامل مؤكسد قوي.
الخصائص الكيميائية والفيزيائية
[عدل]يتوفر حمض النتريك تجاريًا على هيئة مخلوط أزيوتروبي مع الماء بتركيز 68% من HNO3. درجة غليان هذا المحلول هي 120.5 مئوية تحت ضغط 1 atm، ويعرف بحمض النتريك المركز. أما حمض النتريك المركز النقي فيكون سائلًا عديم اللون في درجة حرارة الغرفة.
يتميئ حمض النتريك بطريقتين الأولى يحتوي فيها على جزيئة ماء واحدة (HNO3·H2O أو H3O]NO3) والثانية يحتوي فيها على ثلاث جزيئات من الماء (HNO3·3H2O).
في بعض الأحيان يستخدم مقياس قديم للكثافة للإشارة إلى حمض النتريك المركز بالرمز 42° بوميه.[6]
يعرض الجدول التالي نبذة عن بعض الخصائص الفيزيائية لمحاليل حمض النتريك المائية بتراكيز مختلفة (في درجة حرارة 20 مئوية وضغط 1 بار):[7]
| نسبة كتلة HNO3 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| تركيز HNO3 (mol/L) | 0 | 1,7 | 3,6 | 5,6 | 7,9 | 10,4 | 13,0 | 15,8 | 18,5 | 21 | 24,01 |
| الكثافة (g/cm3) | 1,00 | 1,05 | 1,12 | 1,18 | 1,25 | 1,31 | 1,37 | 1,42 | 1,46 | 1,48 | 1,513 |
| اللزوجة (mPa·s) | 1,00 | 1,04 | 1,14 | 1,32 | 1,55 | 1,82 | 2,02 | 2,02 | 1,84 | 1,47 | 0,88 |
| درجة الانصهار (°C) | 0 | −7 | −17 | −36 | −30 | −20 | −22 | −41 | −39 | −60 | −42 |
| درجة الغليان (°C) | 100,0 | 101,2 | 103,4 | 107,0 | 112,0 | 116,4 | 120,4 | 121,6 | 116,6 | 102,0 | 86,0 |
| الضغط الجزئي HNO3 (mbar) | 0,0 | 0,0 | 0,0 | 0,0 | 0,0 | 0,3 | 1,2 | 3,9 | 14,0 | 36,0 | 60,0 |
| الضغط الجزئي H2O (mbar) | 23,3 | 22,6 | 20,2 | 17,6 | 14,4 | 10,5 | 6,5 | 3,5 | 1,2 | 0,3 | 0,0 |
التلوث بثنائي أكسيد النيتروجين
[عدل]
يكون حمض النتريك عرضة للتحلل الحراري أو الضوئي ولهذا السبب يُخزن في عبوات زجاجية داكنة:
قد ينتج عن هذا التفاعل تغيرات في الضغط البخاري فوق السائل لا يمكن تجاهلها؛ وذلك لأن أكاسيد النيتروجين الناشئة تذوب جزئيًا أو كليًا في الحمض.
يبقى ثنائي أكسيد النيتروجين NO2 ذائبًا في حمض النتريك ويلوّنه باللون الأصفر وقد يتحول اللون إلى الأحمر في درجات الحرارة المرتفعة. يميل الحمض إلى إطلاق أبخرة بيضاء عند تعرضه للهواء، ولكن الحمض الملوث بثنائي أكسيد النيتروجين يطلق أبخرة حمراء أو بنية، ومن هنا نشأت تسمية حمض النتريك المدخن الأبيض وحمض النتريك المدخن الأحمر.
حمض النتريك المدخن
[عدل]يحتوي حمض النتريك المدخن التجاري على 98% من حمض النتريك وكثافته 1.50 g/cm3، ويستخدم غالبًا في صناعة المتفجرات. يكون هذا النوع من حمض النتريك أقل تطايرًا وضررًا من حمض النتريك اللامائي ويصل تركيزه تقريبًا إلى 21.4M.
يحتوي حمض النتريك المدخن الأحمر (يرمز له اختصارا RNFA) على كميات كبيرة من ثنائي أكسيد النيتروجين الذائب والذي يمنح السائل لونًا أحمر بنيًّا، ونتيجة لذلك تنخفض كثافة حمض النتريك المدخن الأحمر لتصل إلى 1.490 g/cm3.
حمض النتريك اللامائي
[عدل]حمض النتريك المدخن الأبيض أو حمض النتريك النقي (يرمز له اختصارًا WFNA) مقارب جدًّا لحمض النتريك اللامائي، ويتوفّر بتركيز 99.9%. يجب أن لا تتجاوز نسبة الماء في حمض النتريك المدخن الأبيض 2% ونسبة ثنائي أكسيد النيتروجين الذائب 0.5%. تصل كثافة حمض النتريك اللامائي إلى 1.513 g/cm3 ويصل تركيزه إلى 24M تقريبًا.
التركيب والبنية
[عدل]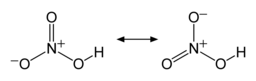
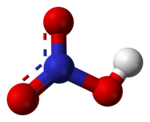
توجد رابطتا N-O متماثلتين وقصيرتين نسبيًا في جزيئة حمض النتريك (يمكن تفسير ذلك بنظرية الرنين، إذ تظهر خصائص الرابطة المزدوجة في هاتين الرابطتين ما يجعلهما أقصر من آصرة N-O الطبيعية)، ورابطة N-O ثالثة طويلة بسبب ارتباط ذرة الأكسجين فيها ببروتون أيضًا.[8][9]
التفاعلات
[عدل]الخصائص الحامضية والقاعدية
[عدل]يعد حمض النتريك عادة حمضًا قويًا في درجات الحرارة المعتدلة. هناك اختلاف حول قيمة ثابت تحلل الحمض على الرغم من تسجيل قيمة pka لتكون أقل من −1. وهذا يعني أن حمض النتريك في المحاليل المخفة يتفكك كليًّا باستثناء بعض محاليل الأحماض القوية جداً. ترتفع قيمة pka إلى 1 في درجة 250 مئوية.[10]
يسلك حمض النتريك سلوك القاعدة عند تفاعله مع حمض الكبريتيك:
ثابت التوازن: K ≈ 22
أيون النيترونيوم هو العامل الفعال في تفاعلات النيترة الأروماتية.
لما كان حمض النتريك يمتلك خصائص حامضية وقاعدية، فبإمكانه إجراء تفاعلات التحلل البروتوني الذاتي كما هو الحال في التأين الذاتي للماء:
التفاعل مع الفلزات
[عدل]
يتفاعل حمض النتريك مع معظم الفلزات، ولكن تفاصيل هذه التفاعلات تعتمد على تركيز الحامض وطبيعة الفلز، فحمض النتريك المخفف يسلك السلوك الطبيعي للأحماض في تفاعلاتها مع معظم الفلزات. يحرّر المغنيسيوم والمنغنيز والزنك غاز الهيدروجين:

يؤكسد حمض النتريك الفلزات الخاملة مثل النحاس والفضة، وتعتمد طبيعة الناتج على درجة حرارة الحمض وتركيزه. فعلى سبيل المثال يتفاعل النحاس مع حمض النتريك المخفف في درجة الحرارة المعتدلة بنسبة 3:8:
يتفاعل أكسيد النتريك المتكون مع الأكسجين الجوي لتكوين ثنائي أكسيد النيتروجين، أما في حال كان الحمض مركّزًا فسيتكون ثنائي أكسيد النيتروجين مباشرة في تفاعل بنسبة 1:4
ينتج عن تفاعل معظم الفلزات مع حمض النتريك ملح النترات المقابل، وتعطي بعض أشباه الفلزات والفلزات الأكاسيد المقابلة لها، فعلى سبيل المثال تتأكسد العناصر Sn وAs وSb وTi إلى SnO2 و As2O5 و Sb2O5 و TiO2 على التوالي.[11]

لا تتفاعل بعض المعادن الثمينة مثل الذهب الخالص وعناصر مجموعة البلاتينوم مع حمض النتريك، ولكن الذهب الخالص يتفاعل مع الماء الملكي، وهو مزيج من حمض النتريك وحمض الهيدروكلوريك. ولكن يمكن لبعض العناصر (مثل الفضة والنحاس)الموجودة في بعض سبائك الذهب التي تكون فيها نسبة الذهب منخفضة مثل الذهب الملون، يمكن لهذه العناصر أن تتأكسد بسهولة وتذوب في حمض النتريك، ليتغير بذلك اللون الخارجي لسبيكة الذهب. يستخدم حمض النتريك كطريقة منخفضة التكلفة في متاجر الحلي والمجوهرات للكشف عن الذهب الرديء (أقل من 14 قيراط) وكطريقة سريعة لتقدير نقاوة الذهب.
حمض النتريك عامل مؤكسد قوي، ويتفاعل بشدة مع العديد من مركبات أشباه الفلزات وقد يكون التفاعل متفجّرًا. وتتغير نتيجة هذه التفاعلات بتغير تركيز الحمض ودرجة حرارة التفاعل والعوامل المختزلة المضافة إلى التفاعل. يحدث التفاعل مع جميع الفلزات باستثناء الفلزات النبيلة وبعض السبائك. وكقاعدة عامة، يمكن القول بأن تفاعلات الأكسدة تحدث بصورة أساسية بوجود تراكيز مرتفعة من الحمض وينتج عنها ثنائي أكسيد النيتروجين في الغالب، ولكن قوة الأكسدة المرتفعة لحمض النتريك حرارية في طبيعتها، وقد تكون هذه التفاعلات غير مفضلة حركيًا. ويجدر الذكر أن وجود كميات ضئيلة من حمض النتروز (HNO2) يزيد من سرعة هذه التفاعلات زيادة ملحوظة.[11]
يذوب كل من الكروميوم (Cr) والحديد (Fe) والألمنيوم (Al) بسهولة في حمض النتريك المخفف. ولكن معاملتها مع حمض النتريك المركز يؤدي إلى تكوين طبقة من أكسيد الفلز التي تحمي بقية الفلز من التأكسد. تسمى عملية تكوين طبقة الحماية هذه بعملية التخميل. تتدرج تراكيز التخميل عادة بين 20% و 50% من الحجم، والفلزات التي تحدث فيها هذه العملية هي الحديد والكوبالت والكروميوم والنيكل والألمنيوم.[11]
التفاعل مع اللافلزات
[عدل]حمض النتريك عامل مؤكسد قوي، ويتفاعل بشدة مع العديد من المركبات العضوية وتكون هذه التفاعلات متفجرة في بعض الأحيان. تسحب مجموعة الهيدروكسيل عادة الهيدروجين من الجزيئة العضوية لتكوين الماء، وتحل مجموعة النايترو المتبقية محل الهيدروجين. تعد عملية نيترة المركبات العضوية باستخدام حمض النتريك الطريقة الأساسية لتصنيع عددٍ من المتفجرات المعروفة، مثل النيتروغليسيرين والتي إن تي. ينتج عن هذه التفاعلات العديد من النواتج العرضية غير المستقرة؛ لذا يجب التحكم في هذه التفاعلات حراريًا وإزالة النواتج العرضية لعزل الناتج المطلوب.
يؤكسد حمض النتريك اللافلزات -باستثناء النيتروجين والأكسجين والغازات النبيلة والسيليكون والهالوجينات عدا اليود- إلى أعلى حالة تأكسدية مكونًا حوامضها إلى جانب تكون ثنائي أكسيد النيتروجين عند استخدام حمض النتريك المركز وأكسيد النتريك عند استخدام الحمض المخفف:
أو
يؤكسد حمض النتريك المركز اليود I2 والفوسفور P4 والكبريت الثماني S8 إلى حمض الأيوديك وحمض الفوسفوريك وحمض الكبريتيك على التوالي.[11] على الرغم من تفاعل حمض النتريك مع الغرافيت والكربون غير البلوري، إلا أنّه لا يتفاعل مع الألماس؛ ولهذا يستخدم حمض النتريك لفصل الألماس عن الكرافيت.[12]
كشف الزانثوبروتيك
[عدل]يتفاعل حمض النتريك مع البروتينات لتكوين ناتج نيترة أصفر اللون. يعرف هذا التفاعل بتفاعل الزانثوبروتيك. يُجرى هذا التفاعل بإضافة حمض النتريك المركز إلى المادة المراد اختبارها، ثم تسخين المزيج. إن احتوى البروتين على أحماض أمينية ذات حلقات عطرية، فإن لون المزيج سينقلب إلى الأصفر، وتؤدي إضافة قاعدة مثل الأمونيا إلى تحويل لون المزيج للبرتقالي. تغير الألوان هذا ناتج من الحلقات العطرية في البروتين.[13][14] يتكون حمض الزانثوبروتيك عند ملامسة الحمض لخلايا النسيج الطلائي، وظهور بقع صفراء على الجلد مؤشر على عدم مراعاة شروط السلامة عند التعامل مع حمض النتريك.
التصنيع
[عدل]يُصنّع حمض النتريك بمفاعلة ثنائي اكسيد النيتروجين مع الماء:
يمكن اختصار التفاعل أعلاه إلى:
تعاد أكسدة أكسيد النتريك المتكون في العادة بواسطة الأكسجين الجوي لإنتاج المزيد من ثنائي أكسيد النيتروجين.
تساعد عملية تمرير غاز ثنائي أكسيد النيتروجين عبر بيروكسيد الهيدروجين إلى زيادة منتوج الحمض.
تتدرج نسبة حمض النتريك في المحاليل التجارية بين 52% و 68%، ويصنّع بواسطة عملية أوستفالد التي سمّيت باسم الكيميائي الألماني فيلهلم أوستفالد. تتأكسد الأمونيا اللامائية في هذه العملية إلى أكسيد النتريك بوجود البلاتين أو شبكة رقيقة من الروديوم كعامل مساعد في درجات حرارة مرتفعة تصل إلى 500 K وتحت ضغط يصل إلى 9 atm.
يتفاعل بعد ذلك أكسيد النتريك مع الأكسجين الجوي لتكوين ثنائي أكسيد النيتروجين:
يمتص الناتج بعد ذلك في الماء لتكوين حمض النتريك وأكسيد النتريك:
تعاد أكسدة أكسيد النتريك مرة أخرى. يمكن إجراء الخطوة الأخيرة في الهواء:
يمكن زيادة تركيز المحلول المائي لحمض النتريك بواسطة التقطير ليصل إلى 68% من الكتلة. ويمكن الوصول إلى تراكيز أعلى 98% باستخدام عملية نزع الماء (البلمهة) بواسطة حمض الكبريتيك المركز. إذا استخدمت الأمونيا الناتجة من عملية هابر، فيمكن حينئذٍ إنتاج حمض النتريك من النيتروجين والهيدروجين والأكسجين كمواد أولية، وهي عناصر يمكن الحصول عليها من الهواء والغاز الطبيعي.[15]
في المختبر
[عدل]
يُصنع حمض النتريك مختبريًا بواسطة التحلل الحراري لنترات النحاس الثنائي والذي ينتج عنه غازا ثنائي أكسيد النيتروجين و الأكسجين، واللذان يمرّران عبر الماء للحصول على حمض النتريك:
ثم تستخدم عملية أوستفالد لإنتاج حمض النتريك:
يمكن الحصول على حمض النتريك بمفاعلة كميات متساوية من أيٍّ من أملاح النترات مثل نترات الصوديوم مع حمض الكبريتيك ثم تقطير المزيج الناتج عند درجة غليان حمض النتريك وهي 83 مئوية لتتبقى كبريتات الفلز الهيدروجينية في وعاء التقطير. ويمكن تحويل حمض النتريك المدخن الأحمر إلى حمض النتريك المدخن الأبيض.[16]
يمكن إزالة أكاسيد النيتروجين المتكونة بسهولة باستخدام ضغط مختزل في درجة حرارة الغرفة (10 إلى 30 دقيقة تحت ضغط 200 مليمتر زئبق أو 27 كيلوباسكال) للحصول على حمض النتريك المدخن الأبيض. ويمكن تنفيذ هذه العملية تحت ضغط مختزل ودرجة حرارة الغرفة بخطوة واحدة وذلك لتجنب إنتاج كميات كبيرة من غاز ثنائي أكسيد النيتروجين.[17]
الاستخدامات
[عدل]يستخدم حمض النتريك بصورة أساسية في إنتاج الأسمدة. يُعادل حمض النتريك مع الأمونيا لإنتاج نترات الأمونيوم، ويستهلك هذا التفاعل 75 إلى 80% من 26 مليون طن من حمض النتريك المنتجة سنويًا (1987).[18] يستخدم حمض النتريك كذلك في إنتاج المتفجرات، وكمادة بادئة لإنتاج النايلون وبعض المركبات العضوية.
مادة بادئة لمركبات النيتروجين العضوية
[عدل]تعد مجموعة النترو من المجاميع الوظيفية المهمّة في الاصطناع العضوي سواء في الصناعة أو غيرها.
يضيف مزيج من حمض النتريك الكبريتيك مجموعة نايترو إلى المركبات العطرية بواسطة تفاعل استبدال عطري محب للإلكترونات. تستخدم هذه الطريقة لإنتاج العديد من المتفجرات ومنها التي إن تي:
- C6H5CH3 + 3 HNO3 → C6H2(NO2)3CH3 + 3 H2O
يمكن امتصاص الكميات الفائضة من الماء باستخدام حمض الكبريتيك المركز:
تختزل مجموعة النترو لإنتاج مجموعة الأمين، ويمكن باستخدام هذه الطريقة إنتاج الأنيلين من مركبات نتروبنزين مختلفة:
عامل مؤكسد
[عدل]تنتج كميات كبيرة من المادة البادئة للنايلون ولحمض الأديبيك بأكسدة زيت KA وهو مزيج من حلقي الهكسانون وحلقي الهكسانول باستخدام حمض النتريك.[18]
وقود الصواريخ
[عدل]يستخدم حمض النتريك بأصناف مختلفة كعامل مؤكسد في الصواريخ ذات الوقود السائل. وتشمل هذه الأصناف حمض النتريك المدخن الأحمر، وحمض النتريك المدخن الأبيض، ومزيج مع حمض الكبريتيك، إضافة إلى استخدام هذه الأصناف مع مثبط HF.[19] وقد استخدم IRFNA (اختصار لحمض النتريك المدخن الأحمر المثبط) كأحد المكونات الثلاثة للوقود السائل للصاروخ BOMARC المصنوع من قبل القوات الجوية الأمريكية سنة 1958 إبان الحرب الباردة.[20]
معالجة المعادن
[عدل]يستخدم حمض النتريك لأكسدة الفلزات، مثل تحويل النحاس إلى نترات النحاس. يستخدم حمض النتريك مع مزيج من حمض الهيدروكليك (يعرف المزيج بالماء الملكي) لإذابة الفلزات النبيلة مثل الذهب لتكوين حمض كلورو الذهبيك. تستخدم هذه الأملاح لتنقية الذهب ومعادن أخرى إلى نسبة 99.9% بواسطة عمليات إعادة التبلور والترسيب الانتقائي.
الأعمال الخشبية
[عدل]يستخدم حمض النتريك بتراكيز منخفضة (10% تقريبًا) في تعتيق خشب الصنوبر والقيقب. يتلون الخشب في هذه العملية بلون رمادي ذهبي ليصبح شبيهًا بالخشب المشمّع القديم.[21]
الأمان
[عدل]حمض النيتريك هو حمض أكال وعامل مؤكسد قوي. يتمثل الخطر الرئيسي الذي يمثله في الحروق الكيميائية، حيث إنه يؤدي إلى التحلل الحمضي بالبروتينات (الأميد) والدهون (الإستر) ، مما يؤدي بالتالي إلى تحلل الأنسجة الحية (مثل الجلد واللحم). يتسبب حمض النيتريك المركز في تلطيخ جلد الإنسان باللون الأصفر نتيجة تفاعله مع الكيراتين. تتحول هذه البقع الصفراء إلى اللون البرتقالي عند تحييدها.[22] الآثار الجهازية غير مرجحة، ولا تعتبر المادة مادة مسرطنة أو مطفرة.[23]
العلاج القياسي للإسعافات الأولية لانسكاب الأحماض على الجلد، كما هو الحال بالنسبة للعوامل المسببة للتآكل الأخرى، وهو الري بكميات كبيرة من الماء. يستمر الغسيل لمدة 10-15 دقيقة على الأقل لتبريد الأنسجة المحيطة بالحرق الحمضي ولمنع حدوث أضرار ثانوية. تتم إزالة الملابس الملوثة على الفور وغسل الجلد تحتها جيدًا.
كونه عامل مؤكسد قوي، يمكن لحمض النيتريك أن يتفاعل مع مركبات مثل السيانيد أو الكربيدات أو المساحيق المعدنية بشكل متفجر ومع العديد من المركبات العضوية، مثل زيت التربنتين، بعنف وبطريقة شديدة (أي الاشتعال الذاتي). وبالتالي ، يجب تخزينها بعيدًا عن القواعد والمواد العضوية.
استخدم في الهجمات الحمضية
[عدل]يعد حمض النيتريك أحد أكثر أنواع الأحماض شيوعًا المستخدمة في اعتداءات الرش بالحمض.[24]
التاريخ
[عدل]ورد ذكر حمض النتريك لأول مرة في أعمال الكيميائي الفارسي محمد بن زكريا الرازي (854-925)[25] ثم ورد تحضيره لاحقًا في كتابات جابر الزائف والذي أشار إلى طريقة الكيميائي العربي جابر بن حيان[26] إذ يكلس مزيج من النتر والشب والزاج الأزرق. وفي القرن الثالث عشر ورد وصف حمض النتريك في كتابات ألبيرتوس ماغنوس ورامون لول الذي حضّر هذا المركب بتقطير مزيج من النتر والزاج الأخضر وسمّاه بالماء القوي aqua fortis.[27][28]
وفي القارن السابع عشر، وصف يوهان رودولف غلاوبر طريقة تحضير حمض النتريك بتقطير نترات البوتاسيوم مع حمض الكبريتيك، وقد أشار أنطوان لافوازييه سنة 1776 إلى عمل جوزيف بريستلي ليستنتج أن بالإمكان تحضير حمض النتريك من أكسيد النتريك (الذي أسماه بهواء النيتروجين) «مع مزيج من أحجام متساوية تقريبًا من الجزء الأنقى من الهواء وكمية وفيرة من الماء».[29] تمكن هنري كافنديش سنة 1785 من تحديد تركيب حمض النتريك وأثبت أنّ بالإمكان تصنيعه بتمرير تيار من الشرارات الكهربائية عبر رطوبة الهواء.[27] وفي العام 1806 سجّل همفري ديفي نتائج تجاربه المكثفة في التحلل الكهربائي للماء ليخلص إلى نتيجة مفادها أنّ حمض النتريك ينتج عند القطب السالب نتيجة لذوبان غاز النيتروجين الجوي. استخدم همفري ديفي بطارية ذات فولتية عالية وأقطاب وأوعية تفاعل خاملة مثل أقطاب من أقماع ذهبية والتي تضاعفت عند توصيل الأوعية باستخدام الأسبستوس الرطب.[30]
كانت عملية بيركلاند إيد فاتحة عمليات الإنتاج الصناعي لحمض النتريك من الهواء الجوي سنة 1905، وتعرف هذه العملية كذلك بعملية القوس.[31] يتأكسد النيتروجين الجوي في هذه العملية بواسطة الأكسجين الجوي وباستخدام قوس كهربائي ذي درجة حرارة مرتفعة، ليتحول النيتروجين إلى أكسيد النتريك، وكانت نسبة الناتج 4 إلى 5% في درجة حرارة 3000 مئوية، وتنخفض هذه النسبة في درجات الحرارة الأوطأ.[31][32] يبرد أكسيد النتريك ثم يُؤكسد بواسطة ما تبقى من الأكسجين الجوي إلى ثنائي أكسيد النيتروجين، والذي يمتصّه الماء بعد ذلك عبر سلسلة من أبراج الامتصاص ذات الأعمدة المعبئة أو المصفحة لإنتاج حمض النتريك المخفف.
ينقل البرج الأول غاز ثنائي أكسيد النيتروجين عبر الماء وقطع من الكوارتز الخامل. لا يتفاعل حوالي 20% من أكاسيد النيتروجين الناتجة؛ لذا فإنّ البرج النهائي يحتوي على محلول قلوي لمعادلة ما تبقى من هذه الأكاسيد.[33] تستهلك هذه الطريقة مقدارًا كبيرًا من الطاقة وقد حلّت محلّها عملية أوستفالد بعد توفّر الأمونيا بأثمان زهيدة.
تمكن المهندس الفرنسي ألبرت نودون سنة 1913 من اختراع طريقة أخرى لإنتاج حمض النتريك. ينتج حمض النتريك في هذه الطريقة من التحلل الكهربائي لنترات الكالسيوم الناتجة من بكتريا في مواد نيتروجينية موجودة في الخث المنتشر في المناطق الطينية الرطبة. تُغطس قطعة من الخزف المحاطة بالجير داخل الخث ثم تثبت باستخدام خشب مغطى بالقطران وذلك لبناء مقصورة لقطب الأنود الكربوني والذي سيتشكّل حوله حمض النتريك. يُضخ حمض النتريك إلى الخارج عن طريق أنبوبة زجاجية تصل إلى قاع القطعة الخزفية، ويُضخ الماء النقي إلى أعلى القطعة الخزفية عبر أنبوبة زجاجية أخرى للتعويض عن السائل المسحوب، وتملأ المقصورة بفحم الكوك. أما قطب الكاثود فكان من الحديد الزهر الذي يحيط بالخث. تنشأ مقاومة قدرها 3 أوم لكل متر مكعب وتزود العملية بمقدار 10 فولت تقريبًا من الكهرباء، ويصل إنتاج مستنقع واحد إلى 800 طن سنويًا.[34][35]
أدى ظهور عملية هابر لإنتاج الأمونيا بكفاءة عالية سنة 1913 إلى انحسار عملية بيركلاند إيد أمام عملية أوستفالد، ولا تزال الأخيرة مستخدمة لإنتاج حمض النتريك في الوقت الحاضر.
اقرأ أيضا
[عدل]روابط خارجية
[عدل]- بطاقة السلامة الكيميائية الدولية لحمض النتريك.
مراجع
[عدل]- ^ ا ب ج د NITRIC ACID (بالإنجليزية), QID:Q278487
- ^ ا ب ج http://www.cdc.gov/niosh/npg/npgd0447.html.
{{استشهاد ويب}}:|url=بحاجة لعنوان (مساعدة) والوسيط|title=غير موجود أو فارغ (من ويكي بيانات) (مساعدة) - ^ ا ب David R. Lide, Jr. (1993). Basic laboratory and industrial chemicals: A CRC quick reference handbook (بالإنجليزية). CRC Press. ISBN:978-0-8493-4498-5. OL:1415774M. QID:Q22236188.
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ قاموس مصطلحات الفلاحة (بالعربية والفرنسية). الجزائر العاصمة: المجلس الأعلى للغة العربية بالجزائر. 2018. ص. 16. ISBN:978-9931-681-42-7. OCLC:1100055505. QID:Q121071043.
- ^ Dean، John (1992). Lange's Handbook of Chemistry (ط. 14). ماكجرو هيل التعليم. ص. 2.79–2.80. ISBN:978-0-07-016194-8. مؤرشف من الأصل في 2021-03-08.
- ^ (بالإنجليزية) M. Thiemann, E. Scheibler & K.W. Wiegand (2005) - Nitric Acid, Nitrous Acid, and Nitrogen Oxides in Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim نسخة محفوظة 3 مايو 2016 على موقع واي باك مشين.
- ^ Luzzati, V. (1951). "Structure cristalline de l'acide nitrique anhydre". Acta Crystallographica (بالفرنسية). 4 (2): 120–131. DOI:10.1107/S0365110X51000404.
- ^ Allan، D. R.؛ Marshall، W. G.؛ Francis، D. J.؛ Oswald، I. D. H.؛ Pulham، C. R.؛ Spanswick، C. (2010). "The crystal structures of the low-temperature and high-pressure polymorphs of nitric acid" (PDF). Dalton Trans. (Submitted manuscript). ج. 39 ع. 15: 3736–3743. DOI:10.1039/B923975H. PMID:20354626. مؤرشف من الأصل (PDF) في 2020-07-23.
- ^ IUPAC SC-Database A comprehensive database of published data on equilibrium constants of metal complexes and ligands نسخة محفوظة 2020-05-09 على موقع واي باك مشين.
- ^ ا ب ج د Catherine E. Housecroft؛ Alan G. Sharpe (2008). "Chapter 15: The group 15 elements". Inorganic Chemistry (ط. 3rd). Pearson. ISBN:978-0-13-175553-6.
- ^ Ōsawa، Eiji (ديسمبر 2007). "Recent progress and perspectives in single-digit nanodiamond". Diamond and Related Materials. ج. 16 ع. 12: 2018–2022. Bibcode:2007DRM....16.2018O. DOI:10.1016/j.diamond.2007.08.008.
- ^ Sherman، Henry Clapp (2007). Methods of organic analysis. Read Books. ص. 315. ISBN:978-1-4086-2802-7.
- ^ Knowles، Frank (2007). A practical course in agricultural chemistry. Read Books. ص. 76. ISBN:978-1-4067-4583-2.
- ^ Considine, Douglas M.، المحرر (1974). Chemical and process technology encyclopedia. New York: McGraw-Hill. ص. 769–72. ISBN:978-0-07-012423-3. مؤرشف من الأصل في 2020-10-03.
- ^ Allan، D. R.؛ Marshall، W. G.؛ Francis، D. J.؛ Oswald، I. D. H.؛ Pulham، C. R.؛ Spanswick، C. (2010). "The crystal structures of the low-temperature and high-pressure polymorphs of nitric acid" (PDF). Dalton Trans. (Submitted manuscript). ج. 39 ع. 15: 3736–3743. DOI:10.1039/B923975H. PMID:20354626. مؤرشف من الأصل (PDF) في 2020-10-27.
- ^ PubChem. "Nitric acid". pubchem.ncbi.nlm.nih.gov (بالإنجليزية). Archived from the original on 2021-02-27. Retrieved 2020-08-03.
- ^ ا ب Thiemann، Michael؛ Scheibler، Erich؛ Wiegand، Karl Wilhelm (2000). "Nitric Acid, Nitrous Acid, and Nitrogen Oxides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. DOI:10.1002/14356007.a17_293. ISBN:978-3527306732.
- ^ Clark، John D (1972). Ignition!. Rutgers University Press. ISBN:978-0-8135-0725-5.
- ^ "BOMARC Summary". BILLONY.COM. مؤرشف من الأصل في 2020-07-03. اطلع عليه بتاريخ 2009-05-28.
- ^ Jewitt، Jeff (1997). Hand-applied finishes. Taunton Press. ISBN:978-1-56158-154-2. مؤرشف من الأصل في 2021-03-07. اطلع عليه بتاريخ 2009-05-28.
- ^ May، Paul (نوفمبر 2007). "Nitric acid". مؤرشف من الأصل في 2021-03-03. اطلع عليه بتاريخ 2009-05-28.
- ^ "Nitric acid: Toxicological overview". وكالة حماية الصحة. مؤرشف من الأصل في 2013-06-03. اطلع عليه بتاريخ 2011-12-07.
- ^ Rees, Anna (1 Oct 2013). "Freeze mob to highlight the issue of acid attacks". RESET.to (بالإنجليزية). Archived from the original on 2021-06-29. Retrieved 2021-06-25.
- ^ Ahmad Y. Al-Hassan, Cultural contacts in building a universal civilisation: Islamic contributions, published by O.I.C. Research Centre for Islamic History, Art and Culture in 2005 and available online at History of Science and Technology in Islam نسخة محفوظة 26 يوليو 2020 على موقع واي باك مشين.
- ^ (بالإنجليزية) The 1911 Classic Encyclopedia - Nitric Acid نسخة محفوظة 9 فبراير 2021 على موقع واي باك مشين.
- ^ ا ب Chisholm, Hugh, ed. (1911). . Encyclopædia Britannica (بالإنجليزية) (11th ed.). Cambridge University Press. Vol. 19. pp. 711–712.
- ^ توماس تومسون, The History of Chemistry (1830) Vol. 1, p. 40.
- ^ Gillispie، Charles Coulston (1960). The Edge of Objectivity: An Essay in the History of Scientific Ideas. Princeton, NJ: Princeton University Press. ص. 223–24. ISBN:0-691-02350-6. مؤرشف من الأصل في 2021-02-25.
- ^ Davy، John، المحرر (1839). "On Some Chemical Agencies of Electricity". The Collected Works of Sir Humphry Davy. ج. 5. ص. 1–12.
- ^ ا ب Mellor, J. W. (1918). Modern Inorganic Chemistry. Longmans, Green and Co. ص. 509. مؤرشف من الأصل في 2020-10-03.
- ^ Martin, Geoffrey؛ Barbour, William (1915). Industrial Nitrogen Compounds and Explosives. Crosby Lockwood and Son. ص. 21. مؤرشف من الأصل في 2020-09-29.
- ^ Knox، Joseph (1914). The Fixation of Atmospheric Nitrogen. D. Van Nostrand Company. ص. 45–50. مؤرشف من الأصل في 2021-03-08.
- ^ Dary, G. (1913). "The Production of Nitrates by the Direct Electrolysis of Peat Deposits". London Electrical Review. ج. 73: 1020–1021. مؤرشف من الأصل في 2020-11-07.
- ^ Hale، Arthur (1919). The Manufacture of Chemicals by Electrolysis. D. Van Nostrand Co. ص. 30–32. مؤرشف من الأصل في 2016-06-03. اطلع عليه بتاريخ 2019-09-15.