داء بطني
| داء بطني | |
|---|---|
| Celiac Disease | |
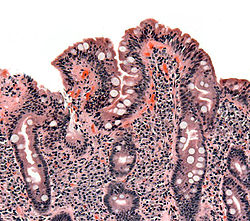
صورة لخزعة نسيجية تظهر أعراض داء بطني على الأمعاء
| |
| تسميات أخرى | ذرب بطني، ذرب لامداري، ذرب مُتَوَطِّن، اعتلال معوي غلوتيني. |
| النطق | /ˈsiːli.æk/ |
| معلومات عامة | |
| الاختصاص | طب الجهاز الهضمي طب باطني |
| من أنواع | مرض الجهاز الهضمي بالمناعة الذاتية [1]، واضطرابات مرتبطة بالغلوتين، ومرض |
| الأسباب | |
| الأسباب | تفاعل مع الغلوتين[2] |
| عوامل الخطر | استعداد وراثي، وسكري النوع الأول، ومرض الدرقية المناعي، ومتلازمة داون، ومتلازمة تيرنر. |
| المظهر السريري | |
| البداية المعتادة | أي عمر[3][4] |
| الأعراض | بدون أعراض أوأعراض غير محددة، تمدد بطني، إسهال، إمساك، سوء امتصاص، فقدان وزن، التهاب الجلد الهربسي الشكل.[3][5] |
| المدة | مدى الحياة[6] |
| المضاعفات | فقر الدم الناجم عن عوز الحديد، وهشاشة العظام، وعقم، وسرطان، واضطرابات عصبية، وأمراض مناعية اخرى.[7][8][9][6][10] |
| الإدارة | |
| التشخيص | التاريخ عائلي، واختبارات الأجسام المضادة في الدم، وخزعات معوية، والفحص الجيني، والاستجابة لقطع الغلوتين.[11][12] |
| العلاج | نظام غذائي خالي من الغلوتين.[14] |
| حالات مشابهة | داء الأمعاء الالتهابي، وطفيليات معوية، ومتلازمة القولون المتهيج، وتليف كيسي.[13] |
| الوبائيات | |
| انتشار المرض | 1 من كل 135.[15] |
| تعديل مصدري - تعديل | |
الداء البطني أو الداء الزلاقي أو السيلياك وأحيانا يُسمى مرض حساسية القمح (بالإنجليزية: Celiac Disease)، كلها أسماء متعددة لمرض واحد. هو مرض مناعي ذاتي مكتسب طويل الأمد، يؤثر في المقام الأول على الأمعاء الدقيقة، حيث يصاب الأفراد بعدم تحمل الغلوتين، الموجود في الأطعمة مثل القمح، الشيلم المزوع، والشعير.[11] تشمل الأعراض الكلاسيكية مشاكل الجهاز الهضمي مثل الإسهال المزمن، انتفاخ البطن، سوء الامتصاص، فقدان الشهية، وفشل النمو بشكل طبيعي عند الأطفال.[3] غالبًا ما يبدأ بين ستة أشهر وسنتين من العمر.[3] وهناك أعراض غير كلاسيكية أكثر شيوعًا، خاصة في الأشخاص الذين تزيد أعمارهم عن عامين.[4][16][17] قد يكون هناك أعراض هضمية خفيفة أو غائبة، أو عدد كبير من الأعراض التي تشمل أي جزء من الجسم أو بدون أعراض واضحة.[3] وُصِفَ المرض لأول مرة في مرحلة الطفولة؛[6][4] ومع ذلك، فقد يتطور في أي عمر.[3][4]وهو مرتبط بأمراض المناعة الذاتية الأخرى، مثل داء السكري من النوع الأول والتهاب الغدة الدرقية (هاشيموتو)، وأمراض أخرى.[6]
ينتج مرض الداء البطني عن تفاعل مع الغلوتين، وهو مجموعة من البروتينات المختلفة الموجودة في القمح والحبوب الأخرى مثل الشعير والجاودار (الشيلم المزروع).[2][18][19] عادة ما تُتَحَمَّل الكميات المعتدلة من الشوفان الخالي من الحبوب الأخرى المحتوية على الغلوتين.[18][20] قد يعتمد حدوث المشكلات على تنوع الشوفان.[18][21] ويحدث هذا في الأشخاص الذين لديهم استعداد وراثي.[11] عند التعرض للجلوتين، قد تؤدي الاستجابة المناعية غير الطبيعية إلى إنتاج العديد من الأجسام المضادة الذاتية المختلفة التي يمكن أن تؤثر على عدد من الأعضاء المختلفة.[8][22] في الأمعاء الدقيقة، يسبب هذا تفاعلًا التهابيًا وقد يؤدي إلى حدوث قصر في الزغابات المبطنة للأمعاء الدقيقة (ضمور زغبي).[11][12] وهذا يؤثر على امتصاص العناصر الغذائية، مما يؤدي في كثير من الأحيان إلى فقر الدم.[11][19]
عادةً ما يُشخَّص المرض من خلال مجموعة من اختبارات الأجسام المضادة في الدم والخزعات المعوية، بمساعدة اختبارات جينية محددة.[11] إن إجراء التشخيص ليس دائمًا بالأمر السهل.[23] في كثير من الأحيان، تكون الأجسام المضادة الذاتية في الدم سلبية،[24][25] ويعاني كثير من الناس فقط من تغيرات طفيفة في الأمعاء مع زغابات طبيعية.[25] قد يعاني الأشخاص من أعراض شديدة ويمكن أن يخضعوا للفحوصات لسنوات قبل الوصول إلى التشخيص.[26][27] بشكل متزايد، يُشخص أشخاص ليس لديهم أعراض وذلك نتيجة للفحص للأشخاص المُحتمل إصابتهم بالمرض (فحص وجود الاجسام المضادة في الدم).[28] ومع ذلك، فإن الأدلة المتعلقة بتأثيرات الفحص ليست كافية لتحديد فائدتها.[29] في حين أن هذا المرض ناجم عن عدم تحمل دائم لبروتينات الغلوتين،[11] فهو يختلف عن حساسية القمح، وهي نادرة جدًا.[30]
العلاج الفعال الوحيد المعروف هو اتباع نظام غذائي صارم خالٍ من الغلوتين مدى الحياة، مما يؤدي إلى تعافي الغشاء المخاطي للأمعاء، ويحسن الأعراض ويقلل من خطر حدوث مضاعفات لدى معظم الناس.[14] ولكنه إذا لم يُعالج، فقد يؤدي إلى الإصابة بالسرطان مثل سرطان الغدد الليمفاوية المعوي وزيادة طفيفة في خطر الموت المبكر.[7] تختلف المعدلات بين مناطق مختلفة من العالم، من 1 في كل 300 إلى 1 في كل 40، بمتوسط يتراوح بين 1 في كل 100 و1 في كل 170 شخصً.[15] تشير التقديرات إلى أن 80٪ من الحالات لا تزال غير مشخصة، وعادةً ما يكون ذلك بسبب قلة أو غياب شكاوى الجهاز الهضمي ونقص المعرفة بالأعراض ومعايير التشخيص.[9][26][31] يعد مرض الداء البطني أكثر شيوعًا بين النساء منه عند الرجال.[32]
العلامات والأعراض
[عدل]تشمل الأعراض التقليدية لمرض الداء البطني غير المعالج البراز الشاحب أوالرخو أوالدهني (الإسهال الدهني)، وفقدان الوزن أوالفشل في زيادة الوزن. قد تكون الأعراض الشائعة الأخرى خفية أو تحدث بشكل أساسي في أعضاء أخرى غير الأمعاء نفسها.[33] من الممكن أيضًا الإصابة بمرض الداء البطني دون أي من الأعراض التقليدية على الإطلاق،[34] وقد ثبت أن هذا يوجد في 43٪ على الأقل من الأطفال المصابين.[35] علاوة على ذلك فإن العديد من البالغين المصابين ويكون المرض لديهم خفيًا قد يصابون فقط بالتعب أو فقر الدم.[36] حيث أن العديد من الأفراد غير المشخصين والذين يعتبرون أنفسهم بدون أعراض هم في الواقع ليسوا كذلك، ولكنهم اعتادوا على العيش في حالة صحية مزمنة. وفي الواقع بعد البدء في اتباع نظام غذائي خالٍ من الغلوتين، يُلاحظ تحسن واضح لدى هؤلاء المرضى، وغالبًا ما يكون هؤلاء الأفراد قادرين على تذكر الأعراض السابقة لمرضهم غير المعالج والتعرف عليها بأثر رجعي والتي تجاهلوها عن طريق الخطأ.[37][38][39]
أعراض الجهاز الهضمي
[عدل]الإسهال الذي يميز مرض الداء البطني هو الإسهال المزمن والشاحب في بعض الأحيان وكبير الحجم وذو رائحة كريهة بشكل غير طبيعي. قد توجد آلام في البطن وتشنجات وانتفاخ مع تمدد في البطن (يُعتقد أنه ناتج عن تخمر وإنتاج غاز في الأمعاء) وتقرحات في الفم،[40] مع زيادة تلف الأمعاء قد تتطور درجة عدم تحمل اللاكتوز.[34] في كثير من الأحيان تُعزى الأعراض إلى متلازمة القولون العصبي (IBS)، وبعد ذلك يُتعرّف عليها على أنها مرض الداء البطني. في مجموعات الأشخاص الذين يعانون من أعراض القولون العصبي يمكن تشخيص مرض الداء البطني في حوالي 3.3٪ من الحالات أو 4 مرات أكثر من الناس الآخرين.[41] ينصح المعهد الوطني للصحة وجودة الرعاية (NICE)، والجمعية البريطانية لأمراض الجهاز الهضمي والكلية الأمريكية لأمراض الجهاز الهضمي، بفحصهم بحثًا عن مرض الداء البطني ولكن ليس له فائدة واضحة في أمريكا الشمالية.[41][42]
يؤدي مرض الداء البطني إلى زيادة خطر الإصابة بالسرطان الغدي والأورام اللمفاوية في الأمعاء الدقيقة (اعتلال معوي مرتبط باللمفوما تائية الخلايا (EATL) أو الأورام اللمفاوية الأخرى التي تكون لاهودجكينية).[43] هذا الخطر أعلى أيضًا في الأقارب من الدرجة الأولى مثل الأشقاء والآباء والأطفال. وليس من الواضح ما إذا كان اتباع نظام غذائي خالٍ من الغلوتين يقلل هذه المخاطر إلى الحد الأدنى أم لا.[44] قد يؤدي المرض غير المعالج ووجوده لمدة طويلة لدى الشخص إلى مضاعفات أخرى، مثل التهاب الصائم التقرحي (ulcerative jejunitis) (تشكل القرحة في الأمعاء الدقيقة) والتضيق (وجود تضيق نتيجة ندبة مع انسداد الأمعاء).[45]
أعراض متعلقة بسوء الامتصاص
[عدل]تؤدي التغيرات في الأمعاء إلى جعلها أقل قدرة على امتصاص العناصر الغذائية والمعادن والفيتامينات القابلة للذوبان في الدهون فيتامين ألف (A) وفيتامين دي (D) وفيتامين إي (E) وفيتامين ك (K).[34][46]
- قد يتسبب سوء امتصاص الكربوهيدرات والدهون في فقدان الوزن (أوفشل النمو أونقص النمو عند الأطفال) والإرهاق أو نقص الطاقة.
- قد يتطور فقر الدم بعدة طرق: قد يتسبب سوء امتصاص الحديد في فقر الدم الناجم عن نقص الحديد، وقد يؤدي سوء امتصاص حمض الفوليك وفيتامين بي 12 إلى فقر الدم الضخم الأرومات.
- قد يؤدي سوء امتصاص الكالسيوم وفيتامين دي (وفرط جارات الدرقية الثانوي التعويضي) إلى انخفاض المحتوى المعدني للعظام أو هشاشة العظام (ضعف العظام وخطر الإصابة بكسور الهشاشة).
- يؤدي سوء امتصاص السيلينيوم في مرض الداء البطني جنبًا إلى جنب مع انخفاض محتوى السيلينيوم في العديد من الأطعمة الخالية من الغلوتين، إلى خطر الإصابة بنقص السيلينيوم.[47]
- ارتبط نقص النحاس والزنك بمرض الداء البطني.[47]
- نسبة صغيرة من الناس لديهم تخثر غير طبيعي بسبب نقص فيتامين ك وهم معرضون بشكل طفيف لخطر حدوث نزيف غير طبيعي.
أعراض متنوعة
[عدل]رُبِط مرض الداء البطني بعدد من الحالات، الكثير منها غير واضح ما إذا كان مرض الأمعاء الناجم عن الغلوتين هو عامل مسبب أو ما إذا كانت هذه الحالات تشترك في نزعة شائعة.
- يوجد نقص الغلوبولين المناعي أ الانتقائي في 2.3٪ من الأشخاص المصابين بمرض الاداء البطني، وهو في حد ذاته مرتبط بزيادة خطر الإصابة بمرض الداء البطني بمقدار عشرة أضعاف. السمات الأخرى لهذه الحالة هي زيادة خطر الإصابة بالعدوى وأمراض المناعة الذاتية.[48]
- رُبِط التهاب الجلد الحربسي الشكل وهو حالة جلدية تسبب الحكة، بإنزيم ناقل الجلوتامين في الجلد، ويتميز بتغيرات في الأمعاء الدقيقة مماثلة لتلك الموجودة في مرض الداء البطني، وقد يستجيب لترك الغلوتين حتى في حالة عدم وجود أعراض معدية معوية.[49][50]
- يمكن أن يحدث فشل في النمو و/أو تأخر البلوغ في مرحلة الطفولة المتأخرة حتى بدون أعراض الأمعاء الواضحة أو سوء التغذية الحاد. غالبًا ما يتضمن تقييم فشل النمو فحص الداء البطني.[51]
- يمكن أن تحدث مضاعفات الحمل إذا كان الداء البطني موجود مسبقًا أو مكتسب لاحقًا، مع نتائج مهمة بما في ذلك الإجهاض وتقييد النمو داخل الرحم وانخفاض الوزن عند الولادة والولادة المبكر.[52]
- يحدث قصور الطحال (طحال صغير وخامل)[53] في حوالي ثلث الحالات وقد يؤهب للعدوى نظرًا لدور الطحال في الحماية من البكتيريا.[51]
- يمكن أن تكون اختبارات وظائف الكبد غير طبيعية (والتي يُكشف عنها بشكل عشوائي في اختبارات الدم).[51]
يرتبط مرض الداء البطني بالعديد من الحالات الطبية الأخرى، وكثير منها من إضطرابات المناعة الذاتية، مثل: داء السكري من النوع الأول، قصور الغدة الدرقية، التهاب الأقنية الصفراوية الأولي، التهاب القولون المجهري، ترنح الغلوتين، الصدفية، البهاق، التهاب الكبد المناعي الذاتي، التهاب الجلد الحربسي الشكل، التهاب الأقنية الصفراوية المصلب الأولي والمزيد.[54]
الأسباب
[عدل]ينتج مرض الداء البطني عن تفاعل مع الغليادين والجلوتينين (بروتينات الغلوتين)[55] الموجودة في القمح، والبروتينات المماثلة الموجودة في محاصيل القبيلة القمحاوية (التي تشمل الحبوب الشائعة الأخرى مثل الشعير والجاودار)[4] وقبيلة أفينيا (الشوفان).[15] كما أن سلالات القمح (مثل الحنطة والصلب وقمح خراسان) وهجن القمح (مثل شيقم) تسبب أيضًا أعراض مرض الداء البطني.[56][15]
يتفاعل عدد قليل من الأشخاص المصابين بالداء البطني مع الشوفان.[4] تعتمد سُمِّية الشوفان لدى الأشخاص الذين يعانون من الداء البطني على صنف الشوفان المستهلك بسبب جينات البرولامين، وتسلسل الأحماض الأمينية البروتينية، والنشاط المناعي للبرولامين السام، والتي تختلف بين أصناف الشوفان.[15][4] أيضًا، غالبًا ما يتلوث الشوفان بالحبوب الأخرى التي تحتوي على الغلوتين.[57][15][4] يشير مصطلح «الشوفان النقي» إلى الشوفان غير الملوث بحبوب أخرى تحتوي على الغلوتين.[4] ولا تزال الآثار طويلة المدى لاستهلاك الشوفان النقي غير واضحة،[58] وهناك حاجة إلى مزيد من الدراسات لتحديد الأصناف المستخدمة قبل تقديم التوصيات النهائية بشأن إدراجها في النظام الغذائي الخالي من الغلوتين.[57] يحتاج الأشخاص الذين يعانون من مرض الداء البطني الذين يختارون تناول الشوفان إلى متابعة أكثر صرامة مدى الحياة، بما في ذلك إجراء دوري لخزعات الأمعاء.[58]
حبوب أخرى
[عدل]الحبوب الأخرى مثل الذرة والدخن والسورغم والتيف والأرز والأرز البري تعتبر آمنة للأشخاص الذين يعانون من الداء البطني، وكذلك غير الحبوبيات مثل القطيفة والكينوا والحنطة السوداء.[59][56] الأطعمة الغنية بالكربوهيدرات غير الحبوبية مثل البطاطس والموز لا تحتوي على الغلوتين ولا تسبب أي أعراض.[59]
معدلات المخاطر
[عدل]هناك العديد من النظريات حول تحديد ما إذا كان الفرد الحساس وراثيًا ستظهر لديه أعراض الإصابة بمرض الداء البطني. تشمل النظريات الرئيسية الجراحة والحمل والعدوى والتوتر العاطفي.[28]
لا يبدو أن تناول الغلوتين في وقت مبكر من حياة الطفل يزيد من خطر الإصابة بمرض الداء البطني، ولكن قد يؤدي تناوله لاحقًا بعد 6 أشهر إلى زيادة هذا الخطر.[60][60] ليس واضحًا إذا ما كانت الرضاعة الطبيعية تقلل من المخاطر. إطالة فترة الرضاعة الطبيعية حتى إدخال الحبوب المحتوية على الغلوتين في النظام الغذائي يبدو أنه يرتبط بإنخفاض خطر الإصابة بمرض الداء البطني بنسبة 50٪ في مرحلة الطفولة؛ وليس من الواضح ما إذا كان هذا يستمر حتى مرحلة البلوغ.[61] قد تؤثر هذه العوامل فقط على توقيت البداية. [62]
الفسيولوجيا المرضية
[عدل]يُعزى مرض الدّاء البَطنيّ إلى عدّة عوامل، فوجود عاملٍ وِراثيٍّ واحدٍ لا يكفي لإحداث المرض، بالإضافة إلى أنه يجب اجتماع عدّة عوامل لتظهَر الأعراض على المريض. تبَيَّن أنّ حوالي 95% من الأشخاص المصابين بالدّاء البطني يحملون الأليل HLA-DQ2 أو (بنسبة أقل) الأليل HLA-DQ8.[28][28] ولكن حوالي 20-30% من الأشخاص الغير مصابين بالدّاء البطني يحملون أيضًا إحدى هذين الألّيلين.[63] وهذا يدل على أن هناك عوامل أخرى يجب توافرها لإحداث المرض: فوجود الأليل HLA يعتبر عاملًا مؤهبًا ضروريًا ولكنه وحدَه غير كافٍ لإحداث المرض. علاوة على ذلك، فإنّ حوالي 5٪ من الأشخاص الذين يصابون بمرض الدّاء البَطنيّ ليس لديهم أليلات HLA-DQ2 أو HLA-DQ8 نموذجية.[28]
عوامل جينية
[عدل]الغالبية العظمى من المصابين بالداء البطني لديهم أحد جينات الزوج الجيني HLA DQ2 [63].HLA-DQ هو جزء من معقد التوافق النسيجي الكبير من الفئة الثانية (يسمى أيضًا مستضد كريات الدم البيضاء البشرية) ويميز الخلايا الذاتية وغير الذاتية لأهداف مناعية. تُرمّز الوحدتان الفرعيتان لبروتين HLA-DQ بواسطة جينات HLA-DQA1 وHLA-DQB1، الموجوتان على الذراع القصير للكروموسوم (الصبغي) السادس.
هناك سبعة أنواع من الجين HLA-DQ (DQ2 و DQ4 – DQ9). أكثر من 95% من المصابين بالداء البطني لديهم شكل الجين DQ2 أو الجين DQ8، والذي يُورث في العائلات. والسبب في أن هذه الجينات تٌنتج زيادة في خطر الإصابة بالداء البطني هو أن المستقبلات التي تشكلها هذه الجينات ترتبط بببتيدات الغليادين بإحكام أكثر من الأشكال الأخرى للمستقبلات المقدمة للمستضد (antigen-presenting receptor). لذلك، من المرجح أن تنشِّط هذه الأشكال من المستقبلات الخلايا الليمفاوية التائية وتنشط بدء عملية التمنيع الذاتي.[28]
يحمل معظم الأشخاص المصابين بالداء البطني جينين من النمط الفرداني من الجين HLA-DQ2 حيث يشار إليه باسم النمط الفرداني للجين DQ2.5. يتكون هذا النمط الفرداني من أليلين جينيي متجاورين، الجين DQA1*0501 والجين DQB1*0201-والذي يشفر الوحدتين الفرعيتين: DQ α5 وDQ β2. في معظم الأفراد، يُشفّر هذا الشكل الإسوي من الجين DQ2.5 بواسطة واحد من اثنين من الكروموسومات رقم 6 الموروثة من الوالدين (DQ2.5cis). ولا يرث أغلب المصابين بالداء البطني سوى نسخة واحدة من هذا النمط الفرداني للجين DQ2.5، بينما يرثها البعض من كلا الوالدين؛ والأخير يكون معرضًا بشكل خاص لخطر الإصابة بالداء البطني فضلا عن كونها أكثر عرضة للمضاعفات الشديدة.[28]

يرث بعض الأفراد الجين DQ2.5 من أحد الوالدين وجزءًا إضافيًا من النمط الفرداني (إما DQB1*02 أو DQA1*05) من الوالد الآخر، مما يزيد من المخاطر. بنسبة أقل شيوعًا، يرث بعض الأفراد أليل الجين DQA1*05 من أحد الوالدين والجين DQB1*02 من الوالد الآخر (DQ2.5trans) (يسمى ارتباط النمط الفرداني أو النمط الفرداني ترانز)، وهؤلاء الأفراد معرضون لخطر مماثل للإصابة بالداء البطني مثل أولئك الذين يحملون نسخة واحدة من الجين DQ2.5 في الكروموسوم السادس، ولكن في هذه الحالة لا يميل المرض إلى أن يكون عائليًا. ومن بين 6% من مرضى الداء البطني الأوروبيين اللذين لا يملكون الجين DQ2.5 (سواء كان بالشكل المفروق أو المقرون) أو الجين DQ8 (المشفرة بالنموذج الفرداني للجين DQA1*03:DQB1*0302)، فإن 4% من مرضى الداء البطني لا يملكون الجين DQ2.2، أما 2% الباقية فيفتقرون إلى الجين DQ2 أو الجين DQ8.[65]
يختلف تواجد هذه الجينات جغرافيًا. الجين DQ2.5 له تكرار عالٍ في شعوب شمال وغرب أوروبا (بلاد البشكنش وأيرلندا[66] ذات التكرار الأعلى) وأجزاء من إفريقيا ويوجد ارتباط للمرض مع الهند،[67] ولكنه غير موجود على طول أجزاء من الغرب مطلة على المحيط الهادي. الجين DQ8 له توزيع عالمي أوسع من الجين DQ2.5 وهو شائع بشكل خاص في أمريكا الجنوبية والوسطى؛ ما يصل إلى 90% من الأفراد في بعض السكان الهنود الأمريكيين يحملون الجين DQ8 وبالتالي قد يعرضون النمط الظاهري للداء البطني.[68]
وُجدت عوامل وراثية أخرى بشكل متكرر في الداء البطني. ومع ذلك، فإن المشاركة في المرض له تميز جغرافي متغير. تُظهر مواقع الجين HLA-DQ فقط مشاركة ثابتة على سكان العالم.[69] وعُثر على العديد من المواقع التي اكتُشِفت مرتبطة بأمراض المناعة الذاتية الأخرى. في أحد المواقع، «الجين الشريك المفضل للورم الشحمي» يشارك في التصاق النسيج البيني خارج الخلية بسطح الخلية، وهناك متغير ثانوي تعدد أشكال النوكليوتيدات المفردة (SNP = rs1464510) يزيد من خطر الإصابة بالمرض بحوالي 30%. يرتبط هذا الجين ارتباطًا وثيقًا بالداء البطني (p < 10−39) في عينات مأخوذة من منطقة واسعة في أوروبا والولايات المتحدة.[69]
إن انتشار الأنماط الجينية للداء البطني في السكان المعاصرين غير مفهوم تمامًا. نظرًا لخصائص المرض وتوارثه الواضح القوي، فمن المتوقع عادةً أن تخضع الطرز الوراثية لانتقاء سلبي وأن تكون غير موجودة في المجتمعات التي تُمارس فيها الزراعة لفترة أطول (بالمقارنة مع حالة مماثلة، عدم تحمل اللاكتوز، والذي كان قد انتُقي سلبياً بشدة لدرجة أن انتشاره انتقل من نسبة حوالي 100% في مجموعات الأسلاف إلى أقل من 5% في بعض البلدان الأوروبية). وقد اقترح سيمونز عام 1981 هذا التوقع لأول مرة.[70] لكن من الواضح الآن أن الأمر ليس كذلك؛ بل على العكس من ذلك، هناك دليل على الانتقاء الإيجابي في الأنماط الجينية للداء البطني. يُشتبه في أن بعضها قد يكون مفيدًا من خلال توفير الحماية ضد الالتهابات البكتيرية.[71][72]
البرولامين
[عدل]تعتبر بروتينات البرولامين من أكثر البروتينات الموجودة في الغذاء والمسؤولة عن رد الفعل المناعي في مرض الدّاء البطني، وهي بروتينات تخزين غنية بالبرولين والجلوتامين والتي تذوب في الكحول وتعتبر مقاومة للببتيدازات (الأنزيمات الهاضمة للروابط الببتيدية) في الأمعاء.[28][73] توجد بروتينات البرولامين في أنواع مختلفة من الحبوب، وكل نوع يحتوي على بروتين برولامين مختلف: القمح (غليادين)، الشعير (هوردين)، الذّرة (سيكالين) والشوفان (أفينين).[74] هناك منطقة في ألفا جليادين تعمل على تحفيز أغشية الخلايا المعوية لتسمح بمرور الجزيئات الكبيرة بين الخلايا. أي قطع في الموَصّل الخلوي المحكم بين الخلايا يسمح للببتيدات الأكبر من 3 أحماض أمينية بالمرور إلى الخلايا المُبَطّنة للأمعاء.[75]

يسمح تسرب الغشاء لببتيدات الجليادين بالمرور والتي بدورها تحفز مستويين من الاستجابة المناعية: الاستجابة الفطرية (الخلقية) والاستجابة التكيفية (بوساطة الخلايا التائية المساعدة). يحتوي أحد الببتيدات المقاوم للبروتياز من ألفا-جليادين على منطقة تحفز الخلايا الليمفاوية وتؤدي إلى إطلاق إنترلوكين -15. ينتج عن هذه الاستجابة الفطرية للغليادين إشارات من الجهاز المناعي تجذب الخلايا الالتهابية وتزيد من إطلاق المواد الكيميائية الالتهابية.[77] توجّه الاستجابة التكيفية الأقوى والأكثر شيوعًا للجليادين نحو جزء ألفا 2-جليادين الذي يتكون من 33 حمضًا أمينيًا.[77]
تحدث الاستجابة لجزء الجليادين ذو الـ 33 حمض أميني في معظم حالات الداء البطني التي لديها الشكل الأيسومري DQ2. هذا الببتيد عندما يُغيَر بواسطة الإنزيم ناقل الجلوتامين المعوي يكون لديه كثافة عالية من حواتم الخلايا التائية المتداخلة. يؤدي هذا إلى زيادة احتمالية ارتباط الشكل الأيسومري DQ2 بالببتيد والبقاء مرتبطًا به عند التعرف عليه بواسطة الخلايا التائية.[76] الجليادين الموجود في القمح هو أفضل عضو مفهوم في هذه العائلة، ولكن توجد البرولامينات الأخرى والتي قد يساهم منها الهوردين (من الشعير)، والسيكالين (من الجاودار)، والأفينين (من الشوفان) في الإصابة بالداء البطني.[77][78][79] تعتمد سمية الأفينينات لدى الأشخاص المصابين بمرض الداء البطني على نوع المستنبت النباتي المستهلَك من الشوفان، بسبب جينات البرولامين وتسلسل الأحماض الأمينية البروتينية والنشاط المناعي للبرولامين السام، والتي تختلف باختلاف أنواع الشوفان.[80]
ناقلة الجلوتامين النسيجية (ترانسغلوتاميز النسيجي)
[عدل]
توجد الأجسام المضادة لناقلة الجلوتامين النسيجية (اختصارًا tTG) عند غالبيّة الأشخاص المصابين بالدّاء البطني والذين تظهر عليهم الأعراض المعروفة للمرض بالإضافة إلى وجود ضمور كامل في الزّغاب المعوي، وفي 70% من الحالات يكون الضمور جزئيًا، أما في 30% من الحالات فيكون هناك تقَرُّحات طفيفة في الغشاء المخاطي للأمعاء.[24] تعمل ناقلة الجلوتامين النسيجية على تعديل الغلوتين إلى شكل آخر، ويُعتقد أن هذا الشّكل يساهم في تحفيز استجابة جهاز المناعة للغلوتين بشكل أكبر.[28] تعمل ناقلة الجلوتامين النسيجية على تعديل هذه الببتيدات بطريقتين، نزع الأميد أو نقل الأميد.[81]
نزع الأميد هو تفاعل يتكوّن فيه بقية جلوتامات عن طريق كسر المجموعة الأمينية على موقع إبليبسون لسلسلة جلوتامين الجانبية. أما بالنسبة لتبادل الأميد (transamidation)، والتي تحدث ثلاث مرات أكثر من عملية نزع الأميد، فهي عملية تشابك بين بقية الجلوتامين من ببتيد الغليادين مع بقية اللايسين من ناقلة الجلوتامين النسيجية في تفاعل يُحفّز عن طريق أنزيم ناقل الجلوتامين. قد يحدث التشابك داخل أو خارج الموقع النّشط للإنزيم. وفي الحالة الأخيرة ينتج رابطة تساهمية دائمة في المركب الناتج عن ارتباط الغليادين مع ناقلة الجلوتامين النسيجية.[82] وذلك يؤدي إلى إنتاج محددات أنتجينية تعمل على إثارة استجابة مناعية أولية من خلال تكوين أجسام مضادة ذاتية ضد ناقلة الجلوتامين النسيجية.[83][84][85]
أظهرت الخزعات المخزنة من الأشخاص الذين اعتُقِد بإصابتهم بمرض الدّاء البطني أنّ رواسب الأجسام المضادة الذاتية تظهر حتى قبل وجود أعراض سريرية للمرض. هذه الرواسب تظهر أيضا عند الأشخاص المصابين بأمراض مناعية أخرى، أنيميا على سبيل المثال، أو عند الأشخاص الذين يعانون من سوء الامتصاص بشكل أكبر من الأشخاص الطّبيعيين.[86] يُعتقد أنّ مكونات غمد الليف العضلي من الأجسام المضادة تهاجم ناقل الجلوتامين الموجود على سطح الخلايا، ولا زالت هذه الأجسام المضادة تستخدم كفحص للتأكد من الإصابة بمرض الدّاء البطني. ولكن في دراسة أجريت في عام 2006 أظهرت أن الأشخاص المصابين بالدّاء البطني وفي نفس الوقت لا تظهر لديهم مكونات غمد الليف العضلي من الأجسام المضادة قد كانوا في الغالب ذكورًا وكبارًا في السن، بالإضافة إلى أنهم كانوا يعانون من ألم بطني شديد، وقِلّة في شيوع الأعراض غير النّموذجية للمرض.[87] في هذه الدراسة، وُجِد أن نسبة رواسب الأجسام المضادة لناقلة الجلوتامين النسيجية لا تتوافق تمامًا مع مدى خطورة وشِدّة التّلف الحاصل في الزُّغاب المعوي. وبالتالي فإنّ هذه النتائج بالإضافة للدارسات الأخيرة التي أظهرت أن هناك مناعة فطرية ضد الغليادين عند الإنسان،[88] أدّت إلى افتراض أن يكون الغليادن المُتَسبّب الرئيسي في حدوث مرض الدّاء البطني، بينما تلعب ناقلة الجلوتامين النسيجية دورًا أكبر في حدوث أعراض ثانوية كالحساسية وظهور أمراض مناعيّة ذاتيّة أخرى. وُجِد أيضًا أنّ الأجسام المضادة لناقلة الجلوتامين النسيجية تستطيع التّعرف على بروتين خاص بالفيروس العجلي يسمى ببروتين VP7 عند نسبة كبيرة من المصابين بالدّاء البطني، فهذه الأجسسام المضادة تساهم في تكاثر الخلايا المناعية الوحيدة، وبالتالي فإن العدوى بالفيروس العجلي قد تُفسّر الظهور المبكّر لتكاثر الخلايا المناعية.[89]
وبالفعل، فَقَد أظهرت بعض الدراسات السابقة أنّ الفيروس العجلي يتسبب في حدوث ضمور في الزغاب المعوي.[90] ويشير هذا إلى أن بروتينات الفيروس قد تشارك في إحداث تَسَطّح أولي لبطانة الأمعاء بالإضافة لتحفيز إنتاج أجسام مضادة ذاتية ذات تفاعل تبادُليّ ضد بروتين VP7. والأجسام المضادة لهذا البروتين قد تتسبب في تأخر الشّفاء حتى تظهر أجسام مضادة ذات تفاعل تبادلي نتيجة للإظهار الغليادين بفعل الترانسجولاميناز النسيجي.
هناك أمراض معوية أخرى ذات خزعة مشابهة للداء البطني، مثل التَقرحات الناتجة عن الإصابة بداء المبيضات.[91]
الضمور الزغبي وسوء الامتصاص
[عدل]تؤدي العملية الالتهابية التي تحدث بوساطة الخلايا التائية إلى تعطيل بنية ووظيفة بطانة الغشاء المخاطي للأمعاء الدقيقة، كما تؤدي إلى سوء الامتصاص حيث أنها تضعف قدرة الجسم على امتصاص العناصر الغذائية والمعادن، والفيتامينات القابلة للذوبان في الدهون وهي فيتامينات (A) أ و (D) د و (E) ه و (K) ك من الطعام. قد يكون عدم تحمل اللاكتوز موجودًا بسبب انخفاض سطح الأمعاء وانخفاض إنتاج اللاكتاز، ولكنه عادةً ما يُحلّ بمجرد علاج الحالة.
اقتُرحت أسباب بديلة لتلف الأنسجة وتضمنت إطلاق الإنترلوكين 15 وتفعيل الجهاز المناعي الفطري بواسطة ببتيد الغلوتين أقصر (p31–43/49). هذا من شأنه أن يؤدي إلى قتل الخلايا المعوية بواسطة الخلايا الليمفاوية في النسيج الطلائي (أنسجة رقيقة تشكل الطبقة الخارجية من سطح الجسم وتبطن القناة الهضمية وغيرها من الهياكل المجوفة).[36] قد يكون الضمور الزغبي الذي يرى في الخزعة ناتجاً أيضًا عن أسباب غير مرتبطة، مثل الذرب المداري وداء الجيارديات والاعتلال المعوي الإشعاعي. في حين أن الأمصال الإيجابية والخزعة النموذجية توحي بشدة بمرض الداء البطني، فإن عدم الاستجابة للنظام الغذائي قد يتطلب النظر في هذه التشخيصات البديلة.[45]
التشخيص
[عدل]غالبًا ما يكون التشخيص صعبًا ومنذ عام 2019 لا يزال هناك نقص في الوعي بين الأطباء حول تنوع أعراض مرض الداء البطني ومعايير التشخيص، بحيث تُشخّص معظم الحالات متأخرة كثيرًا.[92][93] قد يستغرق الأمر ما يصل إلى 12 عامًا لتشخيص المريض من بداية ظهور الأعراض وغالبية المصابين لا يُشخصون أبداً في معظم البلدان.[92]
هناك العديد من الاختبارات التي يمكن استخدامها والتي يمكن ترتيبها من حيث الأولوية بناءً على حدة الأعراض، لكن جميع الاختبارات تفقد فائدتها إذا كان الشخص يتناول بالفعل نظامًا غذائيًا خالٍ من الغلوتين. يبدأ تلف الأمعاء بالشفاء في غضون أسابيع من إزالة الغلوتين من النظام الغذائي، وتبدأ مستويات الأجسام المضادة بالإنخفاض على مدار أشهر. بالنسبة لأولئك الذين بدؤوا بالفعل في اتباع نظام غذائي خالٍ من الغلوتين، قد يكون من الضروري إجراء إعادة اختبار لبعض الأطعمة المحتوية على الغلوتين - (بالإنجليزية: Gluten challenge test وهو اختبار طبي يستهلك فيه المريض أطعمة محتوية على الغلوتين ويُبحث في ملاحظة (إعادة) ظهور الأعراض، لتحديد ما إذا كان الشخص يتفاعل مع هذه الأطعمة ومقدار تفاعلها) - في وجبة واحدة يوميًا على مدار 6 أسابيع قبل تكرار الفحوصات.[22]
تحاليل الدم
[عدل]
اختبارات الدم المصلية هي أول الفحوصات المطلوبة لتشخيص مرض الداء البطني والتي ترتبط حساسيتها بدرجة الآفات النسيجية. فالأشخاص الذين يعانون من أضرار طفيفة في الأمعاء الدقيقة قد يكون لديهم نتائج سلبية للفحص في عينة الدم لذلك غالبًا ما يحصل خطأ في التشخيص للعديد من مرضى الداء البطني. في المرضى الذين يعانون من ضمور زغبي يمكن للأجسام المضادة لمكون غمد الليف العضلي (EMA) من نوع غلوبيولين مناعي أ (IgA) اكتشاف مرض الداء البطني بحساسية ونوعية تبلغ 90٪ و99٪ على التوالي.[94] وذُكر في البداية أن الأمصال الخاصة بمضادات الأجسام المضادة لناقل الجلوتامين (ATA) لديها حساسية أعلى (99٪) وخصوصية (> 90٪)، ومع ذلك يُعتقد الآن أن لها خصائص مشابهة للأجسام المضادة لبطانة الحزمة العضلية.[94] تتمتع كل من الأجسام المضادة لناقل الجلوتامين والأجسام المضادة لبطانة الحزمة العضلية بحساسية عالية لتشخيص الأشخاص الذين يعانون من أعراض كلاسيكية وضمور زغبي كامل، ولكن توجد فقط في 30-89٪ من الحالات المصابة بضمور زغبي جزئي وفي أقل من 50٪ من الأشخاص الذين يعانون من آفات مخاطية طفيفة (كثرة الخلايا الليمفاوية الاثني عشرية) مع الزغب الطبيعي.[95][96]
يقوم ناقل جلوتامين الأنسجة بتعديل ببتيدات الغلوتين إلى شكل قد يحفز جهاز المناعة بشكل أكثر فعالية.[77] تُعدّل هذه الببتيدات بواسطة الأجسام المضادة لناقل الجلوتامين بطريقتين، نزع مجموعة أميد أو نقل مجموعة أميد.[97] تعتمد فحوصات مضادات الأجسام المضادة لناقل الجلوتامين الحديثة على بروتين معاد تركيبه بواسطة البشر ليعمل كمولد ضد.[98] يجب إجراء اختبار الأجسام المضادة لناقل الجلوتامين أولاً لأنه اختبار أسهل في الأداء، النتيجة المشكوك فيها في اختبار الأجسام المضادة لناقل الجلوتامين يجب أن يتبعها فحص الأجسام المضادة لمكون غمد الليف العضلي.[22]
توصي الإرشادات بفحص إجمالي مستوى الغلوبيولين المناعي أ في الدم بشكل متوازٍ، حيث أنه من الممكن أن لا يتمكن الأشخاص المصابون بالداء البطني مع نقص الغلوبيولين المناعي أ من إنتاج الأجسام المضادة التي تعتمد عليها هذه الاختبارات فتظهر لنا النتائج على أنها سلبية كاذبة. في هؤلاء الأشخاص قد تُشخّص الأجسام المضادة غلوبيولين مناعي ز (IgG) ضد ناقل الجلوتامين (IgG-tTG).[99][22]
إذا كانت كل هذه الأجسام المضادة سلبية، فيجب تحديد الأجسام المضادة لببتيدات جليادين المخففة منزوعة الأميد (DGP). قد تكون الأجسام المضادة لببتيدات جليادين المخففة منزوعة الأميد من فئة الغلوبيولين المناعي ز (IgG) مفيدة في الأشخاص الذين يعانون من نقص الغلوبيولين المناعي (أ). في الأطفال الذين تقل أعمارهم عن عامين، تؤدي الأجسام المضادة لببتيدات جليادين المخففة منزوعة الأميد أداءً أفضل من اختبارات الأجسام المضادة لبطانة الحزمة العضلية ومضاد الأجسام المضادة لناقل الجلوتامين.[100]
بسبب الآثار الرئيسية لتشخيص مرض الداء البطني، توصي الإرشادات المهنية بأن اختبار الدم الإيجابي يجب أن يتبعه التنظير الداخلي/تنظير هضمي علوي والخزعة. قد لا يزال الاختبار المصلي السلبي يتبعه توصية للتنظير الداخلي وخزعة الاثني عشر إذا ظل الشك السريري مرتفعًا.[22][101][102]
تاريخيًا قد قيست ثلاثة أجسام مضادة أخرى: مضادات الريتيكولين (ARA)، ومضادات الغليادين (AGA) والأجسام المضادة لمكون غمد الليف العضلي (EMA).[103] ومع ذلك فإن اختبار مضادات الريتيكولين ليس دقيقًا بما يكفي للاستخدام التشخيصي الروتيني.[104] قد لا يكون علم الأمصال موثوقًا عند الأطفال الصغار حيث يكون أداء مضادات الغليادين أفضل إلى حد ما من الاختبارات الأخرى في الأطفال دون سن الخامسة.[103] تعتمد اختبارات الأمصال على التألق المناعي غير المباشر (الريتيكولين، الجليادين، ومكون غمد الليف العضلي) أو مقايسة امتصاصية مناعية للإنزيم المرتبط ELISA (الغليادين أوناقلة الجلوتامين النسيجية، الأجسام المضادة لناقل الجلوتامين).[105]
توجد أجسام مضادة أخرى مثل الأجسام المضادة للسكيراء الجعوية (فطريات الخميرة) في بعض الأشخاص المصابين بمرض الداء البطني ولكنها تحدث أيضًا في اضطرابات المناعة الذاتية الأخرى وحوالي 5٪ ممن يتبرعون بالدم.[106]
يمكن الجمع بين اختبار الأجسام المضادة واختبار مستضد الكريات البيضاء البشرية (HLA) إذا كان التشخيص غير واضحًا. يعتبر اختبار التحليل الوزني الحراري TGA والأجسام المضادة لمكون غمد الليف العضلي من أكثر اختبارات الأجسام المضادة المصلية حساسية، ولكن نظرًا لأن اختبار مستضد الكريات البيضاء البشرية من نوع DQ السلبي يستبعد تشخيص مرض الداء البطني، فإن اختبار مستضد الكريات البيضاء البشرية من نوع DQ2 أوDQ8 يزيد أيضًا من الحساسية والقيم التنبؤية السلبية.[107] ومع ذلك لا يُنصح حاليًا باستخدام أسلوب اختبار مستضد الكريات البيضاء البشرية على نطاق واسع لاستبعاد مرض الداء البطني.[22]
التنظير
[عدل]
يُجرى التنظير العلوي مع خزعة من الإثني عشر (ما وراء بصلة الإثني عشر: هو جزء من الإثني عشر الأقرب إلى المعدة) أو الصائم للحصول على عينات متعددة (أربعة إلى ثمانية) من الإثني عشر. قد لا تكون جميع المناطق متأثرة بشكل متساوٍ؛ ولهذا إذا أخذت الخزعات من أنسجة الأمعاء السليمة، ستكون النتيجة سلبية كاذبة.[101] حتى في نفس الجزء الحيوي المأخوذ منه الخزعة، حيث أنه من الممكن أن توجد درجات مختلفة من الضرر.[108]
يعاني معظم المصابين بمرض الداء البطني من أمعاء دقيقة تبدو طبيعية في التنظير قبل فحص الخزعات. ومع ذلك فقد ارتبطت خمس اكتشافات بخصوصية عالية لمرض الداء البطني: التصاعد في طيات الأمعاء الدقيقة، ونقص الطيات، ونمط الفسيفساء للغشاء المخاطي (الموصوف بمظهر «الطمي المتشقق»)، وبروز الأوعية الدموية تحت المخاطية، ونمط عقدي للغشاء المخاطي.[109]
تشير الإرشادات الأوروبية إلى أنه في الأطفال والمراهقين الذين يعانون من أعراض متوافقة مع مرض الداء البطني، يمكن إجراء التشخيص دون الحاجة إلى أخذ خزعة من الأمعاء إذا كانت مستويات مضادات الأجسام المضادة للجلوتاميناز عالية جدًا (10 أضعاف الحد الأعلى الطبيعي).[100]

حتى السبعينيات كان يُحصل على الخزعات باستخدام كبسولات معدنية متصلة بجهاز شفط. حيث تُبتلع الكبسولة ويُسمح لها بالمرور إلى الأمعاء الدقيقة. بعد التحقق من موقعها بالأشعة السينية يُفعّل الشفط لتجمع جزءًا من جدار الأمعاء داخل الكبسولة. غالبًا ما كانت أنظمة الكبسولات المستخدمة هي كبسولة واتسون Watson وكبسولة كروسبي-كوجلر Crosby-Kugler. واستُبدلت حاليُا هذه الطريقة إلى حد كبير بالتنظير الداخلي بالألياف الضوئية، والذي يمتلك حساسية أعلى وتكرار أخطاء أقل.[110] يسمح تنظير الكبسولة (CE) بتحديد التغيرات النموذجية في الغشاء المخاطي التي لوحظت في مرض الداء البطني، لكن حساسية أقل مقارنةً بالتنظير الداخلي وعلم الأنسجة. لذلك فإن تنظير الكبسولة ليست أداة التشخيص الأولية لمرض الداء البطني. ومع ذلك يمكن استخدام تنظير الكبسولة لتشخيص سرطان الغدد الليمفاوية التائية والتهاب الصائم التقرحي وورم الغدة النخامية في مرض الداء البطني المقاومة للعلاج أو المعقدة.[111]
علم الأمراض
[عدل]تُصَنَّفُ التغييرات المرضية الكلاسيكية لمرض الداء البطني في الأمعاء الدقيقة من خلال «تصنيف مارش»:[112]
- مرحلة مارش 0: الغشاء المخاطي طبيعي.
- مرحلة مارش 1: زيادة عدد الخلايا الليمفاوية داخل الخلايا الطلائية (IELs)، وعادة ما يتجاوز 20 لكل 100 خلية معوية.
- مرحلة مارش 2: تكاثر الغدد المعوية (crypts of Lieberkühn).
- مرحلة مارش 3: ضمور الزغابات بشكل جزئي أوكامل وتضخم الغدد المعوية.[113]
- مرحلة مارش 4: نقص تنسج بنية الأمعاء الدقيقة.
عُدِّلَ تصنيف مارش -الذي قُدِّمَ في عام 1992- في عام 1999 إلى ست مراحل، حيث قُسمت المرحلة الثالثة السابقة إلى ثلاث مراحل فرعية.[114] أظهرت دراسات أخرى أن هذا النظام لم يكن موثوقًا به دائمًا وأن التغييرات التي لوحظت في مرض الداء البطني يمكن وصفها في واحدة من ثلاث مراحل:[51][115]
- مرحلة أ يمثل تسلل الخلايا الليمفاوية مع مظهر زغبي طبيعي.
- مرحلة ب1 يصف ضمور زغبي جزئي.
- مرحلة ب2 يصف الضمور الزغبي الكامل.
التغييرات تتحسن بشكل كلاسيكي أو تنعكس بعد إزالة الغلوتين من النظام الغذائي. ومع ذلك فإن معظم الإرشادات لا توصي بتكرار الخزعة الا إذا لم يكن هناك تحسن في الأعراض خلال النظام الغذائي.[101][102] في بعض الحالات قد يُجرى اختبار لبعض الأطعمة المحتوية على الغلوتين متبوعًا بأخذ عينة لتأكيد أو نفي التشخيص. تشير الخزعة الطبيعية والأمصال الطبيعية بعد الاختبار إلى أن التشخيص قد يكون غير صحيح.[101]
في حالة عدم علاج مرض الداء البطني، يكون ضمور الزغابات أكثر شيوعًا في الأطفال الذين تقل أعمارهم عن ثلاث سنوات، ولكن عند الأطفال الأكبر سنًا والبالغين من الشائع العثور على آفات معوية طفيفة (كثرة اللمفاويات الإثني عشرية) مع زغابات معوية طبيعية.[116][117]
الاختبارات التشخيصية الأخرى
[عدل]في وقت التشخيص يمكن إجراء مزيد من الاختبارات لتحديد المضاعفات، مثل نقص الحديد (عن طريق فحص تعداد الدم الكامل وفحوصات الحديد)، ونقص حمض الفوليك ونقص فيتامين ب 12 ونقص الكالسيوم في الدم (انخفاض مستويات الكالسيوم، غالبًا بسبب انخفاض مستويات فيتامين د). قد يُطلب فحص اختبارات وظائف الغدة الدرقية أثناء اختبارات الدم لتحديد وجود قصور الغدة الدرقية، وهو أكثر شيوعًا لدى الأشخاص المصابين بمرض الداء البطني.[46]
غالبًا ما يوجد قلة العظام (Osteopenia) وهشاشة العظام (Osteoporosis)، وانخفاض كثافة المعادن في العظام بشكل طفيف وشديد في الأشخاص المصابين بمرض الداء البطني، ويمكن إجراء فحوصات لقياس كثافة العظام عند التشخيص مثل مقياس امتصاص الأشعة السينية ثنائي البواعث (DXA)، لتحديد المخاطر من الكسر والحاجة إلى دواء لحماية العظام.[101][46]
ترك الغلوتين
[عدل]على الرغم من أن اختبارات الأجسام المضادة في الدم والخزعات والاختبارات الجينية توفر عادة تشخيصًا واضحًا،[96][118] إلا أنه في بعض الأحيان تكون الاستجابة لسحب الغلوتين في نظام غذائي خالٍ من الغلوتين ضرورية لدعم التشخيص. في الوقت الحالي لم تعد هناك حاجة لاختبارلبعض الأطعمة المحتوية على الغلوتين لتأكيد التشخيص في المرضى الذين يعانون من الآفات المعوية المتوافقة مع مرض الداء البطني والاستجابة الإيجابية لنظام غذائي خالٍ من الغلوتين.[96] ومع ذلك في بعض الحالات قد يكون اختبار بعض الاطعمة المحتوية على الغلوتين مع أخذ خزعة لاحقة مفيدًا لدعم التشخيص على سبيل المثال في الأشخاص الذين يشتبه بشدة في إصابتهم بمرض الداء البطني دون تأكيد الخزعة، والذين لديهم أجسام مضادة سلبية في الدم ويخضعون بالفعل لنظام غذائي خالٍ من الغلوتين.[96] لا يُحبذ اختبار بعض الأطعمة المحتوية على الغلوتين قبل سن 5 سنوات وأثناء البلوغ.[119] يمكن إجراء التشخيص البديل لحساسية الغلوتين اللا بطني في حالة وجود أعراض فقط على حساسية الغلوتين.[120] يمكن أن تكون أعراض الجهاز الهضمي والأمعاء للأشخاص الذين يعانون من حساسية الغلوتين غير الداء البطني مماثلة لتلك الخاصة بمرض الداء البطني،[108] وتتحسن عند إزالة الغلوتين من النظام الغذائي[121][122] بعد استبعاد مرض الداء البطني وحساسية القمح بشكل معقول.[123]
غالبًا يستمر ما يصل إلى 30٪ من الأشخاص في إظهار الأعراض أو إعادة تطويرها بعد بدء نظام غذائي خالٍ من الغلوتين.[124] هناك حاجة إلى تفسير دقيق للاستجابة للأعراض حيث إن عدم الاستجابة لدى الشخص المصاب بمرض الداء البطني قد يكون بسبب استمرار تناول كميات صغيرة من الغلوتين إما بشكل طوعي أو غير مقصود،[116] أو بسبب حالات أخرى شائعة مثل فرط النمو البكتيري في الأمعاء الدقيقة (SIBO)، عدم تحمل اللاكتوز، سوء الإمتصاص للفركتوز[125] والسكروز،[126] والسوربيتول،[127] قصور البنكرياس الإفرازي،[128][129] والتهاب القولون المجهري،[129] من بين أمور أخرى. في حالة عدم علاج مرض الداء البطني غالبًا ما تكون هذه حالات عابرة ناتجة عن تلف الأمعاء.[126][127][130][131][94] عادة ما يعودون أو يتحسنون بعد عدة أشهر من بدء نظام غذائي خالٍ من الغلوتين، لكنهم قد يحتاجون إلى تدخلات مؤقتة مثل المكملات مع إنزيمات البنكرياس،[131][94] أو القيود الغذائية على اللاكتوز أوالفركتوز أوالسكروز أوالأطعمة التي تحتوي على السوربيتول،[126][130] أوالعلاج بالمضادات الحيوية عن طريق الفم في حالة فرط نمو البكتيريا.[94] بالإضافة إلى ترك الغلوتين، يحتاج بعض الأشخاص إلى إتباع نظام غذائي منخفض الفودماب أو تجنب استهلاك المنتجات التجارية الخالية من الغلوتين، والتي عادة ما تكون غنية بالمواد الحافظة والمواد المضافة مثل الكبريتات والغلوتامات (ملح أو إستر حمض الغلوتاميك) والنترات والبنزوات وقد يكون لها دور في إثارة أعراض الجهاز الهضمي الوظيفية.[132]
الفحص
[عدل]هناك جدال بشأن الفوائد المترتبة على فحص الداء البطني. وحتى عام 2017، لم تجد فرقة العمل المعنية بالخدمات الوقائية في الولايات المتحدة أدلة كافية لتقديم توصية بين الأشخاص الذين لا يعانون من أعراض.[29] وفي المملكة المتحدة، أوصى المعهد الوطني للصحة وجودة الرعاية (نيس) بإجراء اختبار لمرضى الداء البطني في الأقارب من الدرجة الأولى من المصابين بالمرض بشكل مؤكد، وفي الأشخاص الذين يعانون من التعب المستمر، وأعراض البطن أو الجهاز الهضمي، والنمو المتعثر، وفقدان الوزن غير المبرر أو الحديد، ونقص فيتامين B12 أو نقص الفولات، وقرحة الفم الشديدة، ومع تشخيص مرض السكري من النوع 1، والتهاب الغدة الدرقية بالمناعة الذاتية،[22] ومع متلازمة التعب المزمن[133] التي شُخِّصت حديثًا ومتلازمة القولون المتهيج. ويُضمّن التهاب الجلد الهربسي الشكل في توصيات أخرى.[134] توصي نايس (NICE) أيضًا بتقديم اختبارات مصلية لمرض الداء البطني في الأشخاص الذين يعانون من أمراض العظام الأيضية (انخفاض كثافة المعادن في العظام أو تلين العظام)، والاضطرابات العصبية غير المبررة (مثل اعتلال الأعصاب المحيطية والرنح)، ومشاكل الخصوبة أو إجهاض تلقائي متكرر، وإنزيمات الكبد التي تُرفع باستمرار مع سبب غير معروف، وعيوب مينا الأسنان وأيضاً تشخيص متلازمة داون أو متلازمة تيرنر.[22]
وقد وجدت بعض الأدلة أن الكشف المبكر قد يقلل من خطر الإصابة بمضاعفات صحية، مثل هشاشة العظام، وفقر الدم، وأنواع معينة من السرطان، والاضطرابات العصبية، وأمراض قلبية وعائية، والمشاكل الإنجابية.[10][28][135][136][137] وبالتالي يوصون بالفحص في الأشخاص الذين يعانون من مشاكل صحية مؤكدة.[137]
اقْتُرح علم الأمصال كإجراء للكشف، لأن وجود الأجسام المضادة من شأنه الكشف عن بعض الحالات التي لم تُشخّص سابقاً من مرض الداء البطني ومنع مضاعفاته في هؤلاء الناس. ومع ذلك، فإن الاختبارات المصلية لديها حساسية عالية فقط في الأشخاص الذين يعانون من ضمور زغابي كلي، ولديهم قدرة قليلة جدًا على اكتشاف الحالات التي تحتوي على ضمور زغابي جزئي أو آفات معوية بسيطة.[25] قد يُقدّم اختبار مرض الداء البطني لأولئك الذين يعانون من حالات مرتبطة عادة.[19][22]
العلاج
[عدل]النظام الغذائي
[عدل]في الوقت الحاضر، العلاج الفعال الوحيد هو اتباع نظام غذائي خال من الغلوتين مدى الحياة.[138] لا يوجد دواء يمنع الضرر أو يمنع الجسم من مهاجمة الأمعاء عندما يكون الغلوتين موجودًا. الالتزام الصارم بالنظام الغذائي يساعد الأمعاء على الشفاء، مما يؤدي إلى حل جميع الأعراض في معظم الحالات، واعتمادًا على وقت بدء النظام الغذائي، يمكن أيضًا القضاء على خطر الإصابة بهشاشة العظام وسرطان الأمعاء وفي بعض الحالات العقم.[139] النظام الغذائي يمكن أن يكون مرهقًا، وعدم الامتثال للنظام الغذائي قد يسبب الانتكاس.
بشكلِ عام فإنّ تدخل أخصائي التغذية مطلوب لضمان أن يكون الشخص على علم بالأطعمة التي تحتوي على الغلوتين، والأطعمة التي هي آمنة، وكيفية الحصول على نظام غذائي متوازن على الرغم من القيود. في العديد من البلدان، تتوفر المنتجات الخالية من الغلوتين بوصفة طبية ويمكن أن تسدد فواتيرها خطط التأمين الصحي. المنتجات الخالية من الغلوتين عادة ما تكون أكثر تكلفة وأصعب للعثور عليها من الأطعمة الشائعة المحتوية على الغلوتين.[140] وبما أن المنتجات الجاهزة تحتوي في كثير من الأحيان على آثار من الغلوتين، فقد يجد بعض المرضى أنه من الضروري طهي الطعام من الصفر.[141]
يستخدم مصطلح «خال من الغلوتين» بشكل عام للإشارة إلى مستوى غير ضار مفترض من الغلوتين بدلاً من عدم وجوده بالكامل.[142] المستوى الدقيق الذي يكون فيه الغلوتين غير ضار غير مؤكد وجدلي. وجدت مراجعة منهجية حديثة مبدئية أن استهلاك أقل من 10 ملغ من الغلوتين يومياً من غير المرجح أن يسبب تشوهات في النسيج، على الرغم من أنه لوحظ أنه لم يُجرى سوى عدد قليل من الدراسات الموثوقة.[142]
يختلف نظام التسمية «خالية من الغلوتين». في الاتحاد الأوروبي، أصدرت المفوضية الأوروبية لوائح في عام 2009 تحد من استخدام الملصقات «خالية من الغلوتين» للمنتجات الغذائية إلا للمنتجات التي يقل وزن الجلوتين فيها عن 20 ملغم/كغم، وملصقات «منخفضة جداً من الغلوتين» للمنتجات التي يقل وزن الجلوتين فيها عن 100 ملغم/كغم.[143] في الولايات المتحدة، أصدرت إدارة الأغذية والعقاقير لوائح في عام 2013 تحد من استخدام الملصقات «الخالية من الغلوتين» للمنتجات الغذائية باستثناء المنتجات التي تقل نسبة الجلوتين فيها عن 20 جزء من المليون.[144][145][146] يسمح معيار Codex Alimentarius الدولي الحالي بـ 20 جزء في المليون من الغلوتين في ما يسمى بالأطعمة «الخالية من الغلوتين».[147] العديد من المنظمات، مثل منظمة إصدار الشهادات الخالية من الغلوتين (GFCO)، وجمعية السيلياك سبري (CSA)، والمؤسسة الوطنية للوعي الداء البطني (NFCA)، أيضا تصدّق على منتجات وشركات باعتبارها خالية من الغلوتين.[148]
النظام الغذائي الخالي من الغلوتين يحسن نوعية الحياة المرتبطة بالرعاية الصحية، والالتزام الصارم بالنظام الغذائي يعطي فائدة أكثر من الالتزام غير المكتمل. ومع ذلك، فإن النظام الغذائي الخالي من الغلوتين لا يجعل نوعية الحياة طبيعيةً تمامًا.[149]
مرض الانكسار
[عدل]ما بين 0.3٪ و 10٪ من الناس يعانون من مرض الانكسار، مما يعني أن لديهم ضمورًا مستمرًا في الجهاز الهضمي على الرغم من التزامهم بنظام غذائي خال من الغلوتين لأكثر من 12 شهرًا.[150] ومع ذلك، التعرض غير المقصود للغلوتين هو السبب الرئيسي للضمور المستمر، ويجب استبعاده قبل إجراء تشخيص مرض الانكسار.[150] الناس الفقراء مع التعليم الأساسي السيئ وفهمهم المحدود للنظام الغذائي الخالي من الغلوتين غالبًا ما يعتقدون أنهم يتبعون النظام الغذائي بدقة، ولكنهم يرتكبون أخطاءً منتظمةً.[14][150][151] أيضًا، عدم وجود أعراض ليس مؤشرا موثوقا للتعافي المعوي.[150]
إذا قُضِيَ على الأسباب البديلة للضمور الزغابي، يمكن النظر في هذا السيناريو لإعطاء الهرمونات القشرية السكرية (Glucocoricoids) أو مثبطات المناعة (مثل الأزوثيوبرين).[152]
لا ينبغي الخلط بين مرض الداء البطني الانكساري وبين استمرار الأعراض «على الرغم من ترك الغلوتين»[150] الناجمة عن ظروف عابرة ناتجة من تلف الأمعاء،[153][154][155] التي عادة ما تعود أو تتحسن بعد عدة أشهر من بدء اتباع نظام غذائي خال من الغلوتين،[156][157] مثل فرط النمو البكتيري المعوي الصغيرة، وعدم تحمل اللاكتوز، والفركتوز،[158] والسكروز،[153] والسوربيتول،[154] وسوء الامتصاص، وقصور إفراز الغدة الخارجية للبنكرياس،[159][150] والتهاب القولون المجهري[150] وأمور أخرى.
علم الأوبئة
[عدل]يصيب الداء البطني (مرض حساسية القمح) على الصعيد العالمي ما بين 1 من كل 100 و 1 من كل 170 شخصاً.[15][56] غير أن المعدلات تتفاوت بين مختلف مناطق العالم من عدد قليل من 1 من 300 إلى ما يصل إلى 1 من 40.[15] في الولايات المتحدة، يعتقد أنها تؤثر على ما بين 1 من 1750 (معرّفة بأنها مرض سريري بما في ذلك التهاب الجلد الهضمي ذو الجهاز الهضمي المحدود) إلى 1 من 105 (محددة بوجود IgA TG في المتبرعين بالدم.).[57] بسبب العلامات والأعراض المتغيرة، يعتقد أن حوالي 85% من الأشخاص المصابين غير مشخصين.[58] النسبة المئوية للأشخاص المصابين بالمرض المشخص سريرياً (أعراض تحفز على إجراء اختبار تشخيصي) هي 0.05-0.27% في مختلف الدراسات. غير أن الدراسات السكانية الواردة من أجزاء من أوروبا، الهند، أمريكا الجنوبية، أستراليا، والولايات المتحدة الأمريكية (استخدام علم الأمصال والخزعة) تشير إلى أن نسبة المصابين بالمرض قد تتراوح بين 0.33 و1.06% في الأطفال (ولكن نسبة 5.66% في دراسة واحدة لأطفال الشعب الصحراوي المستبعد[59]) و0.18-1.2% في البالغين.[28] من بين سكان الرعاية الأولية الذين يُبلغون عن الأعراض المعدية المعوية، يبلغ معدل الإصابة بالداء البطني حوالي 3%.[60] وفي أستراليا، هناك ما يقرب من 1 من 70 شخص مصابون بالمرض.[160] معدل المتبرعين بالدم البالغين في إيران وإسرائيل وسوريا وتركيا هو 0.60%، 0.64%، 1.61%، و1.15%، على التوالي.[61]
نادراً ما يُشخّص السكان المنحدرون من أصل أفريقي أو ياباني أو صيني؛[62] ويعكس هذا تفشي عوامل الخطر الوراثية بدرجة أقل بكثير، مثل HLA-B8.[161] ويبدو أن السكان من أصول هندية يواجهون خطراً مماثلاً لخطر السكان من أصول قوقازية غربية.[61] وتشير الدراسات السكانية أيضا إلى أن نسبة كبيرة من المصابين لا تزال دون تشخيص؛ ويرجع ذلك جزئيا إلى عدم إلمام العديد من الأطباء الطبيين بالحالة وكذلك بسبب حقيقة أنه لا يمكن أن يكون أعراضاً.[162] مرض الداء البطني أكثر شيوعا قليلا في النساء منه في الرجال.[32] وجدت دراسة كبيرة متعددة المراكز في الولايات المتحدة أن نسبة الانتشار تبلغ 0.75% في المجموعات غير المعرضة للخطر، وترتفع إلى 1.8% لدى الأشخاص الذين يعانون من الأعراض، و2.6% من الأقارب من الدرجة الثانية (مثل الأجداد أو العمة أو العم أو الأحفاد وما إلى ذلك) لشخص مصاب بمرض الداء البطني و4.5% في الأقارب من الدرجة الأولى (الأشقاء أو الآباء أو الأطفال).[61] وهذا الموجز مماثل لانتشار المرض في أوروبا.[61] السكان الآخرون المعرضون لخطر متزايد للإصابة بمرض الداء البطني، مع معدلات انتشار تتراوح من 5% إلى 10%، تشمل الأفراد المصابين بمتلازمة داون وتيرنر، مرضى السكري من النوع الأول، ومرضى داء الغدة الدرقية المناعي الذاتي. بما في ذلك فرط نشاط الغدة الدرقية (hyperthyroidism) وقصور نشاط الغدة الدرقية (hypothyroidism).[163]
تاريخياً، كان يُعتقد أنَّ مرض الداء البطني نادر الحدوث، مع انتشار حوالي 0.02%.[163] السبب في الزيادات الأخيرة في عدد الحالات المبلغ عنها غير واضح.[56] قد يكون ذلك جزئياً على الأقل بسبب التغيرات في الممارسة التشخيصية.[164] ويبدو أيضا أن هناك زيادة حقيقية قدرها 4.5 أضعاف تقريبا قد تكون ناجمة عن قلة التعرض للبكتيريا وغيرها من مسببات الأمراض في البيئات الغربيّة.[164]يبلغ متوسط العمر عند التشخيص 38 سنة في الولايات المتحدة الأمريكية.[165] يُشخّص 20 في المائة تقريبا من الأفراد المصابين بمرض الداء البطني بعد سن 60 عامًا.[165]
التاريخ
[عدل]مصطلح «الاضطرابات الهضمية» مشتق من الكلمة اليونانية (κοιλιακός، «البطن») وقد قُدِّم في القرن التاسع عشر في ترجمة لما يعتبره أريتايوس القبادوقي وصفًا إغريقياً قديمًا للمرض.[166][167]
بدأ البشر لأول مرة في زراعة الحبوب في العصر الحجري الحديث (بداية حوالي 9500 قبل الميلاد) في الهلال الخصيب في غرب آسيا، ومن المحتمل أن مرض الداء البطني لم يحدث قبل هذا الوقت. أريتايوس القبادوقي الذي عاش في القرن الثاني في نفس المنطقة، سجل متلازمة سوء الامتصاص مع الإسهال المزمن، مما تسبب في ضعف الجسم كله.[166] حظي كتابه «العلة البطنية» (بطني من اليونانية κοιλιακός، «البطن») باهتمام الطب الغربي عندما قدم فرانسيس آدامز ترجمة لعمل أريتايوس في جمعية سيدنهام في عام 1856. كان المريض الموصوف في عمل أريتايوس يعاني من آلام في المعدة وكان ضامرًا وشاحبًا وضعيفًا وعاجزًا عن العمل. ظهر الإسهال على شكل براز رخو أبيض كريه الرائحة وانتفاخ البطن، وكان المرض مستعصيا على الشفاء وعرضة للعودة الدورية. يعتقد أرياتوس أن المشكلة تكمن في نقص الحرارة في المعدة اللازمة لهضم الطعام وانخفاض القدرة على توزيع منتجات الجهاز الهضمي في جميع أنحاء الجسم، وهذا الهضم غير المكتمل يؤدي إلى الإسهال. لقد اعتبر هذا بلاءً لكبار السن وأكثر شيوعًا عند النساء، ويستبعد الأطفال. ووفقًا لما قاله أرياتوس كان السبب في بعض الأحيان إما مرض مزمن آخر أو حتى إستهلاك «كمية وفيرة من الماء البارد».[166][167]
قدم طبيب الأطفال «صموئيل جي» أول وصف حديث للحالة عند الأطفال في محاضرة في مستشفى «الأطفال المرضى»، «جريت أورموند ستريت»، لندن، عام 1887. اعترف «جي» بالأوصاف والمصطلحات السابقة للمرض واعتمد نفس المصطلح مثل Aretaeus (مرض الاضطرابات الهضمية). وصرح بإدراك: «إذا كان المريض من الممكن علاجه، فيجب أن يكون عن طريق النظام الغذائي». أدرك «جي» أن عدم تحمل الحليب يمثل مشكلة للأطفال الذين يعانون من الاضطرابات الهضمية وأنه يجب تجنب الأطعمة كثيرة النشا. ومع ذلك ، فقد نهى عن الأرز، والساغو، والفواكه، والخضروات، والتي كانت جميعها آمنة للأكل، وأوصى باللحوم النيئة وكذلك شرائح رقيقة من الخبز المحمص. وقد سلط الضوء على نجاح خاص مع طفل «كان يتغذى على ربع جالون من أفضل بلح البحر الهولندي يوميًا». ومع ذلك، لم يستطع الطفل تحمل هذا النظام الغذائي لأكثر من موسم واحد.[168][169]
كتب الطبيب الأمريكي «كريستيان أرشيبالد هيرتر» كتابًا في عام 1908 عن الأطفال المصابين بمرض الاضطرابات الهضمية، والذي أسماه «الطفولة المعوية». وأشار إلى أن نموها يتأخر وأن الدهون يمكن تحملها بشكل أفضل من الكربوهيدرات. استخدم مرض «جي هيرتر» في بعض الأحيان للاعتراف بكلتا المساهمتين.[170][171] وأفاد «سيدني في هاس»، طبيب الأطفال الأمريكي، عن آثار إيجابية لنظام غذائي من الموز في عام 1924.[172] ظل هذا النظام الغذائي رائجًا حتى حُدِّدَ السبب الفعلي لمرض الاضطرابات الهضمية.[168]
في حين اشتُبِه في دور الكربوهيدرات، لم يُربط بالقمح حتى الأربعينيات من قبل طبيب الأطفال الهولندي الدكتور «فيليم كاريل ديك».[173] من المحتمل أن يكون التحسن السريري لمرضاه خلال المجاعة الهولندية عام 1944 (التي كان الدقيق خلالها نادرًا) قد ساهم في اكتشافه.[174] لاحظ «ديك» أن نقص الخبز أدى إلى انخفاض كبير في معدل الوفيات بين الأطفال المصابين بمرض الاضطرابات الهضمية من أكثر من 35٪ إلى صفر أساسًا. كما أفاد أنه بمجرد توفر القمح مرة أخرى بعد الصراع، ارتفع معدل الوفيات إلى المستويات السابقة.[175] رُبِطَت العلاقة بمكون الغلوتين في القمح عام 1952 بواسطة فريق من برمنغهام، إنجلترا.[176] وصف الطبيب البريطاني جون دبليو باولي الضمور الزغابي في عام 1954 على عينات أخذت في الجراحة.[177] وقد مهد هذا الطريق لأخذ عينات الخزعة عن طريق التنظير الداخلي.[168]
خلال الستينيات، وُضِّحَت السمات الأخرى لمرض الاضطرابات الهضمية. وعُرِفَ طابعه الوراثي في عام 1965.[178] وفي عام 1966، ارتبط التهاب الجلد الحلئي الشكل بحساسية الغلوتين.[168][179]
الثقافة والناحية الاجتماعية
[عدل]اعتبرت العديد من منظمات الداء البطني شهر مايو «شهر التوعية بالداء البطني».[180][181]
الكنائس المسيحية والقربان المقدس
[عدل]بشكل عام تحتفل طوائف المسيحيين المختلفة بأفخارستيا، بحيث تُبارك فيها رقاقة أو قطعة صغيرة من الخبز المقدّس من خبز القمح ثم تؤكل. تزن الرقاقة النموذجية حوالي نصف جرام.[182] يحتوي دقيق القمح على حوالي 10 إلى 13٪ جلوتين، لذلك قد تحتوي رقاقة واحدة على أكثر من 50 مجم من الغلوتين وهي كمية تضر بالكثير من الأشخاص المصابين بالداء البطني، خاصة إذا تناولها المريض يوميًا (انظر النظام الغذائي أعلاه).
تقدم العديد من الكنائس المسيحية لمراسليها بدائل خالية من الغلوتين، وعادة ما تكون على شكل رقائق مصنوعة من الأرز أوخبز خال من الغلوتين. وتشمل هذه الميثودية المتحدة والمسيحية الإصلاحية والأسقفية والكنيسة الأنجليكانية (كنيسة إنجلترا، المملكة المتحدة) واللوثريه. قد يتلقى الكاثوليكون من الكأس بمفردهم أويطلبون خبزاً مقدساً مخفض الغلوتين، ومع ذلك لا تعتبر الأطعمة الخالية من الغلوتين خبز قمح وبالتالي فهي غير صالحة.[183]
موقف الروم الكاثوليك
[عدل]تنص العقيدة الكاثوليكية الرومانية على أنه من أجل أفخارستيا صالحة، يجب أن يكون الخبز المستخدم في القداس مصنوعًا من القمح. يلبي الخبز المقدس منخفض الغلوتين جميع متطلبات الكنيسة الكاثوليكية لكنه ليس خالي تمامًا من الغلوتين، وقد رُفِضَ طلبات استخدام رقائق الأرز.[184]
القضية أكثر تعقيدًا بالنسبة للكهنة، بصفته مقيم القداس فإن عليه من أجل ملء ذبيحة القداس، مطلوب تمامًا أن يتلقى تحت كلا النوعين. في 24 تموز/يوليو 2003، صرّح مجمع عقيدة الإيمان «بالنظر إلى مركزية الاحتفال بالأفخارستيا في حياة الكاهن يجب على المرء أن يمضي بحذر شديد قبل قبول الكهنة، بحيث يكون المرشحون قادرون على تناول الغلوتين أو الكحول دون ضرر جسيم».[185]
بحلول كانون الثاني (يناير) 2004، أصبح الخبز المعتمد من الكنيسة منخفض الغلوتين متاح في الولايات المتحدة وإيطاليا وأستراليا.[186] حتى يوليو 2017، لا يزال الفاتيكان يحظر استخدام الخبز الخالي من الغلوتين في المناولة المقدسة.[187]
عيد الفصح
[عدل]قد يطرح مهرجان بيشاش اليهودي مشاكل فيما يتصل بالتزامه بأكل الماتزو، وهو خبز غير مخمر مصنوع بطريقة خاضعة للرقابة الصارمة من القمح أوالشعير أوالحنطة أوالشوفان أوالذرة. الأمر الذي يستبعد العديد من الحبوب الأخرى التي تستخدم عادة كبدائل للأشخاص الذين يعانون من حساسية الغلوتين، وخاصة بالنسبة لليهود الأشكناز الذين يتجنبون الأرز أيضًا. العديد من منتجات الكوشر لعيد الفصح يتجنب فيها الحبوب تمامًا، وبالتالي فهي خالية من الغلوتين. ويعد نشا البطاطس النشا الأساسي المستخدم ليحل محل الحبوب.
التوجهات البحثية
[عدل]ازداد البحث عن العوامل البيئية التي يمكن أن تكون مسؤولة عن اصابة الأشخاص المعرضين وراثيًا للإصابة بعدم تحمل الغلوتين، وازدادت فعالية البحث في التهابات الجهاز الهضمي.[188] تشير الأبحاث المنشورة في أبريل 2017 إلى أن العدوى التي غالبًا ما تكون بدون أعراض بسبب سلالة شائعة من الفيروسات التنفسية المعوية اليتيمة يمكن أن تزيد من الحساسية تجاه الأطعمة مثل الغلوتين.[189]
تُدرس حاليًا مناهج علاجية مختلفة، بما في ذلك بعض الأساليب التي من شأنها تقليل الحاجة إلى اتباع نظام غذائي. لا تزال جميعها قيد التطوير ولا يُتوقع أن تكون متاحة لعامة الناس لفترة من الوقت.[36][190][191]
اقتُرحت ثلاث طرق رئيسية كطرق علاجية جديدة لمرض الداء البطني: إزالة السموم من الغلوتين، وتعديل نفاذية الأمعاء، وتعديل الاستجابة المناعية.[192]
قد يسمح استخدام أنواع القمح المعدلة عن طريق الهندسة الوراثية أوأنواع القمح التي حُسِّن نوعها النباتي بتقليل قدرتها المناعية أقل ما يمكن والذي يسمح باستهلاك القمح. ومع ذلك قد يتداخل هذا مع التأثيرات التي يحدثها الجليادين على جودة العجين. بدلاً من ذلك يمكن التقليل من التعرض للجلوتين عن طريق تناول مجموعة من الإنزيمات (بروبيل إندوبيبتيداز، وإنديوببتيداز السيستين الخاص بالجلوتامين في الشعير (EP-B2) التي تحلل الببتيد المتكون من 33 حمض أميني في الاثني عشر).[36]
تشمل العلاجات البديلة (التي هي قيد الدراسة) تثبيط الزونولين، وهو بروتين تأشير داخلي مرتبط بزيادة نفاذية جدار الأمعاء وبالتالي زيادة عرض الغليادين للجهاز المناعي. أحد مثبطات هذا المسار هو أسيتات لارازوتيد، والذي من المقرر حاليًا إجراء المرحلة الثالثة من التجارب السريرية عليه.[193] معدِّلات أخرى لخطوات أخرى مفهومة جيدًا في التسبب في مرض الداء البطني مثل عمل HLA-DQ2 أو ناقل جلوتامين الأنسجة وتفاعل MICA/ NKG2D الذي قد يحتمل أن يكون سبباً في قتل الخلايا المعوية.[36]
لا تزال محاولات تعديل الاستجابة المناعية فيما يتعلق بمرض الداء البطني في الغالب في المرحلة الأولى من الاختبارات السريرية، وقد قُيِّمَ عامل واحد (CCX282-B) في المرحلة الثانية من التجربة السريرية على أساس الخزعات المعوية الدقيقة المأخوذة من الأشخاص المصابين بمرض الداء البطني قبل وبعد التعرض للجلوتين.[192]
على الرغم من استخدامها بشكل شائع كعلاج بديل للأشخاص المصابين بالتوحد، إلا أنه لا يوجد دليل جيد على أن النظام الغذائي الخالي من الغلوتين مفيد.[194][195][196] في المجموعة الفرعية من الأشخاص الذين لديهم حساسية من الغلوتين، هناك أدلة محدودة تشير إلى أن النظام الغذائي الخالي من الغلوتين قد يحسن بعض سلوكيات التوحد.[194][197][198]
المراجع
[عدل]- ^ Disease Ontology (بالإنجليزية), 27 May 2016, QID:Q5282129
- ^ ا ب Tovoli F، Masi C، Guidetti E، Negrini G، Paterini P، Bolondi L (مارس 2015). "Clinical and diagnostic aspects of gluten related disorders". World Journal of Clinical Cases (Review). ج. 3 ع. 3: 275–84. DOI:10.12998/wjcc.v3.i3.275. PMC:4360499. PMID:25789300.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ ا ب ج د ه و Fasano A (أبريل 2005). "Clinical presentation of celiac disease in the pediatric population". Gastroenterology (Review). ج. 128 ع. 4 Suppl 1: S68–73. DOI:10.1053/j.gastro.2005.02.015. PMID:15825129.
- ^ ا ب ج د ه و ز ح ط Husby S، Koletzko S، Korponay-Szabó IR، Mearin ML، Phillips A، Shamir R، Troncone R، Giersiepen K، Branski D، Catassi C، Lelgeman M، Mäki M، Ribes-Koninckx C، Ventura A، Zimmer KP، ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (يناير 2012). "European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease" (PDF). J Pediatr Gastroenterol Nutr (Practice Guideline). ج. 54 ع. 1: 136–60. DOI:10.1097/MPG.0b013e31821a23d0. PMID:22197856. S2CID:15029283. مؤرشف من الأصل (PDF) في 2016-04-03. اطلع عليه بتاريخ 2016-03-19.
Since 1990, the understanding of the pathological processes of CD has increased enormously, leading to a change in the clinical paradigm of CD from a chronic, gluten-dependent enteropathy of childhood to a systemic disease with chronic immune features affecting different organ systems. (...) atypical symptoms may be considerably more common than classic symptoms
- ^ Zhang، Yong-Guo؛ Singhal، Megha؛ Lin، Zhijie؛ Manzella، Christopher؛ Kumar، Anoop؛ Alrefai، Waddah A.؛ Dudeja، Pradeep K.؛ Saksena، Seema؛ Sun، Jun (30 يناير 2018). "Infection with enteric pathogensSalmonella typhimurium and Citrobacter rodentiummodulate TGF-beta/Smad signaling pathways in the intestine". Gut Microbes: 1–12. DOI:10.1080/19490976.2018.1429878. ISSN:1949-0976. مؤرشف من الأصل في 2021-07-10.
- ^ ا ب ج د Ciccocioppo R، Kruzliak P، Cangemi GC، Pohanka M، Betti E، Lauret E، Rodrigo L (22 أكتوبر 2015). "The Spectrum of Differences between Childhood and Adulthood Celiac Disease". Nutrients (Review). ج. 7 ع. 10: 8733–51. DOI:10.3390/nu7105426. PMC:4632446. PMID:26506381.
Several additional studies in extensive series of coeliac patients have clearly shown that TG2A sensitivity varies depending on the severity of duodenal damage, and reaches almost 100% in the presence of complete villous atrophy (more common in children under three years), 70% for subtotal atrophy, and up to 30% when only an increase in IELs is present. (IELs: intraepithelial lymphocytes)
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ ا ب Lebwohl B، Ludvigsson JF، Green PH (أكتوبر 2015). "Celiac disease and non-celiac gluten sensitivity". BMJ (Review). ج. 351: h4347. DOI:10.1136/bmj.h4347. PMC:4596973. PMID:26438584.
Celiac disease occurs in about 1% of the population worldwide, although most people with the condition are undiagnosed. It can cause a wide variety of symptoms, both intestinal and extra-intestinal because it is a systemic autoimmune disease that is triggered by dietary gluten. Patients with coeliac disease are at increased risk of cancer, including a twofold to fourfold increased risk of non-Hodgkin's lymphoma and a more than 30-fold increased risk of small intestinal adenocarcinoma, and they have a 1.4-fold increased risk of death.
- ^ ا ب Lundin KE، Wijmenga C (سبتمبر 2015). "Coeliac disease and autoimmune disease-genetic overlap and screening". Nature Reviews. Gastroenterology & Hepatology (Review). ج. 12 ع. 9: 507–15. DOI:10.1038/nrgastro.2015.136. PMID:26303674. S2CID:24533103.
The abnormal immunological response elicited by gluten-derived proteins can lead to the production of several different autoantibodies, which affect different systems.
- ^ ا ب "Celiac disease". World Gastroenterology Organisation Global Guidelines. يوليو 2016. مؤرشف من الأصل في 2017-03-17. اطلع عليه بتاريخ 2017-04-23.
- ^ ا ب Lionetti E، Francavilla R، Pavone P، Pavone L، Francavilla T، Pulvirenti A، Giugno R، Ruggieri M (أغسطس 2010). "The neurology of coeliac disease in childhood: what is the evidence? A systematic review and meta-analysis". Developmental Medicine and Child Neurology. ج. 52 ع. 8: 700–7. DOI:10.1111/j.1469-8749.2010.03647.x. PMID:20345955.
- ^ ا ب ج د ه و ز "Celiac Disease". NIDDKD. يونيو 2015. مؤرشف من الأصل في 2016-03-13. اطلع عليه بتاريخ 2016-03-17.
- ^ ا ب Vivas S، Vaquero L، Rodríguez-Martín L، Caminero A (نوفمبر 2015). "Age-related differences in celiac disease: Specific characteristics of adult presentation". World Journal of Gastrointestinal Pharmacology and Therapeutics (Review). ج. 6 ع. 4: 207–12. DOI:10.4292/wjgpt.v6.i4.207. PMC:4635160. PMID:26558154.
In addition, the presence of intraepithelial lymphocytosis and/or villous atrophy and crypt hyperplasia of small-bowel mucosa, and clinical remission after withdrawal of gluten from the diet, are also used for diagnosis antitransglutaminase antibody (tTGA) titers and the degree of histological lesions inversely correlate with age. Thus, as the age of diagnosis increases antibody titers decrease and histological damage is less marked. It is common to find adults without villous atrophy showing only an inflammatory pattern in duodenal mucosa biopsies: Lymphocytic enteritis (Marsh I) or added crypt hyperplasia (Marsh II)
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Ferri، Fred F. (2010). Ferri's differential diagnosis : a practical guide to the differential diagnosis of symptoms, signs, and clinical disorders (ط. 2nd). Philadelphia, PA: Elsevier/Mosby. ص. Chapter C. ISBN:978-0323076999.
- ^ ا ب ج See JA، Kaukinen K، Makharia GK، Gibson PR، Murray JA (أكتوبر 2015). "Practical insights into gluten-free diets". Nature Reviews. Gastroenterology & Hepatology (Review). ج. 12 ع. 10: 580–91. DOI:10.1038/nrgastro.2015.156. PMID:26392070. S2CID:20270743.
A lack of symptoms and/or negative serological markers are not reliable indicators of mucosal response to the diet. Furthermore, up to 30% of patients continue to have gastrointestinal symptoms despite a strict GFD.122,124 If adherence is questioned, a structured interview by a qualified dietitian can help to identify both intentional and inadvertent sources of gluten.
- ^ ا ب ج د ه و ز ح Fasano A، Catassi C (ديسمبر 2012). "Clinical practice. Celiac disease". The New England Journal of Medicine (Review). ج. 367 ع. 25: 2419–26. DOI:10.1056/NEJMcp1113994. PMID:23252527.
- ^ Newnham، Evan D (2017). "Coeliac disease in the 21st century: Paradigm shifts in the modern age". Journal of Gastroenterology and Hepatology. ج. 32: 82–85. DOI:10.1111/jgh.13704. PMID:28244672. S2CID:46285202.
Presentation of CD with malabsorptive symptoms or malnutrition is now the exception rather than the rule.
- ^ Tonutti E، Bizzaro N (2014). "Diagnosis and classification of celiac disease and gluten sensitivity". Autoimmun Rev. ج. 13 ع. 4–5: 472–6. DOI:10.1016/j.autrev.2014.01.043. PMID:24440147.
- ^ ا ب ج Penagini F، Dilillo D، Meneghin F، Mameli C، Fabiano V، Zuccotti GV (نوفمبر 2013). "Gluten-free diet in children: an approach to a nutritionally adequate and balanced diet". Nutrients (Review). ج. 5 ع. 11: 4553–65. DOI:10.3390/nu5114553. PMC:3847748. PMID:24253052.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ ا ب ج Di Sabatino A، Corazza GR (أبريل 2009). "Coeliac disease". Lancet. ج. 373 ع. 9673: 1480–93. DOI:10.1016/S0140-6736(09)60254-3. PMID:19394538. S2CID:8415780.
- ^ Pinto-Sánchez MI، Causada-Calo N، Bercik P، Ford AC، Murray JA، Armstrong D، Semrad C، Kupfer SS، Alaedini A، Moayyedi P، Leffler DA، Verdú EF، Green P (أغسطس 2017). "Safety of Adding Oats to a Gluten-Free Diet for Patients With Celiac Disease: Systematic Review and Meta-analysis of Clinical and Observational Studies" (PDF). Gastroenterology. ج. 153 ع. 2: 395–409.e3. DOI:10.1053/j.gastro.2017.04.009. PMID:28431885. مؤرشف من الأصل (PDF) في 2021-04-27.
- ^ Comino I، Moreno M، Sousa C (نوفمبر 2015). "Role of oats in celiac disease". World Journal of Gastroenterology. ج. 21 ع. 41: 11825–31. DOI:10.3748/wjg.v21.i41.11825. PMC:4631980. PMID:26557006.
It is necessary to consider that oats include many varieties, containing various amino acid sequences and showing different immunoreactivities associated with toxic prolamins. As a result, several studies have shown that the immunogenicity of oats varies depending on the cultivar consumed. Thus, it is essential to thoroughly study the variety of oats used in a food ingredient before including it in a gluten-free diet.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ ا ب ج د ه و ز ح ط المعهد الوطني للصحة وتفوق الرعاية. Clinical guideline 86: Recognition and assessment of coeliac disease. London, 2015.
- ^ Matthias T، Pfeiffer S، Selmi C، Eric Gershwin M (أبريل 2010). "Diagnostic challenges in celiac disease and the role of the tissue transglutaminase-neo-epitope". Clin Rev Allergy Immunol (Review). ج. 38 ع. 2–3: 298–301. DOI:10.1007/s12016-009-8160-z. PMID:19629760. S2CID:33661098.
- ^ ا ب Lewis NR، Scott BB (يوليو 2006). "Systematic review: the use of serology to exclude or diagnose coeliac disease (a comparison of the endomysial and tissue transglutaminase antibody tests)". Alimentary Pharmacology & Therapeutics. ج. 24 ع. 1: 47–54. DOI:10.1111/j.1365-2036.2006.02967.x. PMID:16803602. S2CID:16823218.
- ^ ا ب ج Rostom A، Murray JA، Kagnoff MF (ديسمبر 2006). "American Gastroenterological Association (AGA) Institute technical review on the diagnosis and management of celiac disease". Gastroenterology (Review). ج. 131 ع. 6: 1981–2002. DOI:10.1053/j.gastro.2006.10.004. PMID:17087937. مؤرشف من الأصل في 2014-03-18.
- ^ ا ب Cichewicz AB، Mearns ES، Taylor A، Boulanger T، Gerber M، Leffler DA، وآخرون (1 مارس 2019). "Diagnosis and Treatment Patterns in Celiac Disease". Dig Dis Sci (Review). ج. 64 ع. 8: 2095–2106. DOI:10.1007/s10620-019-05528-3. PMID:30820708. S2CID:71143826.
- ^ Ludvigsson JF، Card T، Ciclitira PJ، Swift GL، Nasr I، Sanders DS، Ciacci C (أبريل 2015). "Support for patients with celiac disease: A literature review". United European Gastroenterology Journal (Review). ج. 3 ع. 2: 146–59. DOI:10.1177/2050640614562599. PMC:4406900. PMID:25922674.
- ^ ا ب ج د ه و ز ح ط ي يا van Heel DA، West J (يوليو 2006). "Recent advances in coeliac disease". Gut (Review). ج. 55 ع. 7: 1037–46. DOI:10.1136/gut.2005.075119. PMC:1856316. PMID:16766754.
- ^ ا ب Bibbins-Domingo K، Grossman DC، Curry SJ، Barry MJ، Davidson KW، Doubeni CA، Ebell M، Epling JW، Herzstein J، Kemper AR، Krist AH، Kurth AE، Landefeld CS، Mangione CM، Phipps MG، Silverstein M، Simon MA، Tseng CW (مارس 2017). "Screening for Celiac Disease: US Preventive Services Task Force Recommendation Statement". JAMA. ج. 317 ع. 12: 1252–1257. DOI:10.1001/jama.2017.1462. PMID:28350936. S2CID:205086614.
- ^ Burkhardt، J. G.؛ Chapa-Rodriguez، A.؛ Bahna، S. L. (يوليو 2018). "Gluten sensitivities and the allergist: Threshing the grain from the husks". Allergy. ج. 73 ع. 7: 1359–1368. DOI:10.1111/all.13354. PMID:29131356.
- ^ Lionetti E، Gatti S، Pulvirenti A، Catassi C (يونيو 2015). "Celiac disease from a global perspective". Best Practice & Research. Clinical Gastroenterology (Review). ج. 29 ع. 3: 365–79. DOI:10.1016/j.bpg.2015.05.004. PMID:26060103.
- ^ ا ب Hischenhuber C، Crevel R، Jarry B، Mäki M، Moneret-Vautrin DA، Romano A، Troncone R، Ward R (مارس 2006). "Review article: safe amounts of gluten for patients with wheat allergy or coeliac disease". Alimentary Pharmacology & Therapeutics. ج. 23 ع. 5: 559–75. DOI:10.1111/j.1365-2036.2006.02768.x. PMID:16480395. S2CID:9970042.
- ^ Schuppan D, Zimmer KP (December 2013). "The diagnosis and treatment of celiac disease". Deutsches Ärzteblatt International. 110 (49): 835–46. doi:10.3238/arztebl.2013.0835. PMC 3884535. PMID 24355936.
- ^ ا ب ج Di Sabatino A, Corazza GR (April 2009). "Coeliac disease". Lancet. 373 (9673): 1480–93. doi:10.1016/S0140-6736(09)60254-3. PMID 19394538. S2CID 8415780.
- ^ Vriezinga SL, Schweizer JJ, Koning F, Mearin ML (September 2015). "Coeliac disease and gluten-related disorders in childhood". Nature Reviews. Gastroenterology & Hepatology (Review). 12 (9): 527–36. doi:10.1038/nrgastro.2015.98. PMID 26100369. S2CID 2023530.
- ^ ا ب ج د ه van Heel DA, West J (July 2006). "Recent advances in coeliac disease". Gut (Review). 55 (7): 1037–46. doi:10.1136/gut.2005.075119. PMC 1856316. PMID 16766754.
- ^ "Celiac disease". World Gastroenterology Organisation Global Guidelines. July 2016. Archived from the original on 17 March 2017. Retrieved 23 April 2017.
- ^ Ludvigsson JF, Card T, Ciclitira PJ, Swift GL, Nasr I, Sanders DS, Ciacci C (April 2015). "Support for patients with celiac disease: A literature review". United European Gastroenterology Journal (Review). 3 (2): 146–59. doi:10.1177/2050640614562599. PMC 4406900. PMID 25922674.
- ^ Lionetti E, Gatti S, Pulvirenti A, Catassi C (June 2015). "Celiac disease from a global perspective". Best Practice & Research. Clinical Gastroenterology (Review). 29 (3): 365–79. doi:10.1016/j.bpg.2015.05.004. PMID 26060103.
- ^ Ferguson R, Basu MK, Asquith P, Cooke WT (1976). "Jejunal mucosal abnormalities in patients with recurrent aphthous ulceration". Br Med J. 1 (6000): 11–13. doi:10.1136/bmj.1.6000.11. PMC 1638254. PMID 1247715.
- ^ ا ب Irvine, AJ; Chey, WD; Ford, AC (January 2017). "Screening for Celiac Disease in Irritable Bowel Syndrome: An Updated Systematic Review and Meta-analysis" (PDF). The American Journal of Gastroenterology. 112 (1): 65–76. doi:10.1038/ajg.2016.466. PMID 27753436. S2CID 269053.
- ^ National Institute for Health and Clinical Excellence. Clinical guideline 61: Irritable bowel syndrome. London, 2008.
- ^ Fasano Alessio, Caio Giacomo; Catassi Carlo, Volta Umberto (July 2019). "Celiac disease: a comprehensive current review". BMC Medicine. Springer Nature. 17 (1): 142. doi:10.1186/s12916-019-1380-z. PMC 6647104. PMID 31331324.
- ^ Gujral N, Freeman HJ, Thomson AB (November 2012). "Celiac disease: prevalence, diagnosis, pathogenesis and treatment" (PDF). World Journal of Gastroenterology. 18 (42): 6036–59. doi:10.3748/wjg.v18.i42.6036. PMC 3496881. PMID 23155333. Archived from the original (PDF) on 20 March 2014.
- ^ ا ب "American Gastroenterological Association medical position statement: Celiac Sprue". Gastroenterology. 120 (6): 1522–5. 2001. doi:10.1053/gast.2001.24055. PMID 11313323. S2CID 28235994.
- ^ ا ب ج Presutti RJ, Cangemi JR, Cassidy HD, Hill DA (2007). "Celiac disease". Am Fam Physician. 76 (12): 1795–802. PMID 18217518.
- ^ ا ب Pietzak MM (2014). "Dietary supplements in celiac disease". In Rampertab SD, Mullin GE (eds.). Celiac disease. pp. 137–59. ISBN 978-1-4614-8559-9.
- ^ Cunningham-Rundles C (September 2001). "Physiology of IgA and IgA deficiency". J. Clin. Immunol. 21 (5): 303–9. doi:10.1023/A:1012241117984. PMID 11720003. S2CID 13285781.
- ^ Marks J, Shuster S, Watson AJ (1966). "Small-bowel changes in dermatitis herpetiformis". Lancet. 2 (7476): 1280–2. doi:10.1016/S0140-6736(66)91692-8. PMID 4163419.
- ^ Nicolas ME, Krause PK, Gibson LE, Murray JA (August 2003). "Dermatitis herpetiformis". Int. J. Dermatol. 42 (8): 588–600. doi:10.1046/j.1365-4362.2003.01804.x. PMID 12890100. S2CID 42280769.
- ^ ا ب ج د Di Sabatino A, Corazza GR (April 2009). "Coeliac disease". Lancet. 373 (9673): 1480–93. doi:10.1016/S0140-6736(09)60254-3. PMID 19394538. S2CID 8415780.
- ^ Tersigni C, Castellani R, de Waure C, Fattorossi A, De Spirito M, Gasbarrini A, Scambia G, Di Simone N (2014). "Celiac disease and reproductive disorders: meta-analysis of epidemiologic associations and potential pathogenic mechanisms". Human Reproduction Update. 20 (4): 582–93. doi:10.1093/humupd/dmu007. PMID 24619876.
- ^ Ferguson A, Hutton MM, Maxwell JD, Murray D (1970). "Adult coeliac disease in hyposplenic patients". Lancet. 1 (7639): 163–4. doi:10.1016/S0140-6736(70)90405-8. PMID 4189238.
- ^ Lundin KE, Wijmenga C (September 2015). "Coeliac disease and autoimmune disease-genetic overlap and screening". Nature Reviews. Gastroenterology & Hepatology (Review). 12 (9): 507–15. doi:10.1038/nrgastro.2015.136. PMID 26303674. S2CID 24533103.
The abnormal immunological response elicited by gluten-derived proteins can lead to the production of several different autoantibodies, which affect different systems.
- ^ Jabri B، Kupfer SS ((2012)). [22 (4): 639–60. doi:10.1016/j.giec.2012.07.003. PMC 3872820. PMID 23083984. ""Pathophysiology of celiac disease""]. Gastrointest Endosc Clin N Am (Review). DOI:Gluten comprises two different protein types, gliadins and glutenins, capable of triggering disease.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة)، تأكد من صحة قيمة|doi=(مساعدة)، وتحقق من قيمة|مسار=(مساعدة) - ^ ا ب ج د Lebwohl B، Ludvigsson JF، Green PH (أكتوبر 2015). "Celiac disease and non-celiac gluten sensitivity". BMJ. ج. 351: h4347. DOI:10.1136/bmj.h4347. PMC:4596973. PMID:26438584.
- ^ ا ب ج Rewers M (أبريل 2005). "Epidemiology of celiac disease: what are the prevalence, incidence, and progression of celiac disease?" (PDF). Gastroenterology. ج. 128 ع. 4 Suppl 1: S47–51. DOI:10.1053/j.gastro.2005.02.030. PMID:15825126. مؤرشف (PDF) من الأصل في 14 أبريل 2007.
- ^ ا ب ج Guandalini S، Assiri A (مارس 2014). "Celiac disease: a review". JAMA Pediatrics. ج. 168 ع. 3: 272–8. DOI:10.1001/jamapediatrics.2013.3858. PMID:24395055.
- ^ ا ب ج Catassi C، Rätsch IM، Gandolfi L، Pratesi R، Fabiani E، El Asmar R، Frijia M، Bearzi I، Vizzoni L (أغسطس 1999). "Why is coeliac disease endemic in the people of the Sahara?". Lancet. ج. 354 ع. 9179: 647–8. DOI:10.1016/S0140-6736(99)02609-4. PMID:10466670. S2CID:9242679.
- ^ ا ب ج van der Windt DA، Jellema P، Mulder CJ، Kneepkens CM، van der Horst HE (2010). "Diagnostic testing for celiac disease among patients with abdominal symptoms: a systematic review". JAMA. ج. 303 ع. 17: 1738–46. DOI:10.1001/jama.2010.549. PMID:20442390.
Most studies used similar histological criteria for diagnosing celiac disease (Marsh grade ≥III), but the level of damage may vary across populations. Only 4 studies presented the proportion of patients in whom only partial villous atrophy was found (Marsh grade of IIIA), which ranged from 4% to 100%. The presence of positive serum antibodies has been shown to correlate with the degree of villous atrophy, and patients with celiac disease who have less severe histological damage may have seronegative findings. This could be important, especially in primary care, in which levels of mucosal damage may be lower, and consequently, more patients with celiac disease may be missed.
- ^ ا ب ج د ه Gujral N، Freeman HJ، Thomson AB (نوفمبر 2012). "Celiac disease: prevalence, diagnosis, pathogenesis and treatment" (PDF). World Journal of Gastroenterology. ج. 18 ع. 42: 6036–59. DOI:10.3748/wjg.v18.i42.6036. PMC:3496881. PMID:23155333. مؤرشف من الأصل (PDF) في 20 مارس 2014.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ ا ب Houlston RS، Ford D (1996). "Genetics of coeliac disease". QJM. ج. 89 ع. 10: 737–43. DOI:10.1093/qjmed/89.10.737. PMID:8944229.
- ^ ا ب Hadithi M، von Blomberg BM، Crusius JB، Bloemena E، Kostense PJ، Meijer JW، Mulder CJ، Stehouwer CD، Peña AS (2007). "Accuracy of serologic tests and HLA-DQ typing for diagnosing celiac disease". Ann. Intern. Med. ج. 147 ع. 5: 294–302. DOI:10.7326/0003-4819-147-5-200709040-00003. PMID:17785484. S2CID:24275278.
- ^ Kim C، Quarsten H، Bergseng E، Khosla C، Sollid L (2004). "Structural basis for HLA-DQ2-mediated presentation of gluten epitopes in celiac disease". Proc Natl Acad Sci USA. ج. 101 ع. 12: 4175–9. Bibcode:2004PNAS..101.4175K. DOI:10.1073/pnas.0306885101. PMC:384714. PMID:15020763.
- ^ Karell K، Louka AS، Moodie SJ، Ascher H، Clot F، Greco L، Ciclitira PJ، Sollid LM، Partanen J (2003). "HLA types in celiac disease patients not carrying the DQA1*05-DQB1*02 (DQ2) heterodimer: results from the European Genetics Cluster on Celiac Disease". Hum. Immunol. ج. 64 ع. 4: 469–77. DOI:10.1016/S0198-8859(03)00027-2. PMID:12651074.
- ^ Michalski JP، McCombs CC، Arai T، Elston RC، Cao T، McCarthy CF، Stevens FM (1996). "HLA-DR, DQ genotypes of celiac disease patients and healthy subjects from the West of Ireland". Tissue Antigens. ج. 47 ع. 2: 127–33. DOI:10.1111/j.1399-0039.1996.tb02525.x. PMID:8851726.
- ^ Kaur G، Sarkar N، Bhatnagar S، Kumar S، Rapthap CC، Bhan MK، Mehra NK (2002). "Pediatric celiac disease in India is associated with multiple DR3-DQ2 haplotypes". Hum. Immunol. ج. 63 ع. 8: 677–82. DOI:10.1016/S0198-8859(02)00413-5. PMID:12121676.
- ^ Layrisse Z، Guedez Y، Domínguez E، Paz N، Montagnani S، Matos M، Herrera F، Ogando V، Balbas O، Rodríguez-Larralde A (2001). "Extended HLA haplotypes in a Carib Amerindian population: the Yucpa of the Perija Range". Hum Immunol. ج. 62 ع. 9: 992–1000. DOI:10.1016/S0198-8859(01)00297-X. PMID:11543901.
- ^ ا ب Dubois PC، Trynka G، Franke L، Hunt KA، Romanos J، Curtotti A، Zhernakova A، Heap GA، Adány R، Aromaa A، Bardella MT، van den Berg LH، Bockett NA، de la Concha EG، Dema B، Fehrmann RS، Fernández-Arquero M، Fiatal S، Grandone E، Green PM، Groen HJ، Gwilliam R، Houwen RH، Hunt SE، Kaukinen K، Kelleher D، Korponay-Szabo I، Kurppa K، MacMathuna P، Mäki M، Mazzilli MC، McCann OT، Mearin ML، Mein CA، Mirza MM، Mistry V، Mora B، Morley KI، Mulder CJ، Murray JA، Núñez C، Oosterom E، Ophoff RA، Polanco I، Peltonen L، Platteel M، Rybak A، Salomaa V، Schweizer JJ، Sperandeo MP، Tack GJ، Turner G، Veldink JH، Verbeek WH، Weersma RK، Wolters VM، Urcelay E، Cukrowska B، Greco L، Neuhausen SL، McManus R، Barisani D، Deloukas P، Barrett JC، Saavalainen P، Wijmenga C، van Heel DA (2010). "Multiple common variants for celiac disease influencing immune gene expression". Nature Genetics. ج. 42 ع. 4: 295–302. DOI:10.1038/ng.543. PMC:2847618. PMID:20190752.
- ^ Walcher DN، Kretchmer N (1981). Food, nutrition, and evolution: food as an environmental factor in the genesis of human variability. Papers presented at the International Congress of the International Organization for the Study of Human Development, Masson Pub. USA. ص. 179–199. ISBN:978-0-89352-158-5.
- ^ Catassi C (2005). "Where Is Celiac Disease Coming From and Why?". مجلة طب الأطفال والجهاز الهضمي والتغذية. ج. 40 ع. 3: 279–282. DOI:10.1097/01.MPG.0000151650.03929.D5. PMID:15735480. S2CID:12843113.
- ^ Zhernakova A، Elbers CC، Ferwerda B، Romanos J، Trynka G، Dubois PC، de Kovel CG، Franke L، Oosting M، Barisani D، Bardella MT، Joosten LA، Saavalainen P، van Heel DA، Catassi C، Netea MG، Wijmenga C (2010). "Evolutionary and functional analysis of celiac risk loci reveals SH2B3 as a protective factor against bacterial infection". American Journal of Human Genetics. ج. 86 ع. 6: 970–7. DOI:10.1016/j.ajhg.2010.05.004. PMC:3032060. PMID:20560212.
- ^ Green PH، Cellier C (2007). "Celiac disease". N. Engl. J. Med. ج. 357 ع. 17: 1731–43. DOI:10.1056/NEJMra071600. PMID:17960014.
- ^ Biesiekierski، Jessica R (2017). "What is gluten?". Journal of Gastroenterology and Hepatology. ج. 32: 78–81. DOI:10.1111/jgh.13703. PMID:28244676. S2CID:6493455.
Similar proteins to the gliadin found in wheat exist as secalin in rye, hordein in barley, and avenins in oats and are collectively referred to as "gluten." Derivatives of these grains such as triticale and malt and other ancient wheat varieties such as spelt and kamut also contain gluten. The gluten found in all of these grains has been identified as the component capable of triggering the immune-mediated disorder, coeliac disease.
- ^ Lammers KM، Lu R، Brownley J، Lu B، Gerard C، Thomas K، Rallabhandi P، Shea-Donohue T، Tamiz A، Alkan S، Netzel-Arnett S، Antalis T، Vogel SN، Fasano A (2008). "Gliadin induces an increase in intestinal permeability and zonulin release by binding to the chemokine receptor CXCR3". Gastroenterology. ج. 135 ع. 1: 194–204.e3. DOI:10.1053/j.gastro.2008.03.023. PMC:2653457. PMID:18485912.
- ^ ا ب Qiao SW, Bergseng E, Molberg Ø, et al. (August 2004). "Antigen presentation to celiac lesion-derived T cells of a 33-mer gliadin peptide naturally formed by gastrointestinal digestion". J. Immunol. 173 (3): 1757–62. doi:10.4049/jimmunol.173.3.1757. PMID 15265905. S2CID 24910686.
- ^ ا ب ج د van Heel DA, West J (July 2006). "Recent advances in coeliac disease". Gut (Review). 55 (7): 1037–46. doi:10.1136/gut.2005.075119. PMC 1856316. PMID 16766754.
- ^ Biesiekierski, Jessica R (2017). "What is gluten?". Journal of Gastroenterology and Hepatology. 32: 78–81. doi:10.1111/jgh.13703. PMID 28244676. S2CID 6493455.
Similar proteins to the gliadin found in wheat exist as secalin in rye, hordein in barley, and avenins in oats and are collectively referred to as “gluten.” Derivatives of these grains such as triticale and malt and other ancient wheat varieties such as spelt and kamut also contain gluten. The gluten found in all of these grains has been identified as the component capable of triggering the immune-mediated disorder, coeliac disease.
- ^ Shan L, Qiao SW, Arentz-Hansen H, Molberg Ø, Gray GM, Sollid LM, Khosla C (2005). "Identification and analysis of multivalent proteolytically resistant peptides from gluten: implications for celiac sprue". J. Proteome Res. 4 (5): 1732–41. doi:10.1021/pr050173t. PMC 1343496. PMID 16212427.
- ^ Comino I, Moreno M, Sousa C (November 2015). "Role of oats in celiac disease". World Journal of Gastroenterology. 21 (41): 11825–31. doi:10.3748/wjg.v21.i41.11825. PMC 4631980. PMID 26557006. It is necessary to consider that oats include many varieties, containing various amino acid sequences and showing different immunoreactivities associated with toxic prolamins. As a result, several studies have shown that the immunogenicity of oats varies depending on the cultivar consumed. Thus, it is essential to thoroughly study the variety of oats used in a food ingredient before including it in a gluten-free diet.
- ^ Skovbjerg H، Norén O، Anthonsen D، Moller J، Sjöström H (2002). "Gliadin is a good substrate of several transglutaminases: possible implication in the pathogenesis of coeliac disease". Scand J Gastroenterol. ج. 37 ع. 7: 812–7. DOI:10.1080/713786534. PMID:12190095.
- ^ Fleckenstein B، Molberg Ø، Qiao SW، Schmid DG، von der Mülbe F، Elgstøen K، Jung G، Sollid LM (2002). "Gliadin T cell epitope selection by tissue transglutaminase in celiac disease. Role of enzyme specificity and pH influence on the transamidation versus deamidation process". J Biol Chem. ج. 277 ع. 37: 34109–34116. DOI:10.1074/jbc.M204521200. PMID:12093810. S2CID:7102008.
- ^ Koning F، Schuppan D، Cerf-Bensussan N، Sollid LM (يونيو 2005). "Pathomechanisms in celiac disease". Best Practice & Research. Clinical Gastroenterology. ج. 19 ع. 3: 373–387. DOI:10.1016/j.bpg.2005.02.003. ISSN:1521-6918. PMID:15925843.
- ^ Mowat AM (2003). "Coeliac disease – a meeting point for genetics, immunology, and protein chemistry". Lancet. ج. 361 ع. 9365: 1290–1292. DOI:10.1016/S0140-6736(03)12989-3. PMID:12699968. S2CID:10259661.
- ^ Dewar D، Pereira SP، Ciclitira PJ (2004). "The pathogenesis of coeliac disease". Int J Biochem Cell Biol. ج. 36 ع. 1: 17–24. DOI:10.1016/S1357-2725(03)00239-5. PMID:14592529.
- ^ Kaukinen K، Peräaho M، Collin P، Partanen J، Woolley N، Kaartinen T، Nuutinen T، Halttunen T، Mäki M، Korponay-Szabo I (2005). "Small-bowel mucosal tranglutaminase 2-specific IgA deposits in coeliac disease without villous atrophy: A Prospective and radmonized clinical study". Scand J Gastroenterol. ج. 40 ع. 5: 564–572. DOI:10.1080/00365520510023422. PMID:16036509. S2CID:27068601.
- ^ Salmi TT، Collin P، Korponay-Szabó IR، Laurila K، Partanen J، Huhtala H، Király R، Lorand L، Reunala T، Mäki M، Kaukinen K (2006). "Endomysial antibody-negative coeliac disease: clinical characteristics and intestinal autoantibody deposits". Gut. ج. 55 ع. 12: 1746–53. DOI:10.1136/gut.2005.071514. PMC:1856451. PMID:16571636.
- ^ Londei M، Ciacci C، Ricciardelli I، Vacca L، Quaratino S، Maiuri L (2005). "Gliadin as a stimulator of innate responses in celiac disease". Mol Immunol. ج. 42 ع. 8: 913–918. DOI:10.1016/j.molimm.2004.12.005. PMID:15829281.
- ^ Zanoni G، Navone R، Lunardi C، Tridente G، Bason C، Sivori S، Beri R، Dolcino M، Valletta E، Corrocher R، Puccetti A (2006). "In celiac disease, a subset of autoantibodies against transglutaminase binds toll-like receptor 4 and induces activation of monocytes". PLOS Med. ج. 3 ع. 9: e358. DOI:10.1371/journal.pmed.0030358. PMC:1569884. PMID:16984219.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Salim AF، Phillips AD، Farthing MJ (1990). "Pathogenesis of gut virus infection". Baillière's Clinical Gastroenterology. ج. 4 ع. 3: 593–607. DOI:10.1016/0950-3528(90)90051-H. PMC:7172617. PMID:1962725.
- ^ "Celiac disease: A review". BCMJ. ج. 43 ع. 7: 390–395. سبتمبر 2001. مؤرشف من الأصل في 22 فبراير 2014. اطلع عليه بتاريخ 15 فبراير 2014.
- ^ ا ب Cichewicz AB, Mearns ES, Taylor A, Boulanger T, Gerber M, Leffler DA, et al. (1 March 2019). "Diagnosis and Treatment Patterns in Celiac Disease". Dig Dis Sci(Review). 64 (8): 2095–2106. doi:10.1007/s10620-019-05528-3. PMID 30820708. S2CID 71143826.
- ^ Matthias T, Pfeiffer S, Selmi C, Eric Gershwin M (April 2010). "Diagnostic challenges in celiac disease and the role of the tissue transglutaminase-neo-epitope". Clin Rev Allergy Immunol (Review). 38 (2–3): 298–301. doi:10.1007/s12016-009-8160-z. PMID 19629760. S2CID 33661098.
- ^ ا ب ج د ه van der Windt DA, Jellema P, Mulder CJ, Kneepkens CM, van der Horst HE (2010). "Diagnostic testing for celiac disease among patients with abdominal symptoms: a systematic review". JAMA. 303 (17): 1738–46. doi:10.1001/jama.2010.549. PMID 20442390.
- ^ Lewis NR, Scott BB (July 2006). "Systematic review: the use of serology to exclude or diagnose coeliac disease (a comparison of the endomysial and tissue transglutaminase antibody tests)". Alimentary Pharmacology & Therapeutics. 24 (1): 47–54. doi:10.1111/j.1365-2036.2006.02967.x. PMID 16803602. S2CID 16823218.
- ^ ا ب ج د Rostom A, Murray JA, Kagnoff MF (December 2006). "American Gastroenterological Association (AGA) Institute technical review on the diagnosis and management of celiac disease". Gastroenterology (Review). 131 (6): 1981–2002. doi:10.1053/j.gastro.2006.10.004. PMID 17087937.
- ^ Skovbjerg H, Norén O, Anthonsen D, Moller J, Sjöström H (2002). "Gliadin is a good substrate of several transglutaminases: possible implication in the pathogenesis of coeliac disease". Scand J Gastroenterol. 37 (7): 812–7. doi:10.1080/713786534. PMID 12190095
- ^ Sblattero D, Berti I, Trevisiol C, Marzari R, Tommasini A, Bradbury A, Fasano A, Ventura A, Not T (2000). "Human recombinant tissue transglutaminase ELISA: an innovative diagnostic assay for celiac disease". Am. J. Gastroenterol.95 (5): 1253–57. PMID 10811336.
- ^ Korponay-Szabó IR, Dahlbom I, Laurila K, Koskinen S, Woolley N, Partanen J, Kovács JB, Mäki M, Hansson T (2003). "Elevation of IgG antibodies against tissue transglutaminase as a diagnostic tool for coeliac disease in selective IgA deficiency". Gut. 52 (11): 1567–71. doi:10.1136/gut.52.11.1567. PMC 1773847. PMID 14570724.
- ^ ا ب Husby S, Koletzko S, Korponay-Szabó IR, Mearin ML, Phillips A, Shamir R, Troncone R, Giersiepen K, Branski D, Catassi C, Lelgeman M, Mäki M, Ribes-Koninckx C, Ventura A, Zimmer KP, ESPGHAN Working Group on Coeliac Disease Diagnosis; ESPGHAN Gastroenterology Committee; European Society for Pediatric Gastroenterology, Hepatology, and Nutrition (January 2012). "European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease" (PDF). J Pediatr Gastroenterol Nutr(Practice Guideline). 54 (1): 136–60. doi:10.1097/MPG.0b013e31821a23d0. PMID 22197856. S2CID 15029283. Archived from the original (PDF) on 3 April 2016. Retrieved 19 March2016.
Since 1990, the understanding of the pathological processes of CD has increased enormously, leading to a change in the clinical paradigm of CD from a chronic, gluten-dependent enteropathy of childhood to a systemic disease with chronic immune features affecting different organ systems. (...) atypical symptoms may be considerably more common than classic symptoms
- ^ ا ب ج د ه "American Gastroenterological Association medical position statement: Celiac Sprue". Gastroenterology. 120 (6): 1522–5. 2001. doi:10.1053/gast.2001.24055. PMID 11313323. S2CID 28235994.
- ^ ا ب Hill ID, Dirks MH, Liptak GS, Colletti RB, Fasano A, Guandalini S, Hoffenberg EJ, Horvath K, Murray JA, Pivor M, Seidman EG (2005). "Guideline for the diagnosis and treatment of celiac disease in children: recommendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition". J. Pediatr. Gastroenterol. Nutr.40 (1): 1–19. doi:10.1097/00005176-200501000-00001. PMID 15625418. S2CID 14805217.
- ^ ا ب Hill ID (April 2005). "What are the sensitivity and specificity of serologic tests for celiac disease? Do sensitivity and specificity vary in different populations?" (PDF). Gastroenterology. 128 (4 Suppl 1): S25–32. doi:10.1053/j.gastro.2005.02.012. PMID 15825123. Archived (PDF) from the original on 14 April 2007.
- ^ Nandiwada SL, Tebo AE (April 2013). "Testing for antireticulin antibodies in patients with celiac disease is obsolete: a review of recommendations for serologic screening and the literature". Clin. Vaccine Immunol. 20(4): 447–51. doi:10.1128/CVI.00568-12. PMC 3623418. PMID 23365209.
- ^ Wong RC, Steele RH, Reeves GE, Wilson RJ, Pink A, Adelstein S (2003). "Antibody and genetic testing in coeliac disease". Pathology. 35 (4): 285–304. doi:10.1080/00313020307527. PMID 12959764.
- ^ Fagoonee S, De Luca L, De Angelis C, Castelli A, Rizzetto M, Pellicano R (March 2009). "Anti-Saccharomyces cerevisiae as unusual antibodies in autoimmune hepatitis". Minerva Gastroenterologica e Dietologica. 55 (1): 37–40. PMID 19212306.
- ^ Hadithi M, von Blomberg BM, Crusius JB, Bloemena E, Kostense PJ, Meijer JW, Mulder CJ, Stehouwer CD, Peña AS (2007). "Accuracy of serologic tests and HLA-DQ typing for diagnosing celiac disease". Ann. Intern. Med. 147 (5): 294–302. doi:10.7326/0003-4819-147-5-200709040-00003. PMID 17785484. S2CID 24275278.
- ^ ا ب Tonutti E, Bizzaro N (2014). "Diagnosis and classification of celiac disease and gluten sensitivity". Autoimmun Rev. 13(4–5): 472–6. doi:10.1016/j.autrev.2014.01.043. PMID 24440147.
- ^ Niveloni S, Fiorini A, Dezi R, Pedreira S, Smecuol E, Vazquez H, Cabanne A, Boerr LA, Valero J, Kogan Z, Mauriño E, Bai JC (1998). "Usefulness of videoduodenoscopy and vital dye staining as indicators of mucosal atrophy of celiac disease: assessment of interobserver agreement". Gastrointestinal Endoscopy. 47(3): 223–29. doi:10.1016/S0016-5107(98)70317-7. PMID 9580349.
- ^ Mee AS, Burke M, Vallon AG, Newman J, Cotton PB (1985). "Small bowel biopsy for malabsorption: comparison of the diagnostic adequacy of endoscopic forceps and capsule biopsy specimens". The BMJ. 291 (6498): 769–72. doi:10.1136/bmj.291.6498.769. PMC 1417146. PMID 3929934.
- ^ Redondo-Cerezo E, Sánchez-Capilla AD, De La Torre-Rubio P, De Teresa J (November 2014). "Wireless capsule endoscopy: Perspectives beyond gastrointestinal bleeding". World J. Gastroenterol. 20 (42): 15664–73. doi:10.3748/wjg.v20.i42.15664. PMC 4229531. PMID 25400450.
- ^ Marsh MN (1992). "Gluten, major histocompatibility complex, and the small intestine. A molecular and immunobiologic approach to the spectrum of gluten sensitivity ('celiac sprue')". Gastroenterology. 102 (1): 330–54. doi:10.1016/0016-5085(92)91819-p. PMID 1727768.
- ^ Corazza GR, Villanacci V (1 June 2005). "Coeliac disease". J. Clin. Pathol. 58 (6): 573–74. doi:10.1136/jcp.2004.023978. PMC 1770677. PMID 15917404.
- ^ Oberhuber G, Granditsch G, Vogelsang H (October 1999). "The histopathology of coeliac disease: time for a standardized report scheme for pathologists". Eur. J. Gastroenterol. Hepatol. 11 (10): 1185–94. doi:10.1097/00042737-199910000-00019. PMID 10524652.
- ^ Corazza GR, Villanacci V, Zambelli C, Milione M, Luinetti O, Vindigni C, Chioda C, Albarello L, Bartolini D, Donato F (2007). "Comparison of the interobserver reproducibility with different histologic criteria used in celiac disease". Clin. Gastroenterol. Hepatol. 5 (7): 838–43. doi:10.1016/j.cgh.2007.03.019. PMID 17544877
- ^ ا ب Vivas S, Vaquero L, Rodríguez-Martín L, Caminero A (November 2015). "Age-related differences in celiac disease: Specific characteristics of adult presentation". World Journal of Gastrointestinal Pharmacology and Therapeutics (Review). 6 (4): 207–12. doi:10.4292/wjgpt.v6.i4.207. PMC 4635160. PMID 26558154.
In addition, the presence of intraepithelial lymphocytosis and/or villous atrophy and crypt hyperplasia of small-bowel mucosa, and clinical remission after withdrawal of gluten from the diet, are also used for diagnosis antitransglutaminase antibody (tTGA) titers and the degree of histological lesions inversely correlate with age. Thus, as the age of diagnosis increases antibody titers decrease and histological damage is less marked. It is common to find adults without villous atrophy showing only an inflammatory pattern in duodenal mucosa biopsies: Lymphocytic enteritis (Marsh I) or added crypt hyperplasia (Marsh II)
- ^ Molina-Infante J, Santolaria S, Sanders DS, Fernández-Bañares F (May 2015). "Systematic review: noncoeliac gluten sensitivity". Alimentary Pharmacology & Therapeutics (Review). 41 (9): 807–20. doi:10.1111/apt.13155. PMID 25753138. S2CID 207050854.
Furthermore, seronegativity is more common in coeliac disease patients without villous atrophy (Marsh 1-2 lesions), but these ‘minor’ forms of coeliac disease may have similar clinical manifestations to those with villous atrophy and may show similar clinical–histological remission with reversal of haematological or biochemical disturbances on a gluten-free diet (GFD).
- ^ van der Windt DA, Jellema P, Mulder CJ, Kneepkens CM, van der Horst HE (2010). "Diagnostic testing for celiac disease among patients with abdominal symptoms: a systematic review". JAMA. 303 (17): 1738–46. doi:10.1001/jama.2010.549. PMID 20442390.
Most studies used similar histological criteria for diagnosing celiac disease (Marsh grade ≥III), but the level of damage may vary across populations. Only 4 studies presented the proportion of patients in whom only partial villous atrophy was found (Marsh grade of IIIA), which ranged from 4% to 100%. The presence of positive serum antibodies has been shown to correlate with the degree of villous atrophy, and patients with celiac disease who have less severe histological damage may have seronegative findings. This could be important, especially in primary care, in which levels of mucosal damage may be lower, and consequently, more patients with celiac disease may be missed.
- ^ Ontiveros N, Hardy MY, Cabrera-Chavez F (2015). "Assessing of Celiac Disease and Nonceliac Gluten Sensitivity". Gastroenterology Research and Practice(Review). 2015: 1–13. doi:10.1155/2015/723954. PMC 4429206. PMID 26064097.
- ^ Genuis SJ, Lobo RA (2014). "Gluten sensitivity presenting as a neuropsychiatric disorder". Gastroenterol Res Pract(Review). 2014: 293206. doi:10.1155/2014/293206. PMC 3944951. PMID 24693281.
- ^ Ludvigsson JF, Leffler DA, Bai JC, Biagi F, Fasano A, Green PH, Hadjivassiliou M, Kaukinen K, Kelly CP, Leonard JN, Lundin KE, Murray JA, Sanders DS, Walker MM, Zingone F, Ciacci C (January 2013). "The Oslo definitions for coeliac disease and related terms". Gut. 62 (1): 43–52. doi:10.1136/gutjnl-2011-301346. PMC 3440559. PMID 22345659.
- ^ Elli L, Roncoroni L, Bardella MT (July 2015). "Non-celiac gluten sensitivity: Time for sifting the grain". World J Gastroenterol (Review). 21 (27): 8221–6. doi:10.3748/wjg.v21.i27.8221. PMC 4507091. PMID 26217073.
- ^ Fasano A, Sapone A, Zevallos V, Schuppan D (May 2015). "Nonceliac gluten sensitivity". Gastroenterology (Review). 148 (6): 1195–204. doi:10.1053/j.gastro.2014.12.049. PMID 25583468.
- ^ See JA, Kaukinen K, Makharia GK, Gibson PR, Murray JA (October 2015). "Practical insights into gluten-free diets". Nature Reviews. Gastroenterology & Hepatology(Review). 12 (10): 580–91. doi:10.1038/nrgastro.2015.156. PMID 26392070. S2CID 20270743.
A lack of symptoms and/or negative serological markers are not reliable indicators of mucosal response to the diet. Furthermore, up to 30% of patients continue to have gastrointestinal symptoms despite a strict GFD.122,124 If adherence is questioned, a structured interview by a qualified dietitian can help to identify both intentional and inadvertent sources of gluten.
- ^ Castillo NE, Theethira TG, Leffler DA (February 2015). "The present and the future in the diagnosis and management of celiac disease". Gastroenterology Report (Review). 3 (1): 3–11. doi:10.1093/gastro/gou065. PMC 4324867. PMID 25326000.
- ^ ا ب ج Levy J, Bernstein L, Silber N (December 2014). "Celiac disease: an immune dysregulation syndrome". Current Problems in Pediatric and Adolescent Health Care(Review). 44 (11): 324–7. doi:10.1016/j.cppeds.2014.10.002. PMID 25499458.
Initially, reduced levels of lactase and sucrase activities might necessitate further dietary restrictions until the villi have healed and those sugars are better tolerated
- ^ ا ب Montalto M, Gallo A, Ojetti V, Gasbarrini A (2013). "Fructose, trehalose and sorbitol malabsorption" (PDF). European Review for Medical and Pharmacological Sciences (Review). 17 Suppl 2 (Suppl 2): 26–9. PMID 24443064. Archived (PDF) from the original on 12 April 2016.
- ^ Leffler DA, Green PH, Fasano A (October 2015). "Extraintestinal manifestations of coeliac disease". Nature Reviews. Gastroenterology & Hepatology (Review). 12 (10): 561–71. doi:10.1038/nrgastro.2015.131. PMID 26260366. S2CID 15561525.
- ^ ا ب Woodward J (3 August 2016). "Improving outcomes of refractory celiac disease - current and emerging treatment strategies". Clinical and Experimental Gastroenterology(Review). 9: 225–36. doi:10.2147/ceg.s87200. PMC 4976763. PMID 27536154.
- ^ ا ب Berni Canani R, Pezzella V, Amoroso A, Cozzolino T, Di Scala C, Passariello A (March 2016). "Diagnosing and Treating Intolerance to Carbohydrates in Children". Nutrients. 8 (3): 157. doi:10.3390/nu8030157. PMC 4808885. PMID 26978392.
- ^ ا ب García-Manzanares A, Lucendo AJ (April 2011). "Nutritional and dietary aspects of celiac disease". Nutrition in Clinical Practice (Review). 26 (2): 163–73. doi:10.1177/0884533611399773. PMID 21447770.
- ^ Volta U, Caio G, Tovoli F, De Giorgio R (September 2013). "Non-celiac gluten sensitivity: questions still to be answered despite increasing awareness". Cellular & Molecular Immunology (Review). 10 (5): 383–92. doi:10.1038/cmi.2013.28. PMC 4003198. PMID 23934026.
- ^ المعهد الوطني للصحة وتفوق الرعاية. Clinical guideline 53: Chronic fatigue syndrome/myalgic encephalomyelitis. London, 2007.
- ^ Murch S، Jenkins H، Auth M، Bremner R، Butt A، France S، Furman M، Gillett P، Kiparissi F، Lawson M، McLain B، Morris MA، Sleet S، Thorpe M (أكتوبر 2013). "Joint BSPGHAN and Coeliac UK guidelines for the diagnosis and management of coeliac disease in children". Archives of Disease in Childhood. ج. 98 ع. 10: 806–11. DOI:10.1136/archdischild-2013-303996. PMID:23986560. S2CID:30417933.
- ^ Tersigni C، Castellani R، de Waure C، Fattorossi A، De Spirito M، Gasbarrini A، Scambia G، Di Simone N (2014). "Celiac disease and reproductive disorders: meta-analysis of epidemiologic associations and potential pathogenic mechanisms". Human Reproduction Update. ج. 20 ع. 4: 582–93. DOI:10.1093/humupd/dmu007. PMID:24619876.
- ^ Han Y، Chen W، Li P، Ye J (2015). "Association Between Coeliac Disease and Risk of Any Malignancy and Gastrointestinal Malignancy: A Meta-Analysis". Medicine (Baltimore) (Meta-Analysis). ج. 94 ع. 38: e1612. DOI:10.1097/MD.0000000000001612. PMC:4635766. PMID:26402826.
- ^ ا ب Ciaccio EJ، Lewis SK، Biviano AB، Iyer V، Garan H، Green PH (2017). "Cardiovascular involvement in celiac disease". World J Cardiol (Review). ج. 9 ع. 8: 652–666. DOI:10.4330/wjc.v9.i8.652. PMC:5583538. PMID:28932354.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Kupper C (2005). "Dietary guidelines and implementation for celiac disease". Gastroenterology. ج. 128 ع. 4 Suppl 1: S121–7. DOI:10.1053/j.gastro.2005.02.024. PMID:15825119.
- ^ Treem WR (2004). "Emerging concepts in celiac disease". Curr Opin Pediatr. ج. 16 ع. 5: 552–9. DOI:10.1097/01.mop.0000142347.74135.73. PMID:15367850. S2CID:20221260.
- ^ Lee AR، Ng DL، Zivin J، Green PH (2007). "Economic burden of a gluten-free diet" (PDF). J Hum Nutr Diet. ج. 20 ع. 5: 423–30. CiteSeerX:10.1.1.662.8399. DOI:10.1111/j.1365-277X.2007.00763.x. PMID:17845376. مؤرشف من الأصل (PDF) في 24 يونيو 2015. اطلع عليه بتاريخ 9 فبراير 2018.
- ^ Troncone R، Ivarsson A، Szajewska H، Mearin ML (2008). "Review article: future research on coeliac disease – a position report from the European multistakeholder platform on coeliac disease (CDEUSSA)". Aliment. Pharmacol. Ther. ج. 27 ع. 11: 1030–43. DOI:10.1111/j.1365-2036.2008.03668.x. PMID:18315588. S2CID:30241867.
- ^ ا ب Akobeng AK، Thomas AG (يونيو 2008). "Systematic review: tolerable amount of gluten for people with coeliac disease". Aliment. Pharmacol. Ther. ج. 27 ع. 11: 1044–52. DOI:10.1111/j.1365-2036.2008.03669.x. PMID:18315587. S2CID:20539463.
- ^ "Gluten-free food". Directorate-General for Health and Consumers. مؤرشف من الأصل في 2015-07-23. اطلع عليه بتاريخ 2015-07-25.
- ^ "What is Gluten-Free? FDA Has an Answer". إدارة الغذاء والدواء. 2 أغسطس 2013. مؤرشف من الأصل في 4 أغسطس 2013. اطلع عليه بتاريخ 2 أغسطس 2013.
As one of the criteria for using the claim 'gluten-free,' FDA is setting a gluten limit of less than 20 ppm (parts per million) in foods that carry this label. This is the lowest level that can be consistently detected in foods using valid scientific analytical tools. Also, most people with celiac disease can tolerate foods with very small amounts of gluten. This level is consistent with those set by other countries and international bodies that set food safety standards.
- ^ Section 206 of the Food Allergen Labeling and Consumer Protection Act of 2004, Title II of قانون عام. 108–282 (text) (PDF), 118 Stat. 891, enacted أغسطس 2, 2004
- ^ 78 FR 47154 (5 August 2013). Codified at 21 قانون اللوائح الفيدرالية 101.91.
- ^ "Current Official Standards". FAO/WHO. مؤرشف من الأصل في 2011-06-04.
- ^ Anderson، Jane. "Certified Gluten-Free Products: What Does Gluten-Free Certification Mean For Consumers?". دوت داش. مؤرشف من الأصل في 2014-04-12. اطلع عليه بتاريخ 2014-03-04.
- ^ Burger JP، de Brouwer B، IntHout J، Wahab PJ، Tummers M، Drenth JP (أبريل 2017). "Systematic review with meta-analysis: Dietary adherence influences normalization of health-related quality of life in coeliac disease". Clinical Nutrition. ج. 36 ع. 2: 399–406. DOI:10.1016/j.clnu.2016.04.021. PMID:27179800.
- ^ ا ب ج د ه و ز Woodward J (3 أغسطس 2016). "Improving outcomes of refractory celiac disease - current and emerging treatment strategies". Clinical and Experimental Gastroenterology (Review). ج. 9: 225–36. DOI:10.2147/ceg.s87200. PMC:4976763. PMID:27536154.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Mulder CJ، van Wanrooij RL، Bakker SF، Wierdsma N، Bouma G (2013). "Gluten-free diet in gluten-related disorders". Dig. Dis. (Review). ج. 31 ع. 1: 57–62. DOI:10.1159/000347180. PMID:23797124. S2CID:14124370.
- ^ "American Gastroenterological Association medical position statement: Celiac Sprue". Gastroenterology. ج. 120 ع. 6: 1522–5. 2001. DOI:10.1053/gast.2001.24055. PMID:11313323. S2CID:28235994.
- ^ ا ب Levy J، Bernstein L، Silber N (ديسمبر 2014). "Celiac disease: an immune dysregulation syndrome". Current Problems in Pediatric and Adolescent Health Care (Review). ج. 44 ع. 11: 324–7. DOI:10.1016/j.cppeds.2014.10.002. PMID:25499458.
Initially, reduced levels of lactase and sucrase activities might necessitate further dietary restrictions until the villi have healed and those sugars are better tolerated.
- ^ ا ب Montalto M، Gallo A، Ojetti V، Gasbarrini A (2013). "Fructose, trehalose and sorbitol malabsorption" (PDF). European Review for Medical and Pharmacological Sciences (Review). 17 Suppl 2 ع. Suppl 2: 26–9. PMID:24443064. مؤرشف (PDF) من الأصل في 12 أبريل 2016.
- ^ Berni Canani R، Pezzella V، Amoroso A، Cozzolino T، Di Scala C، Passariello A (مارس 2016). "Diagnosing and Treating Intolerance to Carbohydrates in Children". Nutrients. ج. 8 ع. 3: 157. DOI:10.3390/nu8030157. PMC:4808885. PMID:26978392.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ García-Manzanares A، Lucendo AJ (أبريل 2011). "Nutritional and dietary aspects of celiac disease". Nutrition in Clinical Practice (Review). ج. 26 ع. 2: 163–73. DOI:10.1177/0884533611399773. PMID:21447770.
- ^ Green PH، Jabri B (أغسطس 2003). "Coeliac disease". Lancet (Review). ج. 362 ع. 9381: 383–91. DOI:10.1016/S0140-6736(03)14027-5. PMID:12907013. S2CID:39188931.
- ^ Castillo NE، Theethira TG، Leffler DA (فبراير 2015). "The present and the future in the diagnosis and management of celiac disease". Gastroenterology Report (Review). ج. 3 ع. 1: 3–11. DOI:10.1093/gastro/gou065. PMC:4324867. PMID:25326000.
- ^ Leffler DA، Green PH، Fasano A (أكتوبر 2015). "Extraintestinal manifestations of coeliac disease". Nature Reviews. Gastroenterology & Hepatology (Review). ج. 12 ع. 10: 561–71. DOI:10.1038/nrgastro.2015.131. PMID:26260366. S2CID:15561525.
- ^ "Coeliac Disease - Coeliac Australia". www.coeliac.org.au. مؤرشف من الأصل في 2021-04-22. اطلع عليه بتاريخ 2019-05-08.
- ^ Buchanan N (1987). Child and Adolescent Health for Practitioners. Williams & Wilkins. ص. 164. ISBN:978-0-86433-015-4.
- ^ Zipser RD، Farid M، Baisch D، Patel B، Patel D (2005). "Physician awareness of celiac disease: a need for further education". J Gen Intern Med. ج. 20 ع. 7: 644–6. DOI:10.1007/s11606-005-0111-7. PMC:1490146. PMID:16050861.
- ^ ا ب Barker JM، Liu E (2008). "Celiac disease: pathophysiology, clinical manifestations, and associated autoimmune conditions". Adv Pediatr. ج. 55: 349–65. DOI:10.1016/j.yapd.2008.07.001. PMC:2775561. PMID:19048738.
- ^ ا ب Leeds JS، Hopper AD، Sanders DS (2008). "Coeliac disease". Br Med Bull. ج. 88 ع. 1: 157–70. DOI:10.1093/bmb/ldn044. PMID:19073695.
- ^ ا ب Oxentenko، AS؛ Rubio-Tapia، A (ديسمبر 2019). "Celiac Disease". Mayo Clinic Proceedings. ج. 94 ع. 12: 2556–2571. DOI:10.1016/j.mayocp.2019.02.019. PMID:31806106.
- ^ ا ب ج Adams F, translator (1856). "On The Cœliac Affection". The extant works of Aretaeus, The Cappadocian. London: Sydenham Society. pp. 350–1. Retrieved 12 December 2009. نسخة محفوظة 2020-08-27 على موقع واي باك مشين.
- ^ ا ب Losowsky MS (2008). "A history of coeliac disease". Digestive Diseases. 26 (2): 112–20. doi:10.1159/000116768. PMID 18431060. S2CID 10062937. نسخة محفوظة 2021-04-20 على موقع واي باك مشين.
- ^ ا ب ج د Losowsky MS (2008). "A history of coeliac disease". Digestive Diseases. ج. 26 ع. 2: 112–20. DOI:10.1159/000116768. PMID:18431060. S2CID:10062937.
- ^ Gee، SJ (1888). "On the coeliac affection". St Bartholomew's Hospital Report. ج. 24: 17–20. مؤرشف من الأصل في 26 سبتمبر 2007. اطلع عليه بتاريخ 20 مارس 2007.
- ^ Herter، CA (1908). On infantilism from chronic intestinal infection; characterized by the overgrowth and persistence of flora in the nursing period. New York: Macmillan & Co. مؤرشف من الأصل في 2022-04-07. as cited by WhoNamedIt
- ^ Enersen OD. "Christian Archibald Herter". Who Named It?. مؤرشف من الأصل في 31 ديسمبر 2006. اطلع عليه بتاريخ 20 مارس 2007.
- ^ Haas SV (1924). "The value of the banana in the treatment of coeliac disease". Am J Dis Child. ج. 24 ع. 4: 421–37. DOI:10.1001/archpedi.1924.04120220017004.
- ^ van Berge-Henegouwen GP، Mulder CJ (1993). "Pioneer in the gluten free diet: Willem-Karel Dicke 1905–1962, over 50 years of gluten free diet". Gut. ج. 34 ع. 11: 1473–5. DOI:10.1136/gut.34.11.1473. PMC:1374403. PMID:8244125.
- ^ Dicke WK (1950). Coeliakie: een onderzoek naar de nadelige invloed van sommige graansoorten op de lijder aan coeliakie, PhD thesis (بالهولندية). Utrecht, the Netherlands: University of Utrecht.
- ^ Fasano A (2009). "Celiac Disease Insights: Clues to Solving Autoimmunity". Scientific American ع. August: 49–57. مؤرشف من الأصل في 8 فبراير 2010.
- ^ Anderson CM، French JM، Sammons HG، Frazer AC، Gerrard JW، Smellie JM (1952). "Coeliac disease; gastrointestinal studies and the effect of dietary wheat flour". Lancet. ج. 1 ع. 17: 836–42. DOI:10.1016/S0140-6736(52)90795-2. PMID:14918439.
- ^ Paulley JW (1954). "Observation on the aetiology of idiopathic steatorrhoea; jejunal and lymph-node biopsies". Br Med J. ج. 2 ع. 4900: 1318–21. DOI:10.1136/bmj.2.4900.1318. PMC:2080246. PMID:13209109.
- ^ Macdonald WC، Dobbins WO، Rubin CE (1965). "Studies of the familial nature of celiac sprue using biopsy of the small intestine". N Engl J Med. ج. 272 ع. 9: 448–56. DOI:10.1056/NEJM196503042720903. PMID:14242522.
- ^ Marks J، Shuster S، Watson AJ (1966). "Small-bowel changes in dermatitis herpetiformis". Lancet. ج. 2 ع. 7476: 1280–2. DOI:10.1016/S0140-6736(66)91692-8. PMID:4163419.
- ^ Buy Me Some Gluten-Free Peanuts, Cracker Jacks". QSR Magazine. Journalistic. 11 May 2010. Archived from the original on 4 December 2011. Retrieved 30 December 2010. نسخة محفوظة 26 أبريل 2021 على موقع واي باك مشين.
- ^ Hillson, Beth (9 January 2008). "May as Celiac Awareness Month". Celiac Disease Foundation. Archived from the original on 24 February 2010. Retrieved 1 July 2011.
- ^ One on-line site sells 1200 wafers weighing a total of 523 g Archived 16 September 2011 at the Wayback Machine. Eden.co.uk (31 July 2013). Retrieved on 3 September 2013 نسخة محفوظة 22 سبتمبر 2020 على موقع واي باك مشين.
- ^ Statement by the National Conference of Catholic bishops on the use of low gluten hosts at Mass Archived 16 July 2013 at the Wayback Machine. BCL Newsletter. November 2003. نسخة محفوظة 26 أبريل 2021 على موقع واي باك مشين.
- ^ "Girl with digestive disease denied Communion". NBC News. Microsoft. Associated Press. 8 December 2004. Retrieved 30 May 2006. نسخة محفوظة 28 أبريل 2021 على موقع واي باك مشين.
- ^ Ratzinger, Joseph (24 July 2003). Prot. 89/78-174 98. Congregation for the Doctrine of the Faith. Full text at: "The Use of Mustum and Low-Gluten Hosts at Mass". BCL Newsletter. United States Conference of Catholic Bishops. November 2003. Archived from the original on 2 January 2007. Retrieved 7 March 2007. نسخة محفوظة 8 يوليو 2011 على موقع واي باك مشين.
- ^ McNamara, Father Edward (15 September 2004). "Liturgy: Gluten-free Hosts". Catholic Online. Archived from the original on 29 September 2007. Retrieved 17 June 2007. نسخة محفوظة 29 يناير 2021 على موقع واي باك مشين.
- ^ Millward, David (8 July 2017). "Vatican outlaws use of gluten free bread for Holy Communion". The Telegraph. Archived from the original on 4 August 2017. Retrieved 3 August 2017. نسخة محفوظة 26 يناير 2021 على موقع واي باك مشين.
- ^ Kemppainen KM, Lynch KF, Liu E, Lönnrot M, Simell V, Briese T, et al. (May 2017). "Factors That Increase Risk of Celiac Disease Autoimmunity After a Gastrointestinal Infection in Early Life". Clinical Gastroenterology and Hepatology. 15 (5): 694–702.e5. doi:10.1016/j.cgh.2016.10.033. PMC 5576726. PMID 27840181.
- ^ Verdu EF, Caminero A (April 2017). "How infection can incite sensitivity to food". Science. 356 (6333): 29–30. Bibcode:2017Sci...356...29V. doi:10.1126/science.aan1500. PMID 28385972. S2CID 206659081.
- ^ Freeman HJ (November 2013). "Non-dietary forms of treatment for adult celiac disease". World Journal of Gastrointestinal Pharmacology and Therapeutics (Review). 4 (4): 108–12. doi:10.4292/wjgpt.v4.i4.108. PMC 3817285. PMID 24199026.
- ^ Vanga RR, Kelly CP (May 2014). "Novel therapeutic approaches for celiac disease". Discovery Medicine. 17 (95): 285–93. PMID 24882720.
- ^ ا ب Castillo NE, Theethira TG, Leffler DA (2015). "The present and the future in the diagnosis and management of celiac disease". Gastroenterology Report (Review). 3 (1): 3–11. doi:10.1093/gastro/gou065. PMC 4324867. PMID 25326000.
- ^ "Innovate Biopharmaceuticals". www.innovatebiopharma.com. Archived from the original on 18 April 2016. Retrieved 17 April 2016.
- ^ ا ب Buie T (2013). "The relationship of autism and gluten". Clin Ther (Review). 35 (5): 578–83. doi:10.1016/j.clinthera.2013.04.011. PMID 23688532.
At this time, the studies attempting to treat symptoms of autism with diet have not been sufficient to support the general institution of a gluten-free or other diet for all children with autism.
- ^ Marí-Bauset S, Zazpe I, Mari-Sanchis A, Llopis-González A, Morales-Suárez-Varela M (December 2014). "Evidence of the gluten-free and casein-free diet in autism spectrum disorders: a systematic review". J Child Neurol. 29 (12): 1718–27. doi:10.1177/0883073814531330. hdl:10171/37087. PMID 24789114. S2CID 19874518.
- ^ Millward C, Ferriter M, Calver S, Connell-Jones G (2008). Ferriter M (ed.). "Gluten- and casein-free diets for autistic spectrum disorder". Cochrane Database Syst Rev (2): CD003498. doi:10.1002/14651858.CD003498.pub3. PMC 4164915. PMID 18425890.
- ^ Volta U, Caio G, De Giorgio R, Henriksen C, Skodje G, Lundin KE (June 2015). "Non-celiac gluten sensitivity: a work-in-progress entity in the spectrum of wheat-related disorders". Best Pract Res Clin Gastroenterol. 29 (3): 477–91. doi:10.1016/j.bpg.2015.04.006. PMID 26060112.
autism spectrum disorders (ASD) have been hypothesized to be associated with NCGS [47,48]. Notably, a gluten- and casein-free diet might have a positive effect in improving hyperactivity and mental confusion in some patients with ASD. This very exciting association between NCGS and ASD deserves further study before conclusions can be firmly drawn
- ^ San Mauro I, Garicano E, Collado L, Ciudad MJ (December 2014). "¿Es el gluten el gran agente etiopatogenico de enfermedad en el siglo XXI?" [Is gluten the great etiopathogenic agent of disease in the XXI century?]. Nutr Hosp (in Spanish). 30 (6): 1203–10. doi:10.3305/nh.2014.30.6.7866. PMID 25433099.