زنك
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
رمادي فضي
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | زنك، 30، Zn | |||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | فلز انتقالي | |||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 12، 4، d | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 65.38(2) غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ar]; 3d10 4s2] | |||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 2 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 7.14 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 6.57 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 692.68 ك، 419.53 °س، 787.15 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 1180 ك، 907 °س، 1665 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 7.32 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 123.6 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 25.470 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | +2, +1, 0 (أكاسيده مذبذبة) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 1.65 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 906.4 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1733.3 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3833 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 134 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 4±122 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 139 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | نظام بلوري سداسي | |||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة | |||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 59.0 نانوأوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 116 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 30.2 ميكرومتر·متر−1·كلفن−1 (25 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | (درجة حرارة الغرفة) (ملفوف) 3850 متر·ثانية−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 108 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 43 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 70 غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.25 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 2.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة برينل | 412 ميغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-66-6 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الزنك | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
الزِّنْك [ملاحظة 1] عنصرٌ كيميائي رمزه Zn وعدده الذرّي 30، وهو ينتمي إلى عناصر المستوى الفرعي d ويقع على رأس عناصر المجموعة الثانية عشرة في الجدول الدوري. يوجد الزنك في الظروف القياسية من الضغط ودرجة الحرارة على هيئة فلز هش نسبياً سهل التأكسد، وعند إزالة طبقة الأكسيد السطحية فإنه يبدو بلون رمادي ذي لمعان. يصنف الزنك كيميائياً ضمن الفلزات الانتقالية، إلا أنه يتميز بحالة خاصة، إذ أن مدار المستوى الفرعي d ممتلئ، لذلك فإن خواصه الكيميائية تشبه إلى حد ما عناصر الفلزات القلوية الترابية، وخاصة المغنيسيوم، لتشابه امتلاك حالة الأكسدة الوحيدة +2، ولتقارب الحجم الذري. يستخرج الزنك بأسلوب التعويم الزبدي للخامة، ثم بالتحميص، ثم بالاستخلاص النهائي والتنقية بالأسلوب الكهربائي.
يأتي الزنك في المرتبة الرابعة والعشرين من حيث الوفرة الطبيعية في القشرة الأرضية؛ ولديه خمسة نظائر مستقرة. أشهر خامات الزنك هو معدن السفاليريت، وينتشر بشكل واسع في قارات أستراليا وآسيا وأمريكا الشمالية. يعد الزنك من الناحية الحيوية ذي أهمية كبيرة، فهو من العناصر الشحيحة الأساسية للإنسان وللكثير من الكائنات الحية؛ فهو يقوم بدور وظيفي مهم في عمل الإنزيمات؛ لذا ينبغي توفره في الغذاء، من أجل تجنب حالات نقص الزنك المرتبطة باضطرابات جسدية.
عرفت سبيكة النحاس الأصفر (أو الصُّفْرُ) المؤلفة من النحاس والزنك منذ الألفية الثالثة قبل الميلاد، وتوجد شواهد أثرية في عدد من مناطق العالم، وخاصة في المنطقة العربية، على الاستخدام المكثف للنحاس الأصفر في الحياة اليومية منذ القدم. استخدام العلماء العرب والمسلمون الزنك في تجاربهم؛ كما عزل في الهند في القرن الرابع عشر، إلا أن عزل الشكل الفلزي النقي في أوروبا ينسب إلى أندرياس سيغيسموند مارغراف سنة 1746. ساهمت تجارب لويجي غلفاني وألساندرو فولتا في توسيع المعارف المتعلقة بالخواص الكيميائية الكهربائية للزنك. تعد عملية غلفنة الحديد لحمايته من التآكل كبرى تطبيقات الزنك، بالإضافة إلى استخدامه في مجال صناعة البطاريات والسبائك.
التاريخ وأصل التسمية
[عدل]العصور القديمة
[عدل]
توجد العديد من الشواهد التاريخية الأثرية الدالة على استخدام الزنك بشكله غير النقي في العصور القديمة؛ إذ استخدمت خامات الزنك في صناعة سبيكة الزنك مع النحاس المعروفة باسم النحاس الأصفر [ملاحظة 3] (أو الصُّفْر) لعدة آلاف من السنين قبل التمكن من عزل الزنك. تحوي بعض عينات النحاس الأصفر التاريخية على نسبة من الزنك تصل إلى 23%.[1]
وصلت المعارف عن كيفية إنتاج النحاس الأصفر إلى اليونان القديمة حوالي القرن السابع قبل الميلاد؛ ولكن كان هناك بعض التحويرات اللاحقة في أسلوب الإنتاج؛[2] إذ عثر هناك على حلي وأدوات زينة تعود إلى حوالي 2500 سنة قبل الميلاد مصنوعة من سبائك تحوي على الزنك بنسبة تصل إلى 80-90% مع عدد من العناصر من ضمنها النحاس والرصاص والحديد والإثمد وعناصر أخرى.[3] كما عثر على تمثال صغير حاو على نسبة 87.5% من الزنك في تركيبه في موقع أثري بالقرب من منطقة داكيا الرومانية.[4] أما في الهند فتشير النصوص المكتوبة في كاراكا سمهيتا [ملاحظة 4] وهو كتاب في الطب الهندي التقليدي يعود إلى الألفية الأولى قبل الميلاد إلى استخدام فلز في يؤدي حرقه إلى الحصول على ما دعي باسم بشبنجان [ملاحظة 5]، والذي يعتقد أنه أكسيد الزنك.[5] من جهة أخرى، عثر في حطام سفينة رومانية [ملاحظة 6]، والتي غرقت حوالي سنة 140 قبل الميلاد، على مستحضرات دوائية يدخل الزنك في تركيبها، لتكون واحدة من أقدم المستحضرات الدوائية المكتشفة.[6]
عرف الرومان صناعة الصفر حوالي 30 سنة قبل الميلاد؛[7] وقد صنعوا تلك السبيكة من معالجة معدن الكالامين [ملاحظة 7]، الحاوي على الزنك، مع الفحم والنحاس ضمن بوتقة؛[7] ثم بصب الصفر أو تطريقه على هيئة أشكال مستخدمة في صناعة الأسلحة أو لاستخدامه في سك النقود المعدنية.[8] عثر في كتابات المؤرخ الرماني سترابو [ملاحظة 8] في القرن الأول قبل الميلاد إلى اقتباسات من المؤرخ ثيوبمبوس [ملاحظة 9] المفقودة والعائدة إلى القرن الرابع قبل الميلاد، والتي تشير إلى استخدام قطرات من الفضة الكاذبة والتي عندما تمزج مع النحاس فإنها تنتج الصُّفر؛ وقد تكون بذلك إشارة إلى استخدام كميات ضئيلة من الزنك، والناتجة ثانوياً عن صهر خامات الكبريتيدات.[9] كان الزنك يطرح في البقايا الموجودة بالقرب من أفران الصهر، لأنه كان يكن ذا قيمة حينها؛[10] ولكن مع مرور الوقت استخدم الزنك بشكل مكثف في صنع السبائك، ومن الأمثلة على ذلك لوح برن المصنوع من الزنك [ملاحظة 10]، وهو نص نذري [ملاحظة 11] يعود إلى عهد الغاليون الرومان، ومنقوش على سبيكة مكون أغلبها من الزنك.[11]
العصور الوسطى
[عدل]
كانت مناجم الزنك منتشرة في الهند، وخاصةً في راجستان [ملاحظة 12]،[12] وكانت نشطة في استخراج الزنك منذ عهد الإمبراطورية الماورية؛ إلا أن الحصول على الزنك بشكله النقي هناك بدأ منذ حوالي القرن الثاني عشر للميلاد.[13][14] تشير بعض التقديرات إلى إنتاج حوالي مليون طن من الزنك الفلزي ومن أكسيد الزنك في الهند بين القرنين الثاني عشر والسادس عشر للميلاد.[15] كانت خامات الزنك غير النقية تستخرج في الهند وتصهر وتعالج مع مواد عضوية منذ القرن الثالث عشر للميلاد؛[16][17] ويشير نص سنسكريتي [ملاحظة 13] في الخيمياء يعود إلى القرن الثالث عشر إلى وجود نوعين من الخامات الحاوية على الزنك، الأول يستخدم من أجل استخراج الفلز النقي، والآخر يستخدم من أجل أغراض استطبابية.[14]
عزل الزنك النقي لأول مرة في الهند حوالي سنة 1300 ميلادية؛[18][19][20] وكان يشار إلى الزنك النقي في نصوص الطب الهندي التقليدي تحت اسم ياسادا [ملاحظة 14].[21] من جهة أخرى، انتقلت المعارف المتعلقة بالزنك والصفر إلى العلماء العرب والمسلمون؛ وكلمة الخارصين أو الخارصيني هي التسمية العربية للزنك.[22][23] أجريت تجارب عدة على الزنك في العصور الوسطى، إذ كان يحرق في الهواء وتجمع أبخرته في مكثفات؛ وأطلق على الناتج (أكسيد الزنك) في بعض الأحيان اسم صوف الفلاسفة [ملاحظة 15]، لأنه كان يجمع في خصل من الصوف؛ في حين أطلق آخرون عليه اسم الثلج الأبيض [ملاحظة 16].[24]
العصور الحديثة
[عدل]من المحتمل أن يكون أول توثيق لتسمية الزنك قد جرى على يد باراسيلسوس [ملاحظة 17]، والذي أشار إلى اسم هذا الفلز على شاكلة زنكوم [ملاحظة 18] أو زنكن [ملاحظة 19] في كتاب له [ملاحظة 20] يعود إلى القرن السادس عشر.[17][25] يظن أن يكون أصل تسمية الزنك من الكلمة الألمانية zinke، والتي تعني مدبب أو مسنن، وذلك إشارة إلى بلورات الزنك الفلزي الإبرية التي تتشكل عند تصلبه من مصهوره.[26] قد تكون هناك أيضاً صلة وصل مع تسمية عنصر القصدير في اللغة الألمانية والتي هي على الشكل Zinn.[27] في رأي آخر، يعتقد أن يكون اشتقاق الكلمة قادماً من الكلمة الفارسية سنگ، والتي تعني الحجر.[28] من الأسماء الأخرى التي أطلق عليها هذا العنصر كل من القصدير الهندي [ملاحظة 21] وتوتانيغو [ملاحظة 22].[3]

كان الزنك يصل إلى أوروبا بشكل أساسي من الهند، وشهدت تجارته بالسفن ازدهاراً خاصةً في القرنين الخامس عشر والسادس عشر.[29] في سنة 1596 قام عالم المعادن أندرياس ليبافيوس [ملاحظة 23] باستلام عينات من سفينة محملة بالبضائع، ومن ضمنها عينات من الزنك، والتي قام بوصفها بشكل مفصل.[30] تمكن عدد من العلماء الأوروبيون من عزل الزنك من أكسيد الزنك، من ضمنهم البلجيكي دي رسبور [ملاحظة 24] في سنة 1668؛[15] والفرنسي إتيان فرانسوا جوفروا [ملاحظة 25] في أوائل القرن الثامن عشر،[15] وفي سنة 1738 قام البريطاني وليام تشامبيون [ملاحظة 26] بإصدار براءة اختراع لعملية كيميائية صناعية تستخرج الزنك من الكالامين في وعاء صهر عمودي شبيه بالمعوجة [ملاحظة 27]؛[31] كما قام السويدي أنتون فون سواب أيضاً [ملاحظة 28] بتقطير الزنك من الكالامين.[17]
على الرغم من ذلك، فينسب الفضل في أوروبا بعزل الزنك النقي لأول مرة إلى العالم الألماني أندرياس سيغيسموند مارغراف [ملاحظة 29]، ففي تجربته سنة 1746 قام مارغراف بتسخين خليط من الكالامين والفحم في آنية مغلقة من غير وجود للنحاس في الوسط، مما مكنه من الحصول على الزنك النقي.[10][32] ثم أصبح ذلك الأسلوب في الاستخراج تجارياً لأول مرة سنة 1752.[33] وفي سنة 1758 أصدرت براءة اختراع في بريطانيا لعملية تكليس [ملاحظة 30] لكبريتيد الزنك (السفاليريت) من أجل الحصول على أكسيد الزنك في عملية المعوجة [ملاحظة 31]؛[3] وقبل ذلك كان الكالامين المصدر الوحيد لإنتاج الزنك. بشكل منفصل تمكن كل من الصناعي الألماني يوهان كريستيان روبرغ [ملاحظة 32] والبلجيكي جان جاك دانييل دوني [ملاحظة 33] من تطوير عملية الصهر لاستخراج فلز الزنك، وذلك عبر بناء أواني صهر على شكل معوجات أفقية.[17][34]
مهدت التجارب الفيزيائية الحيوية التي أجراها العالم الإيطالي لويجي غلفاني [ملاحظة 34]؛[35][36] في تطوير الخلية الغلفانية [ملاحظة 35] وعملية الغلفنة [ملاحظة 36] والحماية المهبطية [ملاحظة 37].[36] كما تابع العالم ألساندرو فولتا [ملاحظة 38] تلك الأبحاث، والتي أدت إلى اختراع العمود الفولتائي [ملاحظة 39] سنة 1800.[35] يتألف هذا العمود من طبقات مكدسة من الخلايا الغلفانية المؤلفة من صفيحتين، واحدة من النحاس وأخرى من الزنك متصلتين ببعضهما ومغموستين في كهرل [ملاحظة 40]؛ ومثلت تلك الاختراعات الأشكال الأولى في صناعة البطاريات ودراسة علم الكهرباء.[35] يعود السبب في تأخر دراسة الأهمية الحيوية للزنك إلى خواصه غير المغناطيسية وإلى عدم تلون محاليل مركباته الكيميائية؛[37] تغير هذا الأمر سنة 1940 عندما اكتشف أن إنزيم الأنهيدراز الكربوني [ملاحظة 41] يحوي على الزنك في الموقع النشط [ملاحظة 42]؛[37] ثم تلا ذلك اكتشاف وجود الزنك أيضاً في الموقع النشط لإنزيم كربوكسي ببتيداز [ملاحظة 43] في سنة 1955.[37]
الوفرة الطبيعية
[عدل]يشكل الزنك ما يقارب 75 جزء في المليون [ملاحظة 44] من القشرة الأرضية، وهو بذلك يأتي في المرتبة الرابعة والعشرين بين العناصر الكيميائية من حيث الوفرة. لا تتجاوز التراكيز النمطية من الزنك في المحيط الحيوي مقدار 1 ميكروغرام لكل متر مكعب في الغلاف الجوي؛ و300 ميليغرام لكل كيلوغرام في التربة؛ و100 ميليغرام لكل كيلوغرام في الغطاء النباتي؛ و20 ميكروغرام لكل ليتر في المياه العذبة؛ و5 ميكروغرام لكل ليتر في مياه البحر.[38]

من النادر العثور على الزنك في القشرة الأرضية على شكله الطبيعي الحر [ملاحظة 45]؛ لكنه عادةً يوجد في على هيئة معدن، مترافقاً مع عدد من الفلزات الوضيعة [ملاحظة 46] مثل النحاس والرصاص في الخامات الأرضية.[3] وفقاً لتصنيف غولدشميت [ملاحظة 47] الجيوكيميائي فإن الزنك يصنف ضمن العناصر المحبّة للكالكوجين [ملاحظة 48]، أي أن لديه ألفة كيميائية [ملاحظة 49] تجاه عناصر المجموعة السادسة عشرة الأثقل في الجدول الدوري، من ضمنها الكبريت، أكثر من الارتباط مع الأكسجين وتشكيل أكاسيد. عموماً فإن معادن الكبريتيدات تشكلت في مرحلة تصلب القشرة الأرضية تحت ظروف اختزالية.[39] يعد معدن السفاليريت [ملاحظة 50] أكثر معادن الزنك انتشاراً، وهو يتألف كيميائياً من كبريتيد الزنك، ويتراوح تركيز الزنك فيه بين 60-62%.[3]
يقدر عدد المعادن الحاوية على الزنك بأكثر من 300 معدن؛[40] ومن الأمثلة عليها كل من السميثسونيت [ملاحظة 51] (كربونات الزنك)، والهيميمورفيت [ملاحظة 52] (سيليكات الزنك)، والفورتزيت [ملاحظة 53] (كبريتيد آخر للزنك)، والهيدروزنكيت [ملاحظة 54]،(كربونات الزنك القاعدية)، والمعروف أيضاً باسم زهر الزنك [ملاحظة 55].[15] من معادن الزنك أيضاً كل من الزنكيت [ملاحظة 56] (أكسيد الزنك)، والمعروف أيضاً باسم خام الزنك الأحمر، والأداميت [ملاحظة 57] (زرنيخات الزنك القاعدية)، وكذلك المنريكورديت [ملاحظة 58] والفرانكلينيت [ملاحظة 59]. باستثناء الفورتزيت، فإن باقي المعادن الأخرى للزنك كانت قد تشكلت نتيجةً لتجوية كبريتيدات الزنك البدائية الأولية في المراحل الأولى من عمر الأرض.[39]
الاستخراج والإنتاج
[عدل]| # | البلد | الكمية بالأطنان |
|---|---|---|
| 1 | الصين | 4,210,000 |
| 2 | البيرو | 1,400,000 |
| 3 | أستراليا | 1,330,000 |
| 5 | الولايات المتحدة | 753,000 |
| 4 | الهند | 720,000 |
| 6 | المكسيك | 677,000 |
يعد الزنك رابع أكثر الفلزات استخراجاً، بعد الحديد والألومنيوم والنحاس، ويبلغ الإنتاج العالمي منه قرابة 13 مليون طن.[41] يستخرج حوالي 70% من الزنك العالمي بواسطة التعدين من المناجم؛ في حين أن نسبة 30% المتبقية تأتي من إعادة التدوير.[42]

توجد توضعات رسوبية كبيرة من خامات الزنك في أستراليا وكندا والولايات المتحدة والصين وكازاخستان، والهند والبيرو، بالإضافة إلى إيران؛[39][43][44] وتصدر الصين تلك الدول بحوالي 38% من الإنتاج العالمي.[41] وفق تقديرات منشورة، فإن كمية الزنك المستخرج عبر التاريخ إلى سنة 2002 قاربت 346 مليون طن، إذ كان يستخرج تحت اسم الكالامين؛ أما الكمية المستخدمة منها بين 109–305 مليون طن.[45][46][47]
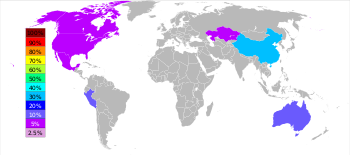
يقدر الاحتياطي العالمي من موارد الزنك الطبيعية الإجمالية بكمية تتراوح بين 1.9-2.8 بليون طن؛[41][49] في حين أن تقديرات أخرى تشير إلى أن احتياطي الزنك القابل للاستخراج تبلغ كميته مقدار 480 مليون طن.[50] أما على صعيد الشركات، فتصنف شركة نيرستار [ملاحظة 61] ضمن أكبر شركات إنتاج الزنك في العالم، وهي ناتج اندماج شركة أوزد للمعادن [ملاحظة 62] مع شركة أوميكور [ملاحظة 63].[51]
التعدين
[عدل]تعد الخامات الكبريتيدية، وخاصة معدن السفاليريت (كبريتيد الزنك ZnS)، المصدر الرئيسي لإنتاج الزنك، لكنها غالباً ما تكون مختلطة مع كبريتيدات فلزات أخرى، مثل النحاس أو الرصاص أو الكادميوم أو الحديد.[52] يستخرج الزنك من خاماته وفق مبادئ علم استخلاص الفلزات [ملاحظة 64]؛[53] إذ تسحق الخامة أولاً ثم تعوّم [ملاحظة 65] من أجل فصل المعادن عن الشوائب، ومن أجل الحصول بالنهاية على مركز خامة كبريتيد الزنك،[53] والمتكون من حوالي 50% زنك، و32% كبريت، و13% حديد، و5% ثنائي أكسيد السيليكون.[53] يؤدي التحميص [ملاحظة 66] اللاحق إلى تحويل الكبريتيد إلى الأكسيد:[52]
يمكن أن يستخدم ثنائي أكسيد الكبريت الناتج في إنتاج حمض الكبريتيك، واللازم من أجل عملية التصويل [ملاحظة 67] فيما بعد. يوجد هناك أسلوبان من أجل المعالجة اللاحقة لخامة الزنك، الأول هو الأسلوب الحراري [ملاحظة 68]، والآخر هو الاستخلاص الكهربائي [ملاحظة 69].
في الأسلوب الحراري لاستخلاص الزنك تجرى عملية اختزال لأكسيد الزنك باستخدام مسحوق الكربون (الفحم) في فرن حراري؛[de 1] أو باستخدام أحادي أكسيد الكربون عند درجات حرارة تقارب 950 °س، حيث يستحصل على الفلز حيننها على هيئة بخار ثم ينقى بالتقطير التجزيئي من الشوائب، وخاصة من الكادميوم.:[52][54]
أما في الأسلوب الكهربائي فتستخلص أملاح الزنك الناتجة عن عملية التصويل من المحلول وترسّب.[55]
ثم تجرى عملية تحليل كهربائي [ملاحظة 70] باستخدام مصعد من الرصاص ومهبط من الألومنيوم من أجل الحصول على فلز الزنك.[52]
يعاد استخدام حمض الكبريتيك من هذه الخطوة في عملية التصويل مرة أخرى. يكون الزنك الناتج عادة بنقاوة تصل إلى 99.9%. من جهة أخرى، عند تلقيم مادة خام مغلفنة [ملاحظة 71] إلى فرن القوس الكهربائي [ملاحظة 72] فإن الزنك يستحصل من الغبار عبر عدة طرائق، أشهرها عملية فيلز [ملاحظة 73] القادرة على استرجاع حوالي 90% من الفلز.[56]
النظائر
[عدل]للزنك ثلاثون نظيراً معروفاً تتراوح أعداد الكتلة لها بين 54 و 83، من بينها خمسة نظائر مستقرة وهي: زنك-64 64Zn و زنك-66 66Zn و زنك-67 67Zn و زنك-68 68Zn و زنك-70 70Zn.[57] يعد النظير زنك-64 64Zn أكثر نظائر الزنك المستقرة من حيث الوفرة الطبيعية حيث يشكل 49.17% من عنصر الزنك في الطبيعة، يليه النظير زنك-66 66Zn بنسبة 27.73% ومن ثم زنك-68 68Zn بنسبة 18.45%.[57][58]
هنالك خمسة وعشرون نظيراً مشعاً للزنك؛ أكثرها ثباتاً هو النظير زنك-65 65Zn، والذي عمر النصف له يبلغ 243.66 يوم، يليه زنك-72 72Zn بعمر نصف 46.5 ساعة.[58] لباقي نظائر الزنك المشعة عمر نصف أقل من 14 ساعة، وأغلبها دون الثانية الواحدة. تجدر الإشارة إلى أن عنصر الزنك لديه عشرة مصاوغات نووية.[58]
الخواص الفيزيائية
[عدل]يوجد الزنك في الظروف القياسية من الضغط ودرجة الحرارة على هيئة فلز رمادي مزرق لامع، وهو ينتمي إلى الفلزات الوضيعة [ملاحظة 74]، بالتالي فإن سطحه قابل للأكسدة، لذلك فإن أغلب العينات التجارية منه ذات سطوح كامدة اللون.[59] للزنك مكسر [ملاحظة 75] ذو لون أبيض فضي؛ وله كثافة أقل من الحديد، وهو يتبلور وفق نظام بلوري سداسي متراص [ملاحظة 76]؛[60] ويتفاوت البعد بين ذرات الزنك في تلك البنية حسب البعد الأفقي أو الشاقولي؛ فيبلغ مقدار 265.9 بيكومتر بين الذرات في نفس مستوي الطبقة؛ ومقدار 290.6 بيكومتر بين الطبقات.[61]
الزنك فلز صلد وهو قابل للسحب والطرق عند درجات حرارة بين 100-200 °س، كما يكون عندها قابلاً للتشكيل [ملاحظة 77]؛ أما عند درجة حرارة الغرفة وعند درجات حرارة تتجاوز 200 °س فإنه يكون نسبياً قابلاً للتقصف؛[16][59] بحيث يمكن أن يستحصل على شكل مسحوق عند التعرض لجهد ميكانيكي.[62] بالمقارنة مع بقية الفلزات، فإن للزنك نقطة انصهار (419.5 °س) ونقطة غليان (907 °س) منخفضتين نسبياً.[63] إن نقطة انصهار الزنك هي الأخفض بين عناصر المستوى الفرعي d، ما عدا الزئبق والكادميوم؛ ولهذا السبب فإن تلك العناصر الثلاثة المذكورة لا تصنف أحياناً ضمن الفلزات الانتقالية، كما هو الحال مع بقية الفلزات في ذلك المستوي الفرعي من الجدول الدوري.[63]
يشكل الزنك العديد من السبائك مع عدد كبير نسبياً من العناصر.[64] للزنك موصلية كهربائية متوسطة؛ ولديه خواص مغناطيسية معاكسة [ملاحظة 78].[16] على الرغم من أن كلاً من الزنك والزركونيوم لا يمتلكان خواصاً مغناطيسية حديدية [ملاحظة 79]، إلا أن للسبيكة ZrZn2 مغناطيسية حديدية عند درجات حرارة منخفضة دون 35 كلفن.[16]
الخواص الكيميائية
[عدل]يصنف الزنك كيميائياً ضمن الفلزات الوضيعة (الفلزات غير النفيسة)، إذ يتفاعل سطحه عند التماس مع الهواء الرطب وثنائي أكسيد الكربون، ويفقد لمعانه، إذ تتشكل طبقة حامية مُخَمّلّةٌ [ملاحظة 80] تتكون من مزيج من أكسيد وكربونات الزنك (Zn5(OH)6(CO3)2)؛ ولذلك يستخدم الزنك بكثرة في مجال غلفنة السطوح المعدنية.[65] يبلغ جهد اختزال الزنك مقدار −0.763 فولت، وهو من المختزلات القوية.[66] للزنك نشاط كيميائي جيد نسبياً، فهو يتفاعل مع الأحماض والقواعد واللافلزات.[67] يشتعل الزنك في الهواء مع إصدار لهب ذي لون أخضر مزرق، ويعطي دخاناً من أكسيد الزنك.[68] ينحل الزنك التجاري بشكل جيد في الأحماض القوية مثل حمض الهيدروكلوريك أو حمض الكبريتيك، إذ تكون تلك الأحماض قادرة على إزالة الطبقة المخملة لتتيح تفاعل باقي بنية الفلز مع الحمض، مع تشكّل الأملاح الموافقة وانطلاق غاز الهيدروجين.[68] بالمقابل، فإن الزنك النقي جداً (99.999 %) يتفاعل ببطء عند درجة حرارة الغرفة.[68] كما ينحل الزنك أيضاً في المحاليل القلوية؛ ففي المحاليل القلوية الضعيفة الحاوية على أيونات الزنك الثنائي 2+Zn يتشكل هيدروكسيد الزنك Zn(OH)2 على هيئة راسب أبيض [ملاحظة 81]؛ أما في المحاليل القلوية القوية فإن ذلك الراسب ينحل ليتشكل ملح الزنكات [ملاحظة 82] 2−[Zn(OH)4].[68]
هناك شبه تطابق في قيمة نصف القطر الأيوني [ملاحظة 83] للزنك ووللمغنيسيوم؛ ولذلك فإن أملاحهما الموافقة تكون ذات بنية بلورية [ملاحظة 84] مشابهة؛[69] كما هناك تشابه عام في الخواص الكيميائية بينهما.[68] من جهة أخرى، يختلف الزنك عن جيرانه من باقي عناصر الفلزات الانتقالية في الصف الأول، إذ لديه مدار d ممتلئ، ومركباته عديمة اللون (ذات لون أبيض)، وذات مغناطيسية معاكسة.[70] كما أن الزنك يميل إلى تشكيل روابط كيميائية ذات سمة تساهمية [ملاحظة 85]؛ كما يشكل معقدات أكثر استقراراً مع الكواشف المانحة للربيطات [ملاحظة 86] النتروجينية والكبريتية.[70] يكون الزنك في معقداته التناسقية رباعي أو سداسي التناسق غالباً؛ على الرغم من وجود بعض المعقدات خماسية التناسق.[68]
المركبات الكيميائية
[عدل]يعرف للزنك العديد من المركبات الثنائية [ملاحظة 87] مع أغلب أشباه الفلزات [ملاحظة 88] واللافلزات [ملاحظة 89] باستثناء الغازات النبيلة. تسيطر حالة الأكسدة +2 على أغلب كيمياء الزنك، ففي أغلب مركباته الكيميائية يكون الزنك ثنائي التكافؤ.[71] ولمركبات الزنك انحلالية جيدة في الماء، وفي محاليله المائية [ملاحظة 90] يكون المعقد ثماني السطوح [ملاحظة 91] 2+[Zn(H2O)6] هو النوع الكيميائي المسطير.[72]
من النادر أن يوجد الزنك في حالة الأكسدة +1، والتي قد تستحصل عند معالجة الزنك ومركباته عند درجات حرارة مرتفعة تتجاوز 285 °س.[68] يستدل على الأيون 2+[Zn2] من تشكل مركب لابلوري زجاجي أصفر اللون ذي مغناطيسية معاكسة، والناتج من حل الزنك الفلزي في مصهور كلوريد الزنك.[73] تشابه نواة 2+[Zn2] في المركب الناتج تلك التي في كاتيون 2+[Hg2] الموجودة في مركبات الزئبق الأحادي. أما السمة المغناطيسية المعاكسة في الأيون فتؤكد البنية ثنائية الوحدات [ملاحظة 92]. من جهة أخرى، لا تعرف مركبات كيميائية للزنك في حالة أكسدة موجبة غير +1 أو +2؛[74] فقد برهنت الحسابات النظرية أن حالة الأكسدة +4 غير ممكنة؛[75] في حين أن البرهان على وجود مركبات في حالة الأكسدة +3 أمر خلافي.[76][77][78]
اللاعضوية
[عدل]
- الأكسيد
يوجد مركب أكسيد الزنك ZnO على هيئة صلب أبيض اللون، وتتبع بلوراته بنية وفق نظام بلوري سداسي؛ وهو غير منحل في الماء؛ كما أنه من المركبات المذبذبة [ملاحظة 93]، إذ ينحل في المحاليل الحمضية والقلوية القوية؛[68] ويستخدم هذا المركب في عدة مجالات، منها في مجال التلوين و صناعة الخضب [ملاحظة 94].[79]
- الهاليدات
كلوريد الزنك ZnCl2 هو مركب كيميائي أبيض اللون، وشديد الاسترطاب [ملاحظة 95]، وله العديد من الاستخدامات منها استخدامه صهارة [ملاحظة 96] في عمليات اللحام واللحام بالقصدير. أما فلوريد الزنك ZnF2 فهو مركب له بنية الروتيل [ملاحظة 97] وتتبع الزمرة الفراغية [ملاحظة 98] P42/mnm؛[80] وهو يستخدم في مجال فلورة [ملاحظة 99] المركبات العضوية، وفي تحضير خلايا التحليل الكهربائي للغلفنة، على سبيل المثال.[79] من بين الهاليدات [ملاحظة 100] الأربعة، فإن لفلوريد الزنك السمة الأيونية الأكبر، في حين أن الهاليدات الأخرى (الكلوريد ZnCl2 والبروميد ZnBr2 واليوديد ZnI2) ذات نقطة انصهار منخفضة نسبياً، وتكون السمة التساهمية واضحة فيها.[81]
- مركبات وأملاح أخرى
يوجد كبريتيد الزنك ZnS في الطبيعة على هيئة معدن السفاليريت، وهو أهم خامات الزنك؛ وهو يستخدم في مجال صناعة الخضب، وإبادة الفطريات [ملاحظة 101]، بالإضافة إلى استخدامه بكثرة في مجال البصريات، كما هو الحال أيضاً مع الكالكوجينات [ملاحظة 102] الأخرى مثل سيلينيد الزنك ZnSe وتيلوريد الزنك ZnTe.[82] أما كبريتات الزنك ZnSO4 فيستخدم بكثرة كاشفاً كيميائياً في مجال الكيمياء التحليلية؛ بالإضافة إلى استخدامه في مجال التبييض في صناعة اللب والورق. لمركب كربونات الزنك ZnCO3 استخدامات عدة، منها دخوله على هيئة مادة مالئة في صناعة اللدائن والمطاط، وفي مجال صناعة مستحضرات التجميل، وكذلك صناعة الخزف. يعد سيانيد الزنك Zn(CN)2 من المركبات السامة، ويستخدم في مجال الطلي [ملاحظة 103]، وكذلك إنتاج المبيدات الحشرية [ملاحظة 104]؛ وفي مجال تعدين الذهب.[79]

من المركبات اللاعضوية المعروفة للزنك أيضاً كل من نتريد الزنك Zn3N2، وفوسفيد الزنك Zn3P2، وزرنيخيد الزنك Zn3As2؛[83][84] بالإضافة إلى بيروكسيد الزنك ZnO2، وهيدريد الزنك ZnH2؛ وكذلك كربيد الزنك ZnC2.[85] تعرف أيضاً مركبات الزنك اللاعضوية التالية: نترات الزنك Zn(NO3)2، وكلورات الزنك Zn(ClO3)2، وفوسفات الزنك Zn3(PO4)2؛ بالإضافة إلى كرومات الزنك ZnCrO4، وهو مثال نادر على مركب ملون للزنك.[86]
هناك عدد من أملاح الزنك للأحماض العضوية؛ منها أسيتات الزنك Zn(CH3COO)2، وهو ملح أبيض اللون، ويستخدم في مجال حفظ الخشب [ملاحظة 105] وفي مجال صناعة اللواصق؛ بالإضافة إلى استخدامه في مجال الكشف عن الألبومين [ملاحظة 106] والعفص [ملاحظة 107] والفوسفات.[79]
العضوية
[عدل]هناك عدد قليل نسبياً من مركبات الزنك العضوية، وهي تلك الحاوية على رابطة تساهمية بين الزنك والكربون؛[87] ومن الأمثلة عليها مركبات ثنائي ألكيل الزنك، مثل مركب ثنائي ميثيل الزنك،[88] وكذلك مركب ثنائي إيثيل الزنك، والذي أعلن عن تحضيره أول مرة سنة 1848 من تفاعل فلز الزنك مع يوديد الإيثيل [ملاحظة 108]؛ وكان من أول المركبات التي برهن على وجود رابطة سيغما [ملاحظة 109] بين ذرة فلز وذرة كربون.[89] عموماً، تعد مركبات الزنك العضوية من المركبات ذات التطبيقات الاختصاصية المهمة.[90][91][92]
التحليل الكيميائي
[عدل]يمكن أن يجرى التحليل الكمّي للزنك وفق معايرة تشكل المعقدات [ملاحظة 110] بمحلول معياري من ثنائي أمين الإيثيلين رباعي حمض الأسيتيك (EDTA) [ملاحظة 111]. أما الكشف عن الآثار النزرة من الزنك فتتم وفق طرائق عدة أيضاً، منها قياس الاستقطابية [ملاحظة 112]، أو القياس الفولتي [ملاحظة 113]، أو مطيافية كتلة مزوّدة ببلازما مقترنة بالحثّ [ملاحظة 114]. أما الكشف النوعي كيميائياً عن الزنك فيجرى بعدة طرائق، أبسطها بتسخين عينة مع بضع قطرات من محلول ممدد من ملح من أملاح الكوبالت على شريحة من أكسيد المغنيسيوم فوق لهب من موقد بنزن [ملاحظة 115]؛ وفي حال وجود الزنك فإن التفاعل يؤدي إلى ظهور أخضر الكوبالت [ملاحظة 116] (المعروف أيضاً باسم أخضر رينمان [ملاحظة 117]). كما يعطي اختبار اللهب التقليدي للكشف عن أيونات الزنك لوناً أزرق إلى أخضر مزرق.[93]
الدور الحيوي
[عدل]للزنك دور حيوي مهم، فهو ينتمي إلى مجموعة العناصر المعدنية الأساسية [ملاحظة 118]، وذلك بالنسبة للإنسان،[94][95][96] وكذلك بالنسبة لباقي الكائنات الحية من الحيوانات،[97] والنباتات،[98] والأحياء الدقيقة.[99] إذ يحتاج إلى الزنك من أجل دوره الوظيفي البارز في أكثر من 300 إنزيم وأكثر من 1000 عامل نسخ [ملاحظة 119]،[96] لذلك يخرن وينقل في بروتينات الميتالوثيونين [ملاحظة 120].[100][101] يعد الزنك ثاني أكثر عنصر معدني أساسي وفرةً في الجسم بعد الحديد؛ وهو العنصر المعدني الوحيد الداخل في تركيب جميع فئات الإنزيمات.[96][98] يشمل الدور الحيوي للزنك في جسم الإنسان طيفاً واسعاً من الوظائف؛[95][102] وهو يتآثر [ملاحظة 121] مع طيف واسع من الربيطات العضوية [ملاحظة 122]،[102] وله دور وظيفي في أداء الأحماض النووية DNA وRNA؛ وفي توصيل الإشارة [ملاحظة 123] والتعبير الجيني [ملاحظة 124]. كما توجد له العديد من الوظائف الأخرى التي لا زالت في طور الاستكشاف، إذ يوجد الزنك في حوالي 10% من بروتينات الجسم.[103]
يحوي جسم الإنسان تقريباً على كمية تتفاوت بين 2 إلى 4 غرام؛[104] وهي تتوزع في كامل الجسم، إذ توجد آثار منه في الدماغ والعضلات والعظام والكبد والكليتين وفي أجزاء من العين؛ وكذلك في البروستات؛[105] إذ أن المني غني بشكل خاص بالزنك، وله دور مهم في الأداء الوظيفي ونمو الأعضاء الجنسية الذكورية.[106] يتعلق استتباب [ملاحظة 125] الزنك داخل الجسم بالقناة الهضمية، والتي تحوي على بروتينات عبر غشائية ناقلة للزنك [ملاحظة 126] مثل ZIP4 وTRPM7، والتي تقوم بدور مهم في امتصاص الزنك من المصادر الغذائية.[107][108] تشكل أيونات الزنك روابط تناسقية إلى السلاسل الجانبية في الأحماض الأمينية [ملاحظة 127] في كل من حمض الأسبارتيك [ملاحظة 128] وحمض الجلوتاميك [ملاحظة 129] والسيستئين [ملاحظة 130] والهستيدين [ملاحظة 131]؛ فعلى سبيل المثال يسهل الهستيدين من امتصاص الزنك في المناطق الدماغية؛[109] وعموماً فقد بيّنت الدراسات باستخدام الوسائل الكيمياء المحوسبة [ملاحظة 132] والنظرية [ملاحظة 133] أن آلية ارتباط الزنك في البروتينات معقدة.[110] يخزن الزنك في الدماغ في حويصلات مشبكية [ملاحظة 134] نوعية بواسطة عصبونات غلوتامية [ملاحظة 135]، ويقوم هناك بدور في تعديل الإشارات العصبية؛[95][96][111] وفي اللدونة المشبكية [ملاحظة 136]؛[95][112] وعموماً فإن لاستباب الزنك دور مهم في التنظيم الوظيفي للجهاز العصبي المركزي.[95][111][113]
الإنزيمات
[عدل]

تصنف أيونات الزنك ضمن أحماض لويس الفعالة، وهي تقدم وظيفة تحفيزية مفيدة في تفاعلات إضافة الهيدروكسيل [ملاحظة 137] على سبيل المثال، وفي تفاعلات أخرى.[114] لذرة الزنك هندسة تناسقية مرنة [ملاحظة 138]، والتي تسمح للبروتينات باستخدام هذا الفلز عند الحاجة إلى تبديل الأشكال الفراغية في بنية البروتين عند القيام بالتفاعلات الحيوية.[115]
يعد الأنهيدراز الكربوني [ملاحظة 139] وكربوكسي ببتيداز [ملاحظة 140] مثالان على الإنزيمات الحاوية على الزنك، وتلك إنزيمات حيوية مهمة في التحكم بنسبة ثنائي أكسيد الكربون في الجسم، وفي استقلاب البروتينات؛ على الترتيب.[116] يقوم الأنهيدراز الكربوني في دم الفقاريات بتحويل CO2 إلى بيكربونات منحلة؛ ويقوم الإنزيم نفسه بتحويل البيكربونات إلى غاز ثنائي أكسيد الكربون عند الزفير؛[117] ومن دون هذا الإنزيم يكون هذا التحول أبطأ بمليون مرة.[118] يوجد نوع آخر من الأنهيدارز الكربوني لدى النباتات، وهو الأنهيدراز الكربوني بيتّا [ملاحظة 141]، وهو يحفز وظائف حيوية مهمة مثل تشكل الأوراق النباتية [ملاحظة 142]، واصطناع واحد من الأكسينات [ملاحظة 143] المهمة وهو إندول حمض الأسيتيك [ملاحظة 144]، بالإضافة إلى التخمر الكحولي.[119] أما إنزيم كربوكسي ببتيداز فيقوم بفصم الرابطة الببتيدية أثناء هضم البروتينات؛ فأثناء العملية تتشكل رابطة تناسقية [ملاحظة 145] بين الببتيد الطرفي وبين مجموعة كربونيل مرتبطة إلى الزنك، مما يمنح ذرة الكربون شحنة موجبة؛ الأمر الذي يساعد على تشكيل وحدة دافعة للماء [ملاحظة 146] على الإنزيم بجانب الزنك، مما يؤدي إلى جذب القسم غير القطبي من البروتين في عملية الهضم.[116]
وظائف أخرى
[عدل]يدخل الزنك في تركيب نوع خاص من البروتينات ذات الطابع البنائي الصغير [ملاحظة 147]، والتي تدعى باسم «إصبع الزنك» [ملاحظة 148]؛[120] وهو يدخل في تركيب عوامل النسخ المهمة في التعرف على تسلسل الحمض النووي الريبوزي منقوص الأكسجين [ملاحظة 149] أثناء عمليات التضاعف [ملاحظة 150] والنسخ [ملاحظة 151]. يحوي إصبع الزنك على ما بين تسع إلى عشر أيونات من الزتك، وتساهم كل واحدة منها في الحفاظ على البنية والهيكلية عن طريق الارتباط التناسقي مع أربع أحماض أمينية موجودة في عوامل النسخ المجاورة.[118]
يساهم الألبومين [ملاحظة 152] وناقل الحديد الترانسفرّين [ملاحظة 153] في نقل الزنك في في بلازما الدم؛[104] كما يوجد الزنك في مخازن الميتالوثيونين داخل الكائنات الحية الدقيقة وفي أمعاء وكبد الحيوانات.[121] إذ يساهم بروتين الميتالوثيونين أيضاً في نقل وامتصاص الزنك.[122] وعموماً فإن عمليات نقل وامتصاص الزنك هي عمليات تنافسية مع فلزات أخرى؛ فنظراً لمساهمة الترانسفرين في نقل الحديد على سبيل المثال، فإن الفائض من الحديد يقلل من امتصاص الزنك، والعكس صحيح؛ وتلاحظ هذه العلاقة التنافسية أيضاً مع النحاس،[123] فالفائض من الزنك يقلل من امتصاص النحاس.[124]
يستخدم الزنك بحد ذاته مرسالاً [ملاحظة 154] في عملية التأشير الخلوي [ملاحظة 155]؛[125] وخاصة في خلايا الجهاز الهضمي والمناعي والتناسلي.[126] لناقل الدوبامين [ملاحظة 156] عند البشر ألفة كيميائية تجاه موقع ارتباط [ملاحظة 157] أيونات الزنك الموجودة خارج الوسط الخلوي [ملاحظة 158]، والتي عند الارتباط مع الزنك تقوم بتثبيط استرداد [ملاحظة 159] الدوبامين وتضخيم النقل العكسي المحرض بالأمفيتامينات [ملاحظة 160] في التجارب خارج الوسط الحيوي [ملاحظة 161].[127][128][129] من جهة أخرى، لا يحوي ناقل السيروتونين [ملاحظة 162] أو ناقل النورإبينفرين [ملاحظة 163] على مواقع رابطة للزنك.[129]
في النباتات
[عدل]الزنك ضروري لنمو النباتات؛[98] ولكن التراكيز المرتفعة التي تزيد عن 500 جزء في المليون في التربة تعيق امتصاص فلزات أساسية أخرى مثل الحديد والمنغنيز.[130] تستطيع أنواع من النباتات (مثل حشيشة المكنسة [ملاحظة 164] أو الخلنج [ملاحظة 165] أو العنبية [ملاحظة 166]) أن تنمو في تربة غنية بالزنك، من غير أن يعود ذلك بآثار سلبية عليها، لأن أنواعاً [ملاحظة 167] من الجذريات الفطرية [ملاحظة 168] تتولى مسؤولية نقل أيونات الزنك.[131] من جهة أخرى، يعد نقص الزنك في التربة المستخدمة في زراعة المحاصيل من المشاكل الشائعة، وخاصة في التربة ذات قيمة pH مرتفعة؛ وتلك ظاهرة ملاحظة في تركيا والهند والصين وغربي أستراليا.[98] وعندما تنمو النباتات في تربة فقيرة بالزنك، تكون أكثر عرضة للأمراض، لذلك يضاف الزنك إلى التربة في خلطة الأسمدة.[98]
التغذية والصحة
[عدل]
من الضروري أن يحتوي الغذاء على الزنك، حتّى بتراكيز ضئيلة، لذلك يصنف الزنك ضمن المغذّيات الضرورية بالنسبة للإنسان.[94] تحوي المنتجات الحيوانية مثل اللحوم والسموك والمأكولات البحرية والبيض ومنتجات الألبان على كميات جيدة من الزنك؛ كما يوجد أيضاً في السمسم والخشخاش والكرفس والخردل؛[132] وكذلك في الفاصولياء والمكسرات واللوز والحبوب الكاملة وبذر القرع وبذر دوار الشمس والكشمش الأسود.[133] تتضمن المصادر الأخرى للزنك كل من الغذاء المدعم بالزنك [ملاحظة 169]؛[134][135] وكذلك المكملات الغذائية [ملاحظة 170] بأشكالها المختلفة؛ ولكن وجد أن إعطاء الزنك على هيئة أكسيد أو كربونات غير مفضل بالمقارنة مع الأشكال الأخرى من الأسيتات والكبريتات، نظراً لضعف الانحلالية الذي يؤثر على عملية الامتصاص.[136]
الامتصاص
[عدل]يؤدي وجود الفيتات [ملاحظة 171] في العديد من الحبوب الكاملة والألياف الغذائية إلى التداخل مع امتصاص الزنك، وذلك بسبب استخلابها [ملاحظة 172] مع الزنك؛ مما قد يؤدي إلى سوء امتصاصه.[137] لذلك ينصح بزيادة الكميات المتناولة من الزنك عبر الغذاء عند تناول وجبات غنية بالفيتات، مثلما هو الحال عند النباتيين على سبيل المثال.[138]
التوصيات الغذائية
[عدل]حددت منظمة الصحة العالمية [ملاحظة 173] في سنة 1996 المقدار اليومي الموصى به من الزنك في الغذاء بمقدار 15 مغ للرجال، و12 مغ للنساء، و10 مغ وللأطفال، 5 مغ للرضع.[139] كما قامت الأكاديمية الوطنية للطبّ [ملاحظة 174] في الولايات المتّحدة الأمريكية (سابقاً تحت اسم المعهد الأمريكي للطبّ) [ملاحظة 175] بتحديث معدّل الحاجة التقريبي [ملاحظة 176] والكمّيّات المُوصى بتناولها [ملاحظة 177] من الزنك في سنة 2001.[114] وحدد معدل الحاجة التقريبي من الزنك لمن يزيد أعمارهم عن 14 سنة بالنسبة للنساء بمقدار 6.8 مغ/اليوم، وللرجال بمقدار 9.4 مغ/اليوم؛ أما الكميات الموصى بتناولها من هذا العنصر فبلغت 8 مغ/اليوم بالنسبة للنساء و11 مغ/اليوم بالنسبة للرجال.[114] أما بالنسبة للمرضعات فكانت الكمية الموصى بها مقدار 12 مغ/اليوم؛ وللرضع حتى عمر 12 شهر بمقدار 3 مغ/اليوم؛ وللأطفال بين عمر سنة واحدة إلى ثلاث عشرة سنة فتزداد الكمية المعطاة تدريجياً مع تقدم العمر من 3-8 مغ/اليوم.[114] أما فيما يخص موضوع السلامة فحُدِّدَ المستوى الأقصى المقبول [ملاحظة 178] بالنسبة للزنك بمقدار 40 ميليغرام في اليوم، متضمناً بذلك الطعام والمكملات الغذائية.[114]
وضعت الهيئة الأوروبية لسلامة الأغذية [ملاحظة 179] مقادير ضابطة مقاربة، ولكنها أعلى نسبياً لما هو متّبع في الولايات المتّحدة،[140] إذ يزداد المقدار الموصى بتناوله مع ازدياد محتوى الفيتات في الغذاء؛[de 2] ولكن من جهة أخرى يبلغ المستوى الأقصى المقبول لمقدار الجرعة اليومية من الزنك في الدول الأوروبية مقدار 25 مغ/اليوم، وهو أدنى مما هو محدد في الولايات المتحدة.[141][142] لا ينصح بتناول جرعات كبيرة من الزنك تفوق 100 مغ/اليوم؛ وعند تخطي عتبة 200 مغ /اليوم تظهر أعراض من غثيان وإسهال وصداع وخمول.[97]
التداوي
[عدل]تعد المراهم الحاوية على الزنك من المستحضرات شائعة الاستخدام لمداواة الآفات الجلدية مثل الإكزيما، ومن أجل التئام الجروح، وتستخدم لذلك أشكال مختلفة من الزنك أهمها أكسيد الزنك بالإضافة إلى أملاح أخرى على هيئة أسيتات أو غلوكونات [ملاحظة 180] أو ستيرات [ملاحظة 181] أو أنديسيلينات [ملاحظة 182].[143] ونظراً لتداخل امتصاص الزنك مع النحاس، لذلك تعطى مستحضرات دوائية حاوية على الزنك (مثل أسيتات الزنك) إلى الأشخاص المصابين بحالة داء ويلسون [ملاحظة 183] الناجمة عن تراكم النحاس في أنسجة الجسم؛ وتعد المعالجة بالزنك من الوسائل الشائعة في إدارة الحالة.[144]
يستخدم الزنك في مجال التداوي الرخيص والفعال لمعالجة الإسهال عند الأطفال في الدول النامية، إذ وجد أن إعطاء جرعات على مدار 10-14 يوم يقلل من مدة وشدة الحالة، ويمكن له أن يمنع حالات مستقبلية على مدى ثلاثة أشهر.[145] يؤدي أخذ جرعات من الزنك إلى التخفيف بشكل كبير من التهاب المعدة والأمعاء [ملاحظة 184]، وقد يعود ذلك إما إلى الأثر المضاد للميكروبات [ملاحظة 185] لأيونات الزنك في القناة الهضمية؛ أو نتيجةً لامتصاص الزنك وإعادة تحريره من الخلايا المناعية (مثل الخلايا المحببة [ملاحظة 186])؛ أو لكلا الآليتين.[146][147]
انتشرت في الأوساط العلمية أخبار عن دراسة قام بها المعهد الهندي للأبحاث والدراسات الطبية، والتي زعمت أن الزنك قادر على التخفيف بشكل كبير من مدة وأعراض الإصابة بالزكام؛ إلا أنها لم تكن دراسة ذات منهجية علمية بالشكل الكافي، الأمر الذي دفع مؤسسة كوكرين [ملاحظة 187] إلى سحبها والتراجع عن نشرها.[148] كما بينت دراسات،[149][150] ومراجعة منهجية أجريت سنة 2021 أن تلك المزاعم غير مدعمة بدلائل علمية ولديها نواقص في التصميم وفي جودة التحليل الإحصائي.[151]
المكملات الغذائية
[عدل]
يضاف الزنك بشكل شائع ضمن خلطة المعادن الغذائية والفيتامينات في المكملات الغذائية [ملاحظة 188]؛ وذلك على هيئة أكسيد أو أسيتات أو غلوكونات؛[152] أو على هيئة متمخلبات مع الأحمض الأمينية [ملاحظة 189].[153][154] عادةً ما ينصح باستخدام مكملات الزنك الغذائية ضمن الإجراءات الوقائية عند ارتفاع احتمالية حدوث حالة خطرة من نقص الزنك.[155]
النقص
[عدل]قد يظهر نقص الزنك (أو عَوَز الزنك [ملاحظة 190]) عند الأشخاص الذين ليس لديهم قدرة على الحصول على وجبات غذائية صحية ومتوازنة تفي بالحاجة اليومية من هذا العنصر؛ فقد يظهر هذا النقص مثلاً لدى الأطفال أو المسنين ذوي الأمراض المزمنة في الدول النامية.[137] يؤدي نقص الزنك لدى الأطفال إلى زيادة التعرض للإصابة بأمراض معدية مثل الإسهال؛ ويقدر أن يكون نقص الزنك مسبباً غير مباشر لوفاة 800 ألف طفل سنوياً.[102] لذا تدعم منظمة الصحة العالمية مهمة تأمين المكملات الغذائية من الزنك للدول المعرضة للمجاعات وانتشار الأمراض المعدية المسببة للإسهال؛[156] وذلك مع ضرورة الانتباه إلى وضع خطة مدروسة في الإعطاء، وذلك لتداخل امتصاص الزنك مع مغذيات صغرى [ملاحظة 191] أخرى.[157] من جهة أخرى بينت دراسة أجريت سنة 2005 في الولايات المتحدة أن البالغين يتناولون وجبات غذائية تحوي على كميات من الزنك أقل من معدل الحاجة التقريبي بنسبة 17% بالنسبة للنساء و11% بالنسبة للرجال؛ وأن تلك النسب ازدادت مع تقدم العمر.[158] وأكدت دراسة لاحقة أجريت بين سنتي 2013-2014 ذلك النقص.[159] على الرغم من ظهور بعض المخاوف من أن حمية النباتيين قد تسبب نقص الزنك بسبب عدم تناول اللحوم؛[138] إلا أن لا يوجد ما يدعم ذلك.[160]
يرتبط نقص الزنك عادة مع طائفة من الأعراض مثل سوء الامتصاص [ملاحظة 192] والتهاب الجلد النهائي المعوي [ملاحظة 193] ومرض الكبد المزمن [ملاحظة 194] ومرض الكلى المزمن [ملاحظة 195] وداء الخلايا المنجلية [ملاحظة 196] ومرض السكّري [ملاحظة 197] والخباثة [ملاحظة 198] وأمراض مزمنة أخرى.[137] من أعراض نقص الزنك الأخرى؛ كل من تأخر النضج الجنسي [ملاحظة 199]، وفقدان الشعر [ملاحظة 200]، وظهور آفات في الجلد ومنطقة العينين، وفقدان الشهية، واضطراب في الوظائف الذهنية، وخلل في وظائف الجهاز المناعي والجهاز التناسلي.[114] يؤدي نقص الزنك إلى التأثير سلباً على أداء الجهاز المناعي؛[161] ولكن الإفراط في تناوله يؤدي إلى ذلك أيضاً.[104]
الفرط والسمية
[عدل]على الرغم من كون الزنك مصنفاً ضمن المغذيات الأساسية، إلا أن الإفراط في تناول الزنك مضر؛ فالامتصاص المفرط من الزنك يعيق امتصاص الحديد والنحاس.[124] هناك دلائل تشير إلى أن الأشخاص الذين يتناولون جرعة يومية تتراوح بين 100-300 مغ من الزنك سيكونون معرضين للإصابة بنقص النحاس [ملاحظة 201] بشكل أكبر. كما بينت دراسة أجريت سنة 2007 أن الأشخاص المسنين الذين يتناولون جرعات يومية من الزنك تبلغ 80 مغ كانوا يدخلون إلى المشافي بسبب مضاعفات بولية.[162]
المخاطر
[عدل]يؤدي استنشاق أبخرة فلز الزنك إلى حدوث ما يسمى بحالة حمى أبخرة الفلزات [ملاحظة 202] (وفي هذه الحالة كانت تدعى باسم رجفات الزنك [ملاحظة 203])، وكانت تلاحظ أثناء عمليات اللحام بالمونة [ملاحظة 204] أو لحام المواد المغلفنة.[163]
تنتمي أيونات الزنك الحرة إلى أحماض لويس القوية، إلى درجة يمكن اعتبارها من المواد الأكالة؛ ولضرب مثال على ذلك، فإن ابتلاع السنت الأمريكي المتكون من 97.5% زنك سيؤدي إلى تفاعله مع الحمض المعدي الحاوي على حمض الهيدروكلوريك، مما يؤدي إلى تحرر أيونات الزنك، الأمر الذي سيؤدي إلى التسبب بضرر للجدار المعدي المعوي.[164] يؤدي ابتلاع الزنك إلى حدوث حالة من الخمول [ملاحظة 205] والرنح [ملاحظة 206]؛[165] وسجلت حالات عديدة لأشخاص عانوا من التسمم بالزنك بسبب ابتلاع قطع نقود معدنية صغيرة مصنوعة من الزنك.[166][167] كما يشكل ابتلاع النقود المعدنية المصنوعة من الزنك خطراً أيضاً على الحيوانات، مثل الكلاب،[168] والببغاوات.[7][169]
الأثر البيئي
[عدل]
يؤدي تعدين الزنك إلى الحصول على آثار سلبية على المحيط البيئي، إذ أن عملية تنقية خامات الزنك الكبريتيدية تنتج كميات كبيرة نسبياً من ثنائي أكسيد الكبريت ومن بخار الكادميوم. يؤدي انطلاق الغازات الكبريتية إلى تلوث الهواء؛ في حين أن الفلزات الثقيلة مثل الكادميوم قد تترسب إلى باطن الأرض، مثلما برهن على ذلك في مجرى نهر خول [ملاحظة 207] في بلجيكا، والذي شهدت ضفافه عمليات تعدين مكثفة للزنك في القرن التاسع عشر، إذ عثر على كميات معتبرة من الفلزات الثقيلة في قعره.[170]
يرتفع مستوى الزنك في الأنهار الجارية في المناطق الصناعية ومناجم التعدين ليصل إلى مستوى 20 جزء في المليون (ppm).[130] إن مجرد وجود تراكيز من الزنك في حدود 2 جزء في المليون يعود بآثار سلبية كبيرة على كمية الأكسجين التي يستطيع السمك حملها في جهازه الدوراني.[171] عموماً، فإن وجود أيونات الزنك حرةً في المحاليل سام جداً بالنسبة للنباتات، واللافقاريات وحتى السمك.[172] إذ أن مجرد تراكيز مولية ضئيلة من مرتبة ميكرومولار [ملاحظة 208] من أيونات الزنك الحرة قادرة على القضاء على بعض الأحياء؛ فعلى سبيل المثال بيّنت تجربة أن 6 ميكرومولار من أيونات الزنك تقضي على 93% من براغيث الماء [ملاحظة 209] في عيّنة التجربة.[173] قد تساهم عمليات معالجة الصرف الصحي في التقليل من كميات الزنك المنحلة في مياه الأنهار، مثلما جرى في نهر الراين على سبيل المثال، إذ أدت المعالجات إلى تقليل مستوى تراكيز الزنك فيه إلى ما يقارب 50 جزء في البليون (ppb).[130] في جانب آخر، تؤدي المستويات المرتفعة من الزنك في التربة إلى التأثير سلباً على قدرة امتصاص النباتات للمغذيات الضرورية مثل الحديد أو المنغنيز، وقد سجلت بالفعل مستويات مرتفعة للزنك وصلت إلى حدود مرتفعة بين 2000-180000 جزء في المليون في بعض عينات التربة.[130]
الاستخدامات
[عدل]تتوزع الاستخدامات الرئيسية لفلز الزنك في سنة 2006 في المجالات التالية:[174] الغلفنة (55%) وصناعة سبيكة النحاس الأصفر (16%) وفي صناعة السبائك الأخرى (21%)؛ بالإضافة إلى متفرقات مختلفة (8%).
الغلفنة والحماية من التآكل
[عدل]
إن أكثر تطبيقات فلز الزنك الصناعية انتشاراً هو استخدامه في مجال الحماية من التآكل، وخاصة في مجال الغلفنة؛[175] وهي عملية تستهلك حوالي النصف من الإنتاج العالمي للزنك.[174] في عملية الغلفنة تغطى أسطح الحديد أو الفولاذ بطبقة من الزنك، ونظراً لأن الزنك ذا نشاط كيميائي أكبر فإنه يخضع إلى عمليات الأكسدة من المحيط التي تتعرض لها تلك الأسطح، مما يحميها من التآكل.[176][177] يضاف الزنك إما بعمليات كهركيميائية أو بإضافة مصهور الزنك عبر عملية الغلفنة بالغمس الساخن [ملاحظة 210] أو بالترذيد [ملاحظة 211]. توجد تطبيقات متنوعة للأسطح المغلفنة في شتى مجالات الحياة المعاصرة.[178]
يستفاد من النشاط الكيميائي للزنك أيضاً في مجال الحماية المهبطية [ملاحظة 212]؛ إذ يصنع من الزنك ما يعرف باسم المصعد الغلفاني [ملاحظة 213] (والذي يسمى أيضاً «مصعد التضحية» [ملاحظة 214]). على سبيل المثال، من أجل إجراء حماية مهبطية لأنبوب نقل حديدي مدفون تحت الأرض، فإنه يلامس مع مصاعد غلفانية مصنوعة من الزنك.[177] كما يستخدم المبدأ ذاته في حماية الأسطح المعدنية المتعرضة بشكل مستمر لمياه البحر،[179] مثل السفن.[176]
صناعة البطاريات
[عدل]يدخل الزنك في صناعة المصعد [ملاحظة 215] في البطاريات التقليدية الجافة؛ وقد يكون على ذلك الشكل إما على هيئة مسحوق في البطارية القلوية [ملاحظة 216] أو على هيئة غلاف معدني للبطارية ذاتها في بطارية الزنك والكربون [ملاحظة 217]، والذي يصنع من صفيحة من الزنك.[180][181] يدخل الزنك أيضاً على شكل مصعد في بطارية الزنك والهواء [ملاحظة 218]، والمعتمدة في عملها على أكسدة الزنك بأكسجين الهواء.[182][183][184] تطور بشكل مستمر أنواع جديدة من البطاريات المعتمدة على الزنك، مثل بطارية الزنك والسيريوم التدفقية [ملاحظة 219].[185]
السبائك
[عدل]
يعد النحاس الأصفر (الصُّفْر) أشهر سبائك الزنك، ويكون النحاس المكون الأساسي لهذه السبيكة، مع وجود نسبة تتراوح بين 3% إلى 45% من الزنك، وذلك اعتماداً على نوع النحاس الأصفر المراد تصنيعه.[177] يتميز الصفر بأنه أكثر مطيلية ومتانة من النحاس، بالإضافة إلى كونه أكثر مقاومة للتآكل؛[177] ويستخدم بكثرة في مجال صناعة الأجهزة والأدوات الموسيقية وعدد السباكة.[177]
يدخل الزنك أيضاً في تركيب عدد من السبائك الأخرى مثل فضّة النيكل والبرونز التجاري؛[16] كما يدخل بديلاً عن الرصاص في صناعة الأرغن ذي الأنابيب [ملاحظة 220]؛[186] وفي موازنة الإطارات، وكذلك في عدد من التطبيقات الأخرى.[187] يستخدم الزنك في سك بعض قطع النقود المعدنية، مثل السنت الأمريكي، والذي يتكون بشكل رئيسي من الزنك.[188][189]

تعد السبائك المصنوعة من الزنك مع كميات ضئيلة من النحاس والألومنيوم والمغنيسيوم مفيدة في عمليات السبك في القوالب [ملاحظة 221] وكذلك السبك المغزلي [ملاحظة 222]، وخاصة في صناعة السيارات والصناعات الكهربائية والصناعات الثقيلة.[16] تسوّق هذه السبائك تحت الاسم التجاري «زاماك» [ملاحظة 223].[190] تتميز تلك السبائك بأنها ذات نقطة انصهار منحفضة نسبياً، كما ان المصهور ذو لزوجة منخفضة مما يسهل من الصب في القوالب، خاصة في إنتاج القطع الصغيرة ذات الأشكال المعقدة.[16][191] كما تستخدم السبائك المصنوعة من الزنك والألومنيوم على هيئة بديل رخيص وعملي عن الحديد في عدد من التطبيقات المختلفة.[192][193] تستخدم سبائك الزنك مع الألومنيوم أو التيتانيوم أو النحاس في مجال الإنشاءات في واجهات المباني والتسقيف، وذلك على هيئة صفائح معدنية، والتي تخضع لاحقاً إلى معالجات هندسية ميكانيكة بعمليات السحب العميق [ملاحظة 224] أو تشكيل الدحرجة [ملاحظة 225] أو بالثني؛ ولا يصلح استخدام فلز الزنك لوحده في تلك العمليات دون سبك.[194] تعد سبيكة تيلوريد كادميوم زنك [ملاحظة 226] من السبائك شبه الموصلة، والتي يمكن تقسيمها إلى شرائح صغيرة من الحساسات الشبيهة بالدارة المتكاملة والقادرة على الكشف عن طاقة فوتونات أشعّة غامّا الواردة، بالإضافة إلى تحديد اتجاهها أيضاً.[195]
متفرقات
[عدل]يستخدم مسحوق الزنك أحياناً مادّةً دافعة [ملاحظة 227] في نماذج الصواريخ الصغيرة؛[196] إذ يؤدي إشعال مزيج مكون من 70% مسحوق زنك مع 30% مسحوق كبريت إلى إصدار كمية كبيرة من الطاقة.[196] من جهة أخرى، يستخدم الزنك حفازاً في بعض تفاعلات الاصطناع العضوي، بما في ذلك الاصطناع اللامتناظر [ملاحظة 228]، وذلك نظراً لانخفاض ثمنه وتوفره، كما تعد كفاءة النتائج والمردود، مقيسةً بفائض المصاوغ المرآتي [ملاحظة 229]، قابلة للمقارنة مع حفازات الفلزات المشهورة مثل البالاديوم والروثيثيوم والإريديوم.[197]
يعد النظير زنك-64 64Zn أكثر نظائر الزنك وفرة، وهو قابل بسهولة لأن يخضع لعمليات تنشيط نيوتروني [ملاحظة 230]، إذ يتحول [ملاحظة 231] إلى النظير المشع زنك-65 65Zn، والذي يبلغ عمر النصف لديه مقدار 244 يوماً، ويصدر أشعة غاما شديدة. لذلك الأمر، يستخدم أكسيد الزنك المنضّب [ملاحظة 232] في المفاعلات النووية على هيئة عامل مقاوم للتآكل [ملاحظة 233]، ويكون ذلك الأكسيد خالياُ من النظير زنك-64 64Zn. يدخل الزنك، بالإضافة إلى الكوبالت أيضاً على هيئة مادة مملحة في صناعة الأسلحة النووية.[198] يستخدم النظير المشع زنك-65 65Zn في عمليات التوسيم [ملاحظة 234] في المجال الهندسي لدراسة كيفية اهتراء السبائك الحاوية على الزنك؛ وفي المجال الحيوي لدراسة دور الزنك في الكائنات الحية.[199]
مركبات الزنك
[عدل]استخدم حوالي ربع الزنك الذي أنتج في الولايات المتحدة سنة 2009 في إنتاج مركبات الزنك الكيميائية المختلفة؛[174] والتي لها العديد من التطبيقات المتنوعة. فيستخدم أكسيد الزنك في صناعة الخضب والدهانات، بالإضافة إلى استخدامه في مادة مضافة إلى اللدائن والمطاط الصناعي من أجل الحماية من الأشعة فوق البنفسجية؛[178] بالإضافة إلى استخدامه في صناعة مكونات الأجهزة الإلكترونية مثل المقاومة المتغيرة مع الجهد [ملاحظة 235].[200] تستخدم دورة زنك-أكسيد الزنك [ملاحظة 236] في إنتاج الهيدروجين.[201]
يضاف كلوريد الزنك إلى الخشب من أجل تثبيط الحرائق؛[202] بالإضافة إلى دخوله ضمن مكونات مواد حفظ الخشب.[203] ويدخل كبريتيد الزنك في تركيب الخضب والطلاءات المضيئة؛[163] كما تستخدم بلورات من كبريتيد الزنك في صناعة أجهزة الليزر العاملة في المجال تحت الأحمر المتوسط [ملاحظة 237].[204] ويستخدم مركب كبريتات الزنك في صناعة الخضب والأصبغة.[202]
يستخدم مركب بيريثيون الزنك في صناعة الدهانات المضادة لظاهرة الحشف الحيوي [ملاحظة 238].[205] كما تستخدم معقدات ثنائي ثيوكربامات الزنك [ملاحظة 239] ضمن مبيدات الفطريات [ملاحظة 240]، مثل زينيب [ملاحظة 241] وغيره من المبيدات الأخرى؛[206] كما يستخدم مركب نفثينات الزنك [ملاحظة 242] ضمن المواد الحافظة للخشب.[207]
طالع أيضاً
[عدل]الهوامش
[عدل]- ^ أو الخارَصِين [ar 1][ar 2] أو التُوتِياء [ar 3]
- ^ Hemmoor
- ^ brass
- ^ Charaka Samhita
- ^ pushpanjan
- ^ Relitto del Pozzino
- ^ Calamine
- ^ Strabo
- ^ Theopompus
- ^ Bern zinc tablet
- ^ votive plaque (Ex-voto)
- ^ Rajasthan
- ^ Rasaratna Samuccaya
- ^ Yasada (Jasada)
- ^ lana philosophica
- ^ nix album
- ^ Paracelsus
- ^ zincum
- ^ zinken
- ^ Liber Mineralium II
- ^ Indian tin
- ^ tutanego
- ^ Andreas Libavius
- ^ P. M. de Respour
- ^ Étienne François Geoffroy
- ^ William Champion
- ^ vertical retort-style smelter
- ^ Anton von Swab
- ^ Andreas Sigismund Marggraf
- ^ calcining
- ^ retort process
- ^ Johann Christian Ruberg
- ^ Jean-Jacques Daniel Dony
- ^ Luigi Galvani
- ^ galvanic cell
- ^ galvanization
- ^ Cathodic protection
- ^ Alessandro Volta
- ^ Voltaic pile
- ^ electrolyte
- ^ carbonic anhydrase
- ^ active site
- ^ carboxypeptidase
- ^ parts per million (ppm)
- ^ Native element mineral
- ^ Base metal
- ^ Goldschmidt classification
- ^ chalcophile
- ^ Chemical affinity
- ^ Sphalerite
- ^ smithsonite
- ^ hemimorphite
- ^ wurtzite
- ^ hydrozincite
- ^ zinc bloom
- ^ Zincite
- ^ Adamite
- ^ Minrecordite
- ^ Franklinite
- ^ Rosh Pinah
- ^ Nyrstar
- ^ OZ Minerals
- ^ Umicore
- ^ extractive metallurgy
- ^ froth flotation
- ^ Roasting
- ^ leaching
- ^ pyrometallurgy
- ^ electrowinning
- ^ electrolysis
- ^ galvanised feedstock
- ^ electric arc furnace
- ^ Waelz process
- ^ base metal
- ^ Fracture
- ^ hexagonal close packing (hcp)
- ^ Forming
- ^ diamagnetic
- ^ Ferromagnetism
- ^ protective passivating
- ^ white precipitate
- ^ Zincate
- ^ Ionic radius
- ^ crystal structure
- ^ covalency
- ^ ligand
- ^ Binary compounds
- ^ Metalloid
- ^ Nonmetal
- ^ aqueous solution
- ^ octahedral complex
- ^ dimeric structure
- ^ amphoteric
- ^ Pigment
- ^ hygroscopic
- ^ Flux
- ^ Rutile Structure
- ^ Space group
- ^ Fluorination
- ^ halide
- ^ Fungicide
- ^ Chalcogen
- ^ Plating
- ^ Insecticide
- ^ Wood preservation
- ^ Albumin
- ^ Tannin
- ^ Ethyl iodide
- ^ Sigma bond
- ^ Complexometric titration
- ^ Ethylenediaminetetraacetic acid (EDTA)
- ^ Polarography
- ^ Voltammetry
- ^ Inductively coupled plasma mass spectrometry (ICP-MS)
- ^ Bunsen burner
- ^ Cobalt green
- ^ Rinman's green
- ^ essential trace element
- ^ transcription factor
- ^ metallothionein
- ^ interacts
- ^ organic ligands
- ^ signal transduction
- ^ gene expression
- ^ homeostasis
- ^ Zinc transporter transmembrane protein
- ^ amino acid side chains
- ^ aspartic acid
- ^ glutamic acid
- ^ cysteine
- ^ histidine
- ^ Computational chemistry
- ^ Theoretical chemistry
- ^ synaptic vesicles
- ^ glutamatergic neurons
- ^ synaptic plasticity
- ^ Hydroxylation
- ^ flexible coordination geometry
- ^ carbonic anhydrase
- ^ Carboxypeptidase
- ^ β-carbonic anhydrase
- ^ leaf formation
- ^ auxin
- ^ Indole-3-acetic acid
- ^ Coordinate covalent bond
- ^ hydrophobic pocket
- ^ small protein structural motif
- ^ Zinc finger
- ^ DNA sequencing
- ^ DNA replication
- ^ transcription
- ^ albumin
- ^ transferrin
- ^ messenger
- ^ Cell signaling
- ^ dopamine transporter
- ^ Binding site
- ^ extracellular
- ^ reuptake
- ^ amphetamine-induced dopamine efflux
- ^ in vitro
- ^ Serotonin transporter
- ^ norepinephrine transporter
- ^ Calluna
- ^ Erica
- ^ Vaccinium
- ^ Ericoid mycorrhiza
- ^ Mycorrhiza
- ^ fortified food
- ^ Dietary supplement
- ^ Phytates
- ^ chelation
- ^ World Health Organization (WHO)
- ^ National Academy of Medicine
- ^ Institute of Medicine (IoM)
- ^ Estimated Average Requirements (EARs)
- ^ Recommended Dietary Allowances (RDAs)
- ^ Tolerable upper intake levels (ULs)
- ^ European Food Safety Authority (EFSA)
- ^ gluconate
- ^ stearate
- ^ undecylenates
- ^ Wilson's disease
- ^ Gastroenteritis
- ^ direct antimicrobial action
- ^ granulocyte
- ^ Cochrane Collaboration
- ^ Dietary supplement
- ^ zinc amino acid chelate
- ^ Zinc deficiency
- ^ micronutrients
- ^ malabsorption
- ^ acrodermatitis enteropathica
- ^ chronic liver disease
- ^ chronic renal disease
- ^ sickle cell disease
- ^ diabetes
- ^ malignancy
- ^ delayed sexual maturation
- ^ alopecia
- ^ copper deficiency
- ^ Metal fume fever
- ^ zinc shakes
- ^ brazing
- ^ Lethargy
- ^ Ataxia
- ^ Geul
- ^ micromolar
- ^ Daphnia
- ^ hot-dip galvanizing
- ^ spraying
- ^ cathodic protection
- ^ Galvanic anode
- ^ sacrificial anode
- ^ anode
- ^ alkaline battery
- ^ Zinc–carbon battery
- ^ zinc–air battery
- ^ flow Zinc–cerium battery
- ^ pipe organ
- ^ die casting
- ^ spin casting
- ^ Zamak
- ^ deep drawing
- ^ Roll forming
- ^ Cadmium zinc telluride (CZT)
- ^ propellant
- ^ asymmetric synthesis
- ^ enantiomeric excess
- ^ neutron activation
- ^ transmuted
- ^ depleted zinc oxide
- ^ anti-corrosion agent
- ^ isotopic tracer
- ^ varistor
- ^ zinc zinc-oxide cycle
- ^ mid-infrared
- ^ Biofouling
- ^ Zinc dithiocarbamate
- ^ fungicide
- ^ Zineb
- ^ Zinc naphthenate
المراجع
[عدل]فهرس المراجع
[عدل]- بالعربية
- ^ "LDLP - Librairie Du Liban Publishers". www.ldlp-dictionary.com. مؤرشف من الأصل في 2019-12-31. اطلع عليه بتاريخ 2019-03-18.
- ^ "LDLP - Librairie Du Liban Publishers". www.ldlp-dictionary.com. مؤرشف من %20Dictionary%20 of%20Geography%20(Eng/Ar)/Zinc الأصل في 2020-01-10. اطلع عليه بتاريخ 2019-03-18.
{{استشهاد ويب}}: تحقق من قيمة|مسار=(مساعدة)< - ^ "LDLP - Librairie Du Liban Publishers". www.ldlp-dictionary.com. مؤرشف من %20Dictionary%20 of%20Geography%20(Eng/Ar)/Zinc الأصل في 2020-01-10. اطلع عليه بتاريخ 2019-03-18.
{{استشهاد ويب}}: تحقق من قيمة|مسار=(مساعدة)
- بالألمانية
- ^ Lehrbuch der Anorganischen Chemie. 102. Auflage (بالألمانية). 2007. p. 102. ISBN:978-3-11-017770-1.
- ^ "Mehr Zink bei Erkältungen?". Klartext Nahrungsergänzung. Verbraucherzentrale. 15 أكتوبر 2020. اطلع عليه بتاريخ 2021-01-28.
- بالإنجليزية
- ^ Greenwood & Earnshaw 1997، صفحة 1201
- ^ Craddock، Paul T. (1978). "The composition of copper alloys used by the Greek, Etruscan and Roman civilizations. The origins and early use of brass". Journal of Archaeological Science. ج. 5 ع. 1: 1–16. DOI:10.1016/0305-4403(78)90015-8.
- ^ ا ب ج د ه Lehto 1968، صفحة 822
- ^ Weeks 1933، صفحة 20
- ^ Craddock, P. T.؛ وآخرون (1998). "Zinc in India". 2000 years of zinc and brass (ط. rev.). London: British Museum. ص. 27. ISBN:978-0-86159-124-4.
- ^ Giachi، Gianna؛ Pallecchi، Pasquino؛ Romualdi، Antonella؛ Ribechini، Erika؛ Lucejko، Jeannette Jacqueline؛ Colombini، Maria Perla؛ Mariotti Lippi، Marta (2013). "Ingredients of a 2,000-y-old medicine revealed by chemical, mineralogical, and botanical investigations". Proceedings of the National Academy of Sciences. ج. 110 ع. 4: 1193–1196. Bibcode:2013PNAS..110.1193G. DOI:10.1073/pnas.1216776110. PMC:3557061. PMID:23297212.
- ^ ا ب ج Emsley 2001، صفحة 501
- ^ Chambers 1901، صفحة 799
- ^ Craddock, P. T. (1998). "Zinc in classical antiquity". في Craddock, P.T. (المحرر). 2000 years of zinc and brass (ط. rev.). London: British Museum. ص. 3–5. ISBN:978-0-86159-124-4.
- ^ ا ب Weeks 1933، صفحة 21
- ^ Rehren، Th. (1996). S. Demirci؛ وآخرون (المحررون). A Roman zinc tablet from Bern, Switzerland: Reconstruction of the Manufacture. Archaeometry 94. The Proceedings of the 29th International Symposium on Archaeometry. ص. 35–45.
- ^ Willies, Lynn؛ Craddock, P. T.؛ Gurjar, L. J.؛ Hegde, K. T. M. (1984). "Ancient Lead and Zinc Mining in Rajasthan, India". World Archaeology. ج. 16 ع. 2, Mines and Quarries: 222–233. DOI:10.1080/00438243.1984.9979929. JSTOR:124574.
- ^ S. M. Gandhi (2000). chapter 2 in Crustal Evolution and Metallogeny in the Northwestern Indian Shield: A Festschrift for Asoke Mookherjee ,Ancient mining and metallurgy in Rajasthan. Alpha Science Int'l Ltd. ص. 46. ISBN:1-84265-001-7.
- ^ ا ب Craddock، P. T.؛ Gurjar L. K.؛ Hegde K. T. M. (1983). "Zinc production in medieval India". World Archaeology. ج. 15 ع. 2: 211–217. DOI:10.1080/00438243.1983.9979899. JSTOR:124653.
- ^ ا ب ج د Emsley 2001، صفحة 502
- ^ ا ب ج د ه و ز CRC 2006، صفحة 4–41
- ^ ا ب ج د Habashi، Fathi. "Discovering the 8th Metal" (PDF). International Zinc Association (IZA). مؤرشف من الأصل (PDF) في 2009-03-04. اطلع عليه بتاريخ 2008-12-13.
- ^ Vaughan، L Brent (1897). "Zincography". The Junior Encyclopedia Britannica A Reference Library of General Knowledge Volume III P-Z. Chicago: E. G. Melven & Company.
- ^ Castellani, Michael. "Transition Metal Elements" (PDF). مؤرشف (PDF) من الأصل في 2014-10-10. اطلع عليه بتاريخ 2014-10-14.
- ^ Habib، Irfan (2011). Chatopadhyaya، D. P. (المحرر). Economic History of Medieval India, 1200–1500. New Delhi: Pearson Longman. ص. 86. ISBN:978-81-317-2791-1. مؤرشف من الأصل في 2016-04-14.
- ^ Ray، Prafulla Chandra (1903). A History of Hindu Chemistry from the Earliest Times to the Middle of the Sixteenth Century, A.D.: With Sanskrit Texts, Variants, Translation and Illustrations (ط. 2nd). The Bengal Chemical & Pharmaceutical Works, Ltd. ج. 1. ص. 157–158. مؤرشف من الأصل في 2023-06-05. (public domain text)
- ^ البيروني. الجماهر في معرفة الجواهر.
- ^ الخوارزمي. مفاتيح العلوم. الفصل الثاني ص 279.
- ^ Arny، Henry Vinecome (1917). Principles of Pharmacy (ط. 2nd). W. B. Saunders company. ص. 483. مؤرشف من الأصل في 2023-06-06.
- ^ Hoover، Herbert Clark (2003). Georgius Agricola de Re Metallica. Kessinger Publishing. ص. 409. ISBN:978-0-7661-3197-2.
- ^ Gerhartz، Wolfgang؛ وآخرون (1996). Ullmann's Encyclopedia of Industrial Chemistry (ط. 5th). VHC. ص. 509. ISBN:978-3-527-20100-6.
- ^ Skeat, W. W (2005). Concise Etymological Dictionary of the English Language. Cosimo, Inc. ص. 622. ISBN:978-1-59605-092-1. مؤرشف من الأصل في 2023-06-07.
- ^ Fathi Habashi (1997). Handbook of Extractive Metallurgy. Wiley-VHC. ص. 642. ISBN:978-3-527-28792-5.
- ^ Jenkins، Rhys (1945). "The Zinc Industry in England: the early years up to 1850". Transactions of the Newcomen Society. ج. 25: 41–52. DOI:10.1179/tns.1945.006.
- ^ Lach، Donald F. (1994). "Technology and the Natural Sciences". Asia in the Making of Europe. University of Chicago Press. ص. 426. ISBN:978-0-226-46734-4.[وصلة مكسورة]
- ^ Comyns، Alan E. (2007). Encyclopedic Dictionary of Named Processes in Chemical Technology (ط. 3rd). CRC Press. ص. 71. ISBN:978-0-8493-9163-7. مؤرشف من الأصل في 2023-06-04.
- ^ Marggraf (1746). "Experiences sur la maniere de tirer le Zinc de sa veritable miniere, c'est à dire, de la pierre calaminaire" [Experiments on a way of extracting zinc from its true mineral; i.e., the stone calamine]. Histoire de l'Académie Royale des Sciences et Belles-Lettres de Berlin (بالفرنسية). 2: 49–57. Archived from the original on 2023-06-04.
- ^ Heiserman 1992، صفحة 122
- ^ Gray، Leon (2005). Zinc. Marshall Cavendish. ص. 8. ISBN:978-0-7614-1922-8.
- ^ ا ب ج Warren، Neville G. (2000). Excel Preliminary Physics. Pascal Press. ص. 47. ISBN:978-1-74020-085-1. مؤرشف من الأصل في 2023-04-18.
- ^ ا ب "Galvanic Cell". The New International Encyclopaedia. Dodd, Mead and Company. 1903. ص. 80.
- ^ ا ب ج Cotton et al. 1999، صفحة 626
- ^ Rieuwerts، John (2015). The Elements of Environmental Pollution. London and New York: Earthscan Routledge. ص. 286. ISBN:978-0-415-85919-6. OCLC:886492996. مؤرشف من الأصل في 2023-06-03.
- ^ ا ب ج Greenwood & Earnshaw 1997، صفحة 1202
- ^ Webmineral (2023). "Mineral Species containing Zinc (Zn )". Mineral News. مؤرشف من الأصل في 2023-06-03.
- ^ ا ب ج د Sai Srujan، A.V (2021). "Mineral Commodity Summaries 2021: Zinc" (PDF). United States Geological Survey. مؤرشف (PDF) من الأصل في 2023-06-03. اطلع عليه بتاريخ 2021-06-21.
- ^ "Zinc Recycling". International Zinc Association. مؤرشف من الأصل في 2011-10-21. اطلع عليه بتاريخ 2008-11-28.
- ^ "Country Partnership Strategy—Iran: 2011–12". ECO Trade and development bank. مؤرشف من الأصل في 2011-10-26. اطلع عليه بتاريخ 2011-06-06.
- ^ "IRAN – a growing market with enormous potential". IMRG. 5 يوليو 2010. مؤرشف من الأصل في 2013-02-17. اطلع عليه بتاريخ 2010-03-03.
- ^ Gordon، R. B.؛ Bertram, M.؛ Graedel, T. E. (2006). "Metal stocks and sustainability". Proceedings of the National Academy of Sciences. ج. 103 ع. 5: 1209–14. Bibcode:2006PNAS..103.1209G. DOI:10.1073/pnas.0509498103. PMC:1360560. PMID:16432205.
- ^ Gerst، Michael (2008). "In-Use Stocks of Metals: Status and Implications". Environmental Science and Technology. ج. 42 ع. 19: 7038–45. Bibcode:2008EnST...42.7038G. DOI:10.1021/es800420p. PMID:18939524.
- ^ Meylan، Gregoire (2016). "The anthropogenic cycle of zinc: Status quo and perspectives". Resources, Conservation and Recycling. ج. 123: 1–10. DOI:10.1016/j.resconrec.2016.01.006.
- ^ Jasinski، Stephen M. "Mineral Commodity Summaries 2007: Zinc" (PDF). United States Geological Survey. مؤرشف (PDF) من الأصل في 2008-12-17. اطلع عليه بتاريخ 2008-11-25.
- ^ Erickson، R. L. (1973). "Crustal Abundance of Elements, and Mineral Reserves and Resources". U.S. Geological Survey Professional Paper ع. 820: 21–25.
- ^ Tolcin، A. C. (2009). "Mineral Commodity Summaries 2009: Zinc" (PDF). United States Geological Survey. مؤرشف (PDF) من الأصل في 2016-07-02. اطلع عليه بتاريخ 2016-08-04.
- ^ Attwood، James (13 فبراير 2006). "Zinifex, Umicore Combine to Form Top Zinc Maker". The Wall Street Journal. مؤرشف من الأصل في 2017-01-26.
- ^ ا ب ج د Porter، Frank C. (1991). Zinc Handbook. CRC Press. ISBN:978-0-8247-8340-2. مؤرشف من الأصل في 2023-05-12.
- ^ ا ب ج Rosenqvist، Terkel (1922). Principles of Extractive Metallurgy (ط. 2nd). Tapir Academic Press. ص. 7, 16, 186. ISBN:978-82-519-1922-7.
- ^ Bodsworth، Colin (1994). The Extraction and Refining of Metals. CRC Press. ص. 148. ISBN:978-0-8493-4433-6.
- ^ Gupta، C. K.؛ Mukherjee, T. K. (1990). Hydrometallurgy in Extraction Processes. CRC Press. ص. 62. ISBN:978-0-8493-6804-2.
- ^ Antrekowitsch، Jürgen؛ Steinlechner، Stefan؛ Unger، Alois؛ Rösler، Gernot؛ Pichler، Christoph؛ Rumpold، Rene (2014)، "9. Zinc and Residue Recycling"، في Worrell، Ernst؛ Reuter، Markus (المحررون)، Handbook of Recycling: State-of-the-art for Practitioners, Analysts, and Scientists
- ^ ا ب Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A (بالإنجليزية), vol. 729, pp. 3–128, Bibcode:2003NuPhA.729....3A, DOI:10.1016/j.nuclphysa.2003.11.001, Archived from the original on 2017-08-09
- ^ ا ب ج Alejandro A. Sonzogni (Database Manager)، المحرر (2008). "Chart of Nuclides". Upton (NY): National Nuclear Data Center, Brookhaven National Laboratory. مؤرشف من الأصل في 2008-05-22. اطلع عليه بتاريخ 2008-09-13.
- ^ ا ب Heiserman 1992، صفحة 123
- ^ اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعHolleman - ^ Wells A.F. (1984) Structural Inorganic Chemistry 5th edition p 1277 Oxford Science Publications (ردمك 0-19-855370-6)
- ^ Scoffern، John (1861). The Useful Metals and Their Alloys. Houlston and Wright. ص. 591–603. مؤرشف من الأصل في 2022-10-19. اطلع عليه بتاريخ 2009-04-06.
- ^ ا ب "Zinc Metal Properties". American Galvanizers Association. 2008. مؤرشف من الأصل في 2015-03-28. اطلع عليه بتاريخ 2015-04-07.
- ^ Ingalls، Walter Renton (1902). "Production and Properties of Zinc: A Treatise on the Occurrence and Distribution of Zinc Ore, the Commercial and Technical Conditions Affecting the Production of the Spelter, Its Chemical and Physical Properties and Uses in the Arts, Together with a Historical and Statistical Review of the Industry". The Engineering and Mining Journal: 142–6. مؤرشف من الأصل في 2022-10-15.
- ^ Porter، Frank C. (1994). Corrosion Resistance of Zinc and Zinc Alloys. CRC Press. ص. 121. ISBN:978-0-8247-9213-8.
- ^ CRC 2006، صفحات 8–29
- ^ Hinds، John Iredelle Dillard (1908). Inorganic Chemistry: With the Elements of Physical and Theoretical Chemistry (ط. 2nd). New York: John Wiley & Sons. ص. 506–508. مؤرشف من الأصل في 2023-06-10.
- ^ ا ب ج د ه و ز ح Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). "Zink". Lehrbuch der Anorganischen Chemie (بالألمانية) (91–100 ed.). Walter de Gruyter. pp. 1034–1041. ISBN:978-3-11-007511-3.
- ^ CRC 2006، صفحات 12–11–12
- ^ ا ب Greenwood & Earnshaw 1997، صفحة 1206
- ^ Ritchie، Rob (2004). Chemistry (ط. 2nd). Letts and Lonsdale. ص. 71. ISBN:978-1-84315-438-9. مؤرشف من الأصل في 2023-06-10.
- ^ Burgess، John (1978). Metal ions in solution. New York: Ellis Horwood. ص. 147. ISBN:978-0-470-26293-1.
- ^ Housecroft، C. E.؛ Sharpe، A. G. (2008). Inorganic Chemistry (ط. 3rd). Prentice Hall. ص. 739–741. ISBN:978-0-13-175553-6.
- ^ Brady، James E.؛ Humiston, Gerard E.؛ Heikkinen, Henry (1983). General Chemistry: Principles and Structure (ط. 3rd). John Wiley & Sons. ص. 671. ISBN:978-0-471-86739-5.
- ^ Kaupp M.؛ Dolg M.؛ Stoll H.؛ Von Schnering H. G. (1994). "Oxidation state +IV in group 12 chemistry. Ab initio study of zinc(IV), cadmium(IV), and mercury(IV) fluorides". Inorganic Chemistry. ج. 33 ع. 10: 2122–2131. DOI:10.1021/ic00088a012. مؤرشف من الأصل في 2023-06-04.
- ^ Samanta، Devleena؛ Jena، Puru (2012). "Zn in the +III Oxidation State". Journal of the American Chemical Society. ج. 134 ع. 20: 8400–8403. DOI:10.1021/ja3029119. PMID:22559713. مؤرشف من الأصل في 2023-06-04.
- ^ Fang، Hong؛ Banjade، Huta؛ Deepika؛ Jena، Puru (2021). "Realization of the Zn3+ oxidation state". Nanoscale. ج. 13 ع. 33: 14041–14048. DOI:10.1039/D1NR02816B. PMID:34477685. S2CID:237400349.
- ^ Schlöder، Tobias؛ وآخرون (2012). "Can Zinc Really Exist in Its Oxidation State +III?". Journal of the American Chemical Society. ج. 134 ع. 29: 11977–11979. DOI:10.1021/ja3052409. PMID:22775535. مؤرشف من الأصل في 2023-06-04.
- ^ ا ب ج د Australian Government (30.06.2022). "Zinc and compounds". Department of Climate Change, Energy, the Environment and Water. مؤرشف من الأصل في 2023-06-04.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ Greenwood & Earnshaw 1997، صفحة 1208
- ^ Greenwood & Earnshaw 1997، صفحة 1211
- ^ "Zinc Sulfide". American Elements. مؤرشف من الأصل في 2012-07-17. اطلع عليه بتاريخ 2009-02-03.
- ^ Academic American Encyclopedia. Danbury, Connecticut: Grolier Inc. 1994. ص. 202. ISBN:978-0-7172-2053-3. مؤرشف من الأصل في 2023-06-06.
- ^ "Zinc Phosphide". American Elements. مؤرشف من الأصل في 2012-07-17. اطلع عليه بتاريخ 2009-02-03.
- ^ Shulzhenko AA، Ignatyeva IY، Osipov AS، Smirnova TI (2000). "Peculiarities of interaction in the Zn–C system under high pressures and temperatures". Diamond and Related Materials. ج. 9 ع. 2: 129–133. Bibcode:2000DRM.....9..129S. DOI:10.1016/S0925-9635(99)00231-9.
- ^ Perry، D. L. (1995). Handbook of Inorganic Compounds. CRC Press. ص. 448–458. ISBN:978-0-8493-8671-8.
- ^ Rappoport، Zvi؛ Marek، Ilan (ديسمبر 17, 2007). The Chemistry of Organozinc Compounds: R-Zn. ISBN:978-0-470-09337-5. مؤرشف من الأصل في أبريل 14, 2016.
- ^ Frankland, Edward (1849). "Notiz über eine neue Reihe organischer Körper, welche Metalle, Phosphor u. s. w. enthalten". Liebig's Annalen der Chemie und Pharmacie (بالألمانية). 71 (2): 213–216. DOI:10.1002/jlac.18490710206. Archived from the original on 2023-03-31.
- ^ Frankland, E. (1850). "On the isolation of the organic radicals". Quarterly Journal of the Chemical Society. ج. 2 ع. 3: 263. DOI:10.1039/QJ8500200263. مؤرشف من الأصل في 2023-06-04.
- ^ Overman، Larry E.؛ Carpenter، Nancy E. (2005). The Allylic Trihaloacetimidate Rearrangement. ج. 66. ص. 1–107. DOI:10.1002/0471264180.or066.01. ISBN:978-0-471-26418-7.
{{استشهاد بكتاب}}:|صحيفة=تُجوهل (مساعدة) - ^ Knochel، Paul؛ Jones، Philip (1999). Organozinc reagents: A practical approach. ISBN:978-0-19-850121-3. مؤرشف من الأصل في أبريل 14, 2016.
- ^ Herrmann، Wolfgang A. (يناير 2002). Synthetic Methods of Organometallic and Inorganic Chemistry: Catalysis. ISBN:978-3-13-103061-0. مؤرشف من الأصل في أبريل 14, 2016.
- ^ Lide، David (1998). CRC- Handbook of Chemistry and Physics. CRC press. ص. Section 8 Page 1. ISBN:978-0-8493-0479-8.
- ^ ا ب Maret، Wolfgang (2013). "Chapter 12. Zinc and Human Disease". في Astrid Sigel؛ Helmut Sigel؛ Roland K. O. Sigel (المحررون). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Springer. ج. 13. ص. 389–414. DOI:10.1007/978-94-007-7500-8_12. ISBN:978-94-007-7499-5. PMID:24470098.
- ^ ا ب ج د ه Prakash A، Bharti K، Majeed AB (أبريل 2015). "Zinc: indications in brain disorders". Fundam Clin Pharmacol. ج. 29 ع. 2: 131–149. DOI:10.1111/fcp.12110. PMID:25659970. S2CID:21141511.
- ^ ا ب ج د Cherasse Y، Urade Y (نوفمبر 2017). "Dietary Zinc Acts as a Sleep Modulator". International Journal of Molecular Sciences. ج. 18 ع. 11: 2334. DOI:10.3390/ijms18112334. PMC:5713303. PMID:29113075.
- ^ ا ب Prasad A. S. (2008). "Zinc in Human Health: Effect of Zinc on Immune Cells". Mol. Med. ج. 14 ع. 5–6: 353–7. PMC:2277319. PMID:18385818.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|لاdoi=تم تجاهله (مساعدة) - ^ ا ب ج د ه Broadley، M. R.؛ White, P. J.؛ Hammond, J. P.؛ Zelko I.؛ Lux A. (2007). "Zinc in plants". New Phytologist. ج. 173 ع. 4: 677–702. DOI:10.1111/j.1469-8137.2007.01996.x. PMID:17286818.
- ^ Zinc's role in microorganisms is particularly reviewed in: Sugarman B (1983). "Zinc and infection". Reviews of Infectious Diseases. ج. 5 ع. 1: 137–47. DOI:10.1093/clinids/5.1.137. PMID:6338570.
- ^ Cotton et al. 1999، صفحات 625–629
- ^ Plum، Laura؛ Rink، Lothar؛ Haase، Hajo (2010). "The Essential Toxin: Impact of Zinc on Human Health". Int J Environ Res Public Health. ج. 7 ع. 4: 1342–1365. DOI:10.3390/ijerph7041342. PMC:2872358. PMID:20617034.
- ^ ا ب ج اكتب عنوان المرجع بين علامتي الفتح
<ref>والإغلاق</ref>للمرجعHambridge2007 - ^ Djoko KY، Ong CL، Walker MJ، McEwan AG (يوليو 2015). "The Role of Copper and Zinc Toxicity in Innate Immune Defense against Bacterial Pathogens". The Journal of Biological Chemistry. ج. 290 ع. 31: 18954–61. DOI:10.1074/jbc.R115.647099. PMC:4521016. PMID:26055706.
Zn is present in up to 10% of proteins in the human proteome and computational analysis predicted that ~30% of these ~3000 Zn-containing proteins are crucial cellular enzymes, such as hydrolases, ligases, transferases, oxidoreductases, and isomerases (42,43).
- ^ ا ب ج Rink، L.؛ Gabriel P. (2000). "Zinc and the immune system". Proc Nutr Soc. ج. 59 ع. 4: 541–52. DOI:10.1017/S0029665100000781. PMID:11115789.
- ^ Wapnir، Raul A. (1990). Protein Nutrition and Mineral Absorption. Boca Raton, Florida: CRC Press. ISBN:978-0-8493-5227-0. مؤرشف من الأصل في 2023-04-04.
- ^ Berdanier، Carolyn D.؛ Dwyer, Johanna T.؛ Feldman, Elaine B. (2007). Handbook of Nutrition and Food. Boca Raton, Florida: CRC Press. ISBN:978-0-8493-9218-4. مؤرشف من الأصل في 2022-12-04.
- ^ Mittermeier، Lorenz؛ Gudermann، Thomas؛ Zakharian، Eleonora؛ Simmons، David G.؛ Braun، Vladimir؛ Chubanov، Masayuki؛ Hilgendorff، Anne؛ Recordati، Camilla؛ Breit، Andreas (15 فبراير 2019). "TRPM7 is the central gatekeeper of intestinal mineral absorption essential for postnatal survival". Proceedings of the National Academy of Sciences. ج. 116 ع. 10: 4706–4715. Bibcode:2019PNAS..116.4706M. DOI:10.1073/pnas.1810633116. ISSN:0027-8424. PMC:6410795. PMID:30770447.
- ^ Kasana، Shakhenabat؛ Din، Jamila؛ Maret، Wolfgang (يناير 2015). "Genetic causes and gene–nutrient interactions in mammalian zinc deficiencies: acrodermatitis enteropathica and transient neonatal zinc deficiency as examples". Journal of Trace Elements in Medicine and Biology. ج. 29: 47–62. DOI:10.1016/j.jtemb.2014.10.003. ISSN:1878-3252. PMID:25468189.
- ^ Yokel، R. A. (2006). "Blood-brain barrier flux of aluminum, manganese, iron and other metals suspected to contribute to metal-induced neurodegeneration". Journal of Alzheimer's Disease. ج. 10 ع. 2–3: 223–53. DOI:10.3233/JAD-2006-102-309. PMID:17119290.
- ^ Brandt، Erik G.؛ Hellgren، Mikko؛ Brinck، Tore؛ Bergman، Tomas؛ Edholm، Olle (2009). "Molecular dynamics study of zinc binding to cysteines in a peptide mimic of the alcohol dehydrogenase structural zinc site". Phys. Chem. Chem. Phys. ج. 11 ع. 6: 975–83. Bibcode:2009PCCP...11..975B. DOI:10.1039/b815482a. PMID:19177216. مؤرشف من الأصل في 2023-05-24.
- ^ ا ب Bitanihirwe BK، Cunningham MG (نوفمبر 2009). "Zinc: the brain's dark horse". Synapse. ج. 63 ع. 11: 1029–1049. DOI:10.1002/syn.20683. PMID:19623531. S2CID:206520330.
- ^ Nakashima AS؛ Dyck RH (2009). "Zinc and cortical plasticity". Brain Res Rev. ج. 59 ع. 2: 347–73. DOI:10.1016/j.brainresrev.2008.10.003. PMID:19026685. S2CID:22507338.
- ^ Tyszka-Czochara M، Grzywacz A، Gdula-Argasińska J، Librowski T، Wiliński B، Opoka W (مايو 2014). "The role of zinc in the pathogenesis and treatment of central nervous system (CNS) diseases. Implications of zinc homeostasis for proper CNS function" (PDF). Acta Pol. Pharm. ج. 71 ع. 3: 369–377. PMID:25265815. مؤرشف (PDF) من الأصل في أغسطس 29, 2017.
- ^ ا ب ج د ه و Institute of Medicine (2001). "Zinc". Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, DC: National Academy Press. ص. 442–501. DOI:10.17226/10026. ISBN:978-0-309-07279-3. PMID:25057538. مؤرشف من الأصل في 2017-09-19.
- ^ Stipanuk، Martha H. (2006). Biochemical, Physiological & Molecular Aspects of Human Nutrition. W. B. Saunders Company. ص. 1043–1067. ISBN:978-0-7216-4452-3.
- ^ ا ب Greenwood & Earnshaw 1997، صفحات 1224–1225
- ^ Kohen، Amnon؛ Limbach, Hans-Heinrich (2006). Isotope Effects in Chemistry and Biology. Boca Raton, Florida: CRC Press. ص. 850. ISBN:978-0-8247-2449-8. مؤرشف من الأصل في 2022-12-04.
- ^ ا ب Greenwood & Earnshaw 1997، صفحة 1225
- ^ Gadallah، MA (2000). "Effects of indole-3-acetic acid and zinc on the growth, osmotic potential and soluble carbon and nitrogen components of soybean plants growing under water deficit". Journal of Arid Environments. ج. 44 ع. 4: 451–467. Bibcode:2000JArEn..44..451G. DOI:10.1006/jare.1999.0610.
- ^ Cotton et al. 1999، صفحة 628
- ^ Cotton et al. 1999، صفحة 629
- ^ Blake، Steve (2007). Vitamins and Minerals Demystified. McGraw-Hill Professional. ص. 242. ISBN:978-0-07-148901-0.
- ^ Whitney، Eleanor Noss؛ Rolfes, Sharon Rady (2005). Understanding Nutrition (ط. 10th). Thomson Learning. ص. 447–450. ISBN:978-1-4288-1893-4.
- ^ ا ب Fosmire، G. J. (1990). "Zinc toxicity". American Journal of Clinical Nutrition. ج. 51 ع. 2: 225–7. DOI:10.1093/ajcn/51.2.225. PMID:2407097.
- ^ Ziliotto، Silvia؛ Ogle، Olivia؛ Yaylor، Kathryn M. (2018). "Chapter 17. Targeting Zinc(II) Signalling to Prevent Cancer". في Sigel، Astrid؛ Sigel، Helmut؛ Freisinger، Eva؛ Sigel، Roland K. O. (المحررون). Metallo-Drugs: Development and Action of Anticancer Agents. Berlin: de Gruyter GmbH. ج. 18. ص. 507–529. DOI:10.1515/9783110470734-023. ISBN:9783110470734. PMID:29394036.
{{استشهاد بكتاب}}:|صحيفة=تُجوهل (مساعدة) - ^ Hershfinkel، M؛ Silverman WF؛ Sekler I (2007). "The Zinc Sensing Receptor, a Link Between Zinc and Cell Signaling". Molecular Medicine. ج. 13 ع. 7–8: 331–336. DOI:10.2119/2006-00038.Hershfinkel. PMC:1952663. PMID:17728842.
- ^ Krause J (2008). "SPECT and PET of the dopamine transporter in attention-deficit/hyperactivity disorder". Expert Rev. Neurother. ج. 8 ع. 4: 611–625. DOI:10.1586/14737175.8.4.611. PMID:18416663. S2CID:24589993.
- ^ Sulzer D (2011). "How addictive drugs disrupt presynaptic dopamine neurotransmission". Neuron. ج. 69 ع. 4: 628–649. DOI:10.1016/j.neuron.2011.02.010. PMC:3065181. PMID:21338876.
- ^ ا ب Scholze P، Nørregaard L، Singer EA، Freissmuth M، Gether U، Sitte HH (2002). "The role of zinc ions in reverse transport mediated by monoamine transporters". J. Biol. Chem. ج. 277 ع. 24: 21505–21513. DOI:10.1074/jbc.M112265200. PMID:11940571.
- ^ ا ب ج د Emsley 2001، صفحة 504
- ^ Geoffrey Michael Gadd (مارس 2010). "Metals, minerals and microbes: geomicrobiology and bioremediation". Microbiology. ج. 156 ع. 3: 609–643. DOI:10.1099/mic.0.037143-0. PMID:20019082. مؤرشف من الأصل في 2014-10-25.
- ^ Ensminger، Audrey H.؛ Konlande, James E. (1993). Foods & Nutrition Encyclopedia (ط. 2nd). Boca Raton, Florida: CRC Press. ص. 2368–2369. ISBN:978-0-8493-8980-1. مؤرشف من الأصل في 2023-06-23.
- ^ "Zinc content of selected foods per common measure" (PDF). USDA National Nutrient Database for Standard Reference, Release 20. United States Department of Agriculture. مؤرشف من الأصل (PDF) في 2009-03-05. اطلع عليه بتاريخ 2007-12-06.
- ^ Rosado، J. L. (2003). "Zinc and copper: proposed fortification levels and recommended zinc compounds". Journal of Nutrition. ج. 133 ع. 9: 2985S–9S. DOI:10.1093/jn/133.9.2985S. PMID:12949397.
- ^ Hotz، C.؛ DeHaene, J.؛ Woodhouse, L. R.؛ Villalpando, S.؛ Rivera, J. A.؛ King, J. C. (2005). "Zinc absorption from zinc oxide, zinc sulfate, zinc oxide + EDTA, or sodium-zinc EDTA does not differ when added as fortificants to maize tortillas". Journal of Nutrition. ج. 135 ع. 5: 1102–5. DOI:10.1093/jn/135.5.1102. PMID:15867288.
- ^ Allen، Lindsay H. (1998). "Zinc and micronutrient supplements for children". American Journal of Clinical Nutrition. ج. 68 ع. 2 Suppl: 495S–498S. DOI:10.1093/ajcn/68.2.495S. PMID:9701167.
- ^ ا ب ج Prasad، AS (2003). "Zinc deficiency : Has been known of for 40 years but ignored by global health organisations". British Medical Journal. ج. 326 ع. 7386: 409–410. DOI:10.1136/bmj.326.7386.409. PMC:1125304. PMID:12595353.
- ^ ا ب American Dietetic Association (2003). "Position of the American Dietetic Association and Dietitians of Canada: Vegetarian diets" (PDF). Journal of the American Dietetic Association. ج. 103 ع. 6: 748–765. DOI:10.1053/jada.2003.50142. PMID:12778049. مؤرشف (PDF) من الأصل في 2017-01-14.
- ^ WHO: Zinc in Drinking-water – Background document for development of WHO Guidelines for Drinking-water Quality (PDF; 152 kB) نسخة محفوظة 2023-06-27 على موقع واي باك مشين.
- ^ "Overview on Dietary Reference Values for the EU population as derived by the EFSA Panel on Dietetic Products, Nutrition and Allergies" (PDF). 2017. مؤرشف (PDF) من الأصل في أغسطس 28, 2017.
- ^ Tolerable Upper Intake Levels For Vitamins And Minerals (PDF)، European Food Safety Authority، 2006، مؤرشف (PDF) من الأصل في مارس 16, 2016
- ^ Hayley Willacy (26 Apr 2019). "Zinc Deficiency, Excess and Supplementation. Zinc problems". Patient UK (بالإنجليزية). Retrieved 2021-01-28.
- ^ "Bioverfügbarkeit von Zinkpräparaten". deutsche-apotheker-zeitung.de. 17 سبتمبر 2020. اطلع عليه بتاريخ 2021-10-25.
- ^ Roberts، Eve A.؛ Schilsky، Michael L. (2003). "A practice guideline on Wilson disease". Hepatology. ج. 37 ع. 6: 1475–92. DOI:10.1053/jhep.2003.50252. PMID:12774027. S2CID:263620.
- ^ Bhutta ZA، Bird SM، Black RE، Brown KH، Gardner JM، Hidayat A، Khatun F، Martorell R، وآخرون (2000). "Therapeutic effects of oral zinc in acute and persistent diarrhea in children in developing countries: pooled analysis of randomized controlled trials". The American Journal of Clinical Nutrition. ج. 72 ع. 6: 1516–1522. DOI:10.1093/ajcn/72.6.1516. PMID:11101480.
- ^ Aydemir، T. B.؛ Blanchard, R. K.؛ Cousins, R. J. (2006). "Zinc supplementation of young men alters metallothionein, zinc transporter, and cytokine gene expression in leukocyte populations". PNAS. ج. 103 ع. 6: 1699–704. Bibcode:2006PNAS..103.1699A. DOI:10.1073/pnas.0510407103. PMC:1413653. PMID:16434472.
- ^ Valko، M.؛ Morris, H.؛ Cronin, M. T. D. (2005). "Metals, Toxicity and Oxidative stress" (PDF). Current Medicinal Chemistry. ج. 12 ع. 10: 1161–208. DOI:10.2174/0929867053764635. PMID:15892631. مؤرشف من الأصل (PDF) في 2017-08-08.
- ^ Meenu Singh, Rashmi R Das: Zinc for the common cold. In: Cochrane Database of Systematic Reviews. doi:10.1002/14651858.CD001364.pub5
- ^ T. J. Caruso, C. G. Prober, J. M. Gwaltney: Treatment of naturally acquired common colds with zinc: a structured review. In: Clin. Infect. Dis. 45, Nr. 5, September 2007, S. 569–574. doi:10.1086/520031. PMID 17682990
- ^ I. Marshall: Zinc for the common cold. In: Cochrane Database Syst Rev. Nr. 2, 2000, S. CD001364. doi:10.1002/14651858.CD001364. PMID 10796643
- ^ J. Hunter, S. Arentz, J. Goldenberg und andere, "Zinc for the prevention or treatment of acute viral respiratory tract infections in adults: a rapid systematic review and meta-analysis of randomised controlled trials" (in German), BMJ Open (11), doi:10.1136/bmjopen-2020-047474
- ^ Santos HO، Teixeira FJ، Schoenfeld BJ (2019). "Dietary vs. pharmacological doses of zinc: A clinical review". Clin Nutr. ج. 130 ع. 5: 1345–1353. DOI:10.1016/j.clnu.2019.06.024. PMID:31303527. S2CID:196616666.
- ^ DiSilvestro، Robert A. (2004). Handbook of Minerals as Nutritional Supplements. CRC Press. ص. 135, 155. ISBN:978-0-8493-1652-4.
- ^ Sanchez، Juliana (13 فبراير 2013). Zinc Sulphate vs. Zinc Amino Acid Chelate (ZAZO) (Report). USA Government. NCT01791608. مؤرشف من الأصل في 2022-04-06. اطلع عليه بتاريخ 2022-04-06 – عبر U.S. National Library of Medecine.
- ^ Mayo-Wilson، E؛ Junior، JA؛ Imdad، A؛ Dean، S؛ Chan، XH؛ Chan، ES؛ Jaswal، A؛ Bhutta، ZA (15 مايو 2014). "Zinc supplementation for preventing mortality, morbidity, and growth failure in children aged 6 months to 12 years of age". The Cochrane Database of Systematic Reviews ع. 5: CD009384. DOI:10.1002/14651858.CD009384.pub2. PMID:24826920.
- ^ "The impact of zinc supplementation on childhood mortality and severe morbidity". World Health Organization. 2007. مؤرشف من الأصل في 2009-03-02.
- ^ Shrimpton، R؛ Gross R؛ Darnton-Hill I؛ Young M (2005). "Zinc deficiency: what are the most appropriate interventions?". British Medical Journal. ج. 330 ع. 7487: 347–349. DOI:10.1136/bmj.330.7487.347. PMC:548733. PMID:15705693.
- ^ Moshfegh, Alanna؛ Goldman, Joseph؛ Cleveland, Linda (2005). "NHANES 2001–2002: Usual Nutrient Intakes from Food Compared to Dietary Reference Intakes" (PDF). U.S. Department of Agriculture, Agricultural Research Service. Table A13: Zinc. مؤرشف من الأصل (PDF) في 2023-07-06. اطلع عليه بتاريخ 2015-01-06.
- ^ What We Eat In America, NHANES 2013–2014 نسخة محفوظة February 24, 2017, على موقع واي باك مشين..
- ^ Freeland-Graves JH؛ Bodzy PW؛ Epright MA (1980). "Zinc status of vegetarians". Journal of the American Dietetic Association. ج. 77 ع. 6: 655–661. DOI:10.1016/S1094-7159(21)03587-X. PMID:7440860. S2CID:8424197.
- ^ Ibs، KH؛ Rink L (2003). "Zinc-altered immune function". Journal of Nutrition. ج. 133 ع. 5 Suppl 1: 1452S–1456S. DOI:10.1093/jn/133.5.1452S. PMID:12730441.
- ^ Johnson AR؛ Munoz A؛ Gottlieb JL؛ Jarrard DF (2007). "High dose zinc increases hospital admissions due to genitourinary complications". J. Urol. ج. 177 ع. 2: 639–43. DOI:10.1016/j.juro.2006.09.047. PMID:17222649.
- ^ ا ب CRC 2006، صفحة 4-42
- ^ Bothwell، Dawn N.؛ Mair, Eric A.؛ Cable, Benjamin B. (2003). "Chronic Ingestion of a Zinc-Based Penny". Pediatrics. ج. 111 ع. 3: 689–91. DOI:10.1542/peds.111.3.689. PMID:12612262.
- ^ Barceloux، Donald G.؛ Barceloux, Donald (1999). "Zinc". Clinical Toxicology. ج. 37 ع. 2: 279–292. DOI:10.1081/CLT-100102426. PMID:10382562.
- ^ Bennett، Daniel R. M. D.؛ Baird, Curtis J. M.D.؛ Chan, Kwok-Ming؛ Crookes, Peter F.؛ Bremner, Cedric G.؛ Gottlieb, Michael M.؛ Naritoku, Wesley Y. M.D. (1997). "Zinc Toxicity Following Massive Coin Ingestion". American Journal of Forensic Medicine and Pathology. ج. 18 ع. 2: 148–153. DOI:10.1097/00000433-199706000-00008. PMID:9185931.
- ^ Fernbach، S. K.؛ Tucker G. F. (1986). "Coin ingestion: unusual appearance of the penny in a child". Radiology. ج. 158 ع. 2: 512. DOI:10.1148/radiology.158.2.3941880. PMID:3941880.
- ^ Stowe، C. M.؛ Nelson، R.؛ Werdin، R.؛ Fangmann، G.؛ Fredrick، P.؛ Weaver، G.؛ Arendt، T. D. (1978). "Zinc phosphide poisoning in dogs". Journal of the American Veterinary Medical Association. ج. 173 ع. 3: 270. PMID:689968.
- ^ Reece، R. L.؛ Dickson, D. B.؛ Burrowes, P. J. (1986). "Zinc toxicity (new wire disease) in aviary birds". Australian Veterinary Journal. ج. 63 ع. 6: 199. DOI:10.1111/j.1751-0813.1986.tb02979.x. PMID:3767804.
- ^ Kucha، H.؛ Martens, A.؛ Ottenburgs, R.؛ De Vos, W.؛ Viaene, W. (1996). "Primary minerals of Zn-Pb mining and metallurgical dumps and their environmental behavior at Plombières, Belgium". Environmental Geology. ج. 27 ع. 1: 1–15. Bibcode:1996EnGeo..27....1K. DOI:10.1007/BF00770598. S2CID:129717791.
- ^ Heath، Alan G. (1995). Water pollution and fish physiology. Boca Raton, Florida: CRC Press. ص. 57. ISBN:978-0-87371-632-1. مؤرشف من الأصل في 2023-05-18.
- ^ Eisler، Ronald (1993). "Zinc Hazard to Fish, Wildlife, and Invertebrates: A Synoptic Review". Contaminant Hazard Reviews. Laurel, Maryland: U.S. Department of the Interior, Fish and Wildlife Service ع. 10. مؤرشف (PDF) من الأصل في 2012-03-06.
- ^ Muyssen، Brita T. A.؛ De Schamphelaere، Karel A. C.؛ Janssen، Colin R. (2006). "Mechanisms of chronic waterborne Zn toxicity in Daphnia magna". Aquatic Toxicology. ج. 77 ع. 4: 393–401. DOI:10.1016/j.aquatox.2006.01.006. PMID:16472524.
- ^ ا ب ج "Zinc: World Mine Production (zinc content of concentrate) by Country" (PDF). 2009 Minerals Yearbook: Zinc. Washington, D.C.: United States Geological Survey. فبراير 2010. مؤرشف (PDF) من الأصل في 2011-06-08. اطلع عليه بتاريخ 2001-06-06.
- ^ Greenwood & Earnshaw 1997، صفحة 1203
- ^ ا ب Stwertka 1998، صفحة 99
- ^ ا ب ج د ه Lehto 1968، صفحة 829
- ^ ا ب Emsley 2001، صفحة 503
- ^ Bounoughaz، M.؛ Salhi, E.؛ Benzine, K.؛ Ghali E.؛ Dalard F. (2003). "A comparative study of the electrochemical behaviour of Algerian zinc and a zinc from a commercial sacrificial anode". Journal of Materials Science. ج. 38 ع. 6: 1139–1145. Bibcode:2003JMatS..38.1139B. DOI:10.1023/A:1022824813564. S2CID:135744939.
- ^ Besenhard، Jürgen O. (1999). Handbook of Battery Materials. Wiley-VCH. Bibcode:1999hbm..book.....B. ISBN:978-3-527-29469-5.
- ^ Wiaux، J.-P.؛ Waefler, J. -P. (1995). "Recycling zinc batteries: an economical challenge in consumer waste management". Journal of Power Sources. ج. 57 ع. 1–2: 61–65. Bibcode:1995JPS....57...61W. DOI:10.1016/0378-7753(95)02242-2.
- ^ Culter، T. (1996). "A design guide for rechargeable zinc–air battery technology". Southcon/96. Conference Record. ص. 616. DOI:10.1109/SOUTHC.1996.535134. ISBN:978-0-7803-3268-3. S2CID:106826667.
- ^ Whartman، Jonathan؛ Brown, Ian. "Zinc Air Battery-Battery Hybrid for Powering Electric Scooters and Electric Buses" (PDF). The 15th International Electric Vehicle Symposium. مؤرشف من الأصل (PDF) في 2006-03-12. اطلع عليه بتاريخ 2008-10-08.
- ^ Cooper، J. F.؛ Fleming, D.؛ Hargrove, D.؛ Koopman, R.؛ Peterman, K (1995). "A refuelable zinc/air battery for fleet electric vehicle propulsion". NASA Sti/Recon Technical Report N. Society of Automotive Engineers future transportation technology conference and exposition. ج. 96: 11394. Bibcode:1995STIN...9611394C. OSTI:82465.
- ^ Xie، Z.؛ Liu، Q.؛ Chang، Z.؛ Zhang، X. (2013). "The developments and challenges of cerium half-cell in zinc–cerium redox flow battery for energy storage". Electrochimica Acta. ج. 90: 695–704. DOI:10.1016/j.electacta.2012.12.066.
- ^ Bush، Douglas Earl؛ Kassel, Richard (2006). The Organ: An Encyclopedia. Routledge. ص. 679. ISBN:978-0-415-94174-7. مؤرشف من الأصل في 2023-06-30.
- ^ McClane, Albert Jules & Gardner, Keith (1987). The Complete book of fishing: a guide to freshwater, saltwater & big-game fishing. Gallery Books. ISBN:978-0-8317-1565-6. مؤرشف من الأصل في 2012-11-15. اطلع عليه بتاريخ 2012-06-26.
- ^ "Coin Specifications". United States Mint. مؤرشف من الأصل في 2015-02-18. اطلع عليه بتاريخ 2008-10-08.
- ^ Jasinski، Stephen M. "Mineral Yearbook 1994: Zinc" (PDF). United States Geological Survey. مؤرشف (PDF) من الأصل في 2008-10-29. اطلع عليه بتاريخ 2008-11-13.
- ^ "Diecasting Alloys". Maybrook, NY: Eastern Alloys. مؤرشف من الأصل في 2008-12-25. اطلع عليه بتاريخ 2009-01-19.
- ^ Apelian، D.؛ Paliwal, M.؛ Herrschaft, D. C. (1981). "Casting with Zinc Alloys". Journal of Metals. ج. 33 ع. 11: 12–19. Bibcode:1981JOM....33k..12A. DOI:10.1007/bf03339527.
- ^ Davies, Geoff (2003). Materials for automobile bodies. Butterworth-Heinemann. ص. 157. ISBN:978-0-7506-5692-4. مؤرشف من الأصل في 2022-05-05.
- ^ Samans، Carl Hubert (1949). Engineering Metals and Their Alloys. Macmillan Co.
- ^ Porter، Frank (1994). "Wrought Zinc". Corrosion Resistance of Zinc and Zinc Alloys. CRC Press. ص. 6–7. ISBN:978-0-8247-9213-8.
- ^ Katz، Johnathan I. (2002). The Biggest Bangs. Oxford University Press. ص. 18. ISBN:978-0-19-514570-0.
- ^ ا ب Boudreaux، Kevin A. "Zinc + Sulfur". Angelo State University. مؤرشف من الأصل في 2008-12-02. اطلع عليه بتاريخ 2008-10-08.
- ^ Łowicki، Daniel؛ Baś, Sebastian؛ Mlynarski, Jacek (2015). "Chiral zinc catalysts for asymmetric synthesis". Tetrahedron. ج. 71 ع. 9: 1339–1394. DOI:10.1016/j.tet.2014.12.022.
- ^ Win، David Tin؛ Masum, Al (2003). "Weapons of Mass Destruction" (PDF). Assumption University Journal of Technology. Assumption University. ج. 6 ع. 4: 199. مؤرشف (PDF) من الأصل في 2009-03-26. اطلع عليه بتاريخ 2009-04-06.
- ^ David E. Newton (1999). Chemical Elements: From Carbon to Krypton. U. X. L. /Gale. ISBN:978-0-7876-2846-8. مؤرشف من الأصل في 2008-07-10. اطلع عليه بتاريخ 2009-04-06.
- ^ Zhang، Xiaoge Gregory (1996). Corrosion and Electrochemistry of Zinc. Springer. ص. 93. ISBN:978-0-306-45334-2. مؤرشف من الأصل في 2022-08-16.
- ^ Weimer، Al (17 مايو 2006). "Development of Solar-powered Thermochemical Production of Hydrogen from Water" (PDF). U.S. Department of Energy. مؤرشف (PDF) من الأصل في 2009-02-05. اطلع عليه بتاريخ 2009-01-10.
- ^ ا ب Heiserman 1992، صفحة 124
- ^ Blew، Joseph Oscar (1953). "Wood preservatives" (PDF). Department of Agriculture, Forest Service, Forest Products Laboratory. hdl:1957/816. مؤرشف (PDF) من الأصل في 2012-01-14.
- ^ Paschotta، Rüdiger (2008). Encyclopedia of Laser Physics and Technology. Wiley-VCH. ص. 798. ISBN:978-3-527-40828-3. مؤرشف من الأصل في 2022-08-30.
- ^ Konstantinou، I. K.؛ Albanis, T. A. (2004). "Worldwide occurrence and effects of antifouling paint booster biocides in the aquatic environment: a review". Environment International. ج. 30 ع. 2: 235–248. DOI:10.1016/S0160-4120(03)00176-4. PMID:14749112.
- ^ Ullmann's Agrochemicals. Wiley-Vch (COR). 2007. ص. 591–592. ISBN:978-3-527-31604-5. مؤرشف من الأصل في 2022-08-30.
- ^ Walker، J. C. F. (2006). Primary Wood Processing: Principles and Practice. Springer. ص. 317. ISBN:978-1-4020-4392-5.
المعلومات الكاملة للمصادر
[عدل]| H | He | |||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||
![{\displaystyle {\ce {2ZnS + 3O2 ->[T] 2ZnO + 2SO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ac8656a0a4a37c51caa12c15ce4fbd6273de0a3f)
![{\displaystyle {\ce {ZnO + C ->[950^oC] Zn + CO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1592f63fc0ae67a24850c33381264f5ca6bd1f55)
![{\displaystyle {\ce {ZnO + CO ->[950^oC] Zn + CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ab85d04dfa0b8e0280b72062a5ecbe660fd247b1)

