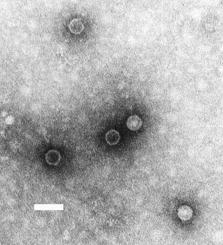
فيروسة سنجابية
الفيروسة السنجابية | |
|---|---|
| تصنيف الفيروسات | |
| المجموعة: | فيروسات الرنا |
| الرتبة: | بيكورناويات |
| الفصيلة: | فيروسات بيكورناوية |
| الجنس: | فيروس معوي |
| الاسم العلمي | |
| Poliovirus | |
| نوع نمطي | |
| Human enterovirus C |
|
| Species | |
| Human enterovirus C[1] | |
| تعديل مصدري - تعديل | |
الفيروسة السنجابية أو فيروس شلل الأطفال (بالإنجليزية: Poliovirus) هو العامل المسبب لشلل الأطفال، هو فيروس معوي بشري وأحد أعضاء عائلة الفيروسات البيكورناوية.[2]
يتكون فيروس شلل الأطفال poliovirus من حمض نووي ريبوزي RNA genome وقفيصة بروتين protein capsid. الجينوم أحادي السلسلة ذو إتجاه إيجابي يبلغ طوله حوالي 7500 نيوكليوتيدة.[3] يبلغ قطر الجسيم الفيروسي حوالي 30 نانومتر مع تناظر عشروني الوجوه. نظرا لحمضه النووي القصير وتكوينه البسيط (فقط الحمض النووي الريبوزي وغطاء بروتين عشروني الوجوه غير المغلف الذي يحيط به)، يعتبر فيروس شلل الأطفال على نطاق واسع أبسط فيروس هام.[4]
تم عزل فيروس شلل الأطفال لأول مرة في عام 1909 من قبل كارل لاندشتاينر وإرفين بوبر.[5] في عام 1981، تم نشر جينوم فيروس شلل الأطفال من قبل فريقين مختلفين من الباحثين: من قبل فينسنت راكانيللو وديفيد بالتيمور في معهد ماساتشوستس للتكنولوجيا (MIT)[6] ونايومي كيتامورا وإيكارد ويمر في جامعة ستوني بروك.[7] يعد فيروس شلل الأطفال أحد أكثر الفيروسات تميزًا، وقد أصبح نظامًا نموذجًا مفيدًا لفهم بيولوجيا فيروسات الرنا.
دورة النسخ
[عدل]يصيب فيروس شلل الأطفال الخلايا البشرية عن طريق الارتباط بمستقبل يشبه الغلوبولين المناعي، CD155 (المعروف أيضا باسم مستقبل فيروس شلل الأطفال (PVR))[8][9] على سطح الخلية.[10] يعمل تفاعل فيروس شلل الأطفال وCD155 على تغيير تكويني لا رجعة فيه للجسيمات الفيروسية اللازمة للدخول الفيروسي.[11][12] كان من المفترض أن يكون دخول الحمض النووي الفيروسي، المرتبط بغشاء الخلية المضيفة، واحدًا من طريقتين: عن طريق تكوين مسام في غشاء البلازما يتم من خلاله حقن «الحمض النووي الريبوزي» في سيتوبلازم الخلية المضيفة، أو ينتقل الفيروس بوساطة مستقبلات الالتقام.[13] تدعم الأدلة التجريبية الحديثة الفرضية الأخيرة وتشير إلى أن فيروس شلل الأطفال يرتبط بـ CD155 ويتم تناوله عن طريق الالتقام. مباشرة بعد الاستيعاب الداخلي للجسيمات، يتم إطلاق الحمض النووي الريبي الفيروسي.
فيروس شلل الأطفال هو فيروس رنا السلسلة موجب. وهكذا، يمكن استخدام الجينوم المغلق داخل الجسيمات الفيروسية على هيئة رنا مرسال، وترجمته الخلية المضيفة على الفور. عند الدخول، يقوم الفيروس باختراق آلية ترجمة الخلية، مما يؤدي إلى تثبيط تخليق البروتين الخلوي لصالح إنتاج البروتين الخاص بالفيروسات.[14] على عكس مرسال الرنا للخلية المضيفة، فإن نهاية 5 'RNA من فيروس شلل الأطفال طويلة للغاية - أكثر من 700 نيوكليوتيدة - ومهيكلة للغاية. وتسمى هذه المنطقة من الجينوم الفيروسي موقع دخول الريبوسوم الداخلي (IRES)، وتوجه ترجمة الرنا الفيروسي. الطفرات الجينية في هذه المنطقة تمنع إنتاج البروتين الفيروسي.[15][16][17] أول IRES يتم اكتشافه كان في الفيروسة السنجابية.[18]
يتم ترجمة مرسال الرنا لفيروس شلل الأطفال كمتعدد بيبتيدات (بوليبيبتيد) طويلا واحدا. ثم يتم انقسامه ذاتيا هذا البوليببتيد عن طريق انزيمات البروتياز الداخلية إلى حوالي 10 بروتينات فيروسية فردية. ليست كل الانقسامات تحدث بنفس الكفاءة. ولذلك، تختلف كميات البروتينات الناتجة عن انقسام بوليبيبتيد: على سبيل المثال، يتم إنتاج كميات صغيرة من ثلاثي البولى ثلاثي الأطوار 3Dpol من تلك البروتينات القفيصة، VP1-4.[19] هذه البروتينات الفيروسية الفردية هي: [4][20]
- 3Dpol ، بوليميراز الرنا المعتمدة على الرنا، وتتمثل وظيفته في عمل نسخ متعددة من حمض الرنا الفيروسي
- 2Apro و3C pro / 3CDpro، وهي بروتيازات تشطر بوليبيبتيد الفيروسي
- (VPg (3B، وهو بروتين صغير يربط الرنا الفيروسي وهو ضروري لتصنيع الحمض النووي الريبي الإيجابي والسلبي
- ATPase)2BC، 2B، 2C)[21]، 3AB، 3A، 3B البروتينات التي تكون المعقد البروتيني اللازم لتناسخ الفيروس
- .VP0، والذي يشطر لاحقا إلى VP2 وVP4، VP1 وVP3، بروتينات القفيصة الفيروسية
بعد الترجمة، يتم تحقيق النسخ وتكرار الجينوم الذي ينطوي على عملية واحدة (تخليق رنا (+)). لتكرار (+) الحمض النووي الريبي، يجب نسخ نسخ متعددة من (-) الحمض النووي الريبي ثم استخدامها كقوالب ل (+) تخليق الحمض النووي الريبي. إن المركبات الوسيطة التكاثرية (RIS) التي هي عبارة عن رابطة لجزيئات RNA تتكون من قالب رنا والعديد من RNAs النامية بطول متباين، تظهر في كل من مجمعات النسخ المتماثلة لـ (-) RNAs و (+) RNAs
البادئ لتصنيع سلسله (+) و (-) هو البروتين الصغير VPG، في مجموعة الهيدروكسيل من بقايا التيروزين بواسطة بوليميراز الرنا للفيروس السنجابي في عنصر النسخ المتماثل cis الموجود في حلقة الجذعية في جينوم الفيروس. يتم استخدام بعض من (+) جزيئات الحمض النووي الريبي كما قوالب لمزيد من التوليف (-) الحمض النووي الريبي، بعضه يخصص كمرسال رنا، وبعضها مقدرة لتكون جينومات للفيري النسل.
في تجميع جسيمات فيروسات جديدة (بمعنى تغليف جينوم النسل إلى بروكابسيد (قفيصه بدائية) يمكن أن يبقى خارج الخلية المضيفة)، بما في ذلك على التوالي:[22] خمس نسخ لكل من VP0، VP3، وVP1 التي يشكل السطح الداخلي لها من الـ N termini وVP4 السطح القفيضي، تتجمع في «شكلا خماسيا يسمى بنتامير» و12 بنتامير تشكل بادئ قفيصة. (يتكون السطح الخارجي من القفيصة من VP1، VP2، VP3 ؛ C termini من VP1 وVP3 تشكل الأخاديد التي حول كل من القمم؛ في هذا الوقت تقطع 60 نسخة من VP0 إلى VP4 وVP2.)
كل بروكابسيد يكتسب نسخة من الجينوم الفيروس، مع VPG لا تزال تعلق في نهاية 5 '.فيروس شلل الأطفال المتجمع بالكامل يترك حدود الخلية المضيفة له عن طريق التحلل[23] من 4 إلى 6 ساعات بعد بدء العدوى في خلايا الثدييات المستزرعة.[24] آلية إطلاق الفيروس من الخلية غير واضحة، ولكن كل خلية تموت يمكن أن تطلق ما يصل إلى 10000فيريون سينجابي. أثبت دريك أن فيروس شلل الأطفال قادر على الخضوع لإعادة تنشيط التعددية.[25] أي أنه عندما يتم تشعيع فيروسات شلل الأطفال مع ضوء الأشعة فوق البنفسجية ويسمح له بالعدوى المتعددة للخلايا المضيفة، يمكن تكوين ذرية قابلة للحياة حتى عند جرعات الأشعة فوق البنفسجية التي تثبط الفيروس في حالات العدوى الواحدة.
وتستخدم سلالات محددة من كل نمط مصلي لإعداد لقاحات ضد شلل الأطفال. يتم إعداد لقاح شلل الأطفال غير النشط بالفورمالين المعطل، وهو تعطيل ثلاثة سلالات مرجعية برية وخبيثة، أو ماهوني أو برونسندرز (PV1)، وMEF-1 / Lansing (PV2)، وSaukett / Leon (PV3). يحتوي لقاح شلل الأطفال الفموي على سلالات موهنة حية (ضعيفة) من الأنماط المصلية الثلاثة لفيروس شلل الأطفال. يؤدي تمرير سلالات الفيروس في الخلايا الطلائية للكلى القرد إلى حدوث طفرات في IRES الفيروسية، ويعوق (أو يضعف) قدرة الفيروس على إصابة الأنسجة العصبية.
تم تصنيف فيروسات شلل الأطفال سابقاً كنوع ممميز ينتمي إلى جنس الفيروسة المعوية في عائلة البيكورنا. في عام 2008، تم القضاء على أنواع فيروس شلل الأطفال من جنس الفيروسة المعوية وتم تعيين الأنماط المصلية الثلاثة للأنواع الفيروس المعوي البشري C (تم تسميته لاحقا إلى الفيروس المعوي سي انتيروفيروس C)، في جنس Enterovirus في عائلة البيكورنا. تم تغيير النوع من جنس الفيروسة المعوية من فيروس شلل الأطفال إلى فيروس (Enterovirus) C.البشري.
الأصل والأنماط المصلية
[عدل]فيروس شلل الأطفال شبيه بنيوياً بالفيروسات المعوية البشرية الأخرى (فيروسات كوكساكي، فيروسات إيكوفيروس، والفيروسات الانفية)، والتي تستخدم أيضا جزيئات شبيهة بالايميونوجلوبيولين للتعرف على خلايا المضيف ودخولها. يشير التحليل التطوري لتسلسل الرنا ومتواليات البروتين من فيروس شلل الأطفال إلى أنه قد يكون تطور من سلالة لفيروس كوكساكي C-cluster ، والتي نشأت من خلال طفرة داخل القفيصة.[26] من المحتمل أن يكون التمييز النوعي لفيروس شلل الأطفال قد حدث نتيجة للتغير في خصوصية المستقبل الخلوي من جزيء الالتصاق بين الخلايا (ICAM-1)، المستخدم من قبل فيروسات الوكساكي C-cluster Coxsackie A إلى CD155. مما يؤدي إلى تغيير في المرضية، والسماح للفيروس لإصابة الأنسجة العصبية.
معدل التحور في الفيروس مرتفع نسبياً حتى بالنسبة لفيروسات الرنا مع معدل إحلال مترادف يبلغ 1.0 × 10−2 استبدال / موقع / سنة ومعدل استبدال غير مترادف يبلغ 3.0 × 10−4 استبدال / موقع / سنة.[27] توزيع القاعدة داخل الحمض النووي ليس عشوائياً مع كون الأدينوساين أقل شيوعاً مما كان متوقعاً في نهاية 5 '' وأعلى في النهاية '3'.[28] استخدام الكودون ليس عشوائيا مع الكودونات المنتهية في الأدينوزين التي يتم تفضيلها وتلك المنتهية بسيتوزين أو جوانين يتم تجنبها. يختلف استخدام الكودون بين الأنماط الجينية الثلاثة ويبدو أنه مدفوعًا بالطفرة بدلاً من الاختيار.[29]
الأنماط المصلية الثلاثة من فيروس شلل الأطفال، PV1، PV2، PV3، لكل منها بروتين قفيصة مختلف قليلاً. تحدد بروتينات الكابسيد خصوصية المستقبل الخلوي واستضداد الفيروس. النمط المصلي PV1 هو الشكل الأكثر شيوعًا في الطبيعة، ولكن الأشكال الثلاثة جميعها معدية للغاية. اعتبارا من شهر نوفمبر عام 2015، تم تصنيف النمط المصلي البري PV1 أنه الأكثر شيوعا في مناطق من باكستان وأفغانستان. أُعلن القضاء على الـ PV2 البرية في سبتمبر 2015 بعد اكتشافه في أكتوبر 1999 في ولاية أوتار براديش بالهند. اعتبارا من نوفمبر عام 2015، لم يشاهد النمط المصلي البري PV3 منذ الكشف عنها عام 2012 في أجزاء من نيجيريا وباكستان.[30]
الإمراضية
[عدل]العامل الأساسي المحدد للعدوى لأي فيروس هو قدرته على دخول خلية وإنتاج جزيئات معدية إضافية. ويعتقد أن وجود CD155 يحدد الحيوانات والأنسجة التي يمكن أن تصاب بفيروس شلل الأطفال. تم العثور على CD155 (خارج المختبرات) فقط على خلايا البشر، والرئيسيات العليا، وقردة العالم القديم. ومع ذلك، فإن فيروس شلل الأطفال هو مُمْرِض بشري صارم، ولا يصيب أي أنواع أخرى بشكل طبيعي (على الرغم من أنه يمكن إصابة قردة الشمبانزي وقردة العالم القديم عند اصابتها مختبريا).[31]
يبدو أن جين CD155 خاضع للاختيار الإيجابي.[32] يحتوي البروتين على العديد من المجالات حيث يحتوي فيها المجال D1 على موقع ربط فيروس شلل الأطفال. ضمن هذا المجال، 37 من الأحماض الأمينية هي المسؤولة عن ربط الفيروس.
فيروس شلل الأطفال هو فيروس معوي. تحدث العدوى عبر الطريق البرازي - الفموي، مما يعني أن أحدًا يبتلع الفيروس ويحدث التكاثر الفيروسي في القناة الهضمية.[33] يتم إلقاء الفيروس في براز الأفراد المصابين. في 95% من الحالات، يحدث فقط وجود عابر أولي (تفيرس الدم)، وتكون عدوى فيروس شلل الأطفال عديمة الأعراض. في حوالي 5% من الحالات، ينتشر الفيروس ويتضاعف في مواقع أخرى مثل الدهون البنية، والأنسجة البطانية الشبكية، والعضلات. يسبب التكاثر الفيروسي المتواصل تفيرس دم ثانويا ويؤدي إلى ظهور أعراض بسيطة مثل الحمى والصداع والتهاب الحلق.[34] يحدث التهاب النخاع السنجابي المسبب للشلل في أقل من 1% من عداوى فيروس شلل الأطفال. يحدث المرض عندما يدخل الفيروس إلى الجهاز العصبي المركزي (CNS) ويتضاعف في الخلايا العصبية الحركية داخل الحبل الشوكي أو جذع الدماغ أو القشرة الحركية، مما يؤدي إلى تدمير انتقائي للخلايا العصبية الحركية مسببا شللا مؤقتا أو دائما. في حالات نادرة، يؤدي شلل الأطفال إلى توقف التنفس والوفاة. في حالات المرض الشللي، كثيرا ما يتم ملاحظة آلام العضلات والتشنجات قبل بداية الضعف والشلل. يستمر الشلل عادة من أيام إلى أسابيع قبل الشفاء.[35]
في العديد من النواحي، يُعتقد أن الطور العصبي للعدوى هو تحويل عرضي للعدوى المعدية المعوية. والآليات التي يدخل فيها فيروس شلل الأطفال إلى الجهاز العصبي المركزي غير مفهومة بشكل جيد. تم اقتراح ثلاث فرضيات غير حصرية لشرح دخولها. جميع النظريات تتطلب تفيرس دم أولي. تتنبأ الفرضية الأولى بأن الفيريونات تمر مباشرة من الدم إلى الجهاز العصبي المركزي عن طريق عبور الحاجز الدموي الدماغي المستقل عن CD155.[36] تشير فرضية ثانية إلى أن الفيريونات يتم نقلها من الأنسجة المحيطة تم تجميعها في الدم المفيرس، على سبيل المثال الأنسجة العضلية، إلى الحبل الشوكي من خلال مسارات الأعصاب عبر النقل المحور العصبي الرجعي.[37] وهناك فرضية ثالثة تتمثل في أن الفيروس يتم جلبه إلى الجهاز العصبي المركزي عبر خلايا الوحيدات المصابة أو البلاعم.[38]
التهاب سنجابية النخاع هو مرض يصيب الجهاز العصبي المركزي. ومع ذلك، يعتقد CD155 أن تكون موجودة على سطح معظم أو كل الخلايا البشرية. لذلك، لا يفسر تعبير المستقبلات سبب إصابة فيروس شلل الأطفال بشكل تفضيلي لبعض الأنسجة. هذا يشير إلى أن يتم تحديد الانتحاء النسيجي بعد العدوى الخلوية. رجحت دراسة حديثة أن استجابة الإنترفيرون نمط-I (تحديدًا ألفا وبيتا) هو عامل مهم يحدد أنواع الخلايا التي تدعم تكاثر فيروس شلل الأطفال.[39] في الفئران التي تعبر عن CD155 (من خلال الهندسة الوراثية) ولكنها تفتقر إلى مستقبل انترفيرون نمط-I، فإن فيروس شلل الأطفال لا يتضاغف فقط في مخزون موسع من أنواع الأنسجة، ولكن هذه الفئران يمكن أيضًا أن تصاب فمويا بالفيروس.[40]
تفادي الجهاز المناعي
[عدل]يستخدم فيروس شلل الأطفال آليتين رئيسيتين للتهرب من نظام المناعة. الأول، هو التغلب على حمضية المعدة الشديدة، مما يسمح للفيروس لإصابة المضيف والانتشار في جميع أنحاء الجسم عن طريق الجهاز اللمفاوي. ثانياً، لأن بأمكانه التضاعف بسرعة كبيرة، فإن الفيروس يربك الأجهزة المضيفة قبل ظهور الاستجابة المناعية.[41] من الأمور الأخرى أنَّ الفراغات الموجودة على سطح الفيروس ضيقة جدًا لتسمح بالتصاق الأجسام المضادة، لذا فإنَّ مواقع التصاق الأضداد بالفيروس محمية إلى حدٍ ما، في حين أن باقي سطح الفيريون يمكن أن يتحور لتفادي الاستجابة المناعية للمضيف.
يكتسب الأفراد المعرضون لفيروس شلل الأطفال، إما عن طريق العدوى أو عن طريق التطعيم بلقاح شلل الأطفال، مناعة ضده. في الأفراد اممنعين، توجد أجسام مضادة ضد فيروس شلل الأطفال في اللوزتين والجهاز الهضمي (على وجه التحديد الأجسام المضادة IgA) وتكون قادرة على منع تضاعف فيروس شلل الأطفال. يمكن أن تمنع الأجسام المضادة IgG وIgM ضد فيروس شلل الأطفال من انتشار الفيروس إلى الخلايا العصبية الحركية للجهاز العصبي المركزي. الإصابة بنمط مصلي واحد من فيروس شلل الأطفال لا يمنح المناعة ضد الأنماط المصلية الأخرى، ومع ذلك فإن الاصابات الثانية داخل نفس الشخص نادرة للغاية
PVR الفأر المعدل وراثيا
[عدل]الاستنساخ والتخليق
[عدل]تعديل العلاجات
[عدل]المراجع
[عدل]- ^ INTERNATIONAL COMMITTEE ON TAXONOMY OF VIRUSES (أغسطس 2011). "ICTV 2009 MASTER SPECIES LIST VERSION 10". مؤرشف من الأصل في 2016-03-05.
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) - ^ Ryan KJ, Ray CG (editors) (2004). Sherris Medical Microbiology (ط. 4th). McGraw Hill.
{{استشهاد بكتاب}}:|مؤلف=باسم عام (مساعدة) والوسيط غير المعروف|الرقم المعياري=تم تجاهله يقترح استخدام|ردمك=(مساعدة) - ^ Hogle J (2002). "Poliovirus cell entry: common structural themes in viral cell entry pathways". Annu Rev Microbiol. 56: 677–702. doi:10.1146/annurev.micro.56.012302.160757. PMC 1500891 . PMID 12142481.
- ^ Goodsell DS (1998). The machinery of life. New York: Copernicus. ISBN 0-387-98273-6.
- ^ Paul JR (1971). A History of Poliomyelitis. (Yale studies in the history of science and medicine). New Haven, Conn: Yale University Press. ISBN 0-300-01324-8.
- ^ Racaniello and Baltimore; Baltimore, D (1981). "Molecular cloning of poliovirus cDNA and determination of the complete nucleotide sequence of the viral genome". Proc. Natl. Acad. Sci. U.S.A. 78 (8): 4887–91. doi:10.1073/pnas.78.8.4887. PMC 320284 . PMID 6272282.
- ^ Kitamura N, Semler B, Rothberg P, et al. (1981). "Primary structure, gene organization and polypeptide expression of poliovirus RNA". Nature. 291 (5816): 547–53. doi:10.1038/291547a0. PMID 6264310.
- ^ Mendelsohn Cl; Wimmer E; Racaniello VR (1989). "Cellular receptor for poliovirus: molecular cloning, nucleotide sequence, and expression of a new member of the immunoglobin superfamily". Cell. 56 (5): 855–865. doi:10.1016/0092-8674(89)90690-9. PMID 2538245.
- ^ He Y, Mueller S, Chipman P, et al. (2003). "Complexes of poliovirus serotypes with their common cellular receptor, CD155". J Virol. 77 (8): 4827–35. doi:10.1128/JVI.77.8.4827-4835.2003. PMC 152153 . PMID 12663789.
- ^ Dunnebacke TH, Levinthal JD, Williams RC (1 October 1969). "Entry and release of poliovirus as observed by electron microscopy of cultured cells". J. Virol. 4 (4): 505–13. PMC 375900 . PMID 4309884.
- ^ Kaplan G, Freistadt MS, Racaniello VR (1 October 1990). "Neutralization of poliovirus by cell receptors expressed in insect cells". J. Virol. 64 (10): 4697–702. PMC 247955 . PMID 2168959.
- ^ Gomez Yafal A, Kaplan G, Racaniello VR, Hogle, JM (1993). "Characterization of poliovirus conformational alteration mediated by soluble cell receptors". Virology. 197 (1): 501–5. doi:10.1006/viro.1993.1621. PMID 8212594.
- ^ Mueller S, Wimmer E, Cello J (2005). "Poliovirus and poliomyelitis: a tale of guts, brains, and an accidental event". Virus Res. 111 (2): 175–93. doi:10.1016/j.virusres.2005.04.008. PMID 15885840.
- ^ Attardi, G. and Smith, J. Virus specific protein and a ribonucleic acid associated with ribosomes in poliovirus infected HeLa cells. Cold Spring Harbor Symp. Quant. Biol. 27: 271–292. 1962
- ^ Chen CY, Sarnow P (1995). "Initiation of protein synthesis by the eukaryotic translational apparatus on circular RNAs". Science. 268 (5209): 415–7. doi:10.1126/science.7536344. PMID 7536344.
- ^ Pelletier J, Sonenberg N (1988). "Internal initiation of translation of eukaryotic mRNA directed by a sequence derived from poliovirus RNA". Nature. 334 (6180): 320–5. doi:10.1038/334320a0. PMID 2839775.
- ^ Jang SK, Kräusslich HG, Nicklin MJ, Duke GM, Palmenberg AC, Wimmer E (1 August 1988). "A segment of the 5' nontranslated region of encephalomyocarditis virus RNA directs internal entry of ribosomes during in vitro translation". J. Virol. 62 (8): 2636–43. PMC 253694 . PMID 2839690.
- ^ John Carter; Venetia A. Saunders (2007). Virology: Principles and Applications. John Wiley & Sons. p. 4. ISBN 978-0-470-02386-0.
- ^ John Carter; Venetia A. Saunders (2007). Virology: Principles and Applications. John Wiley & Sons. p. 165. ISBN 978-0-470-02386-0.
- ^ Charles Chan and Roberto Neisa. "Poliomyelitis". Archived February 22, 2007, at the Wayback Machine. Brown University.
- ^ John Carter; Venetia A. Saunders (2007). Virology: Principles and Applications. John Wiley & Sons. p. 164. ISBN 978-0-470-02386-0.
- ^ John Carter; Venetia A. Saunders (2007). Virology: Principles and Applications. John Wiley & Sons. pp. 161, 165. ISBN 978-0-470-02386-0.
- ^ John Carter; Venetia A. Saunders (2007). Virology: Principles and Applications. John Wiley & Sons. p. 166. ISBN 978-0-470-02386-0.
- ^ Kew O, Sutter R, de Gourville E, Dowdle W, Pallansch M (2005). "Vaccine-derived polioviruses and the endgame strategy for global polio eradication". Annu Rev Microbiol. 59: 587–635. doi:10.1146/annurev.micro.58.030603.123625. PMID 16153180.
- ^ DRAKE JW (August 1958). "Interference and multiplicity reactivation in polioviruses". Virology. 6 (1): 244–64. doi:10.1016/0042-6822(58)90073-4. PMID 13581529.
- ^ Jiang P, Faase JA, Toyoda H, et al. (2007). "Evidence for emergence of diverse polioviruses from C-cluster Coxsackie A viruses and implications for global poliovirus eradication". Proc. Natl. Acad. Sci. U.S.A. 104 (22): 9457–62. doi:10.1073/pnas.0700451104. PMC 1874223 . PMID 17517601.
- ^ Jorba J, Campagnoli R, De L, Kew O (2008). "Calibration of multiple poliovirus molecular clocks covering an extended evolutionary range". J. Virol. 82 (9): 4429–40. doi:10.1128/JVI.02354-07. PMC 2293050 . PMID 18287242.
- ^ Rothberg PG, Wimmer E (1981). "Mononucleotide and dinucleotide frequencies, and codon usage in poliovirion RNA". Nucleic Acids Res. 9 (23): 6221–9. doi:10.1093/nar/9.23.6221. PMC 327599 . PMID 6275352.
- ^ Zhang J, Wang M, Liu WQ, et al. (2011). "Analysis of codon usage and nucleotide composition bias in polioviruses". Virol. J. 8: 146. doi:10.1186/1743-422X-8-146. PMC 3079669 . PMID 21450075.
- ^ Possible Eradication of Wild Poliovirus Type 3 — Worldwide, 2012". CDC. 2014-11-14. Retrieved 2014-11-14.
- ^ Mueller S, Wimmer E (2003). "Recruitment of nectin-3 to cell-cell junctions through trans-heterophilic interaction with CD155, a vitronectin and poliovirus receptor that localizes to alpha(v)beta3 integrin-containing membrane microdomains". J Biol Chem. 278 (33): 31251–60. doi:10.1074/jbc.M304166200. PMID 12759359.
- ^ Suzuki Y (2006). "Ancient positive selection on CD155 as a possible cause for susceptibility to poliovirus infection in simians". Gene. 373: 16–22. doi:10.1016/j.gene.2005.12.016. PMID 16500041.
- ^ Bodian D, Horstmann DH (1969). Polioviruse. Philadelphia, Penn: Lippincott. pp. 430–73.
- ^ Sabin A (1956). "Pathogenesis of poliomyelitis; reappraisal in the light of new data". Science. 123(3209): 1151–7. doi:10.1126/science.123.3209.1151. PMID 13337331.
- ^ Acute Poliomyelitis at eMedicinePediatric Poliomyelitis at eMedicine
- ^ Yang W, Terasaki T, Shiroki K, et al. (1997). "Efficient delivery of circulating poliovirus to the central nervous system independently of poliovirus receptor". Virology. 229 (2): 421–8. doi:10.1006/viro.1997.8450. PMID 9126254.
- ^ Ohka S. Yang WX; Terada E; Iwasaki K; Nomot A (1998). "Retrograde transport of intact poliovirus through the axon via the first transport system". Virology. 250 (1): 67–75. doi:10.1006/viro.1998.9360. PMID 9770421.
- ^ De Jesus NH (2007). "Epidemics to eradication: the modern history of poliomyelitis". Virol. J. 4 (1): 70. doi:10.1186/1743-422X-4-70. PMC 1947962 . PMID 17623069.
- ^ Ida-Hosonuma M, Iwasaki T, Yoshikawa T, et al. (April 2005). "The alpha/beta interferon response controls tissue tropism and pathogenicity of poliovirus". J. Virol. 79 (7): 4460–9. doi:10.1128/JVI.79.7.4460-4469.2005. PMC 1061561 . PMID 15767446.
- ^ Ohka S, Igarashi H, Sakai M, Koike S, Nochi T, Kiyono A, Nomoto A (2007). "Establishment of a poliovirus oral infection system in human poliovirus receptor-expressing transgenic mice that are deficient in alpha/beta interferon receptor". J. Virol. 81 (15): 7902–12. doi:10.1128/JVI.02675-06. PMC 1951287 . PMID 17507470.
- ^ Racaniello V (2006). "One hundred years of poliovirus pathogenesis". Virology. 344 (1): 9–16. doi:10.1016/j.virol.2005.09.015. PMID 16364730.