قوة بين جزيئية
قوى الترابط بين الجزيئات الخارجية هي قوى الجذب أو التنافر التي تعمل بين الجسيمات المجاورة (ذرات ، جزيئات أو أيونات). فهي ضعيفة بالمقارنة مع قوة الترابط داخل الجزيء ، القوى التي تبقي الجزيئات معا. على سبيل المثال، الرابطة التساهمية الموجودة في جزيئات حمض الهيدروكلوريك هو أقوى بكثير من القوى الموجودة بين الجزيئات المجاورة، والتي تكون عندها الجزيئات قريبة بما فيه الكفاية لبعضها البعض.
القوى بين الجزيئات الجذابة:
- قوى ترابط ثنائي القطب ، ثنائي القطب
- قوى الترابط الأيوني ثنائي قطب
- قوى ترابط فان دير فالس
التآثر ثنائي القطب، ثنائي القطب
[عدل]تكون جميع الروابط الأخرى في الحقيقة روابط بين جزيئية ( Intermolecular Forces ) ، وأهمّها :
قوى ترابط بين جزيء قطبي – وجزيء قطبي آخر(Dipole Dipole forces )
[عدل]ترتبط الجزيئات القطبية مع بعضها البعض عن طريق قوى «Dipole Dipole» مثل ترابط جزيئات كبريتيد الهيدروجين H2S مع كلوريد الميثيل CH3Cl .
قوى ترابط بين أيون - جزيء قطبي ( Ion-Dipole Forces )
[عدل]قوى تربط بين الأيونات والجزيئات القطبية ، مثل ترابط أيونات الصوديوم مع جزيئات الماء في محلول كلوريد الصوديوم .
قوى ترابط بين أيون – وجزيء غير قطبي (ion - induced dipole)
[عدل]قوى تربط بين الأيونات والجسيمات غير القطبية ، مثل ترابط أيونات الحديد ( في الهيموجلوبين ) مع جزيئات الأكسجين في الدم .[1]
قوى ترابط بين جزيء قطبي - وجزيء غير قطبي (Dipole-induced dipole )
[عدل]قوى تربط بين الجزيئات القطبية والجسيمات غير القطبية ، مثل ترابط جزيئات الأكسجين الذائب في الماء مع جزيئات الماء .
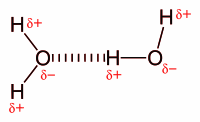
الترابط الهيدروجيني ( Hydrogen bonding )
[عدل]ترابطات قويّة نوعاً ما تربط بين ذرة الهيدروجين في جزيء قطبي مع ذرة ذات سالبية كهربية عالية في جزيء أخر . ومثال ذلك الترابط الهيدروجيني بين جزيئات الماء .
وهذا النوع من القوى هو الذي يفسّر الارتفاع الكبير في درجة غليان الماء مقارنةً بدرجات غليان المركبات الهيدروجينية لعناصر المجموعة السادسة أ . وهذه القوى الأربعة الأخيرة ( قوى الربط بين الجزيئات ) يطلق عليها بشكلٍ عام قوى فان درفال ( Van der Waals forces ) .[2]
قوى فان دير فالس
[عدل]قوى لندن للتشتت جزيء غير قطبي - جزيء غير قطبي ( London Dispersion Forces )
[عدل]عبارة عن ارتباط الجزيئات غير القطبية مع بعضها البعض ، مثل ترابط جزيء الميثان مع جزيء أخر ، وترابط جسيمات اليود (الهالوجينات) مع بعضها البعض .
و في هذا النوع من الترابطات أنّ قوّة الرابطة تتأثر بحجم الجزيئات ، فنجد أنّ قوّة هذه الترابطات تزداد قوّةً بنزولنا إلى أسفل في مجموعة الهالوجينات ومجموعة الغازات النادرة . كما أنّ شكل الجزيء في الفراغ يلعب دوراً مهمّاً هو الأخر في قوّتها ، فنجدها على سبيل المثال أقوى في البنتان العادي منها في النيوبنتان .
المراجع
[عدل]- ^ Dr. Michael Blaber, 1996. Intermolecular Forces. http://www.mikeblaber.org/oldwine/chm1045/notes/Forces/Intermol/Forces02.htm نسخة محفوظة 1 أغسطس 2020 على موقع واي باك مشين.
- ^ الاتحاد الدولي للكيمياء البحتة والتطبيقية. "hydrogen bond". Compendium of Chemical Terminology Internet edition.