ميثان
| ميثان | |
|---|---|
 |
 |
 |
 |
| الاسم النظامي (IUPAC) | |
ميثان |
|
| أسماء أخرى | |
غاز المستنقعات |
|
| المعرفات | |
| رقم CAS | 74-82-8 |
| بوب كيم (PubChem) | 297 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | CH4 |
| الكتلة المولية | 16.042 غ/مول |
| المظهر | غاز عديم اللون |
| الكثافة | 0.717 كغ/م3 غاز |
| نقطة الانصهار | - 182.5 °س |
| نقطة الغليان | - 161.6 °س |
| الذوبانية في الماء | 3.5 مغ/100 مل ماء عند 17 °س |
| المخاطر | |
| ترميز المخاطر | |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| نقطة الوميض | - 188 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الميثان، هو مركب كيميائي له الصيغة الكيميائية CH4 (ذرة كربون واحدة مرتبطة بأربع ذرات هيدروجين). ويصنف ضمن مجموعة الهيدريد 14، وهو أبسط شكل للألكان والمكون الرئيسي للغاز الطبيعي. الميثان النقي ليس له رائحة، ولكن عند استخدامه تجاريًا يخلط بكميات ضئيلة من مركبات الكبريت ذات الرائحة المميزة مثل الإيثانول، مما يمكن من تتبع أثار الميثان في حالة حدوث تسريب.
إن الوفرة النسبية للميثان على الأرض تجعله وقودًا مهمُا اقتصاديًا، على الرغم من أن التقاطه وتخزينه يمثل تحديات تقنية بسبب حالته الغازية في ظل الظروف العادية لدرجة الحرارة والضغط. يتواجد غاز الميثان الطبيعي تحت الأرض وتحت قاع البحر وينتج عن عمليات جيولوجية وبيولوجية مختلفة. يقع أكبر خزان للميثان تحت قاع البحر على شكل هيدرات الميثان. عندما يصل الميثان إلى السطح والغلاف الجوي يُعرف باسم الميثان الجوي. منذ عام 1750 زاد تركيز غاز الميثان في الغلاف الجوي للأرض بنحو 150٪، وهو يمثل 20٪ من إجمالي التأثير الإشعاعي العالمي من جميع غازات الدفيئة والمختلطة. كما اكتُشف الميثان على كواكب أخرى، بما في ذلك المريخ مما كان له أثرٌ كبير على أبحاث علم الأحياء الفلكية.
الخصائص والترابط
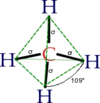
[عدل]الميثان هو غاز له بنية جزيئية رباعية السطوح مع روابط كربون-هيدروجين متكافئة. يوصف هيكله الإلكتروني بأربعة مدارات جزيئية رابطة ناتجة عن تداخل مداري التكافؤ على ذرات الكربون والهيدروجين.
المدارات الجزيئية التي لها أدنى طاقة ناتجة عن تداخل المدار 2s على الكربون مع مدارات 1s على ذرات الهيدروجين الأربعة، فوق مستوى الطاقة هذا توجد مجموعة متدرجة ثلاثياً من المدارات الجزيئية التي تتضمن تداخل مدارات 2p على الكربون مع مجموعات خطية مختلفة من مدارات 1s على الهيدروجين، يتوافق مخطط الترابط الناتج مع القياسات الطيفية الكهروضوئية.
الميثان هو غاز عديم الرائحة ويبدو أنه عديم اللون،[3] يمتص الضوء المرئي خاصة عند الطرف الأحمر من الطيف بسبب النطاقات المفرطة [الإنجليزية] لكن التأثير يكون ملحوظًا فقط إذا كان مسار الضوء طويلًا جدًا، وهو ما يعطي كوكبي أورانوس ونبتون ألوانهما الزرقاء أو الخضراء المزرقة، حيث يمر الضوء عبر غلافهما الجوي المحتوي على الميثان ثم يتشتت مرة أخرى.[4]
كإجراء احترازي للسلامة، تُضاف الروائح التي عادةً ما تحتوي على مادة ثلاثي بوتيل ثيول إلى الغاز الطبيعي المستخدم في المنازل لخلق رائحة مألوفة. تبلغ درجة غليان الميثان 161.5 درجة مئوية عند ضغط جوي واحد، وهو غاز قابل للاشتعال بتركيزات مختلفة في الهواء (5.4-17٪) عند الضغط القياسي.
هناك أشكال مختلفة من الميثان الصلب، تسعة منها معروفة حتى الآن.[5] تبريد الميثان عند ضغط مساوي للضغط الجوي ينتج الميثان 1 . تتبلور هذه المادة في النظام المكعب (زمرة فراغية Fm3m). يحتوي الميثان I على مواقع ذرات هيدروجين غير ثابتة، مما يسمح لجزيئات الميثان بالدوران بحرية، لذا فهي تعتبر بلورات بلاستيكية.[6]
التفاعلات الكيميائية
[عدل]التفاعلات الكيميائية الأولية للميثان هي الاحتراق وإصلاح البخار إلى غاز الاصطناع والهلجنة. بشكل عام من الصعب التحكم في تفاعلات الميثان.
الأكسدة الانتقائية
[عدل]من الصعب أكسدة الميثان جزئيًا لتحويله إلى ميثانول (وهو وقود سائل أكثر ملاءمة)، لأن التفاعل عادة ما يستمر إلى حين تكون ثاني أكسيد الكربون والماء حتى في حالة عدم وجود ما يكفي من الأكسجين. يعمل إنزيم الميثان أحادي أوكسيجيناز [الإنجليزية] على إنتاج الميثانول من الميثان، ولكن لا يمكن استخدامه للتفاعلات على نطاق صناعي.[7] حدثت بعض التطورات في كل من الأنظمة المحفزة غير المتجانسة والمتجانسة، ولكن لا زال لكل منها عيوب كبيرة. تعمل هذه الأنظمة بشكل عام عن طريق توليد منتجات محمية من الأكسدة الزائدة، ومن الأمثلة على ذلك نظام كاتاليتيكا، والزيوليت النحاسي، والزيوليت الحديدي الذي يعمل على تثبيت موقع تفاعل ألفا-أكسجين [الإنجليزية] النشط،[8] في حالة عدم وجود الأكسجين، تعمل أحد أنواع البكتيريا على تحفيز ما يسمى بـ الأكسدة اللاهوائية للميثان [الإنجليزية] باستخدام النتريت كعامل مؤكسد.[9]
التفاعلات الحمضية والقاعدية
[عدل]الميثان حمض ضعيف للغاية مثل الهيدروكربونات الأخرى. يقدر أن ثابت تفكك الحمض في ثنائي ميثيل السلفوكسيد هو 56.[10] ولا يمكن فصله في المحلول، لكن الحمض المرافق معروف في أشكال مثل ميثيل الليثيوم.
لوحظت مجموعة متنوعة من الأيونات الموجبة المشتقة من الميثان، ومعظمها من الأنواع غير المستقرة في مخاليط الغاز منخفضة الضغط. وتشمل هذه الميثينيوم [الإنجليزية] أو الميثيل الموجب CH3+، الميثيل الموجب CH4+، الميثانيوم أو الميثيل الموجب CH5+، أكتشف بعض هذه العناصر في الفضاء الخارجي. يمكن أيضًا إنتاج الميثانيوم كمحلول مخفف من الميثان مع الأحماض الفائقة. الكاتيونات ذات الشحنة الأعلى مثل CH62+ (CH73+) تمت دراستها نظريًا ويُعتقد أنها مستقرة.
على الرغم من قوة روابط الهيروجين-الأكسجين، إلا أن هناك اهتمامًا شديدًا بالمحفزات التي تسهل تنشيط رابطة الهيروجين-الأكسجين [الإنجليزية] في الميثان (والألكانات الأخرى ذات الأرقام المنخفضة).[11]
الاحتراق
[عدل]
تبلغ حرارة احتراق الميثان 55.5 ميجا جول / كجم. احتراق الميثان هو تفاعل متعدد الخطوات يتلخص كالتالي:
CH4 + 2O2 → CO2 + 2H2O (ΔH = −891 k J / mol ، في الظروف القياسية)
كيمياء بيترز المكونة من أربع خطوات [الإنجليزية] هي كيمياء مختصرة منهجية من أربع خطوات تشرح احتراق الميثان.
يوجد عديد من الخطوات عند احتراق الميثان: يتحول الميثان إلى الجذر ميثيل CH3، والذي يتحول إلى فورمالدهيد (HCHO أو H2CO). ويتحول الفورمالدهيد إلى الجذر فورمال HCO، والذي بدوره يكون أول أكسيد الكربون CO. وهذه العملية يطلق عليها تحلل حراري تأكسدي:
CH4 + O2 → CO + H2 + H2O
بعد عملية انحلال حراري تاكسدية يتأكسد H2 مشكلاً H2O، ويطلق حرارة. ويحدث هذا بسرعة جدا، في وقت أقل من ميلي ثانية.
H2 + ½ O2 → H2O
وأخيرا، يتأكسد CO ليكون CO2 وينطلق مزيد من الحرارة. وهذه العملية أبطأ الخطوات وتحتاج بضع ميلي ثواني لتكتمل:
CO + ½ O2 → CO2
تفاعلات الميثان الجذرية
[عدل]
في الظروف المناسبة، يتفاعل الميثان مع جذور الهالوجين على النحو التالي:
X• + CH4 → HX + CH3•
CH3• + X2 → CH3X + X•
حيث X عبارة عن هالوجين: الفلور (F) أو الكلور (Cl) أو البروم (Br) أو اليود (I). تسمى الآلية لهذه العملية بهلجنة الجذور الحرة. تبدأ العملية عندما تنتج الأشعة فوق البنفسجية أو أي بادئ جذري آخر (مثل البيروكسيد) ذرة هالوجين. يتبع ذلك تفاعل تسلسلي من خطوتين تزيل فيه ذرة الهالوجين ذرة هيدروجين من جزيء ميثان، مما يؤدي إلى تكوين جزيء هاليد الهيدروجين وجذر الميثيل [الإنجليزية] (CH3 •). يتفاعل جذر الميثيل بعد ذلك مع جزيء الهالوجين لتكوين جزيء هالوميثان مع وجود ذرة هالوجين جديدة كمنتج ثانوي.[12] يمكن أن تحدث تفاعلات مماثلة على النواتج المهلجنة مما يؤدي إلى استبدال ذرات الهيدروجين الإضافية بواسطة ذرات الهالوجين مع هياكل ثنائي هالو ميثان وثلاثي هالو الميثان وفي النهاية رباعي هالو الميثان [الإنجليزية] اعتمادًا على ظروف التفاعل ونسبة الهالوجين إلى الميثان.
تنشيط الهيدروجين
[عدل]إن الرابطة التساهمية القوية بين الكربون-الهيدروجين في الميثان هي واحدة من أقوى الروابط الهيديروجينية، وعلى ذلك فإن استخدامها كمادة اولية في صناعة البتروكيمياويات محدود. ولايزال البحث جاريا عن عامل حفز مناسب لتكسير الرابطة بين C-H في الميثان والألكانات المنخفضة الأخرى.
الهلجنة
[عدل]يتفاعل الميثان مع الهالوجينات المختلفة حسب المعادلة العامة:
CH4 + X2 → CH3X + HX
ولكن ذلك في الضوء الشمس غير المباشر ويكون هذا التفاعل تفاعل استبدال
مصادر الميثان
[عدل]المصادر الطبيعية
[عدل]يتم استخراج الميثان من الرواسب الجيولوجية حيث يكون مصاحبا لأنواع الوقود الهيدروكربوني الأخرى، كما يمكن الحصول عليه من المصادر الطبيعية:
- تحلل المخلفات العضوية.
- المصادر الطبيعية: المستنقعات 23%
- وقود حفريات 20%
- عملية الهضم في الحيوانات (ماشية) 17%
- قاع البحر توجد كميات ضخمة من الغاز الطبيعي متجمدة تحت قاع البحر. ويقدر الخبراء أن احتياطي هيدرات الميثان الموجودة تحت قاع محيطات وبحار العالم، تبلغ حوالي 3000 غيغاطن، أي حوالي 3 مليار كيلوغرام. وهذا بدوره يعادل ضعف احتياطيات الطاقة المتوفرة في جميع المصادر التقليدية للطاقة كالفحم والنفط والغاز الطبيعي. لذا تتجه بعض الدول مثل الصين واليابان وكوريا الجنوبية والهند والبرازيل والولايات المتحدة، إلى استخراج هيدرات الميثان من أعماق البحار لسد حاجتها المتزايدة من الطاقة.
- البكتريا التي تتواجد أثناء زراعة الأرز.
- تسخين أو حرق الكتلة الحيوية لاهوائيا.
60% من الانبعاثات التي تنتج الميثان ناتجة من الأنشطة البشرية، وخاصة الأنشطة الزراعية. وخلال 200 سنة السابقة، تضاعف تركيز الغاز في الغلاف الجوي من 0.8 إلى 1.6 جزء في المليون.
كما أن الميثان يصنف على أنه كتلة حيوية لأنه يمكن أن ينتج من الحرق اللاهوائي لبعض المواد العضوية.
المصادر الصناعية
[عدل]يمكن تصنيع الميثان واستخدامه صناعيا وذلك عن طريق التفاعلات الكيميائية مثل تفاعل ساباتيه (Sabatier reaction) أو عملية فيشر-تروبش (Fischer-Tropsch process).
وطبقا لتقديرات أحد المصادر فإن الميثان الموجود في شكل رسوبي في المحيط يقدر بـعشرة آلاف مليار طن.[13] وتقترح النظريات أن هذه الكميات الضخمة من الميثان يمكن أن تنطلق فجأة مرة أخرى، وتسبب ارتفاعا في درجات الحرارة.
وكمكون رئيسي للغاز الطبيعي، فإن الميثان أحد أنواع الوقود المهمة. وحرق جزيء واحد من الميثان في وجود الأكسجين ينتج جزيء من ثاني أكسيد الكربون CO2 وجزيئين من الماء H2O:
CH4 + 2O2 → CO2 + 2H2O
الاستخدامات
[عدل]يستخدم الميثان في العمليات الصناعية الكيميائية، ويمكن نقله كسائل مبرد (غاز طبيعي مسال). ونظرًا لأن كثافة الميثان المبرد أكبر من كثافة الهواء، فإن وزن غاز الميثان في حال تسرب من حاوية نقل السوائل المبردة يكون في البداية أثقل من الهواء، أما في درجة حرارة الغرفة فيكون الميثان أخف من الهواء. ينقل ويوزع الغاز الطبيعي (الذي يتكون بشكل أساسي من الميثان) بكميات كبيرة عن طريق خطوط أنابيب الغاز.
الوقود
[عدل]يستخدم الميثان كوقود للأفران والمنازل وسخانات المياه والسيارات والتوربينات وغيرها.[14][15] يستخدم الكربون النشط لتخزين الميثان. يستخدم الميثان السائل المكرر كوقود للصواريخ عندما يخلط بالأكسجين السائل كما هو الحال في محركات بي إي 4 [الإنجليزية] و سبيس إكس رابتور.[16]
باعتباره المكون الرئيسي للغاز الطبيعي، فإن الميثان مهم لتوليد الكهرباء عن طريق حرقه كوقود في توربينات الغاز أو مولدات الكهرباء البخار. بالمقارنة مع أنواع الوقود الهيدروكربوني الأخرى، ينتج الميثان كمية أقل من ثاني أكسيد الكربون لكل وحدة حرارة تنطلق. عند حوالي 891 كيلو جول / مول، تكون حرارة احتراق الميثان أقل من أي هيدروكربون آخر، ولكن نسبة حرارة الاحتراق (891 كيلو جول / مول) إلى الكتلة الجزيئية (16.0 جم / مول ، منها 12.0 جم / مول الكربون) يظهر أن الميثان باعتباره أبسط هيدروكربون ينتج حرارة أكبر لكل وحدة كتلة (55.7 كيلو جول / جم) من الهيدروكربونات المعقدة الأخرى. في العديد من المدن، يتم ضخ الميثان في أنابيب للتدفئة المنزلية والطهي. في هذا الاستخدام يُعرف عادةً باسم الغاز الطبيعي والذي يُعتبر أنه يحتوي على محتوى طاقة يبلغ 39 ميغا جول لكل متر مكعب أو 1000 وحدة حرارية بريطانية لكل قدم مكعب قياسي. الغاز الطبيعي المسال هو في الغالب غاز الميثان الذي يتم تحويله إلى شكل سائل لسهولة التخزين أو النقل.
كوقود صاروخي سائل، يمتاز الميثان عن الكيروسين بإنتاجه لجزيئات عادم صغيرة. يؤدي هذا إلى تراكم كمية أقل من السخام على المكونات الداخلية لمحركات الصواريخ، انخفاض الكتلة الجزيئية لغازات العادم يزيد من الطاقة الحرارية والتي تكون على شكل طاقة حركية متوفرة للدفع مما يزيد من الاندفاع النوعي للصاروخ. يحتوي الميثان السائل أيضًا على نطاق درجة حرارة (91-112 كلفن) متوافق تقريبًا مع الأكسجين السائل (54-90 كلفن).
مناجم الفحم
[عدل]من أجل خفض مخاطر الانفجارات، تتم إزالة غاز الميثان من المناجم الموجودة تحت الأرض، قبل، وخلال، أو بعد التعدين. أما الاستعمالات الممكنة والمربحة للميثان من مناجم الفحم فهي: حقن غاز المناجم في شبكات أنابيب توزيع الغاز الطبيعي، أو استعماله لتوليد الطاقة الكهربائية، أو كوقود للمركبات/السيارات.
مناطق ردميات النفايات
[عدل]الطريقة الرئيسية لخفض انبعاثات الميثان من مواقع طمر النفايات تتضمن جمع وحرق أو إعادة استعمال الغاز الناتج عن مواقع ردميات النفايات. تتركز تكنولوجيا استعمال غاز مناطق الردميات على توليد الطاقة الكهربائية والاستعمال المباشر للغاز. يتم توليد الطاقة الكهربائية من خلال توزيع الميثان المجمع بواسطة شبكات الأنابيب كوقود للمحركات أو التوربينات. كما تستعمل تكنولوجيا الاستعمال المباشر غاز مواقع الردميات مباشرة كوقود. بينما تتطلب التكنولوجيات الأخرى تحسين الغاز وتوزيعه على شبكات أنابيب توزيع الغاز الطبيعي.
المواد الأولية الكيميائية
[عدل]يستخدم الغاز الطبيعي الذي يتكون في الغالب من الميثان لإنتاج غاز الهيدروجين على نطاق صناعي. إعادة تشكيل غاز الميثان بالبخار أو ما يُعرف ببساطة باسم إصلاح البخار هي الطريقة الصناعية القياسية لإنتاج غاز الهيدروجين التجاري. في عام 2013 أُنتج أكثر من 50 مليون طن متري سنويًا في جميع أنحاء العالم بشكل أساسي باستخدام تقنية إصلاح البخار للغاز الطبيعي. يستخدم الكثير من هذا الهيدروجين في مصافي البترول وإنتاج المواد الكيميائية ومعالجة الأغذية، كما تستخدم كميات كبيرة جدًا من الهيدروجين في إنتاج الأمونيا.
عند درجات الحرارة المرتفعة (700-1100 درجة مئوية) وفي وجود محفز ذو قاعدة معدنية (نيكل)، يتفاعل البخار مع الميثان لإنتاج خليط من ثاني أكسيد الكربون و ثنائي الهيدروجين المعروف باسم غاز الماء أو غاز الاصطناع:
هذا التفاعل ماص للحرارة بشدة (يستهلك حرارة ، ΔHr = 206 kJ / mol). يمكن الحصول على هيدروجين إضافي عن طريق تفاعل ثاني أكسيد الكربون مع الماء عبر تفاعل انزياح ماء-غاز:
CO + H2O ⇌ CO2 + H2
هذا التفاعل طارد للحرارة بشكل معتدل (ينتج حرارة ، ΔHr = −41 kJ / mol).
يخضع الميثان أيضًا لهلجنة الجذور الحرة في إنتاج الكلوروميثان، على الرغم من أن الميثانول هو أكثر المواد الأولية شيوعًا.[17]
يمكن أيضًا إنتاج الهيدروجين عن طريق التحلل المباشر للميثان المعروف أيضًا باسم التحلل الحراري للميثان. يعد تحلل الميثان طريقًا واعدًا لإنتاج الهيدروجين منخفض الانبعاثات حيث لا يتم إنتاج انبعاثات كربونية مباشرة على عكس إعادة تشكيل غاز الميثان بالبخار. درجات الحرارة التي تزيد عن 1200 درجة مئوية مطلوبة لكسر روابط الميثان لإنتاج غاز الهيدروجين والكربون الصلب. ومع ذلك من خلال استخدام محفز مناسب يمكن تقليل درجة حرارة التفاعل إلى ما بين 600 درجة مئوية - 1000 درجة مئوية اعتمادًا على المحفز المختار. يكون التفاعل ماصًا للحرارة بشكل معتدل كما هو موضح في معادلة التفاعل أدناه:[18]
CH4(g) → C(s) + 2 H2(g) ΔH° = 74.8 kJ/mol
أنظمة الزيوت والغاز الطبيعي
[عدل]تقع نشاطات تخفيض الانبعاثات هنا في ثلاث فئات: التكنولوجيات أو تحسين المعدات التي تخفض أو تزيل تهوية المعدات والانبعاثات الأخرى، ورفع مستوى الأساليب الإدارية والإجراءات التشغيلية، إضافةً إلى تعزيز الوسائل الإدارية بالاستفادة من التحسينات التكنولوجية. في جميع هذه الحالات، فإن خفض انبعاثات الميثان يوفر غازا أكثر للبيع والاستعمال.
السلامة والأمان
[عدل]غاز الميثان غير سام، ومع ذلك فهو شديد الاشتعال ويمكن أن يشكل خليط متفجر مع الهواء. يعتبر الميثان أيضًا غاز خانق إذا أدى إلى تقليل تركيز الأكسجين إلى أقل من حوالي 16٪ عن طريق الإزاحة، حيث يمكن لمعظم الناس تحمل انخفاض من 21٪ إلى 16٪ دون آثار سيئة. تركيز الميثان الذي تصبح عنده مخاطر الاختناق كبيرة أعلى بكثير من تركيز 5-15٪ في خليط قابل للاشتعال أو متفجر. يمكن لغاز الميثان المنبعث أن يخترق الأجزاء الداخلية للمباني القريبة من مدافن النفايات ويعرض السكان لمستويات كبيرة من الميثان. بعض المباني لديها أنظمة استرجاع مصممة خصيصًا أسفل الطوابق السفلية من أجل التقاط هذا الغاز بشكل فعال وإخراجه بعيدًا عن المبنى.
انفجارات غاز الميثان مسؤولة عن العديد من كوارث التعدين المميتة.[19] في 5 أبريل 2010 انفجر غاز الميثان في أحد مناجم الفحم في ولاية فرجينيا الغربية، مما أسفر عن مقتل 29 شخص.[20] ونظرًا للإطلاقات العرضية السابقة التي أدت إلى حدوث كوارث حرائق الطائرات، فقد كان إطلاق الغاز الطبيعي العرضي أيضًا محورًا رئيسيًا في مجال هندسة السلامة.[21][22]
انظر أيضًا
[عدل]- قائمة الدول حسب انبعاث غازات الدفيئة
- قائمة الدول حسب انبعاثات ثاني أكسيد الكربون
- الألكانات. أحد أنواع الهيدروكربونات والتي يكون الميثان أبسط أعضائها.
- كلاثيرات ميثان، نوع من أنواع الثلج يحتوى على الميثان.
- مجموعة ميثيل، مجموعة فعالة تشبه الميثان.
- إنتاج الميثان من الفحم
المراجع
[عدل]- ^ ا ب ج methane (بالإنجليزية), QID:Q278487
- ^ ChEBI release 2020-09-01، 1 سبتمبر 2020، QID:Q98915402
- ^ Hensher, David A.؛ Button, Kenneth J. (2003). Handbook of transport and the environment. Emerald Group Publishing. ص. 168. ISBN:978-0-08-044103-0. مؤرشف من الأصل في 2015-03-19. اطلع عليه بتاريخ 2016-02-22.
- ^ P.G.J Irwin؛ وآخرون (12 يناير 2022). "Hazy Blue Worlds: A Holistic Aerosol Model for Uranus and Neptune, Including Dark Spots" (PDF). Journal of Geophysical Research: Planets. ج. 127 ع. 6: e2022JE007189. arXiv:2201.04516. DOI:10.1029/2022JE007189. PMC:9286428. PMID:35865671. S2CID:245877540. مؤرشف من الأصل (PDF) في 2022-12-06.
- ^ Bini، R.؛ Pratesi، G. (1997). "High-pressure infrared study of solid methane: Phase diagram up to 30 GPa". Physical Review B. ج. 55 ع. 22: 14800–14809. Bibcode:1997PhRvB..5514800B. DOI:10.1103/physrevb.55.14800.
- ^ Wendelin Himmelheber. "Crystal structures". مؤرشف من الأصل في 2020-02-12. اطلع عليه بتاريخ 2019-12-10.
- ^ Baik، Mu-Hyun؛ Newcomb، Martin؛ Friesner، Richard A.؛ Lippard، Stephen J. (2003). "Mechanistic Studies on the Hydroxylation of Methane by Methane Monooxygenase". Chemical Reviews. ج. 103 ع. 6: 2385–419. DOI:10.1021/cr950244f. PMID:12797835.
- ^ Snyder، Benjamin E. R.؛ Bols، Max L.؛ Schoonheydt، Robert A.؛ Sels، Bert F.؛ Solomon، Edward I. (19 ديسمبر 2017). "Iron and Copper Active Sites in Zeolites and Their Correlation to Metalloenzymes". Chemical Reviews. ج. 118 ع. 5: 2718–2768. DOI:10.1021/acs.chemrev.7b00344. PMID:29256242. مؤرشف من الأصل في 2021-05-26.
- ^ Reimann، Joachim؛ Jetten، Mike S.M.؛ Keltjens، Jan T. (2015). "Chapter 7 Metal Enzymes in "Impossible" Microorganisms Catalyzing the Anaerobic Oxidation of Ammonium and Methane". في Peter M.H. Kroneck and Martha E. Sosa Torres (المحرر). Sustaining Life on Planet Earth: Metalloenzymes Mastering Dioxygen and Other Chewy Gases. Metal Ions in Life Sciences. Springer. ج. 15. ص. 257–313. DOI:10.1007/978-3-319-12415-5_7. ISBN:978-3-319-12414-8. PMID:25707470.
- ^ Bordwell، Frederick G. (1988). "Equilibrium acidities in dimethyl sulfoxide solution". Accounts of Chemical Research. ج. 21 ع. 12: 456–463. DOI:10.1021/ar00156a004.
- ^ Bernskoetter، W. H.؛ Schauer، C. K.؛ Goldberg، K. I.؛ Brookhart، M. (2009). "Characterization of a Rhodium(I) σ-Methane Complex in Solution". Science. ج. 326 ع. 5952: 553–556. Bibcode:2009Sci...326..553B. DOI:10.1126/science.1177485. PMID:19900892. S2CID:5597392.
- ^ March، Jerry (1968). Advance Organic Chemistry: Reactions, Mechanisms and Structure. New York: McGraw-Hill Book Company. ص. 533–534.
- ^ BBC نسخة محفوظة 28 أغسطس 2017 على موقع واي باك مشين.
- ^ "Lumber Company Locates Kilns at Landfill to Use Methane – Energy Manager Today". Energy Manager Today. 23 سبتمبر 2015. مؤرشف من الأصل في 2019-07-09. اطلع عليه بتاريخ 2016-03-11.
- ^ Cornell, Clayton B. (29 أبريل 2008). "Natural Gas Cars: CNG Fuel Almost Free in Some Parts of the Country". مؤرشف من الأصل في 2019-01-20. اطلع عليه بتاريخ 2009-07-25.
Compressed natural gas is touted as the 'cleanest burning' alternative fuel available, since the simplicity of the methane molecule reduces tailpipe emissions of different pollutants by 35 to 97%. Not quite as dramatic is the reduction in net greenhouse-gas emissions, which is about the same as corn-grain ethanol at about a 20% reduction over gasoline
- ^ "Blue Origin BE-4 Engine". مؤرشف من الأصل في 2021-10-01. اطلع عليه بتاريخ 2019-06-14.
We chose LNG because it is highly efficient, low cost and widely available. Unlike kerosene, LNG can be used to self-pressurize its tank. Known as autogenous repressurization, this eliminates the need for costly and complex systems that draw on Earth's scarce helium reserves. LNG also possesses clean combustion characteristics even at low throttle, simplifying engine reuse compared to kerosene fuels.
- ^ Rossberg, M. et al. (2006) "Chlorinated Hydrocarbons" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. دُوِي:10.1002/14356007.a06_233.pub2.
- ^ Lumbers، Brock (2022). "Low-emission hydrogen production via the thermo-catalytic decomposition of methane for the decarbonisation of iron ore mines in Western Australia". International Journal of Hydrogen Energy. ج. 47 ع. 37: 16347–16361. DOI:10.1016/j.ijhydene.2022.03.124. S2CID:248018294. مؤرشف من الأصل في 2022-12-07. اطلع عليه بتاريخ 2022-07-10.
- ^ Dozolme, Philippe. "Common Mining Accidents". About.com. مؤرشف من الأصل في 2012-11-11. اطلع عليه بتاريخ 2012-11-07.
- ^ Messina, Lawrence & Bluestein, Greg (8 أبريل 2010). "Fed official: Still too soon for W.Va. mine rescue". News.yahoo.com. مؤرشف من الأصل في 2010-04-08. اطلع عليه بتاريخ 2010-04-08.
- ^ OSMAN، Karim؛ GENIAUT، Baptiste؛ HERCHIN، Nicolas؛ BLANCHETIERE، Vincent (2015). "A review of damages observed after catastrophic events experienced in the mid-stream gas industry compared to consequences modelling tools" (PDF). Symposium Series. ج. 160 ع. 25. مؤرشف من الأصل (PDF) في 2022-12-07. اطلع عليه بتاريخ 2022-07-01.
- ^ Casal، Joaquim؛ Gómez-Mares، Mercedes؛ Muñoz، Miguel؛ Palacios، Adriana (2012). "Jet Fires: a "Minor" Fire Hazard?" (PDF). Chemical Engineering Transactions. ج. 26: 13–20. DOI:10.3303/CET1226003. مؤرشف من الأصل (PDF) في 2022-12-09. اطلع عليه بتاريخ 2022-07-01.

