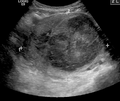
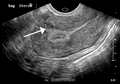
ورم عضلي
| أورام الرحم الليفية | |
|---|---|
أورام عضلية ملساء في الرحم.
| |
| معلومات عامة | |
| الاختصاص | علم الأورام |
| الموقع التشريحي | عضلة |
| التاريخ | |
| وصفها المصدر | معجم التخاطب لماير ، والموسوعة السوفيتية الأرمينية، المجلد السابع |
| تعديل مصدري - تعديل | |


الورم العضلي هو ورم عضلي حميد في الرحم، معظم النساء لا يشكين من أعراض، بينما البعض منهن قد يشكي من الألم أو الدورة الشهرية الغزيرة. إذا ضغط الورم على المثانة، فإن ذلك يؤدي للشعور بالحاجة للتبول باستمرار؛ أيضا، قد يسبب الورم ألماً أثناء ممارسة الجنس، أو ألم أسفل الظهر. يمكن أن يكون لدى المرأة ورم ليفي واحد، أو أكثر من ورم. أحيانا قد يعيق الورم الحمل على الرغم من أن ذلك ليس شائعا.[1]
إن السبب الرئيسي لهذا المرض غير واضح، إلا أن الأورام العضلية تظهر في العائلات، وتبين أنها مرتبطة بشكل جزئي بمستوى الهرمونات. من عوامل الخطورة للمرض: السمنة، وأكل الكثير من اللحوم الحمراء. يتم التشخيص عن طريق التصوير الطبي أو فحص الحوض.[1]
العلاج فعلياً ليس ذو أهمية كبيرة إن لم تكن هناك أعراض، أما الأشخاص الذين يعانون من أعراض خفيفة، فبإمكانهم أخذ العقاقير المسكنة، مثل: الباراسيتامول أو الأيبوبروفن. إن تناول الحديد أمر مهم عند اللاتي يعانين من غزارة في الدورة الشهرية. الأدوية المشابهة للهرمون المحرر لموجهة الغدد التناسلية قد تؤدي إلى تصغير حجم الورم، ولكن لا يفضل استعمالها؛ لأنها باهظة الثمن ولها آثارا جانبية. إذا ظهرت أعراضٌ أقوى، فقد تتم الاستعانة بالجراحة لإزالة الورم أو إزالة الرحم كاملا، أو يمكن سد أو إغلاق الشريان الذي يغذي الرحم. الورم العضلي الليفي الخبيث نادر جدا ويسمى الساركوما العضلية الملساء، ومن الواضح أنه لا ينشأ من الورم العضلي الحميد.[1]
حوالي 20% - 80% من النساء معرضاتُ للورم بحلول عامهن الخمسين.[1] في عام 2013، قُدر عدد النساء المصابات ب 171 مليون امرأة. تحدث هذه الأورام عادةً في المرحلة المتوسطة أو المتأخرة من سنوات الإنجاب، وبعد انقطاع المحيض، فإن حجم الورم يقل.[1] في الولايات المتحدة الأمريكية، يعد مرض الورم العضلي الليفي في الرحم سببا لاستئصال الرحم كاملاً.[2]
الأعراض والعلامات
[عدل]الورم العضلي الليفي الحميد في الغالب لا يكون له أعراض، وإذا كان هناك أعراض، فإنها تعتمد على حجم الورم أو على موقعه. من الأعراض المهمة: نزيف غير طبيعي في الرحم، تكون الدورة الشهرية غزيرة أو مؤلمة، انتفاخ أو ألم في البطن، ألم عند الإخراج، ألم في الظهر، حصر في البول أو كثرة التبول، وفي بعض الحالات قد يكون سببا للعقم[3]، وقد يسبب ألماً أثناء الجماع وذلك بالاعتماد على مكان الورم، وقد يكون سببا للإجهاض خلال الحمل[4]، أو النزيف، أو الولادة المبكرة، أو التحكم في مكان الجنين في الرحم.
وعلى الرغم من أن الورم العضلي الليفي شائع بين النساء، إلا أنه ليس سبباً جوهرياً للعقم؛ حيث أنه يشكل سببا للعقم بنسبة 3%.[5] معظم النساء اللواتي يعانين من هذا الورم يحملن بشكل طبيعي.[6][7] وفي حالات العقم التي يكون سببها هذا الورم، فإنه غالبا ما يكون تحت بطانة الرحم؛ مما قد يؤدي إلى إعاقة انزراع البويضة المخصبة في جدار الرحم.[5] إن الأورام العضلية الليفية كبيرة الحجم قد تؤدي إلى إغلاق قناة فالوب (القناة التي تصل الرحم بالمبيض).
الأسباب
[عدل]يعد الورم العضلي الليفي أكثر شيوعا في النساء اللواتي يعانين من السمنة.[8] تعتمد الأورام العضلية الليفية على البروجيسترون والاستروجين في نموها؛ ولهذا، فهي مرتبطة جدا بسن الإنجاب.
الجينات
[عدل]الأورام الليفية هي وراثية جزئيا كما لو كانت الأم لديها الأورام الليفية، والمخاطر في الابنة أعلى بثلاث مرات من المتوسط.[9]
وأكمل الباحثون التنميط التعبير الجيني العالمي للاورام ليفية في الرحم. ووجد الباحثون أنه ليس هناك سوى عدد قليل من جينات معينة أو الانحرافات الوراثية الخلوية وترتبط مع ULMs.[10] وقد تم الإبلاغ عن وجود علاقة مع سينسيز الأحماض الدهنية.[11]
الورم العضلي الليفي العائلي
[عدل]للمزيد من المعلومات حول هذا الموضوع، انظر الورم العضلي اللليفي الوراثي وسرطان خلايا الجهاز البولي
متلازمة رييد التي تسبب كلّا من الورم العضلي الليفي، والورم العضلي الجلدي، وورم خلايا الجهاز البولي.[12][13][14] ترتبط هذه المتلازمة بوجود طفرة في الجين المسؤول عن إنتاج الإنزيم «فيواريت هايدراتيز»؛ الذي يقع على الكروموسوم رقم 1. تعتبر الوراثة في هذا النوع من الأورام وراثة سائدة.
الفسيولوجيا المرضية
[عدل]
الورم العضلي الأملس يبدو ظاهريا – المظهر الإجمالي - بأنه عقيدة بيضاء أو سمراء صلبة، ومكورة، ومقيدة (دون أن تحاط بكبسولة من النسيج الضام)، وتبدو هذه العقيدة مجعدة في المقطع النسيجي، كما أن حجمها يتراوح ما بين الحجم المجهري إلى عقيدات ذات حجم معتبر؛ فالعقيدة التي بحجم حبة الجريب فروت أو أكبر يمكن أن تحسها المريضة من خلال لمس بطنها.

تحت المجهر، تبدو خلايا الورم كخلايا الرحم الطبيعية (طويلة، مغزلية، والنواة تشبه السيجار)، وتكوّن هذه الخلايا حزم مختلفة الاتجاه (متقاطعة)، هذه الخلايا منتظمة الشكل والحجم، ولها قدرة ضئيلة على الانشطار. هناك ثلاثة أورام حميدة مختلفة: غير النموذجي (العجيب)، والخلوي، والنشيط في الانقسام. ظهور نويات بارزة مع هالات حول النوية يجب أن تغير رأي المتخصص في علم الأمراض ليتحقق من وجود ورم عضلي ليفي وراثي شديد الندرة، وسرطان خلايا الجهاز البولي (متلازمة رييد).[15]
المكان والتصنيف
[عدل]
مكان وحجم نمو الورم هو الذي يحدد وجود الأعراض من عدمه.[2] من الممكن أن يؤدي ورم صغير إلى أعراض إذا نمى داخل جوف الرحم، بينما إذا ظهر ورم كبير الحجم خارج الرحم، من الممكن أن يكون عديم الأعراض. يمكن تصنيف المواقع المختلفة لظهور الورم كالآتي:
- تليف داخل الجدار: يوجد هذا التليف في جدار الرحم، وهو من أكثر الأنواع انتشارا، وعلى الرغم من أنه كبير الحجم فهو لا يتضمن أعراضا. يبدو هذا التليف كعقيدات في الجدار العضلي للرحم، ومع الوقت يمكن أن يمتد إلى الداخل؛ مما قد يسبب تشويه أو استطالة في تجويف الرحم.
- الورم تحت المصل: يقع أسفل الطبقة المخاطية التي تبطن الرحم، ومن الممكن أن يصبح كبيرا جدا، ومن الممكن أن ينمو إلى الخارج على شكل حليمات ليصبح ورما يملك ساقا. وهذه النموات من الممكن أن تنفصل عن الرحم لتصبح أورام ليفية عضلية طفيلية.
- تليف أسفل الطبقة المخاطية: وهو يقع في طبقة العضلات أسفل بطانة الرحم، ويعمل على تشويه جوف الرحم. وحتى أورام صغيرة الحجم في هذا المكان من الممكن أن تؤدي إلى نزيف وعقم. الورم ذو الساق في داخل التجويف الرحمي يسمى ورم ليفي داخلي للتجويف، ومن الممكن أن يمر عبر عنق الرحم.
- أورام عنقية: موجودة في جدار عنق الرحم. ونادرا ما قد تتواجد أورام في الانسجة الداعمة الأخرى (في الرباط الدائري أو الرباط العريض أو في الرباط العجزي الرحمي) والتي تحتوي أيضا انسجة عضلية ملساء.
يمكن أن يكون الورم الليفي متعددا أو وحيدا، ومعظم الأورام الليفية تنمو في الجدار العضلي للرحم، ومع مزيد من النمو؛ بعض هذه الاورام قد تنمو إلى خارج الرحم أو إلى داخل التجويف الرحمي. من التغيرات الثانوية التي قد تحصل للورم: النزيف، والتغير الكيسي، والتكلس، والنخر.
إذا كان الرحم يحتوي على العديد منها، فإننا نكتفي بقولنا أنه ورم ليفي عضلي منتشر.
ورم ليفي عضلي خارج الرحم من أصل رحمي، ورم عضلي ليفي نقيلي
[عدل]وقد يسمى العضلوم الطفيلي، وهو نادر جدا، ولكنه يشخص الآن مع زيادة في عدد الحالات. من الممكن أن يكون له علاقة بالورم العضلي النقيلي، أو مماثلا له. ما زال في معظم حالاته معتمدا على الهرمونات، ولكن من الممكن أن يسبب مضاعفات تهدد الحياة إذا نما في أعضاء أخرى. اقترحت بعض المصادر أن هناك نقطة مشتركة بين الحالات؛ وهي المضاعفات التي تتبع عمليات الجراحة مثل: استئصال الورم العضلي أو استئصال الرحم كاملا. عند استئصال الورم العضلي باستخدام المنظار - عن طريق تفتيته إلى أجزاء صغيرة – فإن خطر حدوث المضاعفات يزداد بشكل ملحوظ.[16][17]
هنالك عدد من الظروف النادرة والتي قد ينتشر فيها الورم العضلي الليفي، ولكنه في الأغلب ورم حميد لا يشكل خطرا الا في بعض مواقعه.[18]
- قد يغزو هذا الورم بعض الأوعية الدموية، ولكن ليس هناك أي خطر لعودته مرة أخرى.
- وهناك أيضا الورم العضلي الليفي الناشئ بدايةً في الرحم، ومن ثم نما داخل الأوردة. إذا وصل هذا الورم إلى القلب فإنه قد يكون مميتا.
- في حالة الورم الليفي العضلي الحميد النقيلي؛ فإنه ينمو في أماكن بعيدة، مثل: الرئتين، والعقد اللمفاوية، إلا أن مصدره ليس معروفا تماما. في حالة شمول الرئتين، فإن ذلك قد يؤدي إلى الموت.
- في حالة الورم الليفي العضلي المنتشر داخل الصفاق؛ فإنه ينمو بشكل منتشر على سطح الصفاق أو سطح الثرب، ومصدر هذا الورم هو االورم الليفي في الرحم. قد يؤدي هذا الورم إلى تحفيز ظهور ورم خبيث، ولكنه يتصرف وكأنه حميد.
تطور المرض
[عدل]
الورم الليفي العضلي هو ورم أحادي النسيلة، وقرابة 40% – 50 % منه يظهر تغيرا في النمط النووي. في حال وجود أورام متعددة؛ فإنها تحتوي على أخطاء جينية غير مرتبطة، وقد لوحظ وجود طفرات معينة في جين البروتين (م ي د 12) في70 % من الحالات.[19] السبب الرئيسي لتكون الأورام الليفية العضلية غير واضح تماما، ولكن النظرية المعمول بها اليوم هي أن الاستعداد الوراثي، والتعرض للهرمونات قبل الولادة، وتأثيرات الهرمونات، وعوامل النمو، وتعاطي هرمون الاستروجين، كلها تؤدي إلى ظهور هذه الأورام. عوامل الخطورة البارزة هي: العرق الإفريقي، السمنة، متلازمة تكيس المبايض، السكري، الضغط، وعدم الإنجاب بتاتا.[20]
من المعتقد أن للاستروجين والبروجستيرون تأثيرا ايجابيا على قدرة الانقسام لخلايا الورم، ولهما القدرة على تحفيز العديد من عوامل النمو (بشكل مباشر أو غير مباشر)، والسايتوكاينات، وعوامل موت الخلية، والكثير من الهرمونات. وزيادة على ذلك، فإن تأثير الاستروجين والبروجستيرون يتم تعديله عن طريق تقاطع العمل بينهما وبين البرولاكتين (هرمون الحليب)؛ والذي يتحكم في المستقبلات النووية لهم. يعتقد أن الاستروجين يحفز النمو عن طريق تحفيز مستقبلات هرمونات النمو التالية: هرمون النمو الشبيه بالانسولين -1، عامل النمو الطلائي، عامل النمو المحول – بيتا 1، عامل النمو المحول – بيتا 3، عامل النمو المشتق من الصفائح الدموية. وكذلك، فإن الاستروجين يحفز البقاء الشاذ لخلايا الورم؛ عن طريق تقليل كمية البروتين «بي 53»، وزيادة إنتاج البروتينات المانعة للموت الخلوي «بي سي بي 4»، ومعاكسة عمل «بي بي ايه ار – غاما». البروجستيرون يعتقد بأنه يؤثر على الورم العضلي الليفي عن طريق زيادة عامل النمو الطلائي، وعامل النمو المحول - بيتا 1، وعامل النمو المحول - بيتا3، وكما أنه – البروجسترون - يحفز النمو والحفاظ على حياة الخلية عن طريق تحفيز عمل وإنتاج البروتين «بي سي ال -2» وتخفيض عمل العامل الناخر للاورام «تي ان اف الفا». ويعتقد أن البروجستيرون يعاكس النمو عن طريق معاكسة عمل العامل المشابه للانسولين -1.[21][22] يزداد تمثيل عامل النمو المتفاعل المحول «تي جي أي اف» في الورم مقارنة ببطانة الرحم[23]، وهو«تي جي أي اف» عبارة عن مثبط قوي لل «تي جي اف – بيتا» الموجود في خلايا البطانة.[23]
يتم التعبير عن انزيم اروماتز و17-بيتا هيدروكسي ستيرويد في الأورام الليفية، مشيرا إلى أن الأورام الليفية يمكنها تحويل الاندروستيرون إلى استراديول.[24] وقد تم توضيح آلية عمل مماثلة في بطانة الرحم وأمراض الرحم أخرى.[25] تعتبر مثبطات الإنزيم أروماتيز تعتبر علاجا، وعلى جرعة معينة فإنه يثبط إفراز الاستروجين بالكامل في الورم، ولكن لا يؤثر على إفرازه في المبايض. تمثيل الأروماتيز بشكل كبير يعد ظاهرة لدى النساء الأمريكيات من أصل أفريقي.[26]
الجينات والوراثة تؤخذان بعين الاعتبار في هذا النوع من الأورام، وهناك العديد من المشاهدات الوبائية تدل على وجود استعداد وراثي له؛ خاصة في نشأته لدى سيدات صغيرات السن. الأقرباء من الدرجة الأولى لديهم خطر 2.5 للإصابة به، وإذا ظهر في سن مبكرة فإن خطر الإصابة يصل إلى 6 أضعاف. التوائم المتطابقون لديهم نسبة موائمة مضاعفة لاستئصال الرحم مقارنة بالتوائم غير المتطابقين.[27]
امتداد الورم يكون بالانقسام البطيء للخلايا وإنتاج كمية كبيرة من الحشوة بين الخلايا.[28]
كمية قليلة من الخلايا في الورم تعتبر خلايا جذعية أو خلايا مولدة، وهي تشارك بشكل واضح في نمو الورم المعتمد على الستيرويدات الموجودة في المبايض، وهذه الخلايا تفتقر إلى مستقبلات الاستروجين الفا ومستقبلات البروجستيرون، ولكنها تعتمد على وجود كمية كبيرة من هذه المستقيلات في الخلايا المجاورة المتمايزة؛ لتفعيل مسار الاستروجين والبروجستيرون بواسطة الإشارة نظيرة الصماوية.[28]
التشخيص
[عدل]الفحص باليدين قادر على تحديد وجود الأورام كبيرة الحجم، يعد استخدام الموجات فوق الصوتية أداة التشخيص المثالية لتقدير وجود الورم. يصف التخطيط بالموجات الصوتية الورم على أنه كتل بؤرية غير متجانسة النسيج، والتي تؤدي إلى تظليل في الإشعاعات فوق الصوتية، ويمكن تحديد موقع وأبعاد الورم، كما يمكن استعمال التصوير بالرنين المغناطيسي لوصف الورم وأبعاده وموقعه في الرحم. طرق التصوير لا يمكنها التمييز بدقة بين الورم الخبيث والحميد، على الرغم من أن الورم الخبيث يعد نادرا. النمو السريع أو المفاجئ بعد انقطاع الطمث سوف يزيد الشك من وجود ورم خبيث في الرحم، وقد يكون هناك آثار غزو للأنسجة المحيطة. نادرا ما يتم أخذ خزعة للتشخيص، وإذا تم أخذها، فإنها لا تكون تشخيصية، وإذا لم يكن هنالك تشخيص واضح بعد التصوير، يتم الإيعاز بالجراحة. ومن طرق التصوير الأخرى التي لها أهمية في تقييم الورم الذي يؤثر على التجويف الرحمي: تصوير الرحم وقنوات فالوب، والتصوير بالموجات الصوتية بعد ملئ الرحم بسائل.
-
ورم ليفي عضلي كبير الحجم (9 سم )، والذي يسبب متلازمة احتقان الحوض كما يظهر في صورة محورية.
-
ورم ليفي عضلي كبير جدا ( 9 سم )، والذي يسبب متلازمة احتقان الحوض كما يُرى في صورة الموجات فوق الصوتية.
-
ورم ليفي عضلي كبير تحت الطبقة المخاطية يملأ معظم التجويف الرحمي.
-
ورم ليفي عضلي صغير كما يشاهد في الجدار العضلي للرحم في الصورة بالموجات فوق الصوتية بشكل مقطعي.
-
ورمان ليفيان عضليان متكلسان في الرحم.
-
ورم ليفي عضلي بحجم الإبهام، بقطر 5 سم تحت المصل.
الاضطرابات المصاحبة
[عدل]الأورام التي تؤدي إلى نزيف مهبلي حاد من الممكن أن تؤدي إلى فقر الدم وفقر الحديد. وبسبب الضغط قد تنتج بعض الأعراض في الجهاز الهضمي، مثل: الإمساك والانتفاخ. أيضاً، الضغط على الحالب قد يؤدي إلى موه الكليتين. وقد يحدث الورم وبتزامن مع مرض بطانة الرحم الهاجرة؛ والذي قد يؤدي بدوره إلى العقم. وقد يخطئ تشخيص العضال الغدي باعتباره ورماً ليفيا عضليا، كما انه من الممكن أن يتزامن معه. في بعض الحالات النادرة جدا، قد ينتج الورم الخبيث في بطانة الرحم.29 في بعض الحالات الشحيحة، يمكن أن يتواجد الورم كجزء أو كعرض ل «متلازمة سرطان خلايا الجهاز البولي والورم العضلي الوراثي».
العلاج
[عدل]معظم الأورام الليفية العضلية لا تحتاج إلى علاج إذا لم يظهر لها أعراض. وبعد انقطاع الطمث يقل حجم الورم، وعادةً، لا يؤدي ذلك إلى مشاكل. وفي الحالات التي تظهر فيها أعراض، فإنه يكتفى بالجراحة أو بانصمام الشريان الرحمي، وكلاهما يؤدي إلى نفس النتيجة.[29]
يمكن علاج الأورام الليفية التي تسبب أعراضاً؛ كالتالي : - أدوية للسيطرة على الأعراض -أدوية لتصغير الورم -تدميره بالموجات فوق الصوتية -استئصال الورم أو فصله باستعمال الموجات المتكررة -استئصال الرحم -انصمام الشريان الرحمي
الأدوية
[عدل]كثير من الأدوية يمكن استعمالها للسيطرة على الأعراض؛ فالأدوية غير الستيرويدية المضادة للالتهاب يمكن استخدامها لتقليل الآلام المصاحبة للحيض، وموانع الحمل توصف لتقليل النزيف والألم.[5] أما فقر الدم، فيمكن معالجته بإعطاء الحديد للمريض.
هنالك اجهزة توضع داخل الرحم وتفرز «ليفونورجيسترل»، وهي تستعمل للحد من النزيف وتحسين الأعراض. أما بالنسبة للآثار الجانبية لليفونورجيسترل (وهو بروجستين)، فهي محدودة جدا؛ حيث أن هذه الأجهزة تفرز الليفونورجيسترل موضعيا وبتراكيز قليلة.[30] كما أن هناك دليل معتمد بأن استعمال الأجهزة داخل الرحمية والتي تفرز ليفونورجيسترل يؤدي إلى تحسين الأعراض عند النساء اللاتي يعانين من هذه الأورام. على الرغم من أن معظم الدراسات التي أجريت على الأجهزة داخل الرحمية والمفرزة لليفونورجيسترل لم تكن على نساء مصابات بالورم، إلا أن بعض الدراسات خرجت بنتائج جيدة جيدا، خاصة تلك التي أجريت على النساء المصابات بالورم؛ حيث أظهرت تراجعاً كبيراً للورم.[31][32]
«كابيرجولاين»: أظهرت دراستان أنه وخلال استعماله بتراكيز متوسطة ومحتملة، يؤدي إلى تصغير حجم الورم وبشكل فعال. أما طريقة عمله فهي غير واضحة.[31]
«اليبرستال اسيتيت»: وهو دواء صناعي يعمل كمعدل انتقائي لمستقبلات البروجستيرون، وقد تم اختباره في العديد من التجارب، وقد أثبت قدرته على تصغير حجم الورم.[33]
«دانازول»: دواء فعال لتصغير حجم الورم وتقليل الأعراض. استعماله محدود لوجود أعراض جانبية مزعجة. يعتقد بأن طريقة عمله تعتمد على التضاد مع الاستروجين. وفي أخبار حديثة، يزعم بأن ملف السلامة والآثار الجانبية للدواء من الممكن تحسينه عن طريق جرعات أكثر حذرا.[31]
مضاهي الهرمون المحرر لموجهة الغدد التناسلية: يسبب تراجعاً في الورم؛ عن طريق تقليل كمية الاستروجين. وبسبب وجود اثار جانبية؛ فإنه غالبا لا يتم وصفه للمرضى إلا قبل العملية؛ كي يؤدي إلى تصغير حجم الورم والرحم. وهو يستخدم كحد أقصى لمدة 6 أشهر أو أقل؛ وذلك لأنه قد يؤدي - مع الاستخدام المستمر - إلى التسبب بهشاشة العظام أو قد يسبب مضاعفات ما بعد انقطاع الحيض، أما التأثيرات الجانبية الرئيسية له، فهي أعراض ما بعد انقطاع الطمث، إلا أن هذه الأعراض تكون مؤقتة ولا تدوم. في معظم الحالات، فإن الورم ينمو مرة أخرى بعد ايقاف الاستخدام، ولكن بعض المنافع المهمة للدواء قد تدوم لمدة أطول في بعض الحالات. هنالك العديد من التركيبات، فمثلا: هنالك مضاهي الهرمون المحرر لموجهة الغدد التناسلية مع تعويض الهرمون بكميات قليلة (كنوع من المعالجة)، وأيضا، توضع إضافات أخرى مع مضاهي الهرمون، مثل: تيبولون، رالوكسيفين، البروجستيرون وحده، الاستروجين وحده، أو الاستروجين مع البروجستيرون.[31]
مضادات البروجستيرون، مثل : ميفيبرستون الذي تم اختباره؛ فهو لديه القدرة على التقليل من بعض الأعراض والذي يعمل على تحسين نوعية حياة المريضة، إلا أنه وبسبب الأعراض الجانبية له على المستوى النسيجي في عدد من التجارب، فإنه يمنع استعماله خارج نطاق الأبحاث.[34][35] الورم يمكن أن يعود إذا تم ايقاف الدواء المضاد للبروجستيرون.[28]
مضادات إنزيم الأروماتيز قد تم اختبارها للتقليل من الورم. يعتقد بأن تأثيره يرجع إلى التقليل من مستويات الاستروجين في الدم جزئيا وأيضا التقليل من صناعة الإنزيم الاروماتيز في خلايا الورم 33، وعلى عكس ذلك فإن الورم يعود للنمو مرة أخرى بعد ايقاف الدواء.[31] However, fibroid growth has recurred after treatment was stopped.[28] دلت تجربة استعمال مضادات إنزيم الاروماتيز في مرض الانتباذ الرحمي البطاني أنه يمكن استعماله مع مضادات الإباضة التي تحصل بفعل البروجستيرون ويكون فعالا.
انصمام الشريان الرحمي
[عدل]انصمام الشريان الرحمي هو إجراء موسع يمنع تدفق الدم إلى الأورام الليفية، وبالتالي يمكن التعامل معهم..[36] النتائج على المدى الطويل فيما يتعلق بمدى رضا الناس مع إجراءات مماثلة لتلك التي من الجراحة.[37] وهناك دليل مبدئي أن الجراحة التقليدية قد يؤدي إلى خصوبة أفضل.[37] ووجد الاستعراض واحد أن انصمام الشريان الرحمي يضاعف من المخاطر المستقبلية للإجهاض..[38] ويبدو أيضا أنها تحتاج إلى مزيد من الإجراءات المتكرارة فيما لو تم إجراء الجراحة في البداية.[37] وهناك شخص عادة التعافي من الإجراء في غضون أيام قليلة.
في بعض الأحيان؛ الإغلاق بالتنظير للشرايين الرحمية، تعتبران أقل اجتياحا؛ لتقليل التغذية الدموية للرحم عن طريق عملية صغيرة والتي يمكن أن تتم من خلال المهبل أو بالتنظير. المبدأ الرئيسي لها قد يبدو شبيها بانصمام الشريان الرحمي ولكنها أسهل وأقل ضررا.[39]قالب:Primary source-inline[40]
استئصال الورم من الرحم
[عدل]وهي عملية جراحية لإزالة واحد أو أكثر من هذا الأوارم. ويلجأ الأطباء لهذا الخيار عندما تستنفد المرأة فرصتها في الحلول الأخرى، والتي تريد فيها أن تحافظ على خصوبتها.[41]
وهناك ثلاثة أنواع من استئصال الورم :
- استئصال الورم عن طريق تنظير الرحم (ويسمى البتر عن طريق عنق الرحم): حيث تتم إزالته إما عن طريق منظارالقطع؛ وهو منظار يتم إدخاله عن طريق المهبل والعنق، والذي يستعمل الطاقة الكهربائية عالية التردد لقص الخلايا، أوعن طريق أداة مشابهة له.
- استئصال الورم باستعمال المنظار؛ والتي تتم عن طريق شق صغير إلى جانب الصرة، ويستعمل الطبيب المنظار والأدوات الجراحية لإزالة الورم. وقد اشارت الدراسات بأن إزالة الورم عن طريق المنظار تعتبر الطريقة الأقل نسبة في عدد الإصابات، كما أن المريضة تستعيد حالتها الصحية بشكل أسرع من الجراحة المباشرة في البطن.[42]
- الجراحة المباشرة في البطن (وتسمى أيضا جراحة البطن المفتوح لاستئصال الورم في الرحم): وهي من أكثرالطرق اجتياحا لإزالة الورم؛ فالطبيب يقوم بعمل شق في البطن ثم يبدأ بإزالة الورم مباشرة.
يعتبر استئصال الورم باستعمال المنظار أقل الطرق ألما، ويمضي المريض خلالها فترة أقصر في المستشفى من طريقة البطن المفتوح.[43]
استئصال الرحم
[عدل]
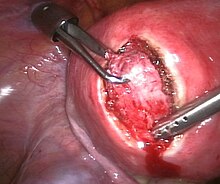
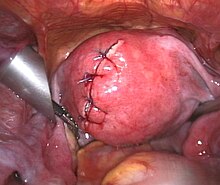
وهي تعتبر الطريقة التقليدية لإزالة الورم. على الرغم من أنها الآن تعتبر كخيار أخير، إلا أن الورم الليفي العضلي يعتبر من الأسباب الرئيسية في التسبب بإزالة الرحم في الولايات المتحدة.
استئصال البطانة الرحمية
[عدل]يمكن استعمال هذه الطريقة فقط في حالة وجود الورم داخل الرحم دون اختراقه طبقات الرحم وحجمه تقريبا صغير. معدلات فشل هذه الطريقة وعودة الورم عالية في حالة وجود ورم كبير أو اختراقه طبقات الرحم.
الأمواج فوق الصوتية المركزة والموجهة بالرنين المغتاطيسي
[عدل]هذه الطريقة لا تتطلب عمل شق أو جرح، ولكنها تستعمل موجات فوق صوتية عالية التركيز لتدمير النسيج، بالإضافة إلى التصوير بالرنين المغناطيسي والذي يستعمل لإدارة ومراقبة العلاج. خلال الإجراء، يتم التحكم بتوصيل الموجات فوق الصوتية المركزة عن طريق التصوير بالرنين المغناطيسي.[44] المريضات اللواتي يملكن ورما بأعراض، واللواتي يرغبن بعلاج غير اجتياحي - من دون شق- ولا يملكن مانعا من استعمال التصوير بالرنين المغناطيسي هن المرشحات لاستعمال الأمواج فوق الصوتية المركزة والموجهة بالرنين المغتاطيسي، وحوالي 60% من المريضات يتأهلن. وهي عملية تتم في العيادات الخارجية للمرضى، وتأخذ حوالي ساعة إلى 3 ساعات اعتمادا على حجم الورم، وهو آمن وفعال بنسبة 75%.[45] ويستمر التحسن في الأعراض لمدة سنتين اضافيتين.[46] أما الحاجة للمزيد من المعالجة، فتختلف من 16-20%، وهي تعتمد على حجم الورم الذي يمكن إزالته بأمان، وكلما زادت الكمية المزالة، قلت احتمالية إعادة استعمال المعالجة.[47] ليس هنالك أي محاولة عشوائية للاختيار بين طريقة انصمام الشريان الرحمي وبين استعمال الأمواج فوق الصوتية المركزة والموجهة بالرنين المغتاطيسي؛ هنالك العديد من المراكز التي تحقق في فعالية كلتا الطريقتين.
التنبؤ
[عدل]حوالي واحد من بين الف ورم يكون أو يصبح خبيثاً،[5] وخاصة ساركومة الخلية العضلية في علم الأنسجة.[5] ويعتبر نمو الورم بعد انقطاع الطمث دلالة على أن هذا الورم خبيث.6 لا يوجد إجماع بين المتخصصين في علم الأمراض حول تحول الورم الحميد إلى خبيث في الخلايا العضلية.
الانتقال
[عدل]هنالك بعض الحالات النادرة والتي يمكن أن ينتقل فيها الورم الليفي العضلي، ولكنه يبقى حميدا، ولكن يمكن أن يكون خطيرا حسب الموقع الذي ينتقل إليه.[18] انظر الاورام خارج الرحم
علم الأوبئة
[عدل]حوالي %20 – 80% من النساء يتعرضن للورم في سن الخمسين.[1] في عام 2013 قدر عدد النساء المصابات ب 171مليون امرأة. وهو يحدث غالبا في سن الإنجاب المتوسط أو المتأخر ،[1] وبعد انقطاع الطمث فإنه يصغر حجمه.[1]
الولايات المتحدة الأمريكية
[عدل]80% من النساء الأمريكيات اللواتي ينحدرن من أصول أفريقية سيصبن بورم ليفي عضلي في نهاية الاربيعينيات من عمرهن، وذلك حسب المؤسسة الوطنية في علوم الصحة البيئية.[48]، كما أن احتمالية إصابتهن بالورم أكثر بضعفين أو ثلاثة من النساء ذوات الأصول القوقازية.[8][49] الورم في النساء الأمريكيات من أصل أفريقي يبدو أنه يبدأ في عمر صغير، وينمو سريعا، واحتماليته أكبر ليظهر أعراضا ؛.[50] هذا يؤدي إلى معدل أعلى من العمليات الجراحية لهن؛ سواءً لاسئصال الرحم أو لاستئصال الورم،[51] وهذا يعرضهن أكثر لمخاطر علاج الخصوبة، ويرفع من خطر الولادة القيصرية أو الولادة المبكرة لديهن.[51]
كما أنه من غير الواضح سبب هذه الظاهرة، بعض الدراسات تقول بأن النساء اللواتي يعانين السمنة أو ارتفاع ضغط الدم هن أكثر عرضة للإصابة بالورم.[51]
المجتمع والثقافة
[عدل]قانون الولايات المتحدة
[عدل]تم قراءة مشروع القانون 2005.س.1289 مرتين، وتمت الإشارة إلى لجنة الصحة والعمل والتقاعد، ولكنه لم يخضع لتصويت مجلس الشيوخ أو النواب. ذكر بحث الورم الليفي العضلي المقترح وقانون التعليم أن 5 مليارات دولار تصرف سنويا على عمليات استئصال الرحم، والتي تؤثر على 77% من الأمريكين الأفارقة، وعلى 7% من الأمريكان من أصل قوقازي. ودعا مشروع القانون لتمويل الأغراض البحثية والتعليمية،[52] ونص أيضا على أن يتم تخصيص 5 ملايين دولار من أصل 28 مليون دولار للورم الليفي العضلي.
حيوانات أخرى
[عدل]يعتبر هذا الورم نادرا في الثدييات الأخرى، وعلى الرغم من ذلك، فقد تم مشاهدته في بعض الكلاب وبعض الفقمات الرمادية في البلطيق.[53]
بحث
[عدل]معدلات مستقبلات هرمون البروجسترون، مثل progenta، قيد التحقيق. يتم اختبار آخر البروجسترون الانتقائي مستقبلات المغير asoprisnil حاليا مع نتائج واعدة كما يحتمل أن تستخدم كعلاج للاورام ليفية - الأمل هو أنه سيوفر مزايا البروجسترون خصم دون آثارها الضارة.[31]
انظر أيضا
[عدل]المراجع
[عدل]- ^ ا ب ج د ه و ز ح "Uterine fibroids fact sheet". Office on Women's Health. 15 يناير 2015. مؤرشف من الأصل في 2017-01-02. اطلع عليه بتاريخ 2015-06-26.
- ^ ا ب Wallach EE، Vlahos NF (أغسطس 2004). "Uterine myomas: an overview of development, clinical features, and management". Obstet Gynecol. ج. 104 ع. 2: 393–406. DOI:10.1097/01.AOG.0000136079.62513.39. PMID:15292018.
- ^ "Benign Uterine Fibroid Tumors (What to Know)". Women's Health. about.com. مؤرشف من الأصل في 2016-03-04.
- ^ Reproductive Surgery in Assisted Conception. 2015. ص. 107. ISBN:9781447149538. مؤرشف من الأصل في 2020-04-03.
- ^ ا ب ج د ه American Society of Reproductive Medicine Patient Booklet: Uterine Fibroids, 2003 نسخة محفوظة 25 أكتوبر 2006 على موقع واي باك مشين.
- ^ Segars JH، Parrott EC، Nagel JD، Guo XC، Gao X، Birnbaum LS، Pinn VW، Dixon D (2014). "Proceedings from the Third National Institutes of Health International Congress on Advances in Uterine Leiomyoma Research: comprehensive review, conference summary and future recommendations". Human Reproduction Update. ج. 20 ع. 3: 309–333. DOI:10.1093/humupd/dmt058. PMC:3999378. PMID:24401287.
- ^ Segars JH، Parrott EC، Nagel JD، Guo XC، Gao X، Birnbaum LS، Pinn VW، Dixon D (2014). "Proceedings from the Third National Institutes of Health International Congress on Advances in Uterine Leiomyoma Research: comprehensive review, conference summary and future recommendations". Hum. Reprod. Update. ج. 20 ع. 3: 309–33. DOI:10.1093/humupd/dmt058. PMC:3999378. PMID:24401287.
- ^ ا ب Uterine Fibroids على الطبعة المهنية من دليل ميرك للتشخيص والعلاج
- ^ "Uterine fibroids fact sheet". womenshealth.gov. مؤرشف من الأصل في 2016-12-24.
- ^ Medikare، V؛ Kandukuri، LR؛ Ananthapur، V؛ Deenadayal، M؛ Nallari، P (يوليو 2011). "The genetic bases of uterine fibroids; a review". Journal of reproduction & infertility. ج. 12 ع. 3: 181–91. PMC:3719293. PMID:23926501. مؤرشف من الأصل في 2020-04-03.
- ^ Eggert SL، Huyck KL، Somasundaram P، Kavalla R، Stewart EA، Lu AT، Painter JN، Montgomery GW، Medland SE، Nyholt DR، Treloar SA، Zondervan KT، Heath AC، Madden PA، Rose L، Buring JE، Ridker PM، Chasman DI، Martin NG، Cantor RM، Morton CC (أكتوبر 2012). "Genome-wide linkage and association analyses implicate FASN in predisposition to Uterine Leiomyomata". Am. J. Hum. Genet. ج. 91 ع. 4: 621–8. DOI:10.1016/j.ajhg.2012.08.009. PMC:3484658. PMID:23040493.
- ^ Tolvanen J، Uimari O، Ryynänen M، Aaltonen LA، Vahteristo P (2012). "Strong family history of uterine leiomyomatosis warrants fumarate hydratase mutation screening". Human Reproduction. ج. 27 ع. 6: 1865–9. DOI:10.1093/humrep/des105. PMID:22473397.
- ^ Toro JR، وآخرون (2003). "Mutations in the fumarate hydratase gene cause hereditary leiomyomatosis and renal cell cancer in families in North America". Am J Hum Genet. ج. 73 ع. 1: 95–106. DOI:10.1086/376435. PMC:1180594. PMID:12772087.
- ^ "نسخة مؤرشفة". مؤرشف من الأصل في 2012-02-24. اطلع عليه بتاريخ 2016-01-22.[استشهاد منقوص البيانات]
- ^ Garg K، Tickoo SK، Soslow RA، Reuter VE (2011). "Morphologic Features of Uterine Leiomyomas Associated with Hereditary Leiomyomatosis and Renal Cell Carcinoma Syndrome". The American Journal of Surgical Pathology. ج. 35 ع. 8: 1235–1237. DOI:10.1097/PAS.0b013e318223ca01. PMID:21753700.
- ^ Cucinella G، Granese R، Calagna G، Somigliana E، Perino A (2011). "Parasitic myomas after laparoscopic surgery: An emerging complication in the use of morcellator? Description of four cases". Fertility and Sterility. ج. 96 ع. 2: e90–e96. DOI:10.1016/j.fertnstert.2011.05.095. PMID:21719004.
- ^ Nezhat C، Kho K (2010). "Iatrogenic Myomas: New Class of Myomas?". Journal of Minimally Invasive Gynecology. ج. 17 ع. 5: 544–550. DOI:10.1016/j.jmig.2010.04.004. PMID:20580324.
- ^ ا ب Fletcher's Diagnostic Histopathology of Tumors (ط. 3rd). ص. 692–4.
- ^ Mäkinen N، Mehine M، Tolvanen J، Kaasinen E، Li Y، Lehtonen HJ، Gentile M، Yan J، Enge M، Taipale M، Aavikko M، Katainen R، Virolainen E، Böhling T، Koski TA، Launonen V، Sjöberg J، Taipale J، Vahteristo P، Aaltonen LA (2011). "MED12, the Mediator Complex Subunit 12 Gene, is Mutated at High Frequency in Uterine Leiomyomas". Science. ج. 334 ع. 6053: 252–255. Bibcode:2011Sci...334..252M. DOI:10.1126/science.1208930. PMID:21868628.
- ^ Okolo S (2008). "Incidence, aetiology and epidemiology of uterine fibroids". Best practice & research. Clinical obstetrics & gynaecology. ج. 22 ع. 4: 571–588. DOI:10.1016/j.bpobgyn.2008.04.002. PMID:18534913.
- ^ Rein MS (2000). "Advances in uterine leiomyoma research: the progesterone hypothesis". Environmental health perspectives. 108 Suppl 5: 791–3. DOI:10.2307/3454308. JSTOR:3454308. PMID:11035984.
- ^ Maruo T، Ohara N، Wang J، Matsuo H (2004). "Sex steroidal regulation of uterine leiomyoma growth and apoptosis". Human reproduction update. ج. 10 ع. 3: 207–220. DOI:10.1093/humupd/dmh019. PMID:15140868.
- ^ ا ب Yen-Ping Ho J، Man WC، Wen Y، Polan ML، Shih-Chu Ho E، Chen B (يونيو 2009). "Transforming growth interacting factor expression in leiomyoma compared with myometrium". Fertil. Steril. ج. 94 ع. 3: 1078–83. DOI:10.1016/j.fertnstert.2009.05.001. PMC:2888713. PMID:19524896.
- ^ Shozu M، Murakami K، Inoue M (2004). "Aromatase and Leiomyoma of the Uterus". Seminars in Reproductive Medicine. ج. 22 ع. 1: 51–60. DOI:10.1055/s-2004-823027. PMID:15083381.
- ^ Bulun SE، Yang S، Fang Z، Gurates B، Tamura M، Zhou J، Sebastian S (2001). "Role of aromatase in endometrial disease". The Journal of Steroid Biochemistry and Molecular Biology. ج. 79 ع. 1–5: 19–25. DOI:10.1016/S0960-0760(01)00134-0. PMID:11850203.
- ^ Ishikawa H، Reierstad S، Demura M، Rademaker AW، Kasai T، Inoue M، Usui H، Shozu M، Bulun SE (2009). "High Aromatase Expression in Uterine Leiomyoma Tissues of African-American Women". Journal of Clinical Endocrinology & Metabolism. ج. 94 ع. 5: 1752–1756. DOI:10.1210/jc.2008-2327. PMC:2684481. PMID:19240151.
- ^ Hodge JC، Morton CC (2007). "Genetic heterogeneity among uterine leiomyomata: insights into malignant progression". Human Molecular Genetics. 16 Spec No 1: R7–13. DOI:10.1093/hmg/ddm043. PMID:17613550.
- ^ ا ب ج د Moravek MB، Yin P، Ono M، Coon V JS، Dyson MT، Navarro A، Marsh EE، Chakravarti D، Kim JJ، Wei JJ، Bulun SE (2014). "Ovarian steroids, stem cells and uterine leiomyoma: therapeutic implications". Human Reproduction Update. ج. 21 ع. 1: 1–12. DOI:10.1093/humupd/dmu048. PMID:25205766.
- ^ Gupta JK، Sinha A، Lumsden MA، Hickey M (26 ديسمبر 2014). "Uterine artery embolization for symptomatic uterine fibroids". The Cochrane database of systematic reviews. ج. 12: CD005073. DOI:10.1002/14651858.CD005073.pub4. PMID:25541260.
- ^ Zapata LB، Whiteman MK، Tepper NK، Jamieson DJ، Marchbanks PA، Curtis KM (2010). "Intrauterine device use among women with uterine fibroids: a systematic review☆". Contraception. ج. 82 ع. 1: 41–55. DOI:10.1016/j.contraception.2010.02.011. PMID:20682142.
- ^ ا ب ج د ه و Sankaran S، Manyonda IT (2008). "Medical management of fibroids" (PDF). Best Pract Res Clin Obstet Gynaecol. ج. 22 ع. 4: 655–76. DOI:10.1016/j.bpobgyn.2008.03.001. PMID:18468953. مؤرشف من الأصل (PDF) في 2016-04-22.
- ^ Kailasam C، Cahill D (2008). "Review of the safety, efficacy and patient acceptability of the levonorgestrel-releasing intrauterine system". Patient preference and adherence. ج. 2: 293–302. DOI:10.2147/ppa.s3464. PMC:2770406. PMID:19920976.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ Talaulikar، VS؛ Manyonda، IT (أغسطس 2012). "Ulipristal acetate: a novel option for the medical management of symptomatic uterine fibroids". Advances in therapy. ج. 29 ع. 8: 655–63. DOI:10.1007/s12325-012-0042-8. PMID:22903240.
- ^ Tristan M، Orozco LJ، Steed A، Ramírez-Morera A، Stone P (2012). Orozco LJ (المحرر). "Mifepristone for uterine fibroids". Cochrane database of systematic reviews (Online). ج. 8: CD007687. DOI:10.1002/14651858.CD007687.pub2. PMID:22895965.
- ^ Malartic C، Morel O، Akerman G، Tulpin L، Desfeux P، Barranger E (2008). "La mifépristone dans la prise en charge des fibromes utérins". Gynécologie Obstétrique & Fertilité. ج. 36 ع. 6: 668–74. DOI:10.1016/j.gyobfe.2008.01.017. PMID:18539512.
- ^ "The Embolisation Process". FEmISA: Fibroid Embolisation: Information, Support, Advice. مؤرشف من الأصل في 2018-07-01.
- ^ ا ب ج Gupta، JK؛ Sinha، A؛ Lumsden، MA؛ Hickey، M (26 ديسمبر 2014). "Uterine artery embolization for symptomatic uterine fibroids". The Cochrane database of systematic reviews. ج. 12: CD005073. DOI:10.1002/14651858.CD005073.pub4. PMID:25541260.
- ^ Homer، Hayden؛ Saridogan، Ertan (يونيو 2010). "Uterine artery embolization for fibroids is associated with an increased risk of miscarriage" (PDF). Fertility and Sterility (Systematic review). ج. 94 ع. 1: 324–330. DOI:10.1016/j.fertnstert.2009.02.069. PMID:19361799. اطلع عليه بتاريخ 2015-05-12.
- ^ Liu WM، Ng HT، Wu YC، Yen YK، Yuan CC (2001). "Laparoscopic bipolar coagulation of uterine vessels: a new method for treating symptomatic fibroids". Fertility and Sterility. ج. 75 ع. 2: 417–22. DOI:10.1016/S0015-0282(00)01724-6. PMID:11172850.
- ^ Akinola OI، Fabamwo AO، Ottun AT، Akinniyi OA (2005). "Uterine artery ligation for management of uterine fibroids". International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics. ج. 91 ع. 2: 137–40. DOI:10.1016/j.ijgo.2005.07.012. PMID:16168993.
- ^ Metwally M، Cheong YC، Horne AW (2012). Metwally M (المحرر). "Surgical treatment of fibroids for subfertility". Cochrane database of systematic reviews (Online). ج. 11: CD003857. DOI:10.1002/14651858.CD003857.pub3. PMID:23152222.
- ^ Agdi M، Tulandi T (أغسطس 2008). "Endoscopic management of uterine fibroids". Best Pract Res Clin Obstet Gynaecol. ج. 22 ع. 4: 707–16. DOI:10.1016/j.bpobgyn.2008.01.011. PMID:18325839.
- ^ Bhave Chittawar P، Franik S، Pouwer AW، Farquhar C (21 أكتوبر 2014). "Minimally invasive surgical techniques versus open myomectomy for uterine fibroids". The Cochrane database of systematic reviews. ج. 10: CD004638. DOI:10.1002/14651858.CD004638.pub3. PMID:25331441.
- ^ Beck، Melinda (20 يناير 2010). "A New Treatment to Help Women Avoid Hysterectomy". The Wall Street Journal. مؤرشف من الأصل في 2020-04-03.
- ^ "FDA Approves New Device to Treat Uterine Fibroids" (Press release). FDA. 22 أكتوبر 2004. مؤرشف من الأصل في 2009-05-15. اطلع عليه بتاريخ 2008-05-26.
- ^ Shen SH, Fennessy F, McDannold N, Jolesz F, Tempany C (أبريل 2009). "Image-guided thermal therapy of uterine fibroids". Seminars in ultrasound, CT, and MR. ج. 30 ع. 2: 91–104. DOI:10.1053/j.sult.2008.12.002. PMC:2768544. PMID:19358440.
- ^ Kurashvili J, Stepanov A, Kulabuchova E, Batarshina O (2014). "MRgFUS for Uterine Myomas: Safety, Effectiveness and Pathogenesis". Journal of Therapeutic Ultrasound. ج. 2 ع. Suppl 1: A1. DOI:10.1186/2050-5736-2-S1-A1.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: دوي مجاني غير معلم (link) - ^ "Helping Black Women Recognize, Treat Fibroids". NPR. مؤرشف من الأصل في 2018-11-07. اطلع عليه بتاريخ 2011-03-30.
- ^ "African American Women and Fibroids". Philadelphia Black Women's Health Project. مؤرشف من الأصل في 2017-09-28. اطلع عليه بتاريخ 2011-03-30.
- ^ "Minority Women's Health". Women's Health.gov. مؤرشف من الأصل في 2016-03-03.
- ^ ا ب ج "Black Women and High Prevalence of Fibroids". Fibroid Treatment Collective. 29 نوفمبر 2010. مؤرشف من الأصل في 2013-05-23. اطلع عليه بتاريخ 2011-03-30.
- ^ http://officeofbudget.od.nih.gov/pdfs/FY11/Approp.%20History%20by%20IC%20(FINAL).pdf[استشهاد منقوص البيانات]
- ^ Bäcklin BM، Eriksson L، Olovsson M (مارس 2003). "Histology of uterine leiomyoma and occurrence in relation to reproductive activity in the Baltic gray seal (Halichoerus grypus)". Vet. Pathol. ج. 40 ع. 2: 175–80. DOI:10.1354/vp.40-2-175. PMID:12637757.