Estructura cristalina
| Estructura cristalina | |
|---|---|
| estructura | |
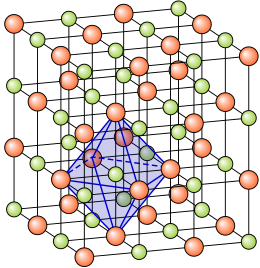 | |

La estructura cristalina ye la forma sólida de cómo s'ordenar y empaquetan los átomos, molécules, o iones. Estos son empaquetados de manera ordenada y con patrones de repetición que s'estienden nos trés dimensiones del espaciu. La cristalografía ye l'estudiu científicu de los cristales y la so formación.

L'estáu cristalín de la materia ye'l de mayor orde, esto ye, onde les correlaciones internes son mayores. Esto refléxase nes sos propiedaes anisótropas y discontinues. Suelen apaecer como entidaes pures, homoxénees y con formes xeométriques definíes (vezu) cuando tán bien formaos. Sicasí, la so morfoloxía esterna nun ye abonda pa evaluar la denomada cristalinidad d'un material.
El grupu más pequeñu de partícules nel material que constitúi'l patrón repetitivu ye la celda unitaria de la estructura. La celda unitaria define dafechu la simetría y la estructura de tola rede cristalina, que se constrúi por aciu la traducción repetitiva de la celda unitaria a lo llargo de les sos exes principales. Dizse que los patrones de repetición tán asitiaos nos puntos de la rede de Bravais. Los llargores de les exes principales o cantos de la celda unitaria y los ángulos ente ellos son les constantes de la rede, tamién llamaes parámetros de la rede.
Estructura
[editar | editar la fonte]Los cristales, átomos, iones o molécules se empaquetan y dan llugar a motivos que se repiten del orde de 1 ångström = 10-10 cm; a esta repetitividad, en tres dimensiones, denominar rede cristalina.
El grupu más pequeñu de partícules nel material que constitúi'l patrón repetitivu ye la celda unitaria o unidá elemental la cual xenera tola rede (tol cristal). La celda unitaria define dafechu la simetría y la estructura de tola rede cristalina, que se constrúi por aciu la traducción repetitiva de la celda unitaria a lo llargo de les sos exes principales. Dizse que los patrones de repetición tán asitiaos nos puntos de la rede de Bravais.
La estructura cristalina y la simetría xueguen un papel na determinación de munches propiedaes físiques, tales como dixebra, estructura de banda electrónica y tresparencia óptica.
Na estructura cristalina (ordenada) de los compuestos inorgánicos, los elementos que se repiten son átomos o iones enllazaos ente sigo, de manera que xeneralmente nun s'estremen unidaes aisllaes; estos enllaces apurren la estabilidá y durez del material. Nos compuestos orgánicos estrémense claramente unidaes moleculares aisllaes, caracterizaes por uniones atómiques bien débiles, dientro del cristal. Son materiales más blandos ya inestables que los inorgánicos.
Celda unitaria
[editar | editar la fonte]
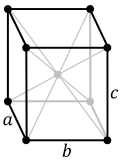
La estructura cristalina d'un material (la disposición de los átomos dientro d'un tipu dau de cristal) puede describise en términos del so celda unitaria. La celda unitaria ye una pequeña caxa que contién unu o más átomos dispuestos en 3 dimensiones. Les celdes unitaries apiladas nun espaciu tridimensional describen la disposición en masa de los átomos del cristal. La célula unitaria ta representada en términos de los sos parámetros de rede, que son los llargores de los cantos celulares (a, b y c) y los ángulos ente ellos (alfa, beta y gamma), ente que les posiciones de los átomos dientro de la celda unitaria describir pol conxuntu de posiciones atómiques (xi, yi, zi) midíes dende un puntu de rede. Comúnmente, les posiciones atómiques representar en términos de coordenaes fraccionales, en rellación colos llargores de la celda unitaria.

Les posiciones de los átomos dientro de la celda unitaria pueden calculase por aciu l'aplicación d'operaciones de simetría a la unidá asimétrica. La unidá asimétrica referir a la menor ocupación posible d'espaciu dientro de la celda unitaria. Sicasí, esto nun implica que la totalidá de la unidá asimétrica ten de tar dientro de les llendes de la celda unitaria. Los tresformamientos simétricos de les posiciones de los átomos calcular a partir del grupu espacial de la estructura cristalina, y ésta ye usualmente una operación en caxa negra realizada por programes informáticos. Sicasí, el cálculu manual de les posiciones atómiques dientro de la célula unitaria puede realizase dende la unidá asimétrica, al traviés de l'aplicación de los operadores de simetría descritos nes Tables Internacionales de Cristalografía
Indices de Miller

Artículu principal: Índiz de Miller
Los vectores y planos nuna rede cristalina describir por aciu la notación d'índiz Miller de trés valores. Utiliza los índices ℓ, m, yn como parámetros direccionales, que tán dixebraos por 90 ◦, y polo tanto son ortogonales.
Por definición, la sintaxis (ℓmn) denota un planu qu'intercepta los trés puntos a1 / ℓ, a2 / m, y a3 / n, o dalgún múltiplu de los mesmos. Esto ye, los índices de Miller son proporcionales a les inverses de les intercepciones del planu cola celda unitaria (na base de los vectores de celosía). Si unu o más de los índices ye cero, significa que los planos non intersecan esa exa (esto ye, la interseición ye "nel infinitu"). Un planu que contién una exa de coordenaes traduzse de cuenta que yá nun contenga esa exa primero que los sos índices de Miller sían determinaos. Los índices de Miller pa un planu son enteros ensin factores comunes. Los índices negativos indicar con barres horizontales, como en (123). Nun sistema de coordenaes ortogonales pa una célula cúbica, los índices de Miller d'un planu son les componentes cartesianes d'un vector normal al planu.
Teniendo en cuenta namái los planos (ℓmn) que intersecan unu o más puntos de rede (los planos de la rede), la distancia d ente los planos de rede axacentes ta rellacionada col vector de retículo recíprocu (más curtiu) ortogonal a los planos pola fórmula
Planos y direiciones
[editar | editar la fonte]Les direiciones cristalográfiques son llinies xeométriques que xunen nodos (átomos, iones o molécules) d'un cristal. De la mesma, los planos cristalográficos son planos xeométricos que xunen nodos. Delles direiciones y planos tienen una mayor densidá de nodos. Estos planos d'alta densidá tienen una influencia nel comportamientu del cristal como sigue
- Propiedaes óptiques: L'índiz de refraición ta direutamente rellacionáu cola densidá (o fluctuaciones de densidá periódiques).
- Adsorción y reactividá: La adsorción física y les reacciones químiques producir n'o cerca d'átomos o molécules de superficie. Estos fenómenos son, por tanto, sensibles a la densidá de nodos.
- Tensión superficial: La condensación d'un material significa que los átomos, iones o molécules son más estables si tán arrodiaos por otres especies similares. Poro, la tensión superficial d'una interfaz varia acordies cola densidá de la superficie.
- Planos cristalográficos mestos
- Defectos microestructurales: Los poros y les cristalitas tienden a tener llendes rectes dempués de planos de mayor densidá.
- Escote: Esto asocede típicamente sobretou en paralelu a los planos de mayor densidá.
- Deformación plástica: El deslizamiento de la dislocación asocede preferentemente paralelu a los planos de mayor densidá. La perturbación llevada pola dislocación (vector Burgers) ye a lo llargo d'una direición trupa. El cambéu d'un nodo nuna direición más trupa rique una menor distorsión de la rede cristalina.
Delles direiciones y planos tán definíos pola simetría del sistema cristalín. En sistemes monoclinicos, romboédricos, tetragonales y trigonales / hexagonales esiste una exa única (dacuando denomináu exa principal) que tien una simetría rotacional más alta que los otros dos exes. El planu basal ye'l planu perpendicular a la exa principal nestos sistemes cristalinos. Pa los sistemes cristalinos triclinicos, ortorrómbicos y cúbicos, la designación de la exa ye arbitraria y nun hai exa principal.
Estructures cúbiques
[editar | editar la fonte]Pal casu especial de los cristales cúbicos simples, los vectores reticulares son ortogonales y d'igual llargor (usualmente denominaos a); Similarmente pal retículo recíprocu. Con éses nesti casu común, los índices de Miller (ℓmn) y [ℓmn] indiquen a cencielles normales / direiciones en coordenaes cartesianes. Pa los cristales cúbicos con una constante de celosía a, la separación d ente planos de celdes axacentes (ℓmn) ye (dende enriba):
Por cuenta de la simetría de los cristales cúbicos, ye posible camudar el llugar y el signu de los enteros y tener direiciones y planos equivalentes:
Les coordenaes en corchetes angulares tales como ⟨100⟩ indiquen una familia de direiciones que son equivalentes por cuenta d'operaciones de simetría, tales como [100], [010], [001] o'l negativu de cualesquier d'eses direiciones.
Les coordenaes ente corchetes como {100} denotan una familia de normales planos que son equivalentes por cuenta d'operaciones de simetría, de la mesma manera que los corchetes angulares indiquen una familia de direiciones.
Clasificación
[editar | editar la fonte]La propiedá definitoria d'un cristal ye la so inherente simetría, colo que queremos dicir que so ciertes 'operaciones' el cristal permanez ensin cambeos. Tolos cristales tienen simetría de traslación en tres direiciones, pero dalgunos tamién tienen otros elementos de simetría. Por casu, xirar el cristal 180 ° alredor d'una cierta exa puede dar como resultáu una configuración atómica que ye idéntica a la configuración orixinal. Dizse entós que'l cristal tien una doble simetría rotacional alredor d'esta exa. Amás de simetríes rotacionales como ésta, un cristal puede tener simetríes en forma de planos d'espeyu y simetríes de traslación, y tamién les llamaes "simetríes compuestes", que son una combinación de simetríes de tresllación y simetríes d'espeyu. Una clasificación completa d'un cristal llógrase cuando toes estes simetríes inherentes del cristal identifíquense.
Redes cristalines
[editar | editar la fonte]Estes redes cristalines son un agrupamientu d'estructures cristalines según el sistema axial utilizáu pa describir la so rede. Cada sistema de rede consiste nun conxuntu de tres eje nuna disposición xeométrica particular. Hai siete sistemes de celosía. Son similares pero non esautamente iguales a los siete sistemes de cristal y a los seis families de cristal.
| Familia/ Rede cristalina | Simetría |
colspan="4" |Redes de Bravais | |||
|---|---|---|---|---|---|
| Centrada na base Centrada nel
cuerpu Centrada nun llau | |||||
| Triclínico | Ci |  |
|||
| Monoclínico | C2h |  |
 |
||
| Ortorómbico | D2h |  |
 |
 |
 |
| Tetragonal | D4h |  |
 |
||
| Hexagonal | D6h |  |
|||
| Oh | 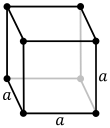 |
 |
 | ||
El sistema cúbicu (o isométrico) más simple y simétricu tien la simetría d'un cubu, esto ye, presenta cuatro eje de rotación triples empobinaos a 109,5 ° (l'ángulu tetraédricu) con respectu al otru. Estos trés exes atopar a lo llargo de les diagonales del cuerpu del cubu. Los otros seis sistemes de redes son hexagonales, tetragonales, romboédricos (de cutiu confundíos col sistema de cristal trigonal), ortorrómbicos, monoclinicos y triclinicos.
Defectos ya impureces
[editar | editar la fonte]Los cristales reales presenten defectos o irregularidaes nes sos disposiciones ideales y son estos defectos los que determinen críticamente munches de les propiedaes llétriques y mecániques de los materiales reales. Cuando un átomu sustitúi a unu de los principales componentes atómicos dientro de la estructura cristalina, puede producise una alteración nes propiedaes llétricu y térmicu del material. Les impureces tamién pueden manifestase como impureces de spin en ciertos materiales. La investigación sobre les impureces magnétiques demuestra qu'una alteración sustancial de ciertes propiedaes, como'l calor específico, puede trate afeutada por pequeñu concentraciones d'una impureza, como por casu les impureces nes aleaciones ferromagnéticas semiconductoras pueden conducir a propiedaes distintes tal como se predixeron per primer vegada a finales de los años sesenta. Les dislocaciones na rede cristalina dexen cortar a una tensión inferior a la necesaria pa una estructura cristalina perfecta.
Predicción de la estructura
[editar | editar la fonte]La dificultá de predicir estructures cristalines estables basaes na conocencia sola de la composición química foi mientres enforma tiempu una torga nel camín escontra'l diseñu de materiales totalmente computacionales. Agora, con algoritmos más potentes y computación d'altu rendimientu, pueden predicise estructures de complexidá media utilizando enfoques tales como algoritmos evolutivos, muestreo aleatoriu o metadinámica.
Les estructures cristalines de los sólidos iónicos simples (por casu, NaCl o sal de mesa) racionalizáronse mientres enforma tiempu en términos de les regles de Pauling, establecíes per primer vegada en 1929 por Linus Pauling, a quien munchos llamaron "padre del venceyu químicu" Pauling tamién consideró la naturaleza de les fuercies interatómicas nos metales y concluyó qu'alredor de la metá de los cinco d-orbitales de los metales de transición tán arreyaos na unión, siendo los restantes d-orbitales non venceyantes responsables de les propiedaes magnétiques. Poro, foi capaz de correlacionar el númberu de d-orbitales na formación d'enllaces col llargor del enllaz, según munches de les propiedaes físiques de la sustancia. Darréu introdució l'orbital metálicu, un orbital extra necesariu pa dexar la resonancia desinhibida de los enllaces de valencia ente delles estructures electróniques.
Na teoría del enllaz de valencia resonante, los factores que determinen la eleición d'unu ente les estructures cristalines alternatives d'un compuestu metálicu o intermetálico xiren alredor de la enerxía de resonancia de los enllaces ente les posiciones interatómicas. Ta claro que delles maneres de resonancia produciríen mayores contribuciones (seríen más estables mecánicamente qu'otros), y qu'en particular una rellación simple ente'l númberu d'enllaces y el númberu de posiciones sería escepcional. El principiu resultante ye que s'acomuñar una estabilidá especial coles rellaciones más simples o "númberos d'enllaz": 1/2, 1/3, 2/3, 1/4, 3/4, etc. La eleición de la estructura y el valor de la rellación axial (que determina los llargores de los enllaces relativos) ye, poro, la resultancia del esfuerciu d'un átomu pa usar la so valencia na formación d'enllaces estables con númberos d'enllaces fraccionales simples.
Dempués de postular una correlación direuta ente la concentración d'electrones y la estructura cristalina nes aleaciones de fase beta, Hume-Rothery analizó los enclinos de los puntos de fusión, compresibilidades y llargores d'enllaces en función del númberu de grupu na tabla periódica pa establecer un sistema de valencies de Los elementos de transición nel estáu metálicu. Esti tratamientu enfatizó asina la fuercia d'unión creciente en función del númberu de grupu. El funcionamientu de les fuercies direccionales se enfatizó nun artículu sobre la rellación ente los híbridos d'enllaz y les estructures metáliques. La correlación resultante ente estructures electróniques y cristalines resumir nun solu parámetru, el pesu de los electrones d por híbridu orbital metálicu. El "pesu-d" calcula a 0,5, 0,7 y 0,9 pa les estructures fcc, hcp y bcc, respeutivamente. La rellación ente los electrones d y la estructura cristalina faise evidente.
Nes predicciones / simulaciones de la estructura cristalina, la periodicidad aplícase xeneralmente, yá que el sistema imaxínase como ilimitáu grande en toles direiciones. A partir d'una estructura triclinica ensin otra propiedá de simetría asumida, el sistema puede ser impulsáu a amosar delles propiedaes de simetría adicionales aplicando la segunda llei de Newton sobre les partícules na celda unitaria y una ecuación dinámica desenvuelta apocayá pa los vectores del periodu del sistema, inclusive si'l sistema ta suxetu a una tensión esterno.
Polimorfismu
[editar | editar la fonte]El polimorfismu ye l'escurrimientu de múltiples formes cristalines d'un material. Atópase en munchos materiales cristalinos incluyendo polímeros, minerales y metales. Según les regles de Gibbs d'equilibriu de fase, estes fases cristalines úniques dependen de variables intensives como la presión y la temperatura. El polimorfismu ta rellacionáu cola alotropía, que se refier a los sólidos elementales. La morfoloxía completa d'un material describir por polimorfismu y otres variables tales como vezu de cristal, fracción amorfa o defectos cristalográficos. Los polimorfos tienen distintes estabilidaes y pueden convertir bonalmente dende una forma metaestable (o forma termodinámicamente inestable) a la forma estable a una temperatura particular. Tamién exhiben distintos puntos de fusión, solubilidaes y patrones de difracción de rayos X.
Un bon exemplu d'esto ye la forma de cuarzu del dióxidu de siliciu, o SiO2. Na gran mayoría de los silicatos, l'átomu de Si amuesa una coordinación tetraédrica por 4 osíxenos. Toes sacante una de les formes cristalines impliquen unidaes tetraédriques {SiO4} xuníes ente sigo por vértices compartíos en distintos arreglos. En distintos minerales, los tetraedros amuesen distintos graos de interconexón y polimerización. Por casu, asoceden solos, xuníos ente sigo, en grupos finitos más grandes, incluyendo aniellos, cadenes, cadenes dobles, llámines y estructures tridimensionales. Los minerales clasificar en grupos basaos nestes estructures. En caúna de les sos 7 formes cristalines termodinámicamente estables o polimorfos de cuarzu cristalín, namái 2 de cada 4 de cada unu de los cantos de los tetraedros {SiO4} compartir con otros, dando la fórmula química neta pal xil: SiO2.
Otru exemplu ye l'estañu elemental (Sn), que ye maleable cerca de les temperatures ambiente pero ye argayadizu cuando s'esfrez. Esti cambéu nes propiedaes mecániques por cuenta de la esistencia de los sos dos principales alótropos, α- y β-estañu. Los dos alótropos que s'atopen a presión y temperatura normal, α-estañu y β-estañu, conócense más comúnmente como estañu gris y llata blanca respeutivamente. Dos alotropos más, γ y σ, esisten a temperatures percima de 161 ° C y presiones percima de dellos GPa. L'estañu blancu ye metálicu, y ye la forma cristalina estable n'o percima de la temperatura ambiente. Per debaxo de 13,2 ° C, l'estañu esiste en forma gris, que tien una estructura cristalina cúbica de diamante, similar a diamante, siliciu o xermaniu. L'estañu gris nun tien propiedaes metáliques n'absolutu, ye un material en polvu gris mate y tien pocos usos, amás de unes poques aplicaciones de semiconductores especializaos. Anque la temperatura de tresformamientu α-β del estañu ye nominalmente 13,2 ° C, les impureces (por casu, Al, Zn, etc.) mengüen la temperatura de transición bien per debaxo de 0 ° C y tres la adición de Sb o Bi el tresformamientu puede nun asoceder n'absolutu.
Propiedaes físiques
[editar | editar la fonte]
Venti de les 32 clases de cristal son piezoeléctricas, y los cristales pertenecientes a una d'estes clases (grupos de puntos) amuesen piezoelectricidad. Toles clases piezoeléctricas escarecen d'un centru de simetría. Cualquier material desenvuelve una polarización dieléctrica cuando s'aplica un campu llétricu, pero una sustancia que tien tal separación de carga natural inclusive n'ausencia d'un campu denominar material polar. El fechu de qu'un material seya polar o nun ta determináu namái pola so estructura cristalina. Namái 10 de los 32 grupos de puntos son polares. Tolos cristales polares son piroeléctricos, polo que les 10 clases de cristal polar denominar dacuando clases piroeléctricas.
Hai delles estructures de cristal, notablemente la estructura de perovskita, qu'exhiben comportamientu ferroeléctrico. Esto ye análogu al ferromagnetismu, en que, n'ausencia d'un campu llétricu mientres la producción, el cristal ferroeléctrico nun exhibe una polarización. Tres l'aplicación d'un campu llétricu de magnitú abonda, el cristal polarízase permanentemente. Esta polarización puede ser invertida por una contra-carga abondo grande, de la mesma manera qu'un ferromagneto puede ser invertíu. Sicasí, anque se llamen ferroelectricos, l'efectu ye por cuenta de la estructura cristalina (non a la presencia d'un metal ferroso).
Ver tamién
[editar | editar la fonte]Referencies
[editar | editar la fonte]Enllaces esternos
[editar | editar la fonte]

