Tensión superficial
| Tensión superficial | |
|---|---|
| fenómenu físicu | |
| cantidá física y propiedá material termodinámica | |
 | |

En física, denomínase tensión superficial d'un líquidu a la cantidá d'enerxía necesaria p'aumentar la so superficie por unidá d'área.[1] Esta definición implica que'l líquidu presenta una resistencia al aumentar la so superficie d'efeutu dexa a dalgunos inseutos, como'l zapateru (Gerris lacustris), poder movese pola superficie de l'agua ensin fundise. La tensión superficial (una manifestación de les fuercies intermoleculares nos líquidos), xunto a les fuercies que se dan ente los líquidos y les superficies sólides qu'entren en contautu con ellos, da llugar a la capilaridad. Como efeutu tien la elevación o depresión de la superficie d'un líquidu na zona de contautu con un liquido.
Otra posible definición de tensión superficial: ye la fuercia qu'actúa tangencialmente por unidá de llargor nel cantu d'una superficie llibre d'un líquidu n'equilibriu y que tiende a contraer dicha superficie. Les fuercies cohesives ente les molécules d'un líquidu son les responsables del fenómenu conocíu como tensión superficial.
Causa
[editar | editar la fonte]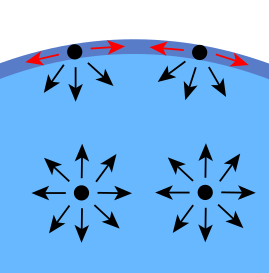

La tensión superficial deber a que les fuercies qu'afecten a cada molécula son distintes nel interior del líquidu y na superficie. Asina, nel senu d'un líquidu cada molécula ta sometida a fuercies d'atraición qu'en permediu s'anulen. Esto dexa que la molécula tenga una enerxía bastante baxa. Sicasí, na superficie hai una fuercia neto escontra l'interior del líquidu. Rigorosamente, si nel esterior del líquidu tiense un gas, va esistir una mínima fuercia curioso escontra l'esterior, anque na realidá esta fuercia ye despreciable por cuenta de la gran diferencia de densidáes ente'l líquidu y gas.
Otra manera de velo ye qu'una molécula en contautu cola so vecina ta nun estáu menor d'enerxía que si nun tuviera en contautu con felicidá vecina. Les molécules interiores tienen toles molécules vecines que podríen tener, pero les partícules de la contorna tienen menos partícules vecines que les interiores y por eso tienen un estáu más altu d'enerxía. Pal líquidu, el menguar el so estáu enerxéticu ye embrivir el númberu de partícules na so superficie.[2]
Energéticamente, les molécules asitiaes na superficie tien una mayor enerxía permediu que les asitiaes nel interior, polo tanto l'enclín del sistema va ser menguar la enerxía total, y ello llógrase menguando'l númberu de molécules asitiaes na superficie, d'ende l'amenorgamientu d'área hasta'l mínimu posible.
Como resultáu d'embrivir la superficie, esta va asumir la forma más nidia que pueda yá que ta probáu matemáticamente que les superficies embriven l'área pola ecuación de Euler-Lagrange. D'esta forma'l líquidu va intentar amenorgar cualquier combadura na so superficie pa menguar el so estáu d'enerxía de la mesma forma qu'una pelota cai al suelu pa menguar el so potencial gravitacional.
Propiedaes
[editar | editar la fonte]
La tensión superficial suel representase por aciu la lletra griega (gamma), o por aciu (sigma). Les sos unidaes son de N·m−1, J·m−2, kg·s−2 o dyn·cm−1 (vease analís dimensional).
Delles propiedaes de :
- > 0, yá que p'aumentar l'estáu del líquidu en contautu fai falta llevar más molécules a la superficie, colo cual mengua la enerxía del sistema y ye :o la cantidá de trabayu necesariu pa llevar
una molécula a la superficie.
- depende de la naturaleza de los dos fases puestes en contautu que, polo xeneral, va ser un líquidu y un sólidu. Asina, la tensión superficial va ser igual por casu p'agua en contautu col so vapor, agua en contautu con un gas inerte o agua en contautu con un sólidu, al cual va poder moyar o non (vease capilaridad) por cuenta de les diferencies ente les fuercies cohesives (dientro del líquidu) y les adesives (líquidu-superficie).
- puede interpretase como una fuercia por unidá de llargor (midir en N·m−1). Esto puede ilustrase considerando un sistema bifásicu confináu por un pistón móvilsobremanera dos líquidos con distinta tensión superficial, como podría ser l'agua y el hexano. Nesti casu'l líquidu con mayor tensión superficial (agua) va tender a menguar la so superficie a cuenta de aumentar la del hexano, de menor tensión superficial, lo cual traduzse nuna fuercia neto que mueve'l pistón dende'l hexano escontra l'agua.
- El valor de depende de la magnitú de les fuercies intermoleculares nel senu del líquidu. D'esta forma, cuanto mayor sían les fuercies de cohesión del líquidu, mayor va ser la so tensión superficial. Podemos ilustrar esti exemplu considerando trés líquidos: hexano, agua y mercuriu. Nel casu del hexano, les fuercies intermoleculares son de tipu fuercies de Van der Waals. L'agua, amás de la de Van der Waals tien interacciones de ponte d'hidróxenu, de mayor intensidá, y el mercuriu ta sometíu al enllaz metálicu, la más intensa de los trés. Asina, la de cada líquidu crez del hexano al mercuriu.
- Pa un líquidu dao, el valor de mengua cola temperatura, debíu al aumentu del baturiciu térmicu, lo que redunda nuna menor intensidá efectiva de les fuercies intermoleculares. El valor de tiende a cero conforme la temperatura averar a la temperatura crítico Tc del compuestu. Nesti puntu, el líquidu ye indistinguible del vapor, formándose una fase continua onde nun esiste una superficie definida ente dambos, sumiendo los dos fases. Al haber solamente una fase, la tensión superficial vale 0.
Midida de la tensión superficial
[editar | editar la fonte]
Métodos estáticos: la superficie caltener col tiempu
[editar | editar la fonte]1. Métodu del aniellu de du Noüy: Calcula la F necesaria pa dixebrar de la superficie del líquidu un aniellu. F=4πR (siendo R el permediu del radiu esternu ya internu del aniellu.
2. Métodu del platillo de Wilhelmy: Midida de la F pa dixebrar la superficie d'una delgada placa de vidriu. Precisión de 0,1 %.
Métodos dinámicos: la superficie fórmase o anueva de cutio
[editar | editar la fonte]Tensiómetro (Métodu de presión de burbuya): Nun líquidu a T cte introduzse un capilar de radio R conectáu a un manómetru. Al introducir gas va formándose una burbuya de radiu r a midida que aumenta la P nel manómetru. Al crecer r mengua hasta un mínimu, r=R y dempués vuelve aumentar. Esto fai posible'l so usu en dambos, llaboratorios d'investigación y desenvolvimientu, según monitoreo del procesu direutamente na planta.

Tamién puede midise con un estalagmómetro.
Ecuaciones
[editar | editar la fonte]Ecuaciones empíriques que s'afaen a les midíes de a distintes T.
Ecuación d'Eötvös: = k/Vm2/3 (Tc-T) k= 2.1 erg/K
Ecuación de Van der Waals: =0(1-T/Tc)n; n=11/9 (liq)=8 (H2O)=1 (metales líquidos)
Pa un líquidu n'equilibriu col so vapor dG= -SdT+VdP+da suponiendo'l sistema zarráu con dn=0. Según la condición d'equilibriu termodinámicu cumplir que: = (dG/da)>0. D'esta ecuación sacamos que la enerxía llibre de Gibbs mengua al menguar l'área superficial d'un sistema, tratándose esti procesu d'un procesu bonal.
Valores pa distintos materiales
[editar | editar la fonte]Tabla de tensiones superficiales de líquidos a 20 °C:
| Material | Tensión Superficial / mN/m o dina/cm) |
|---|---|
| Acetona | 23,70 |
| Bencenu | 28,85 |
| Tetracloruro de Carbonu | 26,95 |
| Acetato de etilo | 23,9 |
| Alcohol etílico | 22,75 |
| Éter etílicu | 17,01 |
| Hexano | 18,43 |
| Metanol | 22,61 |
| Tolueno | 28,5 |
| Agua | 72,75 |
Ver tamién
[editar | editar la fonte]Referencies
[editar | editar la fonte]- ↑ Martínez O., Alejandro y Ricardo Ortega P.
- ↑ White, Harvey Y. (1948). Modern College Physics. van Nostrand. ISBN 0442294018.
Bibliografía
[editar | editar la fonte]- Castellan, Gilbert W., Fisicoquímica, Ed. Pearson, páx. 433, tema 18, Fenómenos superficiales.
Enllaces esternos
[editar | editar la fonte]
 Wikimedia Commons tien conteníu multimedia tocante a Tensión superficial.
Wikimedia Commons tien conteníu multimedia tocante a Tensión superficial.

