Tiazol
Bu məqaləni vikiləşdirmək lazımdır. |
Bu məqalə stil kitabçasına uyğun deyil. |
| Tiazol | |
|---|---|
 | |
 | |
| Ümumi | |
| Kimyəvi formulu | C₃H₃NS[1] |
| Molyar kütlə | 0 kq[1] |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | −33 °C[2] |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 288-47-1 |
| PubChem | 9256 |
| ChEBI | 43732 |
| ChemSpider | 8899 |
Tiazol və ya 1,3-tiazol — tərkibində həm kükürd, həm də azot saxlayan heterosiklik birləşmədir; "tiazol" termini tiazolun törəmələrinin böyük ailəsinə aiddir. Tiazolun özü piridinə bənzər qoxuya və C3H3NS molekulyar formuluna malik açıq sarı rəngli mayedir.[3] Tiazol halqası tiamin (B1) vitamininin tərkib hissəsidir.
Molekulyar və elektron quruluşu
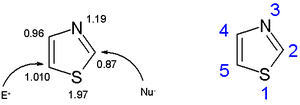
[redaktə | mənbəni redaktə et]Tiazollar azolların, imidazol və oksazolların daxil olduğu heterotsiklik birləşmələrin üzvlərindən biridir. Tiazol da funksional qrup hesab edilə bilər. Oksazollarla əlaqəli birləşmələrdir, kükürd oksigenlə əvəz olunur. Tiazollar struktur olaraq imidazollara bənzəyir, imidazoldan fərqli olaraq tiazolda bir kükürd atomu azotla əvəz olunur. Tiazol həlqəsi plenar və aromatikdir. Tiazollar müvafiq oksazollardan daha böyük pi-elektron delokalizasiyası ilə xarakterizə olunur və buna görə də daha böyük aromatikliyə malikdir. Bu aromatiklik güclü diamaqnit həlqə cərəyanını açıq şəkildə göstərən proton NMR spektroskopiyasında (7,27 ilə 8,77 ppm arasında) həlqə protonlarının kimyəvi yerdəyişməsi ilə sübut olunur. Hesablanmış π-elektron sıxlığı C5-i elektrofil əvəzetmə üçün əsas yer, C2-ni isə nukleofil əvəzetmə yeri kimi qeyd edir.
Tiazolların və tiazolium duzlarının meydana gəlməsi
[redaktə | mənbəni redaktə et]Tiazollar, tez-tez benzotiazollar adlanan benzol törəmələri ilə birləşən müxtəlif ixtisaslaşmış məhsullarda olur. B1 vitamini ilə yanaşı, tiazol həlqəsi epotilonun tərkibində də olur. Digər mühüm tiazol törəmələri benzotiazollardır. O, təbii peptidlərdə olur və peptidomimetikanın (yəni peptidlərin funksiyasını və quruluşunu təqlid edən molekulların) inkişafında istifadə olunur.[4] Ticarət əhəmiyyətli tiazollara əsasən boyalar və funqisidlər daxildir. Tifluzamid, Trisiklazol və Tiabendazol müxtəlif kənd təsərrüfatı zərərvericilərinə qarşı mübarizə üçün bazara çıxarılır. Digər geniş yayılmış tiazol törəməsi steroid olmayan antiinflamatuar dərman Meloksikamdır.
Üzvi sintezi
[redaktə | mənbəni redaktə et]Tiazolların üzvi sintezi üçün müxtəlif laboratoriya üsulları mövcuddur. Hantzsch tiazol sintezi, haloketonlar və tioamidlər arasındakı reaksiyadır. Məsələn, 2,4-dimetiltiazol tioasetamid və xloroasetondan sintez olunur.[5][6] Başqa bir misal[7] aşağıda verilmişdir:
Robinson-Qabriel sintezində 2-asilamino-ketonlar fosfor pentasulfid ilə reaksiya verir. Kuk-Heilbron sintezində α-aminonitril karbon disulfidi ilə reaksiya verir71[8]. Müəyyən tiazolları Herz reaksiyasının tətbiqi ilə olmaq olar.
Biosintez
[redaktə | mənbəni redaktə et]Tiazollar ümumiyyətlə həlqənin N-C-C-S skletini təmin edən sisteinin reaksiyaları nəticəsində əmələ gəlir. Bununla belə, tiamin bu modelə uyğun gəlmir. Bir neçə biosintez üsulları tiaminin əmələ gəlməsi üçün lazım olan tiazol həlqəsinin alınması ilə nəticələnir.[9] Tiazolun kükürdü sisteindən əldə edilir. Anaerob bakteriyalarda ̶ CN qrupu dehidroglisindən əmələ gəlir.
Reaksiyalar
[redaktə | mənbəni redaktə et]- Konjugat turşusu üçün pKa 2,5 olan tiazollar imidazoldan (pKa =7) daha az əsasidır.[10]
C2-də deprotonasiya: bu mövqedəki mənfi yük neytral dipolyar molekul kimi sabitləşir; Hauzer əsasları və üzvi litium birləşmələri bu yerdə protonu əvəz edərək reaksiyaya daxil olur:
- 2-(trimetilsilisium)tiazol[11] (2-ci mövqedə trimetilsilisium qrupu ilə) sabit əvəzedicidir və aldehidlər, asil halogenidlər və ketenlər kimi bir sıra elektrofillərlə reaksiyaya daxil olur.
C5-də elektrofil aromatik əvəzetmə bromlaşmada metil qrupu kimi aktivləşdirici qrupları tələb edir:
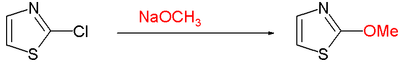
- Nukleofil aromatik əvəzetmə tez-tez C2 -də xlor kimi bir tərk qrupu tələb edir:
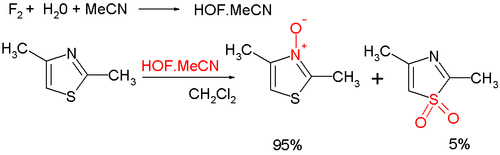
- Azotda üzvi oksidləşməni aromatik tiazol N-oksidi verir; metaxlorperoksibenzoy turşusu kimi bir çox oksidləşdirici maddələr mövcuddur; yeni bir asetonitrildə flüor və sudan hazırlanmış hipoflüor turşusudur; oksidləşmənin bir hissəsi kükürddə baş verir və qeyri-aromatik sulfoksidin alınması ilə nəticələnir:[12]
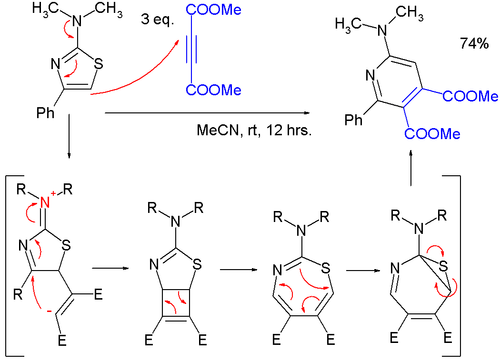
- Tiazollar tsiklik yüklənmələrdə reaksiyaya daxil ola bilər. Əsasən də reaktivin əlverişli aromatik sabitləşməsi səbəbindən yüksək temperaturda; Alkinlərlə Diels-Alder reaksiyalarında kükürdün ekstruziyası baş verir və son məhsul piridindir; bir təcrübədə[7] 2-(dimetilamino)tiazolun dimetilasetilendikarboksilatla (DMAD) reaksiyasının aralıq məhsuldan formal [2+2] tsiklobutenə çevrilmə ilə davam etdiyi aşkar edildi, sonra 4 elektronlu elektrotsiklik həlqədə 1,3-tiazepinə, daha sonra isə 6 elektronlu elektrotsiklik həlqədə 7-tia-2-azanorkaradienə çevrilmişdir.
Tiazolium duzları
[redaktə | mənbəni redaktə et]Tiazolların azotda alkilasiyası tiazolium kationunu əmələ gətirir. Tiazolium duzları Stetter reaksiyasında və benzoin kondensasiyasında katalizatordur. N-alkil tiazolium duzlarının deprotonasiyası sərbəst karbenlər[13] və keçid metallarının karben komplekslərini verir.
Tiazolların (solda) və tiazolium duzlarının (sağda) quruluşu
Alagebrium tiazolium əsaslı bir dərmandır.
İstinadlar
[redaktə | mənbəni redaktə et]- Zoltewicz, J. A.; Deady, L. W. (1978). Quaternization of Heteroaromatic Compounds. Quantitative Aspects. Advances in Heterocyclic Chemistry. Vol. 22. pp. 71–121. doi:10.1016/S0065–2725(08)60103–8. ISBN 9780120206223.
- ^ Eicher, T.; Hauptmann, S. (2003). The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications. ISBN 978-3-527-30720-3.
- ^ Mak, Jeffrey Y. W.; Xu, Weijun; Fairlie, David P. (2015–01-01). Peptidomimetics I (PDF). Topics in Heterocyclic Chemistry. Vol. 48. Springer Berlin Heidelberg. pp. 235–266. doi:10.1007/7081_2015_176. ISBN 978-3-319-49117-2.
- ^ J. R. Byers; J. B. Dickey (1939). "2-Amino-4-methylthiazole". Organic Syntheses. 19: 10. doi:10.15227/orgsyn.019.0010.
- ^ George Schwarz (1945). "2,4-Dimethylthiazole". Organic Syntheses. 25: 35. doi:10.15227/orgsyn.025.0035.
- ^ Jump up to:a b Alajarín, M.; Cabrera, J.; Pastor, A.; Sánchez-Andrada, P.; Bautista, D. (2006). "On the [2+2] Cycloaddition of 2-Aminothiazoles and Dimethyl Acetylenedicarboxylate. Experimental and Computational Evidence of a Thermal Disrotatory Ring Opening of Fused Cyclobutenes". J. Org. Chem. 71 (14): 5328–5339. doi:10.1021/jo060664c. PMID 16808523.
- ^ Kriek, M.; Martins, F.; Leonardi, R.; Fairhurst, S. A.; Lowe, D. J.; Roach, P. L. (2007). "Thiazole Synthase from Escherichia coli: An Investigation of the Substrates and Purified Proteins Required for Activity in vitro" (PDF). J. Biol. Chem. 282 (24): 17413–17423. doi:10.1074/jbc. M700782200. PMID 17403671.
- ^ Thomas L. Gilchrist "Heterocyclic Chemistry" 3rd ed. Addison Wesley: Essex, England, 1997. 414 pp. ISBN 0-582-27843-0.
- ^ Jump up to:a b Dondoni, A.; Merino, P. (1995). "Diastereoselective Homologation of D-(R)-Glyceraldehyde Acetonide using 2-(Trimethylsilyl)thiazole". Organic Syntheses. 72: 21.; Collective Volume, vol. 9, p. 952
- ^ Amir, E.; Rozen, S. (2006). "Easy Access to the Family of Thiazole N-oxides using HOF•CH3CN". Chemical Communications. 2006 (21): 2262–2264. doi:10.1039/b602594c. PMID 16718323.
- ^ Arduengo, A. J.; Goerlich, J. R.; Marshall, W. J. (1997). "A Stable Thiazol-2-ylidene and Its Dimer". Liebigs Annalen. 1997 (2): 365–374. doi:10.1002/jlac.199719970213.
- ↑ 1 2 THIAZOLE (ing.).
- ↑ Bradley J., Williams A. J., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset. // Figshare 2014. doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ Eicher, T.; Hauptmann, S. The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications. 2003. ISBN 978-3-527-30720-3.
- ↑ Mak, Jeffrey Y. W.; Xu, Weijun; Fairlie, David P. Peptidomimetics I (PDF). Topics in Heterocyclic Chemistry (ingilis). 48. Springer Berlin Heidelberg. 2015-01-01. 235–266. doi:10.1007/7081_2015_176. ISBN 978-3-319-49117-2.
- ↑ Şablon:OrgSynth
- ↑ Şablon:OrgSynth
- ↑ 1 2 Alajarín, M.; Cabrera, J.; Pastor, A.; Sánchez-Andrada, P.; Bautista, D. "On the [2+2] Cycloaddition of 2-Aminothiazoles and Dimethyl Acetylenedicarboxylate. Experimental and Computational Evidence of a Thermal Disrotatory Ring Opening of Fused Cyclobutenes". J. Org. Chem. 71 (14). 2006: 5328–5339. doi:10.1021/jo060664c. PMID 16808523.
- ↑ Kriek, M.; Martins, F.; Leonardi, R.; Fairhurst, S. A.; Lowe, D. J.; Roach, P. L. "Thiazole Synthase from Escherichia coli: An Investigation of the Substrates and Purified Proteins Required for Activity in vitro" (PDF). J. Biol. Chem. 282 (24). 2007: 17413–17423. doi:10.1074/jbc.M700782200. PMID 17403671. 2018-11-01 tarixində arxivləşdirilib (PDF). İstifadə tarixi: 2022-10-05.
- ↑ Kriek, M.; Martins, F.; Leonardi, R.; Fairhurst, S. A.; Lowe, D. J.; Roach, P. L. "Thiazole Synthase from Escherichia coli: An Investigation of the Substrates and Purified Proteins Required for Activity in vitro" (PDF). J. Biol. Chem. 282 (24). 2007: 17413–17423. doi:10.1074/jbc.M700782200. PMID 17403671. 2018-11-01 tarixində arxivləşdirilib (PDF). İstifadə tarixi: 2022-10-05.
- ↑ Thomas L. Gilchrist "Heterocyclic Chemistry" 3rd ed. Addison Wesley: Essex, England, 1997. 414 pp. ISBN 0-582-27843-0.
- ↑ Şablon:OrgSynth
- ↑ Amir, E.; Rozen, S. "Easy Access to the Family of Thiazole N-oxides using HOF·CH3CN". Chemical Communications. 2006 (21). 2006: 2262–2264. doi:10.1039/b602594c. PMID 16718323.
- ↑ Arduengo, A. J.; Goerlich, J. R.; Marshall, W. J. "A Stable Thiazol-2-ylidene and Its Dimer". Liebigs Annalen. 1997 (2). 1997: 365–374. doi:10.1002/jlac.199719970213.
Kimya haqqında olan bu məqalə bu məqalə qaralama halındadır. Məqaləni redaktə edərək Vikipediyanı zənginləşdirin. |