Kuinwossastoffe
Kuinwossastoffe (dt. Kohlenwasserstoffe) san a chemische Stoffgruppm, de wos nua aus Kuinstoff- und Wossastoffatoman bstehngan.
Benennung
[Werkeln | Am Gwëntext werkeln]A Kuinwossastoffvabindung wiad noch da Aunzoi vo de Kuinstoff-Atom', de wos de längste Kettn büdn, benaunt:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Meth- | Eth- | Prop- | But- | Pent- | Hex- | Hept- | Oct- | Non- | Dec- |
De Endung gibt au, wos fia Bindungan dass ma haum:
- -an: nua Oafochbindungan
- -en: mind. oa Dopplbindung
- -in: mind. oa Dreifochbindung
Beispü:
-
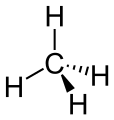
Methan bsteht aus oan Kuinstoffatom, wäu da Kuinstoff via Außnelektronan hod, geht a aa mit via Wossastoffatom' a Bindung ei (de Käu' in da Fuaml suin nua de raimliche Struktua bessa doastöön)
-
Ethan bsteht aus zwoa Kuinstoffatoman mit ana Oafochbindung dazwischn, drum bleim bei jedm C-Atom no drei Bindungselektronan iwa, des hoaßt, jeds C-Atom geht no drei Bindungan mim Wossastoff ei
-
Ethen hod a Dopplbindung und zwoa Wossastoffatom' bei jedm C-Atom
-
Unds Ethin hod a Dreifochbindung und bei jedm C-Atom oan Wossastoff
-
Propen hod a Doppl- und a Oafochbindung und de entsprechende Auzoi vo H-Atoman, sodass jeds C-Atom via Bindungan hod
De Log vo de Meahfochbindungan wiad nummariat, und zwoa so, dass meglichst kloane Zoin aussekumman. Waunst mehre Meahfochbindungan host, nocha muasst das mit Vuasübm auge'm (di-, tri-, tetra-, penta-, ...). Bei Vazweigungan kriagn de Seitnäst' de Endung -yl; es wiad nummariat, bei wos fia an Atom dass' ohzweign und ois Vuasübm vuam Staumnaum gsetzt, z. B.:
- 1,3-Butadien: de Hauptkedn bsteht aus via C-Atoman (-But-) und hod zwoa (-di-) Dopplbindungan (-en), de wos aun easchta und dritta Stöö (1,3-) zan findn san.
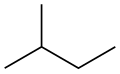
- 2-Methyl-Butan: de Hauptkedn bsteht aus via C-Atoman (-But-) mit Oanzlbindungan dazwischn (-an), de Seitnkedn (-yl) aus oan C-Atom (-Meth-) und se zweigt beim zweitn C-Atom vo da Hauptkedn oh (2-).
- 2-Methyl-but-1-en: De Hauptkedn bsteht aus via C-Atoman (-but-), de Dopplbindung is an easchta Stöö (-1-en) und beim zweitn C-Atom zweigt no a Nemkedn oh, de wos aus oan C-Atom bsteht (2-Methyl-).
Wäu des do a ziemlicha Schreibaufwaund is, jeds Moi de gaunzn Kuin- und Wossastoffatome hiiz'moin, hod ma se a Kuazschreibweis iwalegt, und zwoa zeichnat ma nua de Bindungan zwischn de Kuinstoffatome und lässt de Wossastoffatome wecka. Des hoaßt, Methan wiad a Punkt, Ethan wiad a Strich, Ethen wiad a Dopplstrich und so weida.
-
1,3-Butadien
-
1,3-Butadien - Kuazschreibweis
-
2-Methyl-Butan
-
2-Methyl-but-1-en
Gsättigte Kuinwossastoffe
[Werkeln | Am Gwëntext werkeln]De gsättigtn Kuinwossastoffe haum Oafochbindungan zwischn de Kuinstoffatom'. Ma untascheidt Alkane und Cycloalkane.
Alkane
[Werkeln | Am Gwëntext werkeln]
Alkane (fricha Paraffine) san kednfeamig; de Kuinstoffkedn kau ned vazweigt (n-Alkane) oda vazweigt (i-Alkane) sei. Se haum a Summanfuaml in da Fuam CnH2n+2, z. B. Methan CH4, Ethan C2H6, 2-Metyl-Butan C5H12.
Alkane san ned elektrisch leitend und fost ned wossalösli, bis C4 sans gosfeamig, vo C5 bis C16 flissig und driwa fest. Methan bis Butan wiad zan Hoazn vawendt und de flissign Alkane ois Brennstoff in an Motoa.
Duachs Ohspoitn vo oan Wossastoffatom kriagt ma a Alkyl-Gruppm (Radikale). Waunst bei an Alkan a Wossastoffatom duach a Edlgos easetzn duasd, nocha kriegst de FCKW (Fluor-Chlor-Kuinwossastoffe), de haum jo an seah guadn Ruaf ...
Reaktiaunan:
- Vabrennung:
- A n-Alkan reagiat mim Sauastoff zua Wossa und Kuindioxid.
- Cracken (Spoitung vo laungkettign Moleküün in kuazkettige):
- Dodecan spoit se in a Decyl- und a Ethyl-Radikoi.
- Substitutiaun (a Wossastoffatom wiad duach a aundas Atom oda Atomgruppm austauscht):
- Methan reagiat mim Chlor zua Mono-, Di-, Tri- und Tetrachlormethan sowia Chlorwossastoff.
Cycloalkane
[Werkeln | Am Gwëntext werkeln]
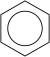
Cycloalkane (fricha Naphthene): de san ringfeamig und kennan aa Ne'mkedn haum. De Summanfuaml schaut so aus: CnH2n, z. B. Cyclohexan C6H12, des is des klassische Sechseck.
Ma untascheidt:
- monocyclische Cycloalkane: oa Ring
- polycyclische Cycloalkane: mehre Ring'
Ungsättigte Kuinwossastoffe
[Werkeln | Am Gwëntext werkeln]Ungsättigte Kuinwossastoffe san Alkene und Alkine, sowia de Cycloalkene und Cycloalkine.
Alkene
[Werkeln | Am Gwëntext werkeln]Alkene (fricha Olefine) haum mindastns oa Dopplbindung, de Summanfuaml lautet CnH2n, z. B. Ethen (Ethylen) C2H4 und Propen (Propylen) C3H6. Kuinwossastoffe mit mehran Dopplbindungan nennt ma Polyene, de wean je noch Auzoi vo de Dopplbindungan ois Diene, Triene, Tetraene usw. bezeichnat. Noch da Log vo de Dopplbindungan hod ma konjugiate, isoliate und kumuliate Polyene.
-
konjugiats Dien (Dopplbindungan ohwechslnd): 1,3-Pentadien
-
isoliats Dien (mind. zwoa Oafochbindungan dazwischn): 1,4-Pentadien
-
kumuliats Dien (olle Dopplbindungan auf an Haufn): 1,2-Pentadien

Ungsättigte Kuinwossastoffe san seah reaktiaunsfreidig; es Ethen is a wichtiga Ausgaungsstoff fia Kunststoffe wia Polyethylen (PE), Polystyrol (PS), Polyvinylchlorid (PVC); es Propen fia Polypropylen (PP) unds 1,3-Butadien fia synthetischn Kautschuk.
Reaktiaunan:
- Additiaun (es kumman Atome oda Atomgruppm aun de Dopplbindung zuwe, de bricht auf und nocha kriagst a Alkan):
- Noch da Markownikow-Regel wiads Wossastoffatom ans wossastoffreichare Kuinstoffatom bundn:
- Reaktiaun vom Propen mim Chlorwossastoff zua 2-Chlorpropan
- Es kau owa aa wos aundas aussekumman:
- Reaktiaun vom Propen mim Chlorwasserstoff zua 1-Chlorpropan
- Kettnpolymerisatiaun (aus an Monomer mocht ma a Polymer, des hoaßt, aus am kuazkettign Moleküü a laungkettigs)
Alkine
[Werkeln | Am Gwëntext werkeln]
Alkine (fricha Acetylene) weisn mindastns oa Dreifochbindung auf und a Summanfuaml in da Fuam CnH2n-2, wia z. B. Ethin (Acetylen) C2H2. Polyine san genauso wia obm Kuinwossastoffe mit mehran Dreifochbindungan.
Cycloalkene und Cycloalkine
[Werkeln | Am Gwëntext werkeln]

Cycloalkene und Cycloalkine san ringfeamige Moleküü mit mindastns oana Doppl- bzw. Dreifochbindung.
Aromatische Kuinwossastoffe
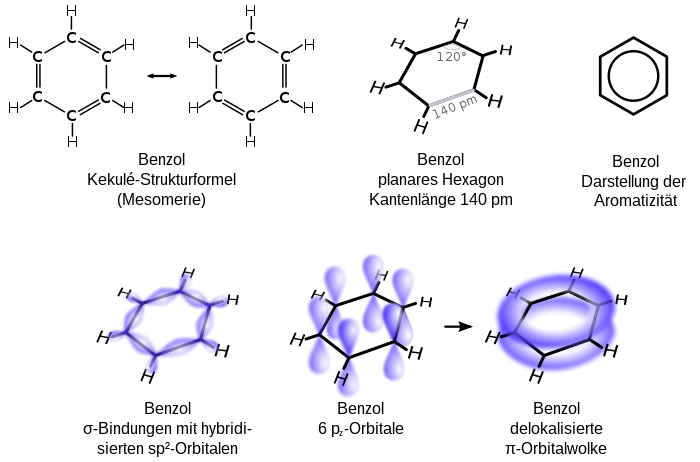
[Werkeln | Am Gwëntext werkeln]Aromatische Kuinwossastoffe (Arene), z. B. Benzol (Benzen), san cyclische Kuinwossastoffe, de wos gewisse Eignschoftn haum, wia dass bsundas stabüü san. Es Benzol bsteht aus sechs Kuin- und sechs Wossastoffatoman. Vo de via Valenzelektronan vom Kuinstoffatom wean zwoa fia'd Bindung mit de benochboatn Kuinstoffatome gnutzt und oans fia de Bindung mim Wossastoff, oiso bleibt no oans iwa. 1865 hod da deitsche Chemika Kekulé prowiat, a Struktuafuaml fias Benzol zan aufstöön, nämli hod a gmoant, dass de iwabliabanan Elektronan Dopplbindungan eigehn, de wos ständig altanian. Späta is ma draufkumman, dass de sechs frein Elektronan a delokalisiate Lodungswuikn iwa und untam Kuinstoffring büdn. Dofia is de Schreibweis mit an Kras im Sechseck übli.
Polycyclische aromatische Kuinwossastoffe bstehngan aus mehran Benzolringan, de wos mitanaund vabundn san, z. B. Naphthalin.
Reaktiaunan:
- Halogenisiarung:
- Akylliarung (a Wossastoffatom vom Benzol wiad duach a Alkylgruppm easetzt):
- Nitriarung (aus Benzol und Soipetasaire kriagst mit ana Nitriasaire Nitrobenzol):
Schau aa
[Werkeln | Am Gwëntext werkeln]Literatua
[Werkeln | Am Gwëntext werkeln]- Handbuch der Experimentellen Chemie Sekundarbereich II, Band 9, Kohlenwasserstoff, Aulis Verlag Deubner & Co. KG.
- Karl-Heinz Lautenschläger, Werner Schröter, Joachim Teschner, Hildegard Bibrack, Taschenbuch der Chemie, 18. Auflage, Harri Deutsch, Frankfurt (Main), 2001.
- J. C. Jones: Hydrocarbons. Physical Properties and their Relevance to Utilisation. J. C. Jones & Ventus Publishing ApS, 2010. ISBN 978-87-7681-513-4 (PDF bei bookboon.com).
- Hartung, Birgitta (1984) Potentielle Kohlenwasserstoff-Muttergesteine in der Tiefsee. Geowissenschaften in unserer Zeit; 2, 6; 208-211; doi:10.2312/geowissenschaften.1984.2.208.