Енантиомер
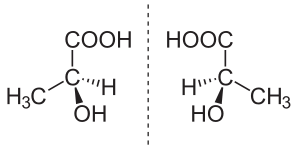
В химията енантиомер (от гръцки: ἐνάντιος, „противоположен“, и μέρος, „част“) е всеки един от два стереоизомера, демонстриращи хиралност: т.е., които са огледални образи един на друг, без да са идентични (например лявата ръка е огледална на дясната, но не е същата, тоест лявата ръкавица не става на дясната ръка).[1]
Органичните съединения, които имат асиметричен хирален въглероден атом, обикновено имат две огледални една на друга структури, наречени енентиоморфи (енентио = противоположен; морф = форма). Оттук този вид оптична изомерия е позната като енантиомерия и играе важна роля във фармацията, тъй като различни енантиомери на лекарствените субстанции като правило имат различна биологична активност. Енантиочисти съединения се отнася до вещества, които в границите на детекция съдържат молекули само на единия енантиомер.
При еднакви условия енантиомерите имат еднакви физични и химични свойства с изключение на това, че въртят поляризираната светлина в еднаква степен, но в различни посоки (проявяват противоположна оптична активност). Смес от равни части от оптично активен изомер и неговия енантиомер се нарича рацемична смес и не оказва оптично въртене на поляризирана светлина.
Болшинството хирални природни съединения (аминокиселини, монозахариди) съществуват само във вид на един енантиомер. Енантиомерите често показват различно поведение при реакции със субстанции, които също са енантиомери. Тъй като молекулите в живите организми често са енантиомери, то при действието на двата енантиомера върху организма също често се наблюдава различен биологичен ефект. При лекарствата обикновено само единият енантиомер допринася за желания физиологичен ефект, докато другият енантиомер е по-слабо активен, неактивен или дори има нежелани или вредни странични ефекти.
Критерии за енантиомер
[редактиране | редактиране на кода]Повечето съединения, които съдържат един или повече асиметрични въглеродни атома, демонстрират енантиомерия, но се срещат и изключения.
Познати са малко на брой изключения, които имат асиметричен въглерод: който образува химични връзки с четири други атома или групи атоми така, че е възможно тези групи да се подредят по два различни начина. Присъствието на такъв асиметричен въглерод представлява често срещана хиралност, която се нарича точкова хиралност или централна хиралност.[2]:pg. 2 Асиметричният атом се нарича център на хиралност. Съединения с един (или нечетен брой) асиметрични атоми са винаги хирални. Обратното, съединения с четен брой асиметрични атоми невинаги са хирални, защото са подредени в огледално-симетрични двойки. Те са известни като мезо съединения. Така например мезо тартаратът има два асиметрични въглерода, но все пак е оптично неактивен. По подобен начин транс-циклохексан – 1,4 – дикарбоксилната киселина има асиметрични въглеродни атоми, но притежава вътрешен център на симетрия, поради което няма енантиомери.
Примери
[редактиране | редактиране на кода]

В хербицида мецорп (2-(4-хлоро-2-метилфенокси)пропанова киселина), карбоксилната група и водородния атом при централния C-атом са разменени (екрана ни служи като равнина на симетрията). След завъртането на изомерите на 180 градуса (в същата равнина), двата продължават да са огледални един на друг.
Друг пример е антидепресантът есциталопрам и циталопрам. Циталопрамът е рацемична смес (1:1 (S)-циталопрам и (R)-циталопрам; докато есциталопрамът е чист (S)-енантиомер на циталопрама. Дозите за есциталопрама са 1/2 от тези за циталопрама.
Квазиенантиомери
[редактиране | редактиране на кода]Квазиенантиомерите не са точно енантиомери, но имат такова поведение.[3]
Вижте също
[редактиране | редактиране на кода]Източници
[редактиране | редактиране на кода]- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the Gold Book) (1997). Online corrected version: (2006–) enantiomer.
- ↑ Karras, Manfred. "Synthesis of Enantiomerically Pure Helical Aromatics Such As NHC Ligands and Their Use in Asymmetric Catalysis, PhD Thesis. Charles University, 2018. Посетен на 6 August 2021.
- ↑ G.S. Coumbarides, M. Dingjan, J. Eames, A. Flinn, J. Northen and Y. Yohannes, Tetrahedron Lett. 46 (2005), p. 2897er
| Тази страница частично или изцяло представлява превод на страницата Enantiomer в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |