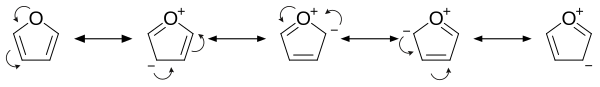Фуран
| Фуран | |
|---|---|

| |
| |
| Обща информация | |
| Наименование по IUPAC | Фуран /Чисто: 5-оксациклопента-1,3-диен/ |
| Други имена | 1,4-епокси-1,3-бутадиен, Оксол Фурфуран, дивинилен оксид |
| Молекулна формула | C4H4O |
| Моларна маса | 68,07 g/mol |
| Външен вид | безцветна летлива течност |
| CAS номер | [110-00-9] |
| Свойства | |
| Плътност и фаза | 0,936 g/ml, течност |
| Точка на топене | -85,6 °C (187,55 K) |
| Точка на кипене | 31,4 °C (304,55 K) |
| Точка на възпламеняване | -35 °C |
| Сродни съединения | |
| Сродни хетероцикли | Пирол Тиофен |
| Сродни съединения | Тетрахидрофуран (THF) 2,5-диметилфуран Бензофуран Дибензофуран |
| Освен където е обявено друго, данните са дадени за материали в стандартно състояние (при 25 °C, 100 kPa) Права и справки | |
Фуран е хетероциклично ароматно органично съединение, представляващо петатомен пръстен от четири въглеродни атома и един кислороден. Класът съединения, които съдържат в структурата си подобна пръстенна система също се наричат фурани. Съединеието фуран се получава от термично разпадане на пентоза-съдържащи материали, целулозни вещества и по-точно борова дървесина. Фуранът е безцветна, запалима, лесно летлива течност с точка на кипене близка до тази на стайна температура. Той е отровен и вероятно карциногенен. Каталитичното хидрогениране на фуран с паладиев катализатор дава тетрахидрофуран.
История
[редактиране | редактиране на кода]Името фуран произлиза от латинската дума furfur, означаваща трици.[1] Първото производно на фурана – 2-фуроената киселина, е описано от Карл Вилхелм Шееле през 1780. Друго важно производно – фурфурал, бива открито от Йохан Волфганг Дьоберайнер през 1831 и охарактеризирано девет години по-късно от Джон Стенхаус. Самият фуран е изолиран за първи път от Хайнрих Лимприхт през 1870 и наречен от него тетрафенол.[2][3]
Получаване
[редактиране | редактиране на кода]- Фуран може да бъде получен от фурфурал, чрез окисление и след това декарбоксилиране на получената фуран-2-карбоксилна киселина, като фурфуралът може да бъде получен направо чрез деструктивна дестилация на смляни царевични кочани, в присъствие на сярна киселина.
- Класически органичен синтез на фуран е получаването по Файст-Бенари.
- Един от най-простите методи за синтез на фурани е взаимодействието на 1,4-дикетони с фосфорен пентоксид(P2O5) по Паал-Кнор.
Химични свойства
[редактиране | редактиране на кода]Ароматността на фурана се дължи на това, че една от свободните електронни двойки на кислородния атом е делокализирана в пръстена, създавайки 4n+2 ароматна система (по правилото на Хюкел) подобно на бензена. Поради ароматността си, молекулата е равнинна и липсват обособени двойни връзки. Другата свободна двойка електрони при кислородния атом се разполага в равнината на молекулата. sp2 хибридизацията дава възможност на една от свободните електронни двойки на кислорода да обитава p-орбитала, позволявайки ѝ да взаимодейства вътре в π-системата.
Вследствие на ароматността си, характерът на фурана е съвсем различен в сравнение с този на по-типичните хетероциклични етери като тетрахидрофурана.
- Той е значително по-реактивоспособен от бензена по отношение на реакциите на електрофилно заместване, вследствие на електроннодонорни свойства на кислородния хетероатом. Разглеждането на резонансните структури показва повишена електронна плътност в ядрото, водеща до по-голяма способност за встъпване в реакции на електрофилно заместване[4].
- Фуранът служи и като диен в реакциите на Дийлс-Алдер с електродефицитни диенофили като етил (E)-3-нитроакрилат.[5] Реакционният продукт е смес от изомери с предпочитане към ендо изомера:
- Хидрогенирането на фурани води до последователно получаване на дихидрофурани и тетрахидрофурани.
- При реакцията на Ахматович, от фурани се получават съединения на дихидропирана.
Източници
[редактиране | редактиране на кода]- ↑ Alexander Senning. Elsevier's Dictionary of Chemoetymology. Elsevier, 2006. ISBN 0-444-52239-5.
- ↑ Limpricht, H. Ueber das Tetraphenol C4H4O // Berichte der deutschen chemischen Gesellschaft 3 (1). 1870. DOI:10.1002/cber.18700030129. с. pp. 90–91.
- ↑ Rodd, Ernest Harry. Chemistry of Carbon Compounds: A Modern Comprehensive Treatise. Elsevier, 1971.
- ↑ Bruice, Paula Y. Organic Chemistry, Fifth Edition. Upper Saddle River, NJ, Pearson Prentice Hall, 2007. ISBN 0-13-196316-3.
- ↑ Masesane I, Batsanov A, Howard J, Modal R, Steel P. The oxanorbornene approach to 3-hydroxy, 3,4-dihydroxy and 3,4,5-trihydroxy derivatives of 2-aminocyclohexanecarboxylic acid // Beilstein Journal of Organic Chemistry 2 (9). 2006. DOI:10.1186/1860-5397-2-9. с. 9.
| Тази страница частично или изцяло представлява превод на страницата Furan в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |