Хистидин
| Хистидин | |
  | |
| Имена | |
|---|---|
| По IUPAC | Хистидин |
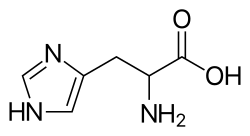
| Други | 2-амино-3-(1H-имидазол-4-ил)пропанова киселина |
| Свойства | |
| Формула | C6H9N3O2 |
| Моларна маса | 155.15 g/mol |
| Точка на топене | 287 °C |
| Разтворимост във вода | 4,19 g на 100 ml |
| pKa | 9,18 |
| Опасности | |
| NFPA 704 |
|
| Идентификатори | |
| CAS номер | 71-00-1 |
| PubChem | 773 |
| ChemSpider | 6038 |
| DrugBank | DB00117 |
| KEGG | D00032 |
| MeSH | D006639 |
| ChEBI | 57595 |
| ChEMBL | CHEMBL17962 |
| SMILES | O=C(O)[C@@H](N)Cc1cncn1 |
| InChI | InChI=1S/C6H9N3O2/c7-5 (6(10)11)1-4-2-8-3-9-4/h2-3, 5H,1,7H2,(H,8,9)(H,10,11)/t5-/m0/s1 |
| InChI ключ | HNDVDQJCIGZPNO-YFKPBYRVSA-N |
| UNII | 4QD397987E |
| Gmelin | 663322 |
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |
| Хистидин в Общомедия | |
Хистидин (съкратено His или H)[1] e α-аминокиселина с имидазолова функционална група. Тя е една от 20-те протеиногенни аминокиселини. Нейните кодони в иРНК са CAU и CAC. Хистидинът е изолиран за първи път от германския лекар Албрехт Косел през 1896. Хистидинът е незаменима аминокиселина както за хората, така и за други бозайници. Първоначално се е смятало, че е незаменима единствено за новородените, но по-продължителни проучвания доказват нейната необходимост и за възрастните.[2]
Химични свойства
[редактиране | редактиране на кода]Имидазоловата странична верига на хистидина притежава pKa около 6, а като цяло pKa на аминокиселината е 6,5. Това означава, че при физиологични pH стойности, относително малки промени в pH могат да променят нейния среден заряд. Под pH 6, имидазоловият пръстен е протониран според изискванията на уравнението на Хендерсон-Хаселбах. Протониран имидазоловият пръстен съдържа две N-H връзки и е зареден положително. Позитивният заряд е равно разпределен между двата азотни атома и може да се представи чрез две еднакво важни резонансни структури.
Ароматност
[редактиране | редактиране на кода]Имидазоловият пръстен на хистидина е ароматен при всички pH стойности.[3] Той съдържа шест π-електрона: четири от две двойни връзки и два от една свободна електронна двойка при азотен атом. Той може да влиза в π-π взаимодействия,[4] но те са усложнени вследствие на положителния заряд.[5] В нито едно състояние не поглъща светлина при 280 nm, но го прави в късата УВ област повече от други аминокиселини.[6][7]
Биохимия
[редактиране | редактиране на кода]Имидазоловата странична верига е често срещан координационен лиганд в различни металопротеини както и част в каталитични центрове на някои ензими. В каталитичните триади, базичният азот на хистидина привлича протон от серин, треонин или цистеин, превръщайки съответната аминокиселина в нуклеофил. В хистидиновата протонна совалка, хистидинът взема участие в бързия транспорт на протони, осъществявайки това чрез своя базичен азотен атом, който откъсва протон и образува положително зареден метаболит. След това този метаболит предава протона и съответно положителния заряд на друга молекула – буфер, освобождавайки своя киселинен азотен атом до неговото основно базично състояние. При карбоанхидразните ензими, хистидинова протонна совалка се използва за бързо пренасяне на протони вън от цинк-свързаните водни молекули, като по този начин се възстановява активната форма на ензима.
Метаболизъм
[редактиране | редактиране на кода]Аминокиселината е прекурсор за биосинтезата на хистамин (биогенен амин, вазодилататор, взимаш участие в алергичните реакции) и карнозин.

Ензимът хистидин амоняк лиаза (хистидиназа) трансформира хистидина в амоняк и уроканова киселина. Липсата на този ензим се среща при рядкото метаболитно заболяване хистидинемия. В актинобактериите и филаментозните гъби, като Neurospora crassa, хистидинът може да бъде превърнат до антиоксиданта ерготионеин.[8]
Катаболизъм
[редактиране | редактиране на кода]Катаболизмът на хистидин протича през уроканат, 4-имидазолон-5-пропионат и N-формаминоглутатамат. Формиминовата група, трансферирана до тетрахидрофолата, формира глутамат, а след това α-кетоглутарат. При дефицит на фолиева киселина прехвърлянето на формиминовата групата се нарушава и N-формаминоглутатаматът се екскретира. Екскрецията му след доза от хистидин може да се използва за установяването на дефицит от фолиева киселина. Заболявания, причинени от нарушения в хистидиновия катаболизъм са хистидинемия и уроканатна ацидурия.
Източници
[редактиране | редактиране на кода]- ↑ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. Nomenclature and Symbolism for Amino Acids and Peptides // Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. Посетен на 17 май 2007.
- ↑ J D Kopple and M E Swendseid. Evidence that histidine is an essential amino acid in normal and chronically uremic man // J Clin Invest. 55 (5). May 1975. DOI:10.1172/JCI108016. с. 881 – 891.
- ↑ MROZEK Agnieszka, KAROLAK-WOJCIECHOWSKA Janina, KIEC-KONONOWICZ Katarzyna. Five-membered heterocycles. Part III. Aromaticity of 1,3-imidazole in 5+n hetero-bicyclic molecules // Journal of Molecular Structure 655 (3). August 2003. DOI:10.1016/S0022-2860(03)00282-5. с. 397 – 403.
- ↑ Lijun Wang, Na Sun, Simon Terzyan, Xuejun Zhang, and, David R. Benson. A Histidine/Tryptophan π-Stacking Interaction Stabilizes the Heme-Independent Folding Core of Microsomal Apocytochrome b5 Relative to that of Mitochondrial Apocytochrome b5. Biochemistry 2006 45 (46), 13750 – 13759
- ↑ Robert H. Blessing, Edward L. McGandy. Base stacking and hydrogen bonding in crystals of imidazolium dihydrogen orthophosphate. Journal of the American Chemical Society 1972 94 (11), 4034 – 4035.
- ↑ Katoh R. Absorption Spectra of Imidazolium Ionic Liquids. Chemistry Letters. Vol. 36 (2007), No. 10 p.1256.
- ↑ AR Goldfarb, LJ Saidel, E Mosovich. THE ULTRAVIOLET ABSORPTION SPECTRA OF PROTEINS. Journal of Biological Chemistry, 1951, p.397 – 404.
- ↑ Fahey RC. Novel thiols of prokaryotes // Annu. Rev. Microbiol. 55. 2001. DOI:10.1146/annurev.micro.55.1.333. с. 333 – 56.
| Тази страница частично или изцяло представлява превод на страницата Histidine в Уикипедия на английски. Оригиналният текст, както и този превод, са защитени от Лиценза „Криейтив Комънс – Признание – Споделяне на споделеното“, а за съдържание, създадено преди юни 2009 година – от Лиценза за свободна документация на ГНУ. Прегледайте историята на редакциите на оригиналната страница, както и на преводната страница, за да видите списъка на съавторите.
ВАЖНО: Този шаблон се отнася единствено до авторските права върху съдържанието на статията. Добавянето му не отменя изискването да се посочват конкретни източници на твърденията, които да бъдат благонадеждни. |
| |||||

