বাষ্প চাপ

বাষ্প চাপ (ইংরেজিঃ Vapor pressure) বা সুস্থিতি বাষ্প চাপ কে সংজ্ঞায়িত করা যায় এভাবে, এটা হল সেই চাপ যা একটি তরলের বাষ্পীভবনের হার প্রকাশ করে।
বাষ্প থার্মোডাইনামিক ইক্যুলিব্রিয়াম পর্যায়ে প্রয়োগ করে বস্তুটির ঘনীভূত পর্যায়ে (কঠিন বা তরল) থাকাকালীন একটি সুনির্দিষ্ট তাপমাত্রায়, একটি বদ্ধ সিস্টেম। সুস্থিতি বাষ্প চাপ একটি তরলের বাষ্পীভবনের হার প্রকাশ করে। এটার সাথে সম্পর্কিত তরল (বা একটি কঠিন) পদার্থ থেকে কণার উড়ে যাবার প্রবণতার হার। স্বাভাবিক তাপমাত্রায় একটি পদার্থের উচ্চ বাষ্প চাপ কে প্রায়ই চিহ্নিত করা হয় উদ্বায়ী হিসাবে। বাষ্প কর্তৃক একটি তরলের পৃষ্ঠের উপরে প্রয়োগকৃত চাপকে বাষ্প চাপ বলে। তরলের তাপমাত্রা বৃদ্ধির সাথে সাথে, তার অণু গুলোর গতিশক্তি বৃদ্ধি পায়। অণুর গতিশক্তি বৃদ্ধির সাথে সাথে অণু গুলো রূপান্তরের মাধ্যমে বাষ্পে পরিনত হওয়া বৃদ্ধি পায়, যার ফলে বৃদ্ধি পায় বাষ্প চাপ।
সেলসিয়াস-ক্যাপেরন (Clausius–Clapeyron) সম্পর্ক অনুসারে এই বাষ্প চাপ বৃদ্ধি কোনো পদার্থের তাপমাত্রার সাথে সুসংগত ভাবে বৃদ্ধি পায় না। বায়ুমণ্ডলীয় চাপে একটি তরলের স্ফুটনাঙ্ক (যা এছাড়াও পরিচিত স্বাভাবিক ফুটন্ত বিন্দু নামে) হল, সেই তাপমাত্রা যখন এর বাষ্প চাপ সমান হয় পরিবেষ্টনকারী বায়ুমণ্ডলীয় চাপের সাথে। কোন ক্রমবর্ধমান তাপমাত্রা বৃদ্ধির সাথে, বাষ্প চাপ যথেষ্ট হয় বায়ুমণ্ডলীয় চাপকে পরাস্ত করতে এবং তরলের ভিতরে থেকে বাষ্পের বুদবুদ আকারে পুরো পদার্থ জুড়ে বেরিয়ে আসে। তরলের গভীরে বাবল গঠনের জন্য প্রয়োজন অধিক উচ্চ চাপ এবং এজন্য উচ্চ তাপমাত্রারও দরকার, কারণ তরলের চাপ বায়ুমন্ডলীয় চাপের তুলনায় বৃদ্ধি পায় গভীরতা বাড়ার সাথে সাথে। আরও গুরুত্বপূর্ণ যে যতো অগভীর গভীরত্ব হয়, উচ্চ তত বেশি তাপমাত্রা প্রয়োজন হয় বাবল গঠন শুরু করার জন্য। বাবলের দেয়ালের পৃষ্ঠ টান অত্যধিক চাপ প্রয়োগ করে খুব ছোট প্রাথমিক বুদবুদের উপর। সুতরাং, থার্মোমিটার ক্যালিব্রেশন ফুটন্ত পানির তাপমাত্রার উপর নির্ভর করে করা উচিত নয়।
কোন একটি মিশ্রণের মধ্যে থাকা একটি উপাদানের চাপ যা ওই সিস্টেমের মোট চাপের অংশ তাকে আংশিক চাপ বলে। উদাহারণস্বরূপ, সমুদ্র সমতলের বাতাসে, ও যা সম্পৃক্ত থাকে পানির বাষ্প দ্বারা ২০°সে, এতে পানির আংশিক চাপ থাকে ২.৩ কিলোপ্যাসকেল, নাইট্রোজেনের থাকে ৭৮ কিলোপ্যাসকেল, অক্সিজেনের থাকে ২১ কিলোপ্যাসকেল এবং আর্গনের থাকে ০.৯ কিলোপ্যাসকেল, যা সর্বোমোট ১০২.২ কিলোপ্যাসকেল, যা স্ট্যান্ডার্ড বায়ুমণ্ডলীয় চাপের মূল ভিত্তি।
পরিমাপ এবং একক
[সম্পাদনা]বাষ্প চাপকে পরিমাপ করা হয় চাপ পরিমাপের স্ট্যান্ডার্ড একক দ্বারা। দ্য ইন্টারন্যাশনাল সিস্টেম অব ইউনিট (এসআই) কর্তৃক চাপের একক কে চিহ্নিত করা হয়েছে একটি প্রাপ্ত একক হিসাবে যার সঙ্গে জড়িত বলের মাত্রা এলাকা প্রতি এবং এটিকে প্রকাশ করা হয় প্যাস্কেল দ্বারা এটা হল এর প্রমাণ একক। এক প্যাস্কেল (একক) হল, এক নিউটন প্রতি বর্গ মিটারে - নিউটন-মি-২ (N·m−2) বা কেজি·মি−১·সে−২ (kg·m−1·s−2)
সাধারণ বাষ্প চাপের মান ১ থেকে ২০০ কিলোপ্যাস্কেল পর্যন্ত পরীক্ষামূলক ভাবে পরিমাপের জন্য সহজ পদ্ধতি রয়েছে।[১] সবচেয়ে সঠিক ফলাফল প্রাপ্ত করা হয় পদার্থের স্ফুটনাংকের কাছাকাছি মান থেকে ও বড় ত্রুটি যুক্ত ফলাফল আসে ১ কিলোপ্যাস্কেল মাপের চেয়ে ছোট মানের ক্ষেত্রে। পরীক্ষন পদ্ধতিটিতে প্রায়শই থাকে পরীক্ষার পদার্থটিকে বিশুদ্ধকরণ, এটিকে আলাদা একটি কন্টেইনারে নেয়া, যেতে কোন ভিন্ন গ্যাস না থাকে, তারপর বায়বীয় অবস্থার বিভিন্ন পর্যায়ের সুস্থির চাপ পরিমাপ করা বিভিন্ন তাপমাত্রার। নিক্ষুত মান অর্জিত হয় যখন যত্ন নেওয়া হয় ও নিশ্চিত করা হয় সমগ্র পদার্থ এবং তার বাষ্প নির্ধারিত তাপমাত্রা থাকে। এই প্রায়শই পরিমাপ করা হয়, একটি আইসোটেনিস্কোপ যন্ত্র ব্যবহার করে, যেখানে পরিমাপের অংশটি ডুবানো থাকে তরলের মাঝে।
কঠিন পদার্থের খুব স্বল্প মানের বাষ্প চাপ পরিমাপ করা যায় কনুডসেন ইফিউশন সেল পদ্ধতি ব্যবহার করে।
অ্যান্টোইন সমীকরণের সাহায্যে আনুমানিক হিসাব বাষ্প চাপ হিসাব
[সম্পাদনা]অ্যান্টোইন সমীকরণ[২][৩] হল বাষ্প চাপ ও বিশুদ্ধ তরল বা কঠিন পদার্থের তাপমাত্রার মধ্যে সম্পর্কের একটি গাণিতিক ব্যাখ্যা। সমীকরণটির সাধারনরূপে নিম্নক্তভাবে লেখা হয়:
এবং সমীকরণটিকে তাপমাত্রা নির্ণয়ের গাণিতিকরূপেও লেখা যায়:
যেখানে: হল পরম বাষ্প চাপ একটি পদার্থের।
- হল ঐ পদার্থের তাপমাত্রা
- এবং এখানে পদার্থ-নির্দিষ্ট সহগ সমূহ (অর্থাৎ, ধ্রুবক বা প্যারামিটার)
- সাধারণত হয়ে থাকে বা
একটি সহজ ধরনের সমীকরণ যাতে মাত্র দুটি সহগ থাকে, কখনও কখনও ব্যবহার করা হয়:
যা থেকে রুপান্তরিত করা যায়:
একই পদার্থের উর্ধপাতন এবং বাষ্পীভবনের জন্য পৃথক ধরনের অ্যান্টোইন সহগ হয়েছে, যদি সেগুলো একটি মিশ্রণে থাকে। একটি নির্দিষ্ট যৌগের জন্য প্রতিটি প্যারামিটার গুচ্ছ শুধুমাত্র প্রযোজ্য একটি নির্দিষ্ট তাপমাত্রা পরিসীমার মধ্যে। সাধারণত তাপমাত্রার পরিসীমা নির্ধারন করা হয় সমীকরণের সঠিকতা অল্প কিছু থেকে ৮-১০ শতাংশ পর্যন্ত ঠিক বজায় রাখার জন্য। অনেকগুলো উদ্বায়ী পদার্থের জন্য, বিভিন্ন গুচ্ছ প্যারামিটার উপলব্ধ রয়েছে এবং যা ব্যবহার করা যায় ভিন্ন ভিন্ন তাপমাত্রার পরিসীমার মধ্যে। অ্যান্টোইন সমীকরণের একক গুচ্ছ প্যারামিটারের ব্যবহার করে যখন কোন যৌগের গলনাঙ্ক নির্ণয় করা হয় এটির ক্রিটিক্যাল তাপমাত্রায় তখন সঠিকতা হয় খুব নিম্ন। সঠিকতা আরও নিম্ন হয় যখন বাষ্প চাপ হয় ১০ টর (Torr) এর নিচে কারণ হল যন্ত্রপাতির সীমাবদ্ধতা যা ব্যবহার করে অ্যান্টোইন সমীকরণের প্যারামিটারের মান নির্ণয় করা হয়।
ওয়াগনার সমীকরণ[৪] থেকে "সবচাইতে ভাল ফলাফল"[৫] নির্ণয়, করা যায় পরীক্ষা থেকে প্রাপ্ত তথ্য অনুসারে, কিন্তু এটি বেশ জটিল। এটি প্রকাশ করে কমে যাওয়া বাষ্প চাপ হল কমে যাবে তাপমাত্রার একটি ফাংশন।
তরলের স্ফুটনাঙ্কের সাথে সম্পর্ক
[সম্পাদনা]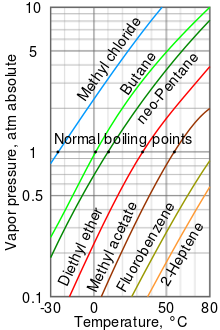
সাধারণ প্রবণতা অনুসারে, স্বাভাবিক বায়ুমণ্ডলের তাপমাত্রায় তরলের বাষ্প চাপ স্ফুটনাঙ্ক হ্রাসের সাথে সাথে বৃদ্ধি পায়। সচিত্র বাষ্প চাপ চার্ট ব্যবহার (ডান দেখুন) করে গ্রাফের সাহায্যে এটি দেখানো যে বিভিন্ন তরলের ক্ষেত্রে বাষ্প চাপের পরিবর্তন বিভিন্ন তাপমাত্রায়।[৬]
উদাহারণস্বরূপ, কোনো নির্দিষ্ট তাপমাত্রা, মিথাইল ক্লোরাইডের রয়েছে সর্বোচ্চ বাষ্প চাপ চার্টের যে কোনো ধরনের তরলের তলনায়। এটির সর্বনিম্ন স্বাভাবিক স্ফুটনাঙ্ক (-২৪.২ °সে) যা হয়, এটা হল সেই সময় যখন মিথাইল ক্লোরাইডের বাষ্প চাপের বক্ররেখা (নীল লাইন) পরম বাষ্প চাপ তথা এক বায়ুমণ্ডলীয় চাপের (এটিএম) অনুভূমিক চাপ রেখাকে ছেদ করে।
যদিও বাষ্প চাপ এবং তাপমাত্রা মধ্যে সম্পর্কটি রৈখিক নয়, তবুও চার্টে একটি লগারিদমিক উল্লম্ব অক্ষ ব্যবহার করা হয় সামান্য বাঁকা রেখায় মান দেখানোর জন্য, এটা করা হয় একই চার্ট ব্যবহার করে অনেক তরলের গ্রাফ তৈরির জন্য। একটি প্রায় সোজা রেখার প্রাপ্তি ঘটে যখন বাষ্প চাপের লগারিদম অঙ্কিত করা হয় ১/(T+২৩০) এর বিপরীতে[৭] যেখানে T হল, তাপমাত্রা ডিগ্রী সেলসিয়াসে। একটি তরলের স্ফুটনাঙ্কের বাষ্প চাপের মান তার পারিপার্শ্বিক পরিবেশের বায়ুমণ্ডলীয় চাপের সমান হয়।
তরল মিশ্রণের ক্ষেত্রে
[সম্পাদনা]রয়ল্টের সূত্র থেকে একটি মিশ্রণে থাকা তরলের বাষ্প চাপের আনুমানিক মান পাওয়া যাবে। এটা ব্যাখ্যা করে একটি একক মিশ্রণ যে কার্যরত (চাপ বা ফুগাসিটি (fugacity)) এর মান তার বাষ্প চাপের উপাদানের মোল-ভগ্নাংশ-ভর সমষ্টির সমান। যেখানে ptot - হল মিশ্রণের বাষ্প চাপ, i হল মিশ্রণের একটি উপাদান এবং Χi হল তরল মিশ্রণের উপাদানের মোল ভগ্নাংশ। piΧi, শব্দটি বলতে বুঝায় মিশ্রণে থাকা i এর আংশিক চাপ। রয়ল্টের সূত্রটি প্রযোজ্য শুধুমাত্র ইলেক্ট্রোলাইট নয় (আধানযুক্ত নয় উপাদানেরর জন্য); এটা সবচেয়ে বেশি উপযুক্ত নন-পোলার অণু সঙ্গে শুধুমাত্র দুর্বল আণবিক আকর্ষণের (যেমন লন্ডন ফোর্স) ক্ষেত্রে।
উপর্যুক্ত সূত্র দ্বারা নির্দেশিত মানের চেয়ে যে সকল সিস্টেমের বাষ্প চাপ বেশি সেগুলোর ইতিবাচক বিচ্যুতি আছে বলে মনে করা হয়। এই ধরনের বিচ্যুতি বিশুদ্ধ উপাদানগুলির তুলনায় দুর্বল অন্তর্বর্তী আকর্ষণকে নির্দেশ করে, তাতে চিন্তা করা যেতে পারে অণুরগুলি তরল পর্যায়ে কম দৃঢ় ভাবে যুক্ত থাকে এর বিশুদ্ধ তরলের তুলনায়। উদাহরণস্বরূপ প্রায় 95% ইথানল ও পানির এজিওট্রোপ। যেহেতু এজিওট্রোপের বাষ্পের চাপ রয়ল্টের সূত্রে দ্বারা হিসাবকৃত মানের চেয়ে বেশি, তাই এটির স্ফুটনাংকের তাপমাত্রার মান এর প্রতিটি বিশুদ্ধ উপাদানটির স্ফুটনাংকের তাপমাত্রা থেকে কম।
আরও কিছু নেতিবাচক বিচ্যুতির সিস্টেম রয়েছে যেগুলোতে প্রত্যাশার তুলনায় কম বাষ্প চাপ থাকে। এই বিচ্যুতি প্রমাণ করে মিশ্রণ উপাদানগুলির মধ্যে শক্তিশালী আন্ত-আণবিক আকর্ষনের যা এর বিশুদ্ধ উপাদানের তুলনায় অধিক। যার কারণে, অণুগুলো তরলে আরও দৃঢ়ভাবে "সংযুক্ত থাকে" যখন একটি দ্বিতীয় অণু উপস্থিত থাকে। একটি উদাহরণ হল ট্রাইক্লোরোমিথেন (ক্লোরোফরম) এবং ২-প্রোপেনোনের (এসিটোন) মিশ্রণ, যার স্ফুটনাংকের তাপমাত্রার মান এর প্রতিটি বিশুদ্ধ উপাদানটির স্ফুটনাংকের তাপমাত্রা থেকে বেশি।
নেতিবাচক এবং ইতিবাচক বিচ্যুতি ব্যবহার করা যায় মিশ্রণের উপাদানের থার্মোডায়নামিক কার্যকলাপের সহগ নির্ণয়ে।
তথ্যসূত্র
[সম্পাদনা]- ↑ Růžička, K.; Fulem, M. & Růžička, V.। "Vapor Pressure of Organic Compounds. Measurement and Correlation" (পিডিএফ)। ২৬ ডিসেম্বর ২০১০ তারিখে মূল (পিডিএফ) থেকে আর্কাইভ করা। সংগ্রহের তারিখ ৪ মে ২০১৭।
- ↑ What is the Antoine Equation?
- ↑ Sinnot, R.K. (২০০৫)। Chemical Engineering Design (4th সংস্করণ)। Butterworth-Heinemann। পৃষ্ঠা 331। আইএসবিএন 0-7506-6538-6।
- ↑ Wagner, W. (১৯৭৩), "New vapour pressure measurements for argon and nitrogen and a new method for establishing rational vapour pressure equations", Cryogenics, 13 (8): 470–482, ডিওআই:10.1016/0011-2275(73)90003-9, বিবকোড:1973Cryo...13..470W
- ↑ Perry's Chemical Engineers' Handbook, 7th Ed. pp. 4–15
- ↑ Perry, R.H.; Green, D.W., সম্পাদকগণ (১৯৯৭)। Perry's Chemical Engineers' Handbook (7th সংস্করণ)। McGraw-Hill। আইএসবিএন 0-07-049841-5।
- ↑ Dreisbach, R. R. & Spencer, R. S. (১৯৪৯)। "Infinite Points of Cox Chart Families and dt/dP Values at any Pressure"। Industrial and Engineering Chemistry,। 41 (1)। পৃষ্ঠা 176। ডিওআই:10.1021/ie50469a040।

