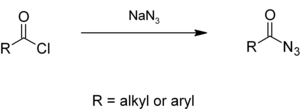অ্যাজাইড
অ্যাজাইড হল একটি অ্যানায়ন এবং এর রাসায়নিক সংকেত N−
3। এটি হাইড্রোজোয়িক অ্যাসিডের কনজুগেট ক্ষার (HN3)। N−
3 একটি লিনিয়ার অ্যানায়ন যা CO2, NCO−, N2O, NO+
2 এবং NCF সহ আইসোইলেক্ট্রনিক। যোজ্যতা বন্ধন তত্ত্ব অনুসারে অ্যাজাইডকে বিভিন্ন অনুরণন কাঠামোর দ্বারা বর্ণনা করা যেতে পারে; গুরুত্বপূর্ণ একটি সত্তা . অ্যাজাইড জৈব রসায়নের একটি কার্যকরী মূলকও RN3।[১]
অ্যাজাইড এর প্রধান ব্যবহার এয়ারব্যাগ এর প্রোপালেন্ট হিসাবে।
প্রস্তুত প্রণালী
[সম্পাদনা]
অজৈব অ্যাজাইড
[সম্পাদনা]শিল্পক্ষেত্রে তরল অ্যামোনিয়া দ্রাবকে নাইট্রাস অক্সাইড N2O সোডিয়াম অ্যামাইড এর বিক্রিয়া দ্বারা সোডিয়াম অ্যাজাইড তৈরি করা হয়:[২]
- N2O + 2 NaNH2 → NaN3 + NaOH + NH3
সোডিয়াম অ্যাজাইড থেকে প্রত্যক্ষ বা পরোক্ষভাবে অনেক অজৈব অ্যাজাইড প্রস্তুত করা যায়। উদাহরণস্বরূপ, ডেটোনেটরে ব্যবহৃত লেড অ্যাজাইড মেটাথেসিস প্রতিক্রিয়ায় লেড নাইট্রেট এবং সোডিয়াম অ্যাজাইডের বিক্রিয়ার মাধ্যমে প্রস্তুত করা যায়। আরেকটি বিকল্প পদ্ধতি হলো তরল অ্যামোনিয়াতে সিলভার অ্যাজাইডের সাথে ধাতু দ্রবীভূত করে সরাসরি বিক্রিয়ার মাধ্যমে।[৩] কিছু অ্যাজাইড হাইড্রজোয়িক অ্যাসিডের সাথে কার্বনেট লবণ বিক্রিয়া করে উৎপাদিত হয়।

জৈব অ্যাজাইড
[সম্পাদনা]অ্যাজাইড এর একটি অংশের মূল উৎস হল সোডিয়াম অ্যাজাইড। ছদ্ম হ্যালোজেন যৌগ হিসাবে সোডিয়াম অ্যাজাইড সাধারণত উপযুক্ত ত্যাগকারী গ্রুপ (যেমন Br, I, OTs) স্থানচ্যুত করে অ্যাজাইডো যৌগ গঠন করে। অ্যারাইল অ্যাজাইডসমূহ সোডিয়াম অ্যাজাইড বা ট্রাইমিথাইলসিলিল অ্যাজাইডের সাথে উপযুক্ত ডায়াজোনিয়াম লবণ প্রতিস্থাপিত করে প্রস্তুত করা যায়; নিউক্লিওফিলিক অ্যারোমেটিক পদার্থ এমনকি ক্লোরাইড প্রস্তুত করা সম্ভব। অ্যালকাইল অ্যামিন এবং হাইড্রাজিনসমূহের মতো অ্যানিলিন এবং অ্যারোমেটিক হাইড্রাজাইনসমূহ ডায়াজোটাইজেশন হয়।[১]
যথাযথ কার্যকরী আলিফ্যাটিক যৌগসমূহ সোডিয়াম অ্যাজাইডের সাথে নিউক্লিওফিলিক প্রতিস্থাপনের মধ্য দিয়ে যায়।[১] হাইড্রাজিনসমূহ সোডিয়াম নাইট্রাইটের সাথে বিক্রিয়ার মাধ্যমে অ্যাজাইড গঠন করতে পারে:[৫]
- PhNHNH2 + NaNO2 → PhN3
জলীয় দ্রবণে অ্যালকাইল বা অ্যারাইল অ্যাসাইল ক্লোরাইডসমূহ সোডিয়াম অ্যাজাইডের সাথে বিক্রিয়া করে অ্যাসাইল অ্যাজাইড তৈরি করে,[৬][৭] যা কার্টিয়াস পুনর্বিন্যাসের মাধ্যমে আইসোসায়ানেট উৎপন্ন করে।
অ্যাজো-ট্রান্সফার যৌগসমূহ সোডিয়াম অ্যাজাইড থেকে ট্রাইফ্লোরোমিথানেসালফোনাইল অ্যাজাইড এবং ইমিডাজল -১-সালফোনাইল অ্যাজাইড উৎপন্ন করে। তারা অ্যামিনের সাথে বিক্রিয়া করে অনুরূপ অ্যাজাইডসমূহ তৈরি করে:
- RNH2 → RN3
দত্ত–ওয়ার্মল বিক্রিয়া
[সম্পাদনা]অ্যাজাইডসমূহ সংশ্লেষণের একটি সর্বোত্তম পদ্ধতি হল দত্ত–ওয়ার্মল বিক্রিয়া[৮] যেখানে ডায়াজোনিয়াম লবণের সাথে সালফোনামাইড বিক্রিয়া করে প্রথমে ডায়াজোঅ্যামিনোসালফিনেট এবং পরে হাইড্রোলাইসিস করে অ্যাজাইড এবং সালফিনিক অ্যাসিড পাওয়া যায়।[৯]
বিক্রিয়া
[সম্পাদনা]অজৈব অ্যাজাইড
[সম্পাদনা]নাইট্রোজেন গ্যাস মুক্ত হলে অ্যাজাইড লবণ বিশ্লিষ্ট হয়। ক্ষারীয় ধাতব অ্যাজাইডসমূহের বিশ্লিষ্ট হওয়ার তাপমাত্রা হল: NaN3 (২৭৫ °সে), KN3 (৩৫৫ °সে), RbN3 (৩৯৫ °সে), এবং CsN3 (৩৯০ °সে)। এই পদ্ধতিটি অত্যন্ত বিশুদ্ধ ক্ষারীয় ধাতু উৎপাদন করতে ব্যবহৃত হয়।[১০]
শক্তিশালী অ্যাসিডের উপস্থিতিতে অজাইড লবণের প্রোটোনেশনের ফলে বিষাক্ত হাইড্রজোয়িক অ্যাসিড উৎপন্ন করে:
- H+ + N−
3 → HN3
অ্যাজাইড লবণসমূহ ভারী ধাতু বা ভারী ধাতব যৌগের সাথে বিক্রিয়া করে অনুরূপ অ্যাজাইড তৈরি করে যা সোডিয়াম অ্যাজাইডের চেয়ে বেশি ঘাত সংবেদী। অম্লীয় করা হলে এরা সোডিয়াম নাইট্রাইটে বিশ্লিষ্ট হয়। এটি অপসারণ করার পূর্বে অ্যাজাইডের অধঃক্ষেপ ধ্বংস করার একটি পদ্ধতি।[১১]
- 2 NaN3 + 2 HNO2 → 3 N2 + 2 NO + 2 NaOH
অনেক অজৈব সমযোজী অ্যাজাইড (উদাঃ ক্লোরিন, ব্রোমিন এবং আয়োডিন অ্যাজাইড) রয়েছে।[১২]
অ্যাজাইড অ্যানায়ন নিউক্লিওফিল হিসাবে আচরণ করে; এটি আলিফ্যাটিক এবং অ্যারোমেটিক উভয় পদ্ধতিতে নিউক্লিওফিলিক প্রতিস্থাপন দেয়। এটি ইপোক্সাইডসমূহের সাথে বিক্রিয়া করে ফলে একটি খোলা-চক্র সৃষ্টি হয়; এটি ১,৪-অসম্পৃক্ত কার্বনিল যৌগসমূহে মাইকেল-লাইক অনুবন্ধী সংযোজন করে।[১]
N2 মুক্ত করার জন্য ধাতব নাইট্রিডো জটিলের পূর্ববর্তী হিসাবে অ্যাজাইডসমূহ ব্যবহার করা যেতে পারে, অস্বাভাবিক জারণ অবস্থায় ধাতব জটিল তৈরি করে (দেখুন: উচ্চ যোজী আয়রন)।
জৈব অ্যাজাইড
[সম্পাদনা]জৈব অ্যাজাইড কার্যকর জৈব বিক্রিয়ার সাথে জড়িত। প্রান্তিক নাইট্রোজেন হালকা নিউক্লিওফিলিক। অ্যাজাইডসমূহ সহজেই দ্বি-পরমানুক নাইট্রোজেনকে অপসারণ করে, এমন একটি প্রবণতা যা স্টুডিঞ্জার বন্ধ্যাকরণ বা কার্টিয়াস পুনর্বিন্যাসের মতো অনেক বিক্রিয়াতে বা উদাহরণস্বরূপ γ-ইমিনো-β-ইনামিনো এস্টার এর সংশ্লেষণে ব্যবহার করা হয়।[১৩][১৪]
অ্যাজাইড হাইড্রোজেনোলাইসিস[১৫] দ্বারা অ্যামিন বা স্টুডিঞ্জার বিক্রিয়ায় ফসফিন (উদাহরণস্বরূপ ট্রাইফিনাইলফসফিন) হ্রাস করে। এই বিক্রিয়ায় অ্যাজাইডসমূহ ১,১,১-ট্রিস(অ্যামিনোমিথাইল)ইথেন এর সংশ্লেষণ দ্বারা চিত্রিত আশ্রিত -NH2 সিন্থন হিসাবে তৈরি করে:
- 3 H2 + CH3C(CH2N3)3 → CH3C(CH2NH2)3 + 3 N2
অ্যাজাইড অ্যালকিন হুইজেন সাইক্লোডিশনে জৈব অ্যাজাইডসমূহ ১,৩-ডাইপোল হিসাবে বিক্রিয়া করে, অ্যালকাইনের সাথে বিক্রিয়া করে ১,২,৩-ট্রাইঅ্যাজোল প্রতিস্থাপন করে।
অন্য একটি নিয়মিত অ্যাজাইড হল টসাইল অ্যাজাইড এখানে নাইট্রোজেন সন্নিবেশের বিক্রিয়াতে নরবর্নাডিয়েনের সাথে বিক্রিয়া করে:[১৬]
ব্যবহার
[সম্পাদনা]প্রতিবছর প্রায় ২৫০ টন অ্যাজাইডযুক্ত যৌগ উৎপাদিত হয়, অ্যাজাইডযুক্ত প্রধান পণ্য হল সোডিয়াম অ্যাজাইড।[১৭]
ডিটোনেটর এবং প্রোপালেন্ট
[সম্পাদনা]সোডিয়াম অ্যাজাইড মোটর গাড়ির এয়ারব্যাগের প্রোপালেন্ট হিসাবে ব্যবহৃত হয়। এটিকে তাপ দিলে বিশ্লিষ্ট হয়ে নাইট্রোজেন গ্যাস উৎপন্ন হয় যা বায়ু ব্যাগ দ্রুত ফুলানোর জন্য ব্যবহৃত হয়:[১৭]
- 2 NaN3 → 2 Na + 3 N2
ভারী ধাতব লবণ যেমন লেড আজাইড Pb(N3)2 হল শক-সংবেদনশীল ডিটোনেটর যা বিশ্লিষ্ট হয়ে অনুরূপ ধাতু এবং নাইট্রোজেন উৎপন্ন হয়, উদাহরণস্বরূপ:[১৮]
- Pb(N3)2 → Pb + 3 N2
সিলভার এবং বেরিয়াম লবণ একইভাবে ব্যবহৃত হয়। কিছু জৈব অ্যাজাইড কার্যকর রকেট প্রোপালেন্ট যেমন ২-ডাইমিথাইলঅ্যামিনোইথাইলঅ্যাজাইড (ডিএমএজেড)।
অন্যান্য
[সম্পাদনা]এদের ব্যবহারগত ঝুঁকির কারণে কিছু সংখ্যক অ্যাজাইড বাণিজ্যিকভাবে ব্যবহৃত হয়, যদিও এগুলো গবেষকদের জন্য আকর্ষণীয় প্রতিক্রিয়া দেখায়। কম আণবিক ভরের অ্যাজাইডসমূহ বিশেভাবে ঝুঁকিপূর্ণ হিসাবে বিবেচিত হয় এবং এড়িয়ে চলা হয়। গবেষণাগারে অ্যাজাইডসমূহ অ্যামিনের পূর্ববর্তী হয়। অ্যাজাইড "ক্লিক বিক্রিয়া" এবং স্টুডিঞ্জার লিগেশনে অংশ নেওয়ার জন্যও বহুল প্রচলিত। এই দুটি বিক্রিয়া সাধারণত অধিক নির্ভরযোগ্য, হারমোনিক রসায়নে নিজেকে উপযোজন করে।
ভাইরাস প্রতিরোধী ঔষধ জিডোভুডিন (এজেডটি) এ অ্যাজিডো গ্রুপ রয়েছে। কিছু অ্যাজাইড বায়োঅর্থোগোনাল রাসায়নিক হিসাবে মূল্যবান।
নিরাপত্তা
[সম্পাদনা]- অ্যাজাইডগুলি বিস্ফোরক এবং বিষাক্ত।
- সোডিয়াম অ্যাজাইড বিষাক্ত (টেমপ্লেট:LD50 মুখে খাবার জন্য (ইঁদুর) = ২৭ মিলিগ্রাম/কেজি) এবং এটি ত্বকের মাধ্যমে শুষিত হয়। এটি ২৭৫ ডিগ্রি সেন্টিগ্রেডের বেশি তাপমাত্রায় বিস্ফোরণসহ বিশ্লিষ্ট হয় এবং CS2, ব্রোমিন, নাইট্রিক অ্যাসিড, ডাইমিথাইল সালফেট এবং তামা এবং সীসা সহ ভারী ধাতুর একটি শ্রেণী উৎপন্ন করাসহ জোরালো প্রতিক্রিয়া দেখায়। পানি বা ব্রনস্টেড অ্যাসিডের সাথে বিক্রিয়া করে অত্যন্ত বিষাক্ত বিস্ফোরক হাইড্রোজেন অ্যাজাইড উৎপন্ন করে।
- ভারী ধাতব অ্যাজাইডসমূহ যেমন লেড অ্যাজাইড উত্তপ্ত বা আন্দোলিত অবস্থায় প্রাথমিক উচ্চ বিস্ফোরক। ভারী ধাতব বা তাদের লবণ সোডিয়াম অ্যাজাইড দ্রবণ বা HN3 বাষ্পের সংস্পর্শে এলে ভারী ধাতব অ্যাজাইডসমূহ গঠিত হয়। ভারী-ধাতব অ্যাজাইডসমূহ নির্দিষ্ট পরিস্থিতিতে জমতে পারে, উদাহরণস্বরূপ ধাতব পাইপলাইনগুলিতে এবং বিভিন্ন সরঞ্জামের ধাতু উপাদানগুলিতে (ঘূর্ণমান বাষ্পীভবনকারী, হিমায়িতকরণ সরঞ্জাম, শীতলীককরণ জাল, পানি-সংভরণ, বর্জ্যনিষ্কাষণ পাইপ) জমতে পারে এবং এর ফলে ভয়াবহ বিস্ফোরণ ঘটে।
- কিছু জৈব এবং অন্যান্য সমযোজী অ্যাজাইডকে অত্যন্ত বিস্ফোরক এবং বিষাক্ত হিসাবে শ্রেণিবদ্ধ করা হয়: অজৈব অ্যাজাইড নিউরোটক্সিন হিসাবে; অ্যাজাইড আয়ন সাইটোক্রোম সি অক্সিডাস ইনহিবিটার হিসাবে।
- জানা গেছে যে সোডিয়াম অ্যাজাইড এবং পলিমার-বন্ধনকৃত অ্যাজাইড বিকারকসমূহ ডাইক্লোরোমিথেন এবং ব্রোমোফর্মের সাথে ডাই- এবং ট্রাইঅ্যাজিডোমিথেন গঠন করে, উভয়ই উচ্চ ঘনত্বের ক্ষেত্রে দ্রবণে অস্থিতিশীল। বিক্রিয়ার মিশ্রণগুলি একটি ঘূর্ণমান বাষ্পীভবনকে কেন্দ্র করে ঘনীভূত হলে অনেক ভয়াবহ বিস্ফোরণ ঘটতে পারে। ডাইঅ্যাজাইডোমিথেন (এবং ট্রাইঅ্যাজাইডোমিথেন) এর ঝুঁকিসমূহ যথেষ্ট পরিমানে নথিভুক্ত আছে।[১৯][২০]
- কঠিন আয়োডোঅ্যাজাইড বিস্ফোরক এবং দ্রাবকের অনুপস্থিতিতে প্রস্তুত করা উচিত নয়।[২১]
আরও দেখুন
[সম্পাদনা]তথ্যসূত্র
[সম্পাদনা]- ↑ ক খ গ ঘ S. Bräse; C. Gil; K. Knepper; V. Zimmermann (২০০৫)। "Organic Azides: An Exploding Diversity of a Unique Class of Compounds"। Angewandte Chemie International Edition। 44 (33): 5188–5240। ডিওআই:10.1002/anie.200400657। পিএমআইডি 16100733।
- ↑ Greenwood, N. N.; Earnshaw, A. (১৯৯৭)। Chemistry of the Elements (2nd সংস্করণ)। Butterworth-Heinemann। পৃষ্ঠা 433। আইএসবিএন 0080379419।
- ↑ Müller, Thomas G.; Karau, Friedrich; Schnick, Wolfgang; Kraus, Florian (২০১৪)। "A New Route to Metal Azides"। Angewandte Chemie। 53 (50): 13695–13697। ডিওআই:10.1002/anie.201404561।
- ↑ I. Bernal, J. Cetrullo, W. G. Jackson (১৯৯৩)। "The phenomenon of conglomerate crystallization in coordination compounds. XXIII: The crystallization behavior of [cis-Co(en)2(N3)(SO3)]·2H2O (I) and of [cis-Co(en)2(NO2)(SO3)]·H2O (II)"। Struct.Chem.। 4: 235। ডিওআই:10.1007/BF00673698।
- ↑ R. O. Lindsay; C. F. H. Allen (১৯৫৫)। "Phenyl azide"। অর্গানিক সিন্থেসিস।; Collective Volume, 3, পৃষ্ঠা 710
- ↑ C. F. H. Allen; Alan Bell। "Undecyl isocyanate"। অর্গানিক সিন্থেসিস।; Collective Volume, 3, পৃষ্ঠা 846
- ↑ Jon Munch-Petersen (১৯৬৩)। "m-Nitrobenzazide"। অর্গানিক সিন্থেসিস।; Collective Volume, 4, পৃষ্ঠা 715
- ↑ Pavitra Kumar Dutt; Hugh Robinson Whitehead; Arthur Wormall (১৯২১)। "CCXLI.—The action of diazo-salts on aromatic sulphonamides. Part I"। J. Chem. Soc., Trans.। 119: 2088–2094। ডিওআই:10.1039/CT9211902088। অজানা প্যারামিটার
|name-list-style=উপেক্ষা করা হয়েছে (সাহায্য) - ↑ Name Reactions: A Collection of Detailed Reaction Mechanisms by Jie Jack Li Published 2003 Springer আইএসবিএন ৩-৫৪০-৪০২০৩-৯
- ↑ E. Dönges "Alkali Metals" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 475.
- ↑ Committee on Prudent Practices for Handling, Storage, and Disposal of Chemicals in Laboratories, Board on Chemical Sciences and Technology, Commission on Physical Sciences, Mathematics, and Applications, National Research Council (১৯৯৫)। Prudent practices in the laboratory: handling and disposal of chemicals। Washington, D.C.: National Academy Press। আইএসবিএন 0-309-05229-7।
- ↑ I. C. Tornieporth-Oetting; T. M. Klapötke (১৯৯৫)। "Covalent Inorganic Azides"। Angewandte Chemie International Edition in English। 34 (5): 511–520। ডিওআই:10.1002/anie.199505111। অজানা প্যারামিটার
|name-list-style=উপেক্ষা করা হয়েছে (সাহায্য) - ↑ Mangelinckx, S.; Van Vooren, P.; De Clerck, D.; Fülöp, F.; De Kimpea, N. (২০০৬)। "An efficient synthesis of γ-imino- and γ-amino-β-enamino esters"। Arkivoc (iii): 202–209।
- ↑ Reaction conditions: a) sodium azide 4 eq., acetone, 18 hours reflux 92% chemical yield b) isopropyl amine, titanium tetrachloride, diethyl ether 14 hr reflux 83% yield. Azide 2 is formed in a nucleophilic aliphatic substitution reaction displacing chlorine in 1 by the azide anion. The ketone reacts with the amine to an imine which tautomerizes to the enamine in 4. In the next rearrangement reaction nitrogen is expulsed and a proton transferred to 6. The last step is another tautomerization with the formation of the enamine 7 as a mixture of cis and trans isomers
- ↑ https://www.organic-chemistry.org/synthesis/N1H/reductionsazides.shtm
- ↑ Damon D. Reed; Stephen C. Bergmeier (২০০৭)। "A Facile Synthesis of a Polyhydroxylated 2-Azabicyclo[3.2.1]octane"। J. Org. Chem.। 72 (3): 1024–6। ডিওআই:10.1021/jo0619231। পিএমআইডি 17253828। অজানা প্যারামিটার
|name-list-style=উপেক্ষা করা হয়েছে (সাহায্য) - ↑ ক খ Horst H. Jobelius, Hans-Dieter Scharff "Hydrazoic Acid and Azides" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. ডিওআই:10.1002/14356007.a13_193
- ↑ Shriver and Atkins. Inorganic Chemistry (Fifth Edition). W. H. Freeman and Company, New York, pp 382.
- ↑ M. S. Alfred Hassner (১৯৮৬)। "Synthesis of Alkyl Azides with a Polymeric Reagent"। Angewandte Chemie International Edition in English। 25 (5): 478–479। ডিওআই:10.1002/anie.198604781।
- ↑ A. Hassner; M. Stern; H. E. Gottlieb; F. Frolow (১৯৯০)। "Synthetic methods. 33. Utility of a polymeric azide reagent in the formation of di- and triazidomethane. Their NMR spectra and the x-ray structure of derived triazoles"। J. Org. Chem.। 55 (8): 2304–2306। ডিওআই:10.1021/jo00295a014।
- ↑ L. Marinescu; J. Thinggaard; I. B. Thomsen; M. Bols (২০০৩)। "Radical Azidonation of Aldehydes"। J. Org. Chem.। 68 (24): 9453–9455। ডিওআই:10.1021/jo035163v। পিএমআইডি 14629171।
বহিঃসংযোগ
[সম্পাদনা]- জৈব অ্যাজাইডের সংশ্লেষণ, সাম্প্রতিক পদ্ধতি
- জৈব অ্যাজাইড সংশ্লেষণ, বিশুদ্ধকরণ এবং পরিচালণ