রাসায়নিক গতিবিদ্যা
রাসায়নিক গতিবিদ্যা বা বিক্রিয়া গতিবিদ্যা নামেও পরিচিত, এবং এটি হলো ভৌত রসায়নের এমন একটি শাখা যা রাসায়নিক বিক্রিয়ার হার বোঝার সাথে সম্পর্কিত। এটিকে রাসায়নিক তাপগতিবিদ্যার বিপরীত হিসেবে বুঝলে সুবিধা হবে। রাসায়নিক তাপগতিবিদ্যা একটি বিক্রিয়ার দিক বা বিক্রিয়াটি কোনদিকে ঘটবে তা নির্দেশ করে; কিন্তু এ থেকে বিক্রিয়াটির হার সম্পর্কে কিছুই জানা যায় না। অন্যদিকে, রাসায়নিক গতিবিদ্যায় অন্তর্ভুক্ত আছে সেই সমস্ত পরীক্ষ-নিরীক্ষা ভিত্তিক পর্যবেক্ষণাদি যেগুলোর উপর ভিত্তি করে বলা যায় যে, কিভাবে একটি বিক্রিয়ার পরীক্ষাকালীন অবস্থা (তাপমাত্রা, চাপ, ঘনমাত্রা ইত্যাদি) উক্ত রাসায়নিক বিক্রিয়ার গতিকে প্রভাবিত করে এবং এটি বিক্রিয়ার ক্রিয়া-কৌশল এবং অবস্থান্তর অবস্থা সম্পর্কে তথ্য দেয়। এছাড়াও রাসায়নিক গতিবিদ্যা দ্বারা সে সমস্ত গাণিতিক মডেলগুলি দাঁড় করানো সম্ভব যেগুলো একটি রাসায়নিক বিক্রিয়ার বৈশিষ্ট্যাবলী ব্যাখ্যা করতে পারে।
ইতিহাস
[সম্পাদনা]জার্মান রসায়নবিদ লুডভিগ ১৮৫০ সালে সর্বপ্রথম রাসায়নিক গতিবিদ্যা নিয়ে কাজ করেন।[১] তিনি পরীক্ষামূলকভাবে সুক্রোজের (গ্লুকোজ ও ফ্রুক্টোজে) রুপান্তর হার অধ্যয়ন করেন এবং এই বিক্রিয়ার রাসায়নিক গতিপ্রকৃতি নির্ধারণের জন্য তিনি "সমন্বিত হার সূত্র" ব্যবহার করেন। ৩৪ বছর পরে তার কাজ উইলহেম অস্টওয়াল্ড এর নজরে আসে। উইলহেলমির পরে, পিটার ওয়েজ এবং ক্যাটো গুল্ডবার্গ ১৮৬৪ সালে ভরক্রিয়ার সূত্র প্রকাশ করেন। ভরক্রিয়ার সূত্র মতে, রাসায়নিক বিক্রিয়ার গতি (বা, হার) বিক্রিয়াকারী পদার্থসমূহের পরিমাণের সমানুপাতিক।[২][৩][৪]
ভ্যান'ট হফ রাসায়নিক গতিবিদ্যা অধ্যয়ন করেন এবং ১৮৮৪ সালে তিনি তার বিখ্যাত "এটিউতস্ ডে ডুইনামিক চিমিক (রাসায়নিক গতিবিদ্যা অধ্যয়ন)" প্রকাশ করেন।[৫] "রাসায়নিক গতিবিদ্যা এবং দ্রবণের অসমোটিক চাপের সূত্রসমূহ" আবিষ্কারের মাধ্যমে যে অসাধারণ কাজ ভ্যান'ট হফ করেছিলেন, তার স্বীকৃতিস্বরূপ ১৯০১ সালে তিনি রসায়নে প্রথম নোবেল পুরস্কারে ভূষিত হন।[৬] ভ্যান'ট হফের পরে রাসায়নিক গতিবিদ্যা বিক্রিয়া হারের পরীক্ষামূলক র্নিণয় নিয়ে আলোকপাত করা শুরু করে, আর সেখান থেকে বিক্রিয়ার হার সূত্রাবলী এবং হার ধ্রুবকগুলি নির্ণয় করা যায়। শূন্য ক্রম বিক্রিয়াগুলির জন্য তুলনামূলকভাবে সহজ হার সুত্র বিদ্যমান (যার জন্য বিক্রিয়া হারগুলি ঘনমাত্রার উপর নির্ভরশীল নয়), এবং প্রথম ক্রম বিক্রিয়া এবং দ্বিতীয় ক্রম বিক্রিয়া গুলির জন্যও অনুরুপ সহজ হার সূত্রাবলী আছে। আর, অপরাপর বিক্রিয়া গুলির জন্যও তাদের হার সমীকরণ প্রতিপাদন করা যায়। মৌলিক বিক্রিয়াগুলি ভরক্রিয়ার সূত্র অনুসরণ করে, কিন্তু যে সমস্ত বিক্রিয়া একাধিক ধাপে সংঘটিত হয় ধাপ-ভিত্তিক বিক্রিয়া, তাদের হার সূত্র বের করতে হয় প্রতিটি ধাপের সাথে সংশ্লিষ্ট বিভিন্ন মৌলিক বিক্রিয়ার হার সূত্র গুলিকে যোগ করার মাধ্যমে এবং এভাবে বিক্রিয়ার হার বের করা কখনো বেশ জটিল হতে পারে। জটিল বিক্রিয়া বা বহু-ধাপ যুক্ত বিক্রিয়া যা আবার ক্রমাগত বিক্রিয়া নামেও পরিচিত, এরুপ বিক্রিয়ার হার-নির্ণায়ক ধাপ প্রায়শই বিক্রিয়ার হার নির্ধারণ করে থাকে। প্রথম ক্রম সার্বিক বিক্রিয়ার ক্ষেত্রে একটি স্থিত অবস্থা অনুমানকরণ দ্বারা বিক্রিয়ার হার সূত্রের সরলীকরণ করা যাতে পারে। আরহেনিয়াস সমীকরণ এবং আইরিং সমীকরণের মাধ্যমে একটি বিক্রিয়ার সক্রিয়ন শক্তি পরীক্ষামূলকভাবে নির্ণয় করা হয় । যে সমস্ত নিয়ামক বিক্রিয়ার হার কে প্রভাবিত করে সেগুলোর মধ্যে প্রধান হলোঃ বিক্রিয়কগুলির ভৌত অবস্থা, বিক্রিয়কগুলির ঘনত্ব, বিক্রিয়াটি যে তাপমাত্রায় ঘটে তা এবং বিক্রিয়াটিতে কোনও অনুঘটক উপস্থিত আছে কিনা এসব।
গরব্যান এবং ইয়াবলনস্কি এর মতে, রাসায়নিক গতিবিদ্যার ইতিহাসকে তিনটি যুগে ভাগ করা যেতে পারে।[৭] প্রথম পর্যায়ে আছে বিজ্ঞানী ভ্যান্ট হফ কর্তৃক একাদিক্রমে অনুসন্ধান যার মাধ্যমে তিনি রাসায়নিক বিক্রিয়ার সাধারণ হার সূত্রাবলী এবং তাপগতিবিদ্যার সাথে রাসায়নিক গতিবিদ্যাকে সম্পর্কিত করার উপায় খুঁজছিলেন। রাসায়নিক গতিবিদ্যার ইতিহাসের দ্বিতীয় পর্যায়কে বলা যেতে পারে সেমিয়োনভ-হিনশেলউডের যৌথ প্রচেষ্টা, যেখানে তারা বিক্রিয়ার কৌশলের উপর জোর দিয়েছিলেন, বিশেষতঃ তারা জোর দিয়েছিলেন শিকল বিক্রিয়ার কৌশলের উপর। গতিবিদ্যার ইতিহাসের তৃতীয় পর্যায়ের সাথে সংশ্লিষ্ট ছিলেন অ্যারিস , আর তার কাজ সংশ্লিষ্ট ছিল রাসায়নিক বিক্রিয়া নেটওয়ার্কগুলির বিশদ গাণিতিক বর্ণনার সাথে।
বিক্রিয়ার হারকে প্রভাবিত করে এমন নিয়ামক সমূহ
[সম্পাদনা]বিক্রিয়কের প্রকৃতি
[সম্পাদনা]কোন পদার্থগুলো বিক্রিয়ায় অংশগ্রহণ করছে তার উপর ভিত্তি করে বিক্রিয়ার হার পরিবর্তিত হয়। অম্ল/ ক্ষার বিক্রিয়া, লবণের গঠন এবং আয়ন বিনিময় এসব বিক্রিয়াগুলো সাধারণত দ্রুত ঘটে। যখন অণুগুলির মধ্যে সমযোজী বন্ধন গঠিত হয় এবং যখন বড় অণু গঠিত হয়, তখন বিক্রিয়াগুলোর ধীর গতিতে ঘটার প্রবণতা থাকে।
বিক্রিয়ক অণুতে উপস্থিত বন্ধনের প্রকৃতি এবং শক্তি তাদের উৎপাদে রূপান্তরের হারকে ব্যাপকভাবে প্রভাবিত করে।
ভৌত অবস্থা
[সম্পাদনা]একটি বিক্রিয়কের ভৌত অবস্থাও (কঠিন, তরল বা গ্যাস ) বিক্রিয়ার হারের পরিবর্তনের একটি গুরুত্বপূর্ণ নিয়ামক। যখন বিক্রিয়কগুলি একই দশায় থাকে, যেমন জলীয় দ্রবণে , তখন তাপীয় গতি তাদেরকে পরস্পরের সংস্পর্শে নিয়ে আসে। অন্যদিকে, যখন তারা ভিন্ন দশায় থাকে, তখন বিক্রিয়াটি শুধুমাত্র বিক্রিয়কগুলির ইন্টারফেস বা স্পর্শ-তলের মধ্যে সীমাবদ্ধ থাকে। বিক্রিয়া শুধুমাত্র তাদের স্পর্শ-তলে ঘটতে পারে; যেমন, বিক্রিয়কসমূহ তরল এবং গ্যাসীয় এ দু'টি ভিন্ন দশায় থাকলে, বিক্রিয়া ঘটবে তরলের পৃষ্ঠে। বিক্রিয়াটি সম্পূর্ণ করার জন্য জোরালো ঝাঁকুনি এবং নাড়ানোর প্রয়োজন হতে পারে। এর মানে হল যে, কঠিন বা তরল বিক্রিয়কগুলোকে যত সূক্ষ্মকণায় বিভক্ত করা হবে, প্রতি একক আয়তনে এদের পৃষ্ঠতলের ক্ষেত্রফল তত বেশি হবে এবং এর ফলে অন্যান্য বিক্রিয়কের সাথে এটির সংস্পর্শ অধিকতর হবে, আর এভাবে বিক্রিয়াও দ্রুততর ঘটবে। এটি বুঝার জন্য একটি উপমা ব্যবহার করা যায়, যেমন, যখন কেউ আগুন জ্বালানো শুরু করে, তখন সে কাঠের ছোট ফালি এবং ছোট ছোট ডাল ব্যবহার করে - শুরুতেই কিন্তু কেউ বড় কাঠের লগ বা গুড়ী দিয়ে আগুন জ্বালানো শুরু করে না। জৈব রসায়নে, পানিতে সংঘটিত বিক্রিয়াগুলির ক্ষেত্রে এই নিয়মের ব্যতিক্রম ঘটে এভাবে যে, এসবক্ষেত্রে সমসত্ত্বীয় বিক্রিয়াগুলি অসমসত্ত্ব বিক্রিয়াগুলির চেয়ে দ্রুততর সংঘটিত হয় (অসমসত্ত্ব বিক্রিয়া হলো সেসব বিক্রিয়া যাদের ক্ষেত্রে দ্রব এবং দ্রাবক সঠিকভাবে মিশ্রিত হয় না।)
বিক্রিয়কের কঠিন অবস্থার পৃষ্ঠতলের ক্ষেত্রফল
[সম্পাদনা]একটি কঠিন পদার্থের মধ্যে অবস্থিত কণাগুলোর মধ্যে শুধুমাত্র সেই কণাগুলো বিক্রিয়ায় অংশগ্রহণ করে, যেগুলো বিক্রিয়কের পৃষ্ঠতলে থাকে। কোন কঠিন পদার্থকে ছোট ছোট অংশে চূর্ণ-বিচূর্ণ করার অর্থ হল এই যে, চূর্ণ-বিচূর্ণ অবস্থায় এর পৃষ্ঠতলে পূর্বের চেয়ে অধিকতর কণা থাকে এবং এর ফলে বিক্রিয়ক কণাগুলির মধ্যে সংঘর্ষের মাত্রা বৃদ্ধি পায়, আর তাই বিক্রিয়া আরও দ্রুত ঘটে। উদাহরণস্বরূপ, শরবত (গুঁড়া) হলো, ম্যালিক অ্যাসিড (একটি দুর্বল জৈব অ্যাসিড) এবং সোডিয়াম হাইড্রোজেন কার্বনেটের খুব সূক্ষ্ম পাউডারের একটি মিশ্রণ। মুখের লালার সংস্পর্শে, এই পাউডারের মিশ্রণে থাকা রাসায়নিক পদার্থগুলো দ্রুত দ্রবীভূত হয় এবং বিক্রিয়া করার মাধ্যমে কার্বন ডাই অক্সাইড ছেড়ে দেয় এবং কানে বা পেটের মধ্যে সাঁ-সাঁ শব্দানুভূতি প্রদান করে। এছাড়াও, আতশবাজি প্রস্তুতকারীরা কঠিন বিক্রিয়কের পৃষ্ঠের ক্ষেত্রফল পরিবর্তন করার মাধ্যমে আতশবাজিতে ব্যবহৃত জ্বালানীর দহন হওয়ার হার নিয়ন্ত্রণ করে, আর এভাবে তারা আতশবাজিতে বৈচিত্রময় বৈশিষ্ট্য আনয়ন করে। উদাহরণস্বরূপ, একটি শেলের মধ্যে আবদ্ধ মিহিভাবে গুঁড়া করা অ্যালুমিনিয়াম বিকটভাবে বিস্ফোরিত হয়। আর যদি এক্ষেত্রে অ্যালুমিনিয়ামের বড় টুকরো ব্যবহার করা হত, সেক্ষেত্রে বিক্রিয়াটি ধীরগতির হত এবং আতশবাজির বৈচিত্রময় বৈশিষ্ট্যের পরিবর্তে জ্বলন্ত ধাতুর টুকরোগুলি বের হয়ে যাওয়ার কারণে শুধুমাত্র স্ফুলিঙ্গ দেখা যেত ।
ঘনমাত্রা
[সম্পাদনা]বিক্রিয়কগুলোর পারস্পরিক সংঘর্ষের কারণে বিক্রিয়া সংঘটিত হয়। অণু বা আয়নগুলি যে ফ্রিকোয়েন্সি বা কম্পাঙ্কে পরস্পরের সাথে সংঘর্ষে লিপ্ত হয় তা তাদের ঘনত্বের উপর নির্ভর করে। যৌগের অণুগুলি যত বেশি পরস্পরের সন্নিকটে ঠাসাঠাসি অবস্থায় থাকে, ততই তাদের একে অপরের সাথে সংঘর্ষের সম্ভাবনা বাড়ে এবং এর ফলে তাদের মধ্যে বিক্রিয়ার সম্ভাবনাও বৃদ্ধি পায়। আর এভাবে বিক্রিয়কগুলির ঘনত্ব বৃদ্ধির ফলে সাধারণত বিক্রিয়ার হারের অনুরূপ বৃদ্ধি ঘটে, অপরদিকে বিক্রিয়কগুলির ঘনত্ব হ্রাস সাধারণত বিপরীত প্রভাব ফেলে। উদাহরণস্বরূপ, বাতাসের (যেখানে ২১% অক্সিজেন থাকে) উপস্থিতে যেকোন দহন এর তুলনায় বিশুদ্ধ অক্সিজেনে দহন আরও দ্রুত ঘটবে।
হার সমীকরণটি হতে বিক্রিয়ক এবং বিক্রিয়ায় উপস্থিত অন্যান্য বিক্রিয়ক প্রজাতির ঘনত্বের উপর বিক্রিয়া হারের নির্ভরতা বিস্তারিতভাবে বুঝা যায়। এসব বিক্রিয়ার হার বিষয়ক গাণিতিক রুপগুলি প্রতিপাদন বিক্রিয়ার কৌশলের উপর নির্ভর করে। যেকোন একটি বিক্রিয়ার প্রকৃত "হার সমীকরণ" পরীক্ষামূলকভাবে নির্ণয় করা হয় এবং তা বিক্রিয়ার কলা-কৌশল সম্পর্কে তথ্য প্রদান করে। "হার সমীকরণের" গাণিতিক প্রকাশ সাধারণত নিম্নে দেখানো রূপে প্রকাশ করা হয়:
এখানে বিক্রিয়া হার ধ্রুবক, হলো বিক্রিয়ক i এর মোলার ঘনত্ব, এবং হলো এই বিক্রিয়কটির জন্য বিক্রিয়ার আংশিক ক্রম। একটি বিক্রিয়কের আংশিক ক্রম শুধুমাত্র পরীক্ষামূলকভাবে নির্ণয় করা যেতে পারে এবং সাধারণতঃ স্টোইকিওমেট্রিক সহগ দ্বারা এটি প্রতিনির্দেশিত হয় না।
তাপমাত্রা
[সম্পাদনা]রাসায়নিক বিক্রিয়ার হারের উপর তাপমাত্রার সাধারণত একটি বড় প্রভাব বিদ্যমান। উচ্চ তাপমাত্রায় অণুগুলির তাপীয় শক্তি বেশি থাকে। যদিও উচ্চ তাপমাত্রায় সংঘর্ষের ফ্রিকোয়েন্সি বেশি থাকে, তবে শুধুমাত্র এটি একা বিক্রিয়ার হার বৃদ্ধিতে খুব সামান্য অনুপাতে অবদান রাখে। সবচেয়ে বেশি গুরুত্বপূর্ণ যে ব্যাপারটি তা হলো এই যে, বিক্রিয়া করার জন্য পর্যাপ্ত শক্তি আছে এমন বিক্রিয়ক অণুগুলির অনুপাত ( সক্রিয়ন শক্তির চেয়ে বেশি শক্তি : E > E a ) উল্লেখযোগ্যভাবে বেশী এবং এটি আণবিক শক্তির ম্যাক্সওয়েল-বোল্টজম্যান বিতরণ দ্বারা বিশদভাবে ব্যাখ্যা করা হয়েছে।
বিক্রিয়ার হার ধ্রুবকের উপর তাপমাত্রার প্রভাব সাধারণত অ্যারহেনিয়াস সমীকরণ মেনে চলে। অ্যারহেনিয়াস সমীকরণটি হলো , যেখানে A হল প্রাক-সূচক ফ্যাক্টর বা A-ফ্যাক্টর, E a হল সক্রিয়ন শক্তি, R হল মোলার গ্যাস ধ্রুবক এবং T হল পরম তাপমাত্রা।[৮]
একটি নির্দিষ্ট তাপমাত্রায়, একটি বিক্রিয়ার রাসায়নিক হার নির্ভর করে A-ফ্যাক্টরের মান, সক্রিয়ন শক্তির মাত্রা এবং বিক্রিয়কগুলির ঘনত্বের উপর । সাধারণত, দ্রুতগতির বিক্রিয়ার জন্য অপেক্ষাকৃত কম সক্রিয়করণ শক্তির প্রয়োজন হয়।
"বৃদ্ধাংগুল নিয়ম", যে অনুযায়ী প্রতি ১০ °C তাপমাত্রা বৃদ্ধির জন্য রাসায়নিক বিক্রিয়ার হার দ্বিগুণ হয় - একটি সাধারণ ভুল ধারণা। এটিকে বায়োলোজিক্যাল সিস্টেমের বিশেষ কিছু ক্ষেত্রের জন্য সাধারণীকরণ করা যেতে পারে, যেখানে α তাপমাত্রা সহগ প্রায়শই ১.৫ থেকে ২.৫ এর মধ্যে থাকে।
দ্রুত বিক্রিয়ার গতিবিদ্যা তাপমাত্রা লাফ পদ্ধতি দ্বারা বুঝা যেতে যেতে পারে। এর মধ্যে রয়েছে তাপমাত্রার দ্রুত বৃদ্ধি এবং সাম্যাবস্থায় ফিরে আসার রিলাক্সেশন সময় পর্যবেক্ষণ করা। তাপমাত্রা লাফ যন্ত্রপাতির একটি বিশেষ উপযোগী রূপ হল একটি শক টিউব যা কোন গ্যাসের তাপমাত্রা দ্রুত ১০০০ ডিগ্রির বেশি বাড়িয়ে দিতে পারে।
অনুঘটক
[সম্পাদনা]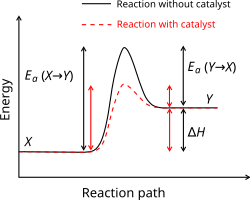
অনুঘটক এমন একটি পদার্থ যা রাসায়নিক বিক্রিয়ার হারকে পরিবর্তন করে কিন্তু পরে এটি রাসায়নিকভাবে অপরিবর্তিত থাকে। অনুঘটক কম সক্রিয়ন শক্তির একটি নতুন বিক্রিয়া কৌশল সূচনা করার মাধ্যমে বিক্রিয়ার হার বৃদ্ধি করে। স্ব-প্রভাবন এমন একটি বিক্রিয়া যেখানে একটি বিক্রিয়ার উৎপাদ নিজেই সেই বিক্রিয়ার জন্য একটি অনুঘটক হিসেবে কাজ করার মাধ্যমে বিক্রিয়াটিকে ইতিবাচক দিকে পরিচালিত করে। জৈব রাসায়নিক বিক্রিয়ায় অনুঘটক হিসেবে কাজ করে এমন প্রোটিনকে এনজাইম বলে। মাইকেলিস-মেন্টেন গতিবিদ্যা এনজাইম ঘটিত বিক্রিয়ার হার বর্ণনা করে। অনুঘটক সাম্যাবস্থার অবস্থানকে প্রভাবিত করে না, কারণ অনুঘটকটি পশ্চাৎমুখী এবং সম্মুখমুখী বিক্রিয়ার গতি সমানভাবে ত্বরান্বিত করে।
কতিপয় নির্দিষ্ট জৈব অণুতে, নির্দিষ্ট কিছু প্রতিস্থাপক প্রতিবেশী গ্রুপ অংশগ্রহণের মাধ্যমে বিক্রিয়া হারের উপর প্রভাব ফেলতে পারে।[তথ্যসূত্র প্রয়োজন]
চাপ
[সম্পাদনা]গ্যাসীয় বিক্রিয়ায় চাপ বাড়ালে বিক্রিয়ক অনুগুলোর মধ্যে সংঘর্ষের সংখ্যা বাড়বে, ফলে বিক্রিয়ার হার বাড়বে। কারণ একটি গ্যাসের তাপগতিয় অ্যাক্টিভিটি সরাসরি গ্যাসের আংশিক চাপের সমানুপাতিক। এটি দ্রবণের ঘনত্ব বাড়ানোর প্রভাবের অনুরূপ।
এই সহজবোধ্য ভর-ক্রিয়া প্রভাব ছাড়াও, চাপের কারণে ( বিক্রিয়ার) হারের সহগগুলি নিজেই পরিবর্তিত হতে পারে। অনেক উচ্চ-তাপমাত্রার গ্যাসীয় দশার বিক্রিয়ার হার সহগ এবংউৎতপাদগুলি পরিবর্তিত হয় যদি মিশ্রণে একটি নিষ্ক্রিয় গ্যাস যোগ করা হয়; এরুপ প্রভাবের পরিবর্তনগুলিকে বলা হয় ফল-অফ এবং রাসায়নিক সক্রিয়করণ। এই ঘটনাগুলি তাপোৎপাদী বা তাপহারী বিক্রিয়াগুলির কারণে ঘটে যেগুলো তাপ স্থানান্তরের চেয়ে দ্রুততর ঘটে, যার ফলে বিক্রিয়াকারী অণুগুলির অ-তাপীয় শক্তি বিতরণ অ- বোল্টজম্যান বন্টন- হয়। চাপের বৃদ্ধি বিক্রিয়াশীল অণু এবং সিস্টেমের বাকি অংশের মধ্যে তাপ স্থানান্তর হার বৃদ্ধি করে, যা এই প্রভাবকে হ্রাস করে।
ঘনীভূত-দশার হার সহগগুলিও চাপ দ্বারা প্রভাবিত হতে পারে, যদিও পরিমাপ করা যায় এমন প্রভাবের জন্য উচ্চ চাপের প্রয়োজন হয়। আর এর কারণ হলো যে, আয়ন এবং অণুগুলি খুব সংকোচনযোগ্য নয়। আর এই প্রভাবকে সাধারণত হীরার অ্যানভিল ব্যবহার করে গবেষণাগারে অধ্যয়ন করা হয়।
বিক্রিয়ার গতিবিদ্যাও চাপ লম্ফন পদ্ধতিতে গবেষণাগারে অধ্যয়ন করা যেতে পারে। এর মধ্যে অন্তর্ভুক্ত আছে চাপের দ্রুত পরিবর্তন করা এবং সাম্যাবস্থায় ফিরে আসার শিথিলকরণ সময় পর্যবেক্ষণ করা।
আলোর শোষণ
[সম্পাদনা]রাসায়নিক বিক্রিয়ার জন্য সক্রিয়ন শক্তি প্রয়োগ করা যেতে পারে যখন একটি বিক্রিয়াকারী অণু উপযুক্ত তরঙ্গদৈর্ঘ্যের আলো শোষণ করে নেয় এবং এটি একটি উত্তেজিত অবস্থায় উন্নীত হয়। আলো দ্বারা প্রাথমিকভাবে সংঘটিত বিক্রিয়াগুলির অধ্যয়নকে বলা হয় আলোক রসায়ন, যার অন্যতম একটি উদাহরণ হল সালোকসংশ্লেষণ।
পরীক্ষামূলক পদ্ধতি
[সম্পাদনা]
বিক্রিয়া হারের পরীক্ষামূলক নির্ণয়ের সাথে জড়িত আছে যেটি তা হলো, সময়ের সাথে বিক্রিয়ক বা উৎপাদগুলির ঘনত্ব কীভাবে পরিবর্তিত হয় তা পরিমাপ করা। উদাহরণস্বরূপ, একটি বিক্রিয়কের ঘনত্ব আলোক বর্ণালীমিতি দ্বারা একটি নির্দিষ্ট তরঙ্গদৈর্ঘ্যে পরিমাপ করা যেতে পারে, যেক্ষেত্রে ঐ একই সিস্টেমের অন্য কোন বিক্রিয়ক বা উৎপাদ আলো শোষণ করবে না।
যে বিক্রিয়াগুলি সংঘটিত হতে কমপক্ষে কয়েক মিনিট সময় নেয়, সেসব বিক্রিয়ার ক্ষেত্রে বিক্রিয়কগুলি পরস্পর সংমিশ্রিত হওয়ার পরে পরীক্ষনীয় (ইচ্ছাধীন) তাপমাত্রায় (বিক্রিয়ার হারের) পর্যবেক্ষণগুলি শুরু করা সম্ভব।
দ্রুতগতির বিক্রিয়া
[সম্পাদনা]দ্রুততর বিক্রিয়ার জন্য, বিক্রিয়কগুলিকে মিশ্রিত করতে এবং এর পরে একটি নির্দিষ্ট তাপমাত্রায় আনতে যে সময় প্রয়োজন তা বিক্রিয়াটির অর্ধ-জীবনের সাথে তুলনীয় বা সে সময়কালটা বিক্রিয়াটির অর্ধ-জীবনের চেয়ে বেশি হতে পারে।[৯] যেসব বিক্রিয়ার ক্ষেত্রে ধীর মিশ্রণ ধাপ বর্তমান, সেগুলো ব্যতীত দ্রুতগতির বিক্রিয়া শুরু করার বিশেষ পদ্ধতিগুলোর মধ্যে অন্তর্ভুক্ত আছেঃ
- স্টপড প্রবাহ পদ্ধতি, যা (বিক্রিয়কগুলিকে) মিশ্রিত করার সময়কে মিলিসেকেন্ডের পর্যায়ে কমিয়ে আনতে পারে।[৯][১০][১১] স্টপড প্রবাহ পদ্ধতির সীমাবদ্ধতা আছে, উদাহরণস্বরূপ, গ্যাস বা দ্রবণগুলিকে মিশ্রিত করতে যে সময় লাগে তা আমাদেরকে বিবেচনায় আনতে হবে এবং এটিও বিবেচনায় আনতে হবে যে, যেসব বিক্রিয়ার অর্ধ-জীবন এক সেকেন্ডের শতভাগের কম সেগুলোর জন্য এ পদ্ধতি উপযুক্ত নয়।
- রাসায়নিক শিথিলকরণ পদ্ধতি যেমন তাপমাত্রা লাফ এবং চাপ লাফ । এসব পদ্ধতিতে প্রাথমিকভাবে সাম্যাবস্থ্যায় থাকা বিক্রিয়ার একটি পূর্ব-মিশ্রিত সিস্টেমকে দ্রুত তাপ প্রদান বা অ-চাপীয় অবস্থায় (depressurization) এনে একে বিচলিত (perturbed) করা হয় যাতে এটি আর সাম্যাবস্থ্যায় না থাকে এবং শিথিলায়ন (relaxation) সাম্যাবস্থ্যায় ফিরে আসে এমনটা পরিলক্ষিত হয়।[৯][১১] [১২] [১৩] উদাহরণস্বরূপ, এই পদ্ধতিটি H 3 O + + OH − প্রশমন বিক্রিয়াটি অধ্যয়ন করতে ব্যবহৃত হয়েছে, আর সেক্ষেত্রে সাধারণ অবস্থায় বিক্রিয়াটির অর্ধ-জীবন ১ μs (মাইক্রো সে.) বা তার কম। [৯] [১৩]
- ফ্ল্যাশ ফটোলাইসিস , যেখানে একটি লেজার পালস অত্যন্ত উত্তেজিত রাসায়নিক সত্তা যেমন মুক্ত মূলক তৈরি করে, যার বিক্রিয়া পরবর্তীতে অধ্যয়ন করা হয়।[১১] [১৪] [১৫] [১৬]
সাম্যাবস্থ্যা
[সম্পাদনা]যদিও রাসায়নিক গতিবিদ্যা রাসায়নিক বিক্রিয়ার হারের সাথে সম্পর্কিত, তাপগতিবিদ্যা নির্ধারণ করে থাকে যে কতটা পরিমাণে বিক্রিয়া ঘটে থাকে। একটি বিপরীতমুখী বিক্রিয়ায়, রাসায়নিক সাম্যাবস্থ্যা তখনই অর্জিত হয় যখন সামনের এবং বিপরীত বিক্রিয়ার হার সমান হয়। গতিশীল সাম্যাবস্থ্যার নীতি এবং এ অবস্থায় বিক্রিয়ক এবং উৎপাদগুলির ঘনত্ব আর পরিবর্তিত হয় না। উদাহরণস্বরূপ, এ ঘটনাটি অ্যামোনিয়া তৈরির জন্য নাইট্রোজেন এবং হাইড্রোজেন একত্রিত করার জন্য হ্যাবার-বশ প্রক্রিয়ার ক্ষেত্রে পরিলক্ষিত হয় । রাসায়নিক ঘড়ির বিক্রিয়া যেমন বেলোসভ-জাবোটিনস্কি বিক্রিয়াতে দেখা যায় যে, বিক্রিয়ার উপাদানের ঘনত্ব দীর্ঘ সময়ের জন্য দোদুল্যমান বা পরিবর্তনশীল অবস্থায় থাকতে পারে, তারপর সবশেষে সাম্যাবস্থ্যা অর্জন করে।
মুক্ত শক্তি
[সম্পাদনা]সাধারণ পরিভাষায়, একটি রাসায়নিক পরিবর্তন ঘটবে কিনা তা নির্ধারণ করে থাকে একটি বিক্রিয়ার মুক্ত শক্তি পরিবর্তন (ΔG) কিন্তু গতিবিদ্যা বলে দেয় যে বিক্রিয়াটি কত দ্রুত ঘটে। একটি বিক্রিয়া খুবই তাপোৎপাদী হতে পারে এবং এটির খুবই ধনাত্মক এনট্রপি পরিবর্তন থাকতে পারে তথাপিও বাস্তবিকভাবে বিক্রিয়াটি ঘটবে না যদি তা খুব ধীরগতির হয়। যদি একটি বিক্রিয়ক দুটি উৎপাদ তৈরি করতে পারে, তবে বিশেষ পরিস্থিতি ছাড়া তাপগতীয়ভাবে সবচেয়ে স্থিতিশীল উৎপাদটিই সাধারণভাবে তৈরি হয়। আর, বিশেষ পরিস্থিতিতে যখন এর ব্যতিক্রম ঘটে তখন বিক্রিয়াটিকে গতি বিক্রিয়া নিয়ন্ত্রণে আছে বলে ধরা হয়। যখন দুটি বিক্রিয়ক পরস্পরের মধ্যে আন্তঃপরিবর্তনের মাধ্যমে দু'টি ভিন্ন উৎপাদ তৈরি করে, তখন তাদের উৎপাদ-অনুপাত নির্ণয় করার জন্য কার্টিন-হ্যামেট নীতিটি প্রয়োগ করা হয়। মুক্ত-শক্তি সম্পর্ক থেকে যেকোন বিক্রিয়ার জন্য বিক্রিয়াটির হার ধ্রুবক সম্পর্কে ভবিষ্যদ্বাণী করা সম্ভব।
কাইনেটিক আইসোটোপ প্রভাব হল রাসায়নিক বিক্রিয়ার হারের পার্থক্যের সাথে সম্পর্কিত যখন বিক্রিয়কগুলির একটিতে একটি পরমাণু তার একটি আইসোটোপ দ্বারা প্রতিস্থাপিত হয়।
রাসায়নিক গতিবিদ্যা রাসায়নিক প্রকৌশলে ব্যবহৃত রাসায়নিক চুল্লিতে অবস্থান সময় এবং তাপ স্থানান্তর এবং পলিমার রসায়নে মোলার ভর বিতরণের বিষয়ে তথ্য প্রদান করে। এছাড়া এটি ধাতু-ক্ষয় প্রকৌশল বিদ্যাতেও (বিবিধ) তথ্য প্রদান করে থাকে।
প্রয়োগ এবং মডেল
[সম্পাদনা]রাসায়নিক বিক্রিয়া গতিবিদ্যা বর্ণনাকারী গাণিতিক মডেলগুলি রসায়নবিদ এবং রাসায়নিক প্রকৌশলীদেরকে এমনসব উপায় সরবরাহ করে যার মাধ্যমে তারা খাদ্য পচন, অণুজীবের বৃদ্ধি, স্ট্র্যাটোস্ফিয়ারিক ওজোন ভাঙ্গন এবং বায়োলজিক্যাল সিস্টেমের রসায়নের মতো বিষয়গুলোর সাথে সংশ্লিষ্ট রাসায়নিক প্রক্রিয়াগুলিকে আরও ভালভাবে বুঝতে এবং তা ব্যাখ্যা করতে পারে। এছাড়াও এই মডেলগুলি রাসায়নিক চুল্লিগুলির নকশা বা তার পরিবর্তনেও ব্যবহার করা যেতে পারে যার মাধ্যমে উৎপাদের উৎপাদন অপ্টিমাইজ করা, অধিকতর দক্ষতার সাথে উৎপাদগুলোকে পৃথক করা এবং পরিবেশগতভাবে ক্ষতিকারক উপজাতগুলিকে দূর করা সম্ভব। উদাহরণস্বরূপ, ভারী হাইড্রোকার্বনের অনুঘটকীয় ভাঙ্গন দ্বারা পেট্রল এবং হালকা গ্যাস তৈরির সময়, রাসায়নিক গতিবিদ্যা সম্পর্কিত মডেলগুলি ব্যবহৃত হয় যার দ্বারা বিক্রিয়ার জন্য উপযুক্ত তাপমাত্রা এবং চাপ নির্ধারণ করা সম্ভব হয় যেন ভারী হাইড্রোকার্বন হতে সর্বাধিক পরিমাণে গ্যাসোলিন উৎপাদ পাওয়া যায়।
রাসায়নিক গতিবিদ্যাকে যাচাই এবং এ বিষয়ে অধিকতর অনুসন্ধান করা হয় সাধারণত মডেলিংয়ের মাধ্যমে, যে মডেলগুলো আবার কিছু বিশেষ প্যাকেজ আকারে সাধারণ ডিফারেনশিয়াল সমীকরণ -সমাধান (ODE-সমাধান) এবং বক্ররেখা ফিটিং এর একটি ফাংশন হিসাবে থাকে। [১৭]
সংখ্যাগত পদ্ধতি
[সম্পাদনা]কিছু কিছু ক্ষেত্রে, সমীকরণগুলি বিশ্লেষণাত্মকভাবে অসমাধানযোগ্য, তবে ডেটা মান দেওয়া থাকলে সংখ্যাসূচক পদ্ধতি ব্যবহার করে সমাধান করা যেতে পারে। এটি করার দুটি ভিন্ন উপায় রয়েছেঃ একটি হলো সফ্টওয়্যার প্রোগ্রাম ব্যবহার করা, অন্যটি হলো গাণিতিক পদ্ধতি যেমন ইউলার পদ্ধতি ব্যবহার করা। রাসায়নিক গতিবিদ্যার জন্য সফ্টওয়্যারের উদাহরণ হল i) টেনুয়া, একটি জাভা অ্যাপ যা রাসায়নিক বিক্রিয়াকে সংখ্যাগতভাবে সিম্যুলেশন করে এবং সিমুলেশনকে বাস্তব ডেটার সাথে তুলনা করার সুযোগ করে দেয়, ii) গণনা এবং পরিমাপের জন্য পাইথন কোডিং এবং iii) কিন্টেকাস সফ্টওয়্যার কম্পাইলার
যেটি বিক্রিয়াগুলোর মডেল, রিগ্রেস, ফিট এবং অপ্টিমাইজ করার জন্য ব্যবহার করা হয়।
-সাংখ্যিক ইন্টিগ্রেশন: প্রথম ক্রম বিক্রিয়া A → B এর জন্য
বিক্রিয়ক A এর ডিফারেনশিয়াল সমীকরণ হল:এটিকে নিম্নাক্তাকারেও প্রকাশ করা যেতে পারেযা মূলতঃ এর অনুরুপ
ইউলার এবং রুঞ্জ-কুট্টা পদ্ধতির মাধ্যমে ডিফারেনশিয়াল সমীকরণগুলি সমাধান করার জন্য আমাদের প্রাথমিক মান জানা থাকতে হবে।
- Euler method → simple but inaccurate.
At any point is the same as
We can approximate the differentials as discrete increases:
The unknown part of the equation is y(x+Δx), which can be found if we have the data for the initial values. - Runge-Kutta methods → it is more accurate than the Euler method.
In this method, an initial condition is required: y = y0 at x = x0. The problem is to find the value of y when x = x0 + h, where h is a given constant.
It can be shown analytically that the ordinate at that moment to the curve through (x0, y0) is given by the third-order Runge-Kutta formula.
In first-order ordinary equations, the Runge-Kutta method uses a mathematical model that represents the relationship between the temperature and the rate of reaction. It is worth it to calculate the rate of reaction at different temperatures for different concentrations. The equation obtained is: - Stochastic methods → probabilities of the differential rate laws and the kinetic constants. In an equilibrioum reaction with direct and inverse rate constants, it is easier to transform from A to B rather than B to A. As for probability computations, at each time it choose a random number to be compared with a threshold to know if the reaction runs from A to B or the other way around.
আরও দেখুন
[সম্পাদনা]- অটোক্যাটালিটিক বিক্রিয়া এবং অর্ডার সৃষ্টি
- ধাতু-ক্ষয় প্রকৌশলবিদ্যা
- বিস্ফোরণ
- তড়িৎ-রাসায়িনিক গতিবিদ্যা
- শিখার গতি
- অসমসত্ত্ব অনুঘটন
- অভ্যন্তরীণ নিম্ন-মাত্রিক বহুগুণ
- এমএলএবি রাসায়নিক গতিবিদ্যা মডেলিং প্যাকেজ
- অ-তাপীয় পৃষ্ঠ বিক্রিয়া
- পটারসহুইল ম্যাটল্যাব টুলবক্স যা রাসায়নিক হার ধ্রুবকের মানগুলোকে পরীক্ষামূলক ডেটাতে ফিট করতে ব্যবহৃত হয়
- বিক্রিয়ার অগ্রগতির গতি্বিদ্যা বিশ্লেষণ
তথ্যসূত্র
[সম্পাদনা]- ↑ L. Wilhelmy, "Ann. Phys. Chem. (Poggendorf)" Vol 81, (1850) 413
- ↑ C.M. Guldberg and P. Waage,"Studies Concerning Affinity" Forhandlinger i Videnskabs-Selskabet i Christiania (1864), 35
- ↑ P. Waage, "Experiments for Determining the Affinity Law" ,Forhandlinger i Videnskabs-Selskabet i Christiania, (1864) 92.
- ↑ C.M. Guldberg, "Concerning the Laws of Chemical Affinity", Forhandlinger i Videnskabs-Selskabet i Christiania (1864) 111
- ↑ Hoff, J. H. van't (Jacobus Henricus van't); Cohen, Ernst (১৮৯৬-০১-০১)। Studies in chemical dynamics। Amsterdam : F. Muller; London : Williams & Norgate।
- ↑ The Nobel Prize in Chemistry 1901, Nobel Prizes and Laureates, official website.
- ↑ A.N. Gorban, G.S. Yablonsky Three Waves of Chemical Dynamics, Mathematical Modelling of Natural Phenomena 10(5) (2015), p. 1–5.
- ↑ Laidler, K. J. Chemical Kinetics (3rd ed., Harper and Row 1987) p.42 আইএসবিএন ০-০৬-০৪৩৮৬২-২
- ↑ ক খ গ ঘ Laidler, K. J. Chemical Kinetics (3rd ed., Harper and Row 1987) p.33-39 আইএসবিএন ০-০৬-০৪৩৮৬২-২
- ↑ Laidler, K. J. Chemical Kinetics (3rd ed., Harper and Row 1987) p.33-39 আইএসবিএন ০-০৬-০৪৩৮৬২-২
- ↑ ক খ গ Espenson, J.H. Chemical Kinetics and Reaction Mechanisms (2nd ed., McGraw-Hill 2002), p.254-256 আইএসবিএন ০-০৭-২৮৮৩৬২-৬
- ↑ Espenson, J.H. Chemical Kinetics and Reaction Mechanisms (2nd ed., McGraw-Hill 2002), p.256-8 আইএসবিএন ০-০৭-২৮৮৩৬২-৬
- ↑ ক খ Steinfeld J.I., Francisco J.S. and Hase W.L. Chemical Kinetics and Dynamics (2nd ed., Prentice-Hall 1999) p.140-3 আইএসবিএন ০-১৩-৭৩৭১২৩-৩
- ↑ Atkins P. and de Paula J., Physical Chemistry (8th ed., W.H. Freeman 2006) p.793 আইএসবিএন ০-৭১৬৭-৮৭৫৯-৮
- ↑ Laidler, K.J. Chemical Kinetics (3rd ed., Harper and Row 1987) p.359-360 আইএসবিএন ০-০৬-০৪৩৮৬২-২
- ↑ Espenson, J.H. Chemical Kinetics and Reaction Mechanisms (2nd ed., McGraw-Hill 2002), p.264-6 আইএসবিএন ০-০৭-২৮৮৩৬২-৬
- ↑ "Chemical Kinetics: Simple Binding: F + G ⇋ B" (পিডিএফ)। Civilized Software, Inc.। সংগ্রহের তারিখ ২০১৫-০৯-০১।
বহিঃসংযোগ
[সম্পাদনা]| গ্রন্থাগার সংরক্ষণ সম্পর্কে Chemical kinetics |
- রসায়ন অ্যাপলেট ওয়েব্যাক মেশিনে আর্কাইভকৃত ৪ জুন ২০০৯ তারিখে
- ওয়াটারলু বিশ্ববিদ্যালয়
- গ্যাস ফেজ বিক্রিয়ার রাসায়নিক গতিবিদ্যা
- কিনপি: গতি সমীকরণ সমাধানের জন্য পাইথন কোড জেনারেটর
- বিক্রিয়া হার সুত্র এবং বিক্রিয়া প্রোফাইল - তাপমাত্রা, ঘনত্ব, দ্রাবক এবং অনুঘটকের উপর একটি প্রশ্ন - একটি বিক্রিয়া কত দ্রুত এগিয়ে যাবে (টিআইবি এভি-পোর্টালে সাইফক্সের ভিডিও)





![{\displaystyle {\frac {d{\ce {[A]}}}{dt}}=-k{\ce {[A]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5afc7459a6c89649f2aa0176e075cf709c88a8cb)
![{\displaystyle {\frac {d{\ce {[A]}}}{dt}}=f(t,{\ce {[A]}})}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5cbbece9164c4f458325c33774da32a5f87c1588)



