Defenzin
Defenzin
 | |
|---|---|
| Identifikatori | |
| Simbol | Defenzin |
Defenzini su mali cisteinski -kationima bogati proteini u ćelijskom životu, uključujući i kičmenjake[1] i beskičmenjake[2] biljke,[3][4] i gljive.[5] Oni su peptidi odbrane domaćina, sa članovima koji pokazuju ili direktne antimikrobne aktivnost, imunske signalne aktivnosti, ili oboje. Različito su aktivni protiv bakterija, gljiva i mnogih omotanih i neovijenih virusa. Dužine su obično 18-45 aminokiselina, sa tri ili četiri visoko konzervirane disulfidne veze.
Kod životinja ih proizvode ćelije urođenog imunskog sistema i epitelne ćelije, dok ih u biljkama i gljivama proizvode široki spektar tkiva. Organizam obično proizvodi mnogo različitih defenzina, od kojih se neki pohranjuju unutar ćelija (npr. u neutrofilnim granulocitima da ubiju fagocitozirane bakterije), a drugi se izlučuju u vanćelijski medij. Za one koji direktno ubijaju mikrobe, njihov mehanizam djelovanja varira od poremećajnog mikroba ćelijske membrane do metaboličkih poremećaja.
Varijeteti
[uredi | uredi izvor]Naziv 'defenzin' nastao je sredinom 1980-ih, iako su se proteini, među ostalim, nazivani kao 'kationski antimikrobni proteini', 'neutrofilni peptidi', 'gama tionini', između ostalog.[6]
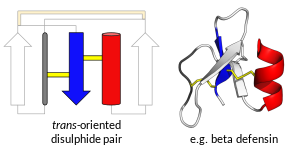
Proteini zvani „defenzini“ nisu svi međusobno evolucijski povezani.[7] Umjesto toga, dijele se u dvije široke superporodice, od kojih svaka sadrži više porodica.[7][8] Jedna superporodica, trans–defenzini, sadrži defenzine koji se nalaze u ljudima i drugim kičmenjacima [9][10] kao i nekim beskičmenjacima.[11][12] The other superfamily, cis-defensins, contains the defensins found in invertebrates, plants and fungi.[13][14][15] The superfamilies and families are determined overall tertiary structure and each family usually has a conserved pattern of disulphide bonds.[9][16] Svi defenzini tvore male i kompaktne presavijene strukture, tipski sa visoko pozitivnim nabojem, koje su vrlo stabilne zbog višestrukih disulfidnih veza. U svim porodicama, osnovni geni odgovorni za proizvodnju defenzina su visoko polimorfni.
Trans-defenzini
[uredi | uredi izvor]Defenzini kičmenjaka su prvenstveno α-defenzini i β-defenzini. Neki primati imaju i znatno manje θ-defensini. Generalno, i α- i β-defensini su kodirani sa dva - egzonska gena, pri čemu prvi egzon kodira za hidrofobnu vodeću sekvencu (koja se uklanja nakon translacije) i sekvenca bogata cisteinom (zreli peptid). Disulfidne veze koje formiraju cisteini su suštinske za aktivnosti povezane s urođenomm imunošću sisara, ali nisu nužno potrebne za antimikrobnu aktivnost.[17][18] Teta-defenzini čine jedinstvenu beta ukosničku strukturu i stoga također predstavljaju zasebnu grupu. Kod ljudi, eksprimiraju se samo se alfa- i beta-defenzini.[19]
- Ljudski defenzini
| Tip | Gen (simbol) | Naziv gena | Naziv proteina | Opis |
|---|---|---|---|---|
| α-defenzini | DEFA1 | Defenzin, alfa 1 | Neutrofilni defenzin 1 | Izražavaju se prvenstveno u neutrofilima, kao i NK-ćelijama i određenim podskupinama T-limfocita. DEFA5 i DEFA6 se eksprimiraju u Panethovim ćelijama tankog crijeva, gdje mogu regulirati i održavati mikrobnu ravnotežu u lumenu crijeva. |
| DEFA1B | Defenzin, alfa 1B | Defenzin, alfa 1 | ||
| DEFA3 | Defenzin, alfa 3, neutrofil-specifični | Neutrofilni defenzin 3 | ||
| DEFA4 | Defenzin, alfa 4, kortikostatin | Neutrofilni defenzin 4 | ||
| DEFA5 | Defenzin, alfa 5, Panethova ćelija-specifični | Defenzin-5 | ||
| DEFA6 | Defenzin, alfa 6, Panethova ćelija-specifični | Defenzin-6 | ||
| β-defenzini | DEFB1 | Defenzin, beta 1 | Beta-defenzin 1 | Najrasprostranjeniji su, a izlučuju ih leukociti i epitelne ćelije mnogih vrsta. Naprimjer, mogu se naći na jeziku, koži, rožnjači, u pljuvačnim žlijezdama, bubrezima, jednjaku i respiratornom traktu. Sugerira se (ali i osporava) da neka od patologija cistne fibroze proizlazi iz inhibicije aktivnosti β-defenzina na epitelnim površinama pluća i dušnika zbog većeg sadržaja [[soli. |
| DEFB2 | Defenzin, beta 2 | Beta-defenzin 2 | ||
| DEFB3 | Defenzin, beta 3 | Beta-defenzin 3 | ||
| DEFB103A | Defenzin, beta 103B | Beta-defenzin 103 | ||
| ... | ... | ... | ||
| DEFB106A | Defenzin, beta 106A | Beta-defenzin 106A | ||
| DEFB106B | Defenzin, beta 106B | Beta-defenzin 106B | ||
| DEFB107B | Defenzin, beta 107A | Beta-defenzin 107 | ||
| DEFB110 | Defenzin, beta 110 | Beta-defenzin 110 | ||
| ... | ... | ... | ||
| DEFB136 | Defenzin, beta 136 | Beta-defenzin 136 | ||
| θ-defenzini | DEFT1P | Defenzin, teta 1 pseudogen | Ne eksprimira se kod ljudi | Rijetki su i do sada su pronađeni samo u leukocitima rezus makaka.[20] and the olive baboon, Papio anubis, the gene coding for it is corrupted in humans and other primates.[21][22] |
|} Iako su najbolje proučavani, defenrini kičmenjački, porodica trans-defenzina zvanih veliki defensini nalazi se u mehkušaca, člankonožaca i kopljača.
Cis-defenzini
[uredi | uredi izvor]Artropodni defenzini su najbolje okarakterizirani defenzini beskičmenjaka (posebno onih kod insekata).[23] Ostali beskičmenjaci, za koje je poznato da proizvode defenzine iz ove proteinske natporodice uključuju mehkušce, člankovite gliste i grupu Cnidaria.[24]
Biljni defenzini otkriveni su 1990. i naknadno su pronađeni u većini biljnih tkiva sa antimikrobnim aktivnostima, uz primjere antigljivičnih i antibakterijskih sredstava.[25] Identificirani su u svim glavnim skupinama vaskularnih biljaka, ali ne i u paprati, mahovinama ili algama.
Defenzivi gljiva prvi put opisani su 2005.[26] Proučeni primjeri uglavnom imaju antibakterijsko delovanje i pronađeni su u obje glavne divizije gljiva: (Ascomycota i Basidiomycota), kao i u baznim grupama Zygomycota i Glomeromycota.[5]
Identificirani su i bakterijski defenzini, ali oni su daleko najmanje proučavani. Uključuju varijante sa samo četiri cisteina, dok defenzini iz eukariotskih organizama gotovo svi ih imaju šest ili osam.[27]
Reference
[uredi | uredi izvor]- ^ Hazlett L, Wu M (januar 2011). "Defensins in innate immunity". Cell and Tissue Research. 343 (1): 175–88. doi:10.1007/s00441-010-1022-4. PMID 20730446. S2CID 2234617.
- ^ Tassanakajon A, Somboonwiwat K, Amparyup P (februar 2015). "Sequence diversity and evolution of antimicrobial peptides in invertebrates". Developmental and Comparative Immunology. Specific immunity in invertebrates. 48 (2): 324–41. doi:10.1016/j.dci.2014.05.020. PMID 24950415.
- ^ Thomma BP, Cammue BP, Thevissen K (decembar 2002). "Plant defensins". Planta. 216 (2): 193–202. doi:10.1007/s00425-002-0902-6. PMID 12447532. S2CID 19356421.
- ^ Sathoff AE, Samac DA (maj 2019). "Antibacterial Activity of Plant Defensins". Molecular Plant-Microbe Interactions. 32 (5): 507–514. doi:10.1094/mpmi-08-18-0229-cr. PMID 30501455.
- ^ a b Wu J, Gao B, Zhu S (august 2014). "The fungal defensin family enlarged". Pharmaceuticals. 7 (8): 866–80. doi:10.3390/ph7080866. PMC 4165938. PMID 25230677.
- ^ Lehrer RI (septembar 2004). "Primate defensins". Nature Reviews. Microbiology. 2 (9): 727–38. doi:10.1038/nrmicro976. PMID 15372083. S2CID 8774156.
- ^ a b Shafee TM, Lay FT, Hulett MD, Anderson MA (septembar 2016). "The Defensins Consist of Two Independent, Convergent Protein Superfamilies". Molecular Biology and Evolution. 33 (9): 2345–56. doi:10.1093/molbev/msw106. PMID 27297472.
- ^ Shafee TM, Lay FT, Phan TK, Anderson MA, Hulett MD (februar 2017). "Convergent evolution of defensin sequence, structure and function". Cellular and Molecular Life Sciences. 74 (4): 663–682. doi:10.1007/s00018-016-2344-5. PMID 27557668. S2CID 24741736.
- ^ a b Hollox, Edward J.; Abujaber, Razan (2017). "Evolution and Diversity of Defensins in Vertebrates". u Pontarotti, Pierre (ured.). Evolutionary Biology: Self/Nonself Evolution, Species and Complex Traits Evolution, Methods and Concepts (jezik: engleski). Springer International Publishing. str. 27–50. doi:10.1007/978-3-319-61569-1_2. ISBN 978-3-319-61569-1.
- ^ Mitchell ML, Shafee T, Papenfuss AT, Norton RS (juli 2019). "Evolution of cnidarian trans-defensins: Sequence, structure and exploration of chemical space". Proteins. 87 (7): 551–560. doi:10.1002/prot.25679. PMID 30811678. S2CID 73469576.
- ^ Zhu S, Gao B (2013). "Evolutionary origin of β-defensins". Developmental and Comparative Immunology. 39 (1–2): 79–84. doi:10.1016/j.dci.2012.02.011. PMID 22369779.
- ^ Montero-Alejo V, Corzo G, Porro-Suardíaz J, Pardo-Ruiz Z, Perera E, Rodríguez-Viera L, et al. (februar 2017). "Panusin represents a new family of β-defensin-like peptides in invertebrates". Developmental and Comparative Immunology. 67: 310–321. doi:10.1016/j.dci.2016.09.002. PMID 27616720.
- ^ Dias RD, Franco OL (oktobar 2015). "Cysteine-stabilized αβ defensins: From a common fold to antibacterial activity". Peptides. Festschrift to highlight the career of Abba J. Kastin as a founding editor, researcher, and educator in the peptide field. 72: 64–72. doi:10.1016/j.peptides.2015.04.017. PMID 25929172. S2CID 17846143.
- ^ Shafee T, Anderson M (mart 2019). "A quantitative map of protein sequence space for the cis-defensin superfamily". Bioinformatics. 35 (5): 743–752. doi:10.1093/bioinformatics/bty697. PMID 30102339.
- ^ Zhu S (februar 2008). "Discovery of six families of fungal defensin-like peptides provides insights into origin and evolution of the CSalphabeta defensins". Molecular Immunology. 45 (3): 828–38. doi:10.1016/j.molimm.2007.06.354. PMID 17675235.
- ^ Wang YP, Lai R (februar 2010). "[Insect antimicrobial peptides: structures, properties and gene regulation]". Dong Wu Xue Yan Jiu = Zoological Research. 31 (1): 27–34. doi:10.3724/sp.j.1141.2010.01027. PMID 20446450.
- ^ Varkey J, Singh S, Nagaraj R (novembar 2006). "Antibacterial activity of linear peptides spanning the carboxy-terminal beta-sheet domain of arthropod defensins". Peptides. 27 (11): 2614–23. doi:10.1016/j.peptides.2006.06.010. PMID 16914230. S2CID 21104756.
- ^ Varkey J, Nagaraj R (novembar 2005). "Antibacterial activity of human neutrophil defensin HNP-1 analogs without cysteines". Antimicrobial Agents and Chemotherapy. 49 (11): 4561–6. doi:10.1128/AAC.49.11.4561-4566.2005. PMC 1280114. PMID 16251296.
- ^ Dhople V, Krukemeyer A, Ramamoorthy A (septembar 2006). "The human beta-defensin-3, an antibacterial peptide with multiple biological functions". Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758 (9): 1499–512. doi:10.1016/j.bbamem.2006.07.007. PMID 16978580.
- ^ Tran D, Tran P, Roberts K, Osapay G, Schaal J, Ouellette A, Selsted ME (mart 2008). "Microbicidal properties and cytocidal selectivity of rhesus macaque theta defensins". Antimicrobial Agents and Chemotherapy. 52 (3): 944–53. doi:10.1128/AAC.01090-07. PMC 2258523. PMID 18160518.
- ^ Garcia AE, Selsted M (mart 2008). "Olive baboon θ-defensins". The FASEB Journal. 22 (1 Suppl): 673.11. doi:10.1096/fasebj.22.1_supplement.673.11 (neaktivno 10. 1. 2021).CS1 održavanje: DOI nije aktivan od 2021 (link)
- ^ Garcia AE, Osapay G, Tran PA, Yuan J, Selsted ME (decembar 2008). "Isolation, synthesis, and antimicrobial activities of naturally occurring theta-defensin isoforms from baboon leukocytes". Infection and Immunity. 76 (12): 5883–91. doi:10.1128/IAI.01100-08. PMC 2583559. PMID 18852242.
- ^ Koehbach J (2017). "Structure-Activity Relationships of Insect Defensins". Frontiers in Chemistry (jezik: English). 5: 45. Bibcode:2017FrCh....5...45K. doi:10.3389/fchem.2017.00045. PMC 5506212. PMID 28748179.CS1 održavanje: nepoznati jezik (link)
- ^ Greco S, Gerdol M, Edomi P, Pallavicini A (januar 2020). "Molecular Diversity of Mytilin-Like Defense Peptides in Mytilidae (Mollusca, Bivalvia)". Antibiotics. 9 (1): 37. doi:10.3390/antibiotics9010037. PMC 7168163. PMID 31963793.
- ^ Parisi K, Shafee TM, Quimbar P, van der Weerden NL, Bleackley MR, Anderson MA (april 2019). "The evolution, function and mechanisms of action for plant defensins". Seminars in Cell & Developmental Biology. 88: 107–118. doi:10.1016/j.semcdb.2018.02.004. PMID 29432955.
- ^ Mygind PH, Fischer RL, Schnorr KM, Hansen MT, Sönksen CP, Ludvigsen S, et al. (oktobar 2005). "Plectasin is a peptide antibiotic with therapeutic potential from a saprophytic fungus". Nature. 437 (7061): 975–80. Bibcode:2005Natur.437..975M. doi:10.1038/nature04051. PMID 16222292. S2CID 4423851.
- ^ Dash TS, Shafee T, Harvey PJ, Zhang C, Peigneur S, Deuis JR, et al. (februar 2019). "A Centipede Toxin Family Defines an Ancient Class of CSαβ Defensins". Structure. 27 (2): 315–326.e7. doi:10.1016/j.str.2018.10.022. PMID 30554841.
Vanjski linkovi
[uredi | uredi izvor]- Defensins Database, Singapore Arhivirano 24. 4. 2008. na Wayback Machine
- Innate ( Nonspecific ) Immunity at Western Kentucky University
- Šablon:UMichOPM - Vertebrate defensins and related sea anemone sodium channel toxins
- Šablon:UMichOPM - Defensins from insects and plants and scorpion toxins
- Defensins na US National Library of Medicine Medical Subject Headings (MeSH)