Gaucherova bolest
| Gaucherova bolest | |
|---|---|
 Kisela beta-glukozidaza | |
| Klasifikacija i vanjski resursi | |
| ICD-10 | E75.2 (ILDS E75.220) |
| ICD-9 | 272.7 |
| OMIM | 230800 OMIM: 230900 OMIM: 231000 |
| DiseasesDB | 5124 |
| MedlinePlus | 000564 |
| eMedicine | ped/837 derm/709 |
| MeSH | D005776 |
| GeneReviews | Gaucher disease |
Gaucherova bolest ili Gaucher-bolest je genetički poremećaj u kojem se glukocerebrozid (sfingolipid, također poznat kao glukozilceramid) akumulira u ćelijama i određenim organima. Poremećaj karakteriziraju modrice, umor, anemija, nizak broj krvnih pločica i povećanje jetre i slezene, a uzrokovano nasljednim nedostatkom enzima glukocerebrozidaza (također poznatog kao glukozilceramidaza), koji djeluje na glukocerebrozid. Kada je enzim neispravan, glukocerebrozid se akumulira, posebno u bijelim krvnim zrncima i posebno u makrofagima (monojedarni leukociti). Glukocerebrozid se može nakupljati u slezeni, jetri, bubrezima, plućima, mozgu i koštanoj srži .
Manifestacije mogu uključivati povećanu slezinu i jetru, kvar jetre skeletne poremećaje ili lezije kostiju koje mogu biti bolne, teške neurološke komplikacije, oticanje limfnih čvorova i (povremeno) susjednih zglobova, nategnut abdomen, smećkasta nijansa kože, anemija, nizak broj trombocita u krvi i žute masne naslage na bjelini oka (bionjača). Osobe koje su ozbiljno pogođene mogu takođe biti podložnije infekcijama. Neki oblici Gaucherove bolesti mogu se liječiti zamjenskom enzimskom terapijom.
Bolest je uzrokovana recesivnom mutacijom u genu GBA koji se nalazi na hromosomu 1 i pogađa i muškarce i žene. Otprilike jedna od 100 osoba u Sjedinjenim Državama je nositelj najčešćeg tipa Gaucherove bolesti. Stopa nositelja među Aškenazi Jevrejima je 8,9% dok je učestalost rođenja 1/450.[1]
Gaucherova bolest je najčešća od lizosonmskih bolesti skladištenja.[2] To je oblik sfingolipidoza (podgrupa lizosomnih bolesti skladištenja), jer uključuje disfunkcionalni metabolizam sfingolipida.[3] Bolest je nazvana po francuskom ljekaru Philippeu Gaucheru, koji ju je prvobitno opisao 1882.[4]
Znakovi i simptomi
[uredi | uredi izvor]- Bezbolna hepatomegalija i splenomegalija: veličina slezne može biti 1500–3000 g, za razliku od normalne veličine od 50–200 g. Splenomegalija može smanjiti kapacitet oboljele osobe za jelo vršenjem pritiska na želudac. Iako je bezbolno, povećanje slezene povećava rizik od njene rupture.
- Hipersplenizam i pancitopenija, brzo i prerano uništavanje krvnih ćelija, dovode do anemija, neutropenije, lwukopenije i trombocitopenije (sa povećanim rizikom od infekcija i krvarenja).
- Ciroza jetre je rijetka.
- Javlja se jak bol povezan sa zglobovima i kostima, koji se često u kukovima i koljenima.
- Neurološki simptomi se javljaju samo kod nekih tipova Gaucherove bolesti (vidi dolje):
- Tip I: oštećeni miris i kognicija
- Tip II: ozbiljne konvulzije, hipertonija, intelektualna invalidnost i apneja
- Tip III: trzaji mišića poznati kao mioklonus, konvulzije, demencija i apraksija očnih mišića
- Parkinsonova bolest je prepoznata kao češća kod pacijenata s Gaucherovom bolešću i njihovih heterozigotnih srodnika.[5]
- Osteoporozitis: 75% pacijenata razviju vidljive koštane abnormalnosti zbog akumuliranog glukozilceramida. Često se opisuje deformitet distalnog dijela femura u obliku Erlenmeyerove tikvice.
- Žućkasto-smeđa kožna pigmentacija
Genetika
[uredi | uredi izvor]Tri tipa Gaucherove bolesti su autosomno recesivna. Oba roditelja moraju biti nositelji da bi dijete bilo pogođeno. Ako su oba roditelja heterozigotna, šansa za oboljenje je 1/4, ili 25%, sa svakom trudnoćom za oboljelo dijete. Za članove porodice koji mogu biti nositelju mutacija, preporučuju se genetičko savjetovanje i genetičko testiranje.
Svaki tip je povezan sa određenim mutacijama. Sve u svemu, oko 80 poznatih mutacija GBA gena grupisano je u tri glavna tipa:[6]
- Tip I (N370S homozigot), najčešći je, koji se naziva i "neuropatski" tip javlja se uglavnom kod Aškenazi Jevreja, 100 puta češće nego u općoj populaciji. Srednja dob pri postavljanju dijagnoze je 28 godina,[7] a očekivani životni vijek je blago smanjen.[8]
- Tip II (jedan ili dva alela L444P) karakteriziraju neurološki problemi kod male djece. Enzim se jedva otpušta u lizosome. Prognoza je loša: većina umire prije treće godine.
- Tip III (također jedna ili dvije kopije L444P, moguće odložene zaštitnim polimorfizmima) javlja se u švedskih pacijenata iz regije Norrbottena.[9] Ova grupa razvija bolest nešto kasnije, ali većina umire prije 30. rođendana.
Mutacije koje izazivaju Gaucherovu bolest možda su ušle u genski fond Aškenazi Jevreja u ranom srednjem vijeku (prije 48–55 generacija).[10]
Patofiziologija
[uredi | uredi izvor]Bolest je uzrokovana defektom domaćinskog gena za lizosomnu glukocerebrozidazu (također poznatu kao beta-glukozidaza, 3.2.1.4, 1OGS) na prvom hromosomu (1q22). Ovaj enzim je protein dug 55,6 kilodaltona, sa 497 aminokiselina, a koji katalizuje razgradnju glukocerebrozida, membranskih sastojka crvenih] i bijelih krvnih zrnaca. Kod Gaucherove bolesti, enzim ne može pravilno funkcionirati i akumulira se glukocerebrozid. Makrofagi koji čiste ove ćelije nisu u stanju da eliminišu otpadni proizvod, koji se nakuplja u fibrilima, i pretvaraju se u 'Gaucherove ćelije', koje se na svetlosnoj mikroskopiji pojavljuju kao da podsećaju na zgužvani papir.<ref. name=pmid26588331/>
Tačan mehanizam neurotoksičnosti nije shvaćen, ali se smatra da uključuje reakciju na glukozilsfingozin.[3]
Različite mutacije gena GBA (beta-glukozidaze) određuju preostalu aktivnost enzima. Kod tipa I postoji određena rezidualna aktivnost enzima, što objašnjava nedostatak neuropatoloških promjena kod ovog tipa.[3] Iako postoji određena korelacija između genotipa i fenotipa, ni količina pohranjenih lipida, niti zaostala aktivnost enzima dobro koreliraju sa simptomima bolesti.[11] Ova okolnost je zahtijevala alternativna objašnjenja koja uključuju simptome bolesti
- ometanje endo/lizosomnog sistema [12]
- Stres ER-a[13]
- promijenjen sastav membranskih lipida u cijeloj ćeliji, uključujući plazmamembranu,[14] i posljedične promjene u dinamičkim i signalnim svojstvima ćelijske membrane,[15]
- upala uzrokovana lučenjem citokina, kao posljedica akumulacije sfingolipida i neurodegeneracija uzrokovana nakupljanjem glukozilsfingozina, neurotoksina.[16]
Heterozigoti za određene mutacije kisele beta-glukozidaze imaju oko petostruki rizik od razvoja Parkinsonove bolesti, što ovo čini najčešćim poznatim genetičkim faktorom rizika za Parkinsonovu bolest.[17][18]
Rizik od raka može biti povećan, posebno mijeloma.[19][20][21] Smatra se da je to zbog akumulacije glukozilceramida i kompleksnih glikosfingolipida.[22]
Uloga upalnih procesa u Gaucherovoj bolesti je slabo razjašnjena. Međutim, poznato je da sfingolipidi učestvuju u upali i apoptozi, a markeri aktivacije makrofaga su povišeni kod ljudi s Gaucherovom bolešću. Ovi markeri uključuju enzim koji konvertuje angiotenzin, katepsin S, hitotriozidazu i CCL18 u krvnoj plazmi; i faktor nekroze tumora alfa u slezenskim Gaucherovim ćelijama (preplavljeni makrofagi).[3]
Dijagnoza
[uredi | uredi izvor]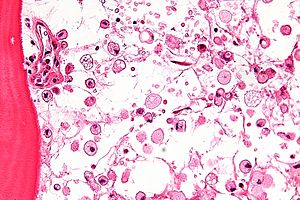
Gaucherova bolest se dijagnosticira na osnovu ukupne kliničke slike. Inicijalno laboratorijsko testiranje može uključivati ispitivanje enzima. Kao rezultat toga, manje od 15% srednje normalne aktivnosti smatra se dijagnostičkim.[23] Smanjenje nivoa enzima često će biti potvrđeno genetičkim testiranjem. Javljaju se brojne različite mutacije; sekvenciranje gena beta-glukozidaze ponekad je neophodno da bi se potvrdila dijagnoza. Prenatalna dijagnoza je dostupna i korisna kada je prisutan poznati genetički faktor rizika.
Dijagnoza se također može implicirati biohemijskim abnormalnostima, kao što su visoki alkalna fosfataza, angiotenzin-konvertujući enzim i nivoi imunoglobulina ili analiza ćelija koja pokazuje citoplazmu "zgužvanog papira" i makrofagnim glikolipidima.
Neki lizosomni enzimi su povišeni, uključujući tartrat rezistentnu kiselu fosfatazu, heksosaminidazu i ljudsku hitinazu, hitotriozidazu. Ovaj posljednji enzim se pokazao vrlo korisnim za praćenje aktivnosti Gaucherove bolesti kao odgovor na liječenje, i može odražavati ozbiljnost bolesti.
Klasifikacija
[uredi | uredi izvor]Gaucherova bolest (GD) ima tri uobičajena klinička podtipa.[24][25] Ovi podtipovi su bili pod određenim kritikama jer ne uzimaju u obzir cijeli spektar vidljivih simptoma (fenotipova[26]) Također, javljaju se složene heterozigotne varijacije koje značajno povećavaju složenost predviđanja toka bolesti.
GD tip I (neneuropatski) je najčešći i najmanje težak oblik bolesti. Simptomi mogu početi rano u životu ili u odrasloj dobi i uglavnom pogađaju jetru, slezenu i kosti. Uvećana jetra i izrazito uvećana slezena (zajedno hepatosplenomegalija) su česti;[3] slezena može puknuti i uzrokovati dodatne komplikacije. Slabost skeleta i bolest kostiju mogu biti ekstenzivni.[3] Povećanje slezene i zamjena koštane srži uzrokuju anemiju, trombocitopeniju i leukopeniju. Mozak i nervni sistem nisu patološki zahvaćeni,[3] ali može doći do oštećenja pluća i, rijetko, bubrega. Pacijenti u ovoj grupi obično lahko dobijaju modrice (zbog niskog nivoa trombocita) i osjećaju umor zbog malog broja crvenih krvnih zrnaca. Ovisno o početku i težini bolesti, pacijenti tipa I mogu živjeti i u odrasloj dobi. Opseg i težina simptoma mogu se dramatično razlikovati među pacijentima.
GD tip II (akutna infantilna neuropatija) obično počinje u roku od 6 mjeseci od rođenja i ima stopu incidencije oko jedan na 100.000 živorođenih. Simptomi uključuju povećanu jetru i slezinu, opsežno i progresivno oštećenje mozga, poremećaje pokreta očiju, grčenje, napad, ukočenost udova i slabu sposobnost sisanja i gutanja. Zaražena djeca obično umiru do druge godine.
GD tip III (hronična neuropatija) može početi u bilo kojem uzrastu u djetinjstvu ili čak u odrasloj dobi, a javlja se kod otprilike 1/100.000 živorođenih. Karakteriziraju ga sporo progresivni, ali blaži neurološki simptomi u odnosu na akutnu ili verziju tipa II. Glavni simptomi uključuju povećanu slezenu i/ili jetru, napade, lošu koordinaciju, skelet[]ne nepravilnosti, poremećaje pokreta očiju, poremećaje krvi uključujući anemiju i respiratorne probleme. Pacijenti često žive u ranim tinejdžerskim godinama i odrasloj dobi.[27]
Liječenje
[uredi | uredi izvor]Za one sa tipom I i većinom tipa III, enzimsko nadomjesno liječenje s intravenozno davanje rekombinantne glukocerebrozidaze može smanjiti veličinu jetre i slezene, smanjiti skeletne abnormalnosti i preokrenuti druge manifestacije.[16][28] Ovaj tretman košta oko 200.000 USD godišnje za jednu osobu i treba ga nastaviti doživotno. Rijetkost bolesti znači da je bilo teško provesti studije određivanja doze, tako da i dalje postoje kontroverze oko optimalne doze i učestalosti doziranja.[7] Zbog niske incidence, ovo je postalo lijek za siročad u mnogim zemljama, što znači da vlada prepoznaje i prilagođava finansijska ograničenja koja ograničavaju istraživanje lijekova koji su namijenjeni maloj populaciji.
Prvi lijek za Gaucherovu bolest bila je algluceraza (ceredaza), koja je bila verzija glukocerebrozidaze koja je sakupljena iz ljudskog placentnog tkiva, a zatim modificirana enzimima.[29] It was approved by the FDA in 1991[30] i povučen je sa tržišta.[31][32] zbog odobrenja sličnih lijekova napravljenih tehnologijom rekombinantne DNK, umjesto da se sakupljaju iz tkiva, lijekovi koji se prave rekombinantno su poželjniji, budući da nema zabrinutosti da se bolesti prenose iz tkiva koje se koristi u prikupljanju, postoji manji rizik od varijacija u strukturi enzima od serije do serije i jeftiniji su za proizvodnju.[29]
Dostupne rekombinantne glukocerebrozidaze su:[16]
- Imigluceraza (odobrena 1995.)[29]
- Velagluceraza (odobrena 2010.)[33]
- Taligluceraza alfa (Elelyso) (odobran 2012.)[34]
Miglustat je malA molekulA, oralno dostupan lijek koji je u Evropi prvi put odobren za Gaucherovu bolest 2002. godine.[35] Djeluje tako što sprječava stvaranje glukocerebrozida, tvari koja se nakuplja i uzrokuje štetu kod Gaucherove bolesti. Ovaj pristup se naziva terapija redukcije supstrata.[36]
Eliglustat (Cerdelga) (odobren 2014.) [37] je također mala molekula. Vjeruje se da spoj djeluje inhibicijom glukozilceramid sintaza.
Epidemiologija
[uredi | uredi izvor]Nacionalna Gaucher fondacija (Sjedinjene Američke Države) navodi da je incidencija Gaucherove bolesti oko 1720.000 živorođenih.[38] Around one in 100 people in the general US population is a carrier for type I Gaucher's disease, giving a prevalence of one in 40,000.[39] Među Jevrejima Aškenazi, stopa nositelja je znatno veća, otprilike 1/15.
Gaucherova bolest tipa II ne pokazuje posebne preferencije za bilo koju etničku grupu.
Tip III Gaucherove boleste je posebno čest u populaciji sjevernog švedskog regiona Norrbotten, gdje je učestalost bolesti 1/50.000.[40]
Historija
[uredi | uredi izvor]Bolest je prvi prepoznao francuski doktor Philippe Gaucher, koji ju je prvobitno opisao 1882. godine i dao svoje ime tom stanju.[4] Njen način nasljeđivanja otkrio je Nathan Brill je 1902. godine .[3] Oštećenje neurona povezanih s bolešću otkriveno je 1920-ih godina, a Roscoe Brady razjasnio je biohemijsku osnovu bolesti, 1960-ih.[3][41] Prvi efikasan tretman za ovu bolest, lek algluceraza (Ceredase), odobrila je FDA u aprilu 1991. Poboljšani lek, imigluceraza (Cerezyme), odobrila je FDA u maju 1994. godine i zamijenio je upotrebu Ceredase.
Oktobar je Nacionalni mjesec svijesti o Gocherovoj bolesti u Sjedinjenim Državama.
Istaknuti ljudi s ovom bolesti
[uredi | uredi izvor]- Wallace Chapman; Novozelandska radio i televizijska ličnost[42]
- Anne Begg; škotski političar
- Adam Rose, američki glumac najpoznatiji po ulozi Aarona Bassa u Supernatural i Maksa u Veronici Mars
Dodatne slike
[uredi | uredi izvor]-
Sfingolipidoza
Također pogledajte
[uredi | uredi izvor]- Lizozomska bolest skladištenja
- Niemann-Pikova bolest
- Fabryjeva bolest
- Tay-Sachsova bolest
- Krabbeova bolest
- Metakromatska leukodistrofija
Reference
[uredi | uredi izvor]- ^ Zimran A, Gelbart T, Westwood B, Grabowski GA, Beutler E (oktobar 1991). "High frequency of the Gaucher disease mutation at nucleotide 1226 among Ashkenazi Jews". American Journal of Human Genetics. 49 (4): 855–9. PMC 1683177. PMID 1897529.
- ^ James WD, Elston DM, Berger TG, Andrews GC (2006). Andrews' Diseases of the Skin: clinical Dermatology. Saunders Elsevier. str. 536. ISBN 978-0-7216-2921-6. OCLC 663444979.
- ^ a b c d e f g h i Dandana A, Ben Khelifa S, Chahed H, Miled A, Ferchichi S (2016). "Gaucher Disease: Clinical, Biological and Therapeutic Aspects". Pathobiology. 83 (1): 13–23. doi:10.1159/000440865. PMID 26588331.
- ^ a b Gaucher PCE (1882). De l'epithelioma primitif de la rate, hypertrophie idiopathique de la rate sans leucemie [Primary epithelioma of the spleen, idiopathic hypertrophy of the spleen without leukemia] (academic thesis) (jezik: francuski). Paris, France.Šablon:Pn
- ^ McNeill A, Duran R, Hughes DA, Mehta A, Schapira AH (august 2012). "A clinical and family history study of Parkinson's disease in heterozygous glucocereb[rosidase mutation carriers". Journal of Neurology, Neurosurgery, and Psychiatry. 83 (8): 853–4. doi:10.1136/jnnp-2012-302402. PMC 3927562. PMID 22577228.
- ^ OMIM: Gluosidase, beta, acid; GBA -606463
- ^ a b Grabowski GA (oktobar 2008). "Phenotype, diagnosis, and treatment of Gaucher's disease". Lancet. 372 (9645): 1263–71. doi:10.1016/S0140-6736(08)61522-6. PMID 19094956. S2CID 25221799.
- ^ Weinreb NJ, Deegan P, Kacena KA, Mistry P, Pastores GM, Velentgas P, vom Dahl S (decembar 2008). "Life expectancy in Gaucher disease type 1". American Journal of Hematology. 83 (12): 896–900. doi:10.1002/ajh.21305. PMC 3743399. PMID 18980271.
- ^ Dahl N, Lagerström M, Erikson A, Pettersson U (august 1990). "Gaucher disease type III (Norrbottnian type) is caused by a single mutation in exon 10 of the glucocerebrosidase gene". American Journal of Human Genetics. 47 (2): 275–8. PMC 1683716. PMID 2378352.
- ^ Diaz GA, Gelb BD, Risch N, Nygaard TG, Frisch A, Cohen IJ, Miranda CS, Amaral O, Maire I, Poenaru L, Caillaud C, Weizberg M, Mistry P, Desnick RJ (juni 2000). "Gaucher disease: the origins of the Ashkenazi Jewish N370S and 84GG acid beta-glucosidase mutations". American Journal of Human Genetics. 66 (6): 1821–32. doi:10.1086/302946. PMC 1378046. PMID 10777718.
- ^ Sidransky E (oktobar 2012). "Gaucher disease: insights from a rare Mendelian disorder". Discovery Medicine. 14 (77): 273–81. PMC 4141347. PMID 23114583.
- ^ Simons K, Gruenberg J (novembar 2000). "Jamming the endosomal system: lipid rafts and lysosomal storage diseases". Trends in Cell Biology. 10 (11): 459–62. doi:10.1016/S0962-8924(00)01847-X. PMID 11050411.
- ^ Westbroek W, Gustafson AM, Sidransky E (septembar 2011). "Exploring the link between glucocerebrosidase mutations and parkinsonism". Trends in Molecular Medicine. 17 (9): 485–93. doi:10.1016/j.molmed.2011.05.003. PMC 3351003. PMID 21723784.
- ^ Hein LK, Meikle PJ, Hopwood JJ, Fuller M (decembar 2007). "Secondary sphingolipid accumulation in a macrophage model of Gaucher disease". Molecular Genetics and Metabolism. 92 (4): 336–45. doi:10.1016/j.ymgme.2007.08.001. PMID 17881272.
- ^ Batta G, Soltész L, Kovács T, Bozó T, Mészár Z, Kellermayer M, Szöllősi J, Nagy P (januar 2018). "Alterations in the properties of the cell membrane due to glycosphingolipid accumulation in a model of Gaucher disease". Scientific Reports. 8 (1): 157. Bibcode:2018NatSR...8..157B. doi:10.1038/s41598-017-18405-8. PMC 5760709. PMID 29317695.
- ^ a b c Grabowski GA (2012). "Gaucher disease and other storage disorders". Hematology. American Society of Hematology. Education Program. 2012: 13–8. doi:10.1182/asheducation.v2012.1.13.3797921. PMID 23233555.
- ^ Beals JK (19. 11. 2008). "ASHG 2008: Gaucher Disease Mutation Carriers at Higher Risk for Parkinson's Disease". Medscape Medical News.
- ^ Aharon-Peretz J, Rosenbaum H, Gershoni-Baruch R (novembar 2004). "Mutations in the glucocerebrosidase gene and Parkinson's disease in Ashkenazi Jews". The New England Journal of Medicine. 351 (19): 1972–7. doi:10.1056/NEJMoa033277. PMID 15525722.
- ^ Arends M, van Dussen L, Biegstraaten M, Hollak CE (juni 2013). "Malignancies and monoclonal gammopathy in Gaucher disease; a systematic review of the literature". British Journal of Haematology. 161 (6): 832–42. doi:10.1111/bjh.12335. PMID 23594419.
- ^ Thomas AS, Mehta A, Hughes DA (maj 2014). "Gaucher disease: haematological presentations and complications". British Journal of Haematology. 165 (4): 427–40. doi:10.1111/bjh.12804. PMID 24588457.
- ^ Ayto R, Hughes DA (2013). "Gaucher disease and myeloma". Critical Reviews in Oncogenesis. 18 (3): 247–68. doi:10.1615/critrevoncog.2013006061. PMID 23510067.
- ^ Barth BM, Shanmugavelandy SS, Tacelosky DM, Kester M, Morad SA, Cabot MC (2013). "Gaucher's disease and cancer: a sphingolipid perspective". Critical Reviews in Oncogenesis. 18 (3): 221–34. doi:10.1615/critrevoncog.2013005814. PMC 3604879. PMID 23510065.
- ^ "Gaucher Disease". symptoma. Arhivirano s originala, 9. 9. 2018. Pristupljeno 7. 12. 2015.
- ^ Nagral A (mart 2014). "Gaucher disease". Journal of Clinical and Experimental Hepatology. 4 (1): 37–50. doi:10.1016/j.jceh.2014.02.005. PMC 4017182. PMID 25755533.
- ^ Bennett LL, Mohan D (septembar 2013). "Gaucher disease and its treatment options". The Annals of Pharmacotherapy. 47 (9): 1182–93. doi:10.1177/1060028013500469. PMID 24259734. S2CID 10092272.
- ^ [1] Arhivirano 24. 9. 2006. na Wayback Machine
- ^ Dreborg S, Erikson A, Hagberg B (mart 1980). "Gaucher disease--Norrbottnian type. I. General clinical description". European Journal of Pediatrics. 133 (2): 107–18. doi:10.1007/BF00441578. PMID 7363908. S2CID 12375149.
- ^ Shemesh E, Deroma L, Bembi B, Deegan P, Hollak C, Weinreb NJ, Cox TM (mart 2015). "Enzyme replacement and substrate reduction therapy for Gaucher disease". The Cochrane Database of Systematic Reviews (3): CD010324. doi:10.1002/14651858.CD010324.pub2. PMID 25812601.
- ^ a b c Deegan PB, Cox TM (2012). "Imiglucerase in the treatment of Gaucher disease: a history and perspective". Drug Design, Development and Therapy. 6: 81–106. doi:10.2147/DDDT.S14395. PMC 3340106. PMID 22563238.
- ^ World Health Organization. Regulatory Matters WHO Drug Information 5:3 1991. p 123
- ^ Aetna. Last reviewed 8 August 2014 Clinical Policy Bulletin Number: 0442: Enzyme-replacement Therapy for Lysosomal Storage Disorders
- ^ FDA lista proizvoda na recept i lijekova bez recepta. 32. izdanje Zbirni dodatak broj 3: mart 2012.Additions/Deletions for Prescription Drug Product List
- ^ "Shire Announces FDA Approval Of VPRIV(TM) (velaglucerase Alfa For Injection) For The Treatment Of Type I Gaucher Disease". Medicalnewstoday.com. Arhivirano s originala, 13. 6. 2011. Pristupljeno 13. 8. 2012.
- ^ Yukhananov A (1. 5. 2012). "U.S. FDA approves Pfizer/Protalix drug for Gaucher". Chicago Tribune. Reuters. Arhivirano s originala, 14. 9. 2022. Pristupljeno 2. 5. 2012.
- ^ European Medicines Agency. Human Medicines Database. Zavesca (miglustat) Arhivirano 7. 1. 2016. na Wayback Machine Page Accessed 1 September 2014.
- ^ European Medicines Agency 1 April 2003 Scientific discussion related to approval of Zavesca Arhivirano 24. 9. 2015. na Wayback Machine.
- ^ "Center Watch: Cerdelga (eliglustat)". Arhivirano s originala, 5. 8. 2019. Pristupljeno 12. 12. 2021.
- ^ Gaucher Disease at National Gaucher Foundation. Retrieved June 2012
- ^ "Gaucher Disease Genetics | About Gaucher Disease | National Gaucher Foundation". National Gaucher Foundation (jezik: engleski). Pristupljeno 16. 11. 2016.
- ^ "Gaucher disease - Affected population". NORD - National Organization for Rare Disorders. Arhivirano s originala, 25. 9. 2013. Pristupljeno 21. 9. 2013.
- ^ Brady RO, Kanfer JN, Shapiro D (januar 1965). "Metabolism of glucocerebrosides II. Evidence of an enzymatic deficiency in Gaucher's disease". Biochemical and Biophysical Research Communications. 18 (2): 221–5. doi:10.1016/0006-291X(65)90743-6. PMID 14282020.
- ^ "Eating Fried Chicken - Cold is Gold". RNZ (jezik: engleski). 1. 8. 2019. Pristupljeno 8. 8. 2019.
