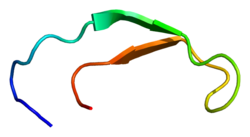HAMP
| Hepcidin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifikatori | |||||||||
| Simbol | Hepcidin | ||||||||
| Pfam | PF06446 | ||||||||
| InterPro | IPR010500 | ||||||||
| SCOP2 | 1m4f / SCOPe / SUPFAM | ||||||||
| OPM superporodica | 153 | ||||||||
| OPM protein | 1m4e | ||||||||
| |||||||||
| Hepcidinski antimikrobni peptid | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||
| Simbol | HAMP | ||||||
| NCBI gen | 57817 | ||||||
| HGNC | 15598 | ||||||
| OMIM | 606464 | ||||||
| RefSeq | NM_021175 | ||||||
| UniProt | P81172 | ||||||
| Ostali podaci | |||||||
| Lokus | Hrom. 19 q13.1 | ||||||
| |||||||
Hepcidin je protein koji je kod ljudi kodiran genom HAMP. Hepcidin je ključni regulator ulaska gvožđa u sisarsku circulaciju.[6]
Tokom stanja u kojima je nivo hepcidina abnormalno visok, kao što je upala, serumsko gvožđe pada usled zadržavanja u makrofazima i ćelijama jetre i smanjene apsorpcije gvožđa u crijevima. To obično dovodi do anemije zbog neadekvatne količine serumskog gvožđa dostupnog za razvoj crvenih krvnih ćelija. Kada je nivo hepcidina nenormalno nizak, naprimjer kod hemohromatoze, dolazi do preopterećenja gvožđem, zbog povećanog izlivanja gvožđa posredovanog feroportinom iz skladišta i povećane apsorpcije u crijevima.
Struktura
[uredi | uredi izvor]Hepcidin postoji kao prethormon (84 aminokiseline), prohormon (60 aminokiselina) i hormon (25 aminokiselina). Dvadeset i 22-aminokiselinski metaboliti hepcidina takođe postoje u urinu. Delecija 5' N-terminalnih aminokiselina rezultira gubitkom funkcije. Konverziju prohepcidina u hepcidin posreduje prohormonska konvertaza furin.[7] Ovu konverziju može regulirati alfa-1 antitripsin.[8]
Hepcidin je čvrsto presavijeni polipeptid sa 32% karakteristična beta-lista i strukture ukosnice stabilizirane sa četiri disulfidne veze. Struktura hepcidina određena je rastvorom NMR.[5] Studije NMR pokazale su novi model za hepcidin: na sobnoj temperaturi, protein se pretvara između dvije konformacije, što bi se moglo pojedinačno riješiti promjenom temperature. Struktura rastvora hepcidina određena je na 325 K i 253 K u prehlađenoj vodi. Rentgenska analiza ko-kristala sa Fab-om otkrila je strukturu sličnu visokotemperaturnoj strukturi NMR.[9]
Funkcija
[uredi | uredi izvor]
Hepcidin je regulator metabolizma gvožđa. Inhibira transport gvožđa vežući se za izlazni kanal gvožđevog feroportina, koji se nalazi u bazolateralnoj plazemamembrani crijeva enterocitima i plazmamembrani retikuloendotelnih ćelija (makrofaga), što na kraju rezultira razlaganjem feroportina u lizosomima. Inhibiranje feroportina sprečava izlaz gvožđa iz ćelije.[10][11] U enterocitima ovo sprečava prenos gvožđa u jetreni portni sistem, smanjujući tako apsorpciju gvožđa u ishrani. U makrofazima inhibicija feroportina uzrokuje sekvestraciju gvožđa unutar ćelije. Povećana aktivnost hepcidina djelimično je odgovorna za smanjenu dostupnost gvožđa viđenu kod anemije hroničnih upala, kao što je otkazivanje bubrega.[12]
Bilo koja od nekoliko mutacija hepcidina rezultira juvenilnom hemohromatozom. Većina slučajeva maloljetniče hemohromatoze nastala je zbog mutacija u hemojuvelinu.[13] Mutacije u genu TMPRSS6 mogu izazvati anemiju, remećenjem regulacije hepcidina.[14]
Hepcidin ima snažnu antimikrobnu aktivnost protiv Escherichia coli soja ML35P i Neisseria cinerea i slabiju antimikrobnu aktivnost protiv Staphylococcus epidermidis, Staphylococcus aureus i Streptococcus agalactiae. Također je aktivan protiv gljive Candida albicans, ali je neaktivan protiv Pseudomonas aeruginosa.[15]
Regulacija
[uredi | uredi izvor]Sintezu i sekreciju hepcidina u jetri kontroliraju zalihe gvožđa unutar makrofaga, upala (hepcidin je reaktant akutne faze), hipoksija i eritropoeza. Makrofagi komuniciraju s hepatocitima radi regulacije oslobađanja hepcidina u cirkulaciju, putem osam različitih proteina: hemojuvelin, nasljedni protein hemohromatoze, transferin receptor 2, koštani morfogeni protein 6 (BMP6), matriptaza-2, neogenin, BMP receptor i transferin.[16]
Eritroferon, proizveden u eritroblastima, identificiran je kao inhibitor hepcidina i tako pruža više gvožđa za sintezu hemoglobina u situacijama kao što je stresna eritropoeza.[17][18]
Pokazalo se da vitamin D smanjuje hepcidin, u ćelijskim modelima koji utiču na transkripciju i kada se daju u velikim dozama ljudskim dobrovoljcima. Optimalna funkcija hepcidina može se zasnivati na adekvatnom prisustvu vitamina D u krvi.[19]
Historija
[uredi | uredi izvor]Prvootkriveni peptid u početku nazvan je LEAP-1, kao antimikrobni protein izražen je u jetri, kada je prvi put opisan 2000.[20] Kasnije je otkriven peptid povezan sa upalom i nazvan hepcidin nakon što je primijećeno da se proizvodi u jetri (hep-) i da ima baktericidna svojstva (-cid za ubijanje).[21] Iako se primarno sintetizira u jetri, manje količine se sintetiziraju u drugim tkivima, poput masnih ćelija.[22]
Hepcidin je prvi put otkriven u ljudskom urinu i serumu u 2000.[23]
Ubrzo nakon ovog otkrića, otkriveno je da se proizvodnja hepcidina kod miševa povećava u uvjetima preopterećenja gvožđem, kao i kod upala. Genetički modificirani miševi dizajnirani da prekomjerno eksprimiraju hepcidin uginuli su ubrzo nakon rođenja, sa ozbiljnim nedostatkom gvožđa, što opet sugerira centralnu i ne suvišnu ulogu u regulaciji gvožđa. Prvi dokazi koji su hepcidin povezali sa kliničkim stanjem poznatim kao upalna anemija došli su iz laboratorije Nancy Andrews u Bostonu, kada je pregledano tkivo dva pacijenta sa tumorom jetre s teškom mikrocitnom anemijom, koji nisu reagirali na dodatak gvožđa. Činilo se da tumorsko tkivo prekomjerno proizvodi hepcidin i sadrži ga u velikim količinama iRNK. Anemija je izliječena hirurškim uklanjanjem tumora.
Zajedno, ova otkrića sugeriraju da hepcidin regulira apsorpciju gvožđa u tijelu.
Klinički značaj
[uredi | uredi izvor]Postoje mnoge bolesti kod kojih neadekvatna apsorpcija gvožđa doprinosi njegovom nedostatku i anemiji zbog nedostatka gvožđa. Tretman će ovisiti o prisutnim razinama hepcidina, jer je malo vjerojatno da će oralno liječenje biti učinkovito ako hepcidin blokira crijevnu apsorpciju, u kojim slučajevima bi bilo primjereno liječenje parenteralnim unosom gvožđa. Studije su otkrile da bi mjerenje hepcidina bilo korisno za uspostavljanje optimalnog liječenja,[24] iako ovo nije široko dostupno, a C-reaktivni protein (CRP) koristi se kao zamjenski marker.
β-talasemija, jedna od najčešćih urođenih anemija, proizlazi iz djelomičnog ili potpunog nedostatka sinteze β-globina. Prekomjerna apsorpcija gvožđa jedna je od glavnih karakteristika β-talasemije i može dovesti do ozbiljnog morbiditeta i smrtnosti. Serijske analize β-talasemijskih miševa pokazuju da se razina hemoglobina smanjuje s vremenom, dok se koncentracija gvožđa u jetri, slezeni i bubrezima znatno povećava. Preopterećenje gvožđem povezano je s niskim nivoima hepcidina. Pacijenti sa β-talasemijom također imaju nizak nivo hepcidina. Posmatranja su navela istraživače na pretpostavku da se u β-talasemiji apsorbuje više gvožđa nego što je potrebno za eritropoezu. Povećana ekspresija hepcidina kod β-talasemijskh miševa ograničava preopterećenje gvožđem, a takođe smanjuje i stvaranje netopljivih membranski vezanih globina i reaktivnih vrsta kisika, a poboljšava stanje anemije.[25] Miševi sa povećanom ekspresijom hepcidina također su pokazali povećanje životnog vijeka crvenih krvnih zrnaca, preokret neefikasne eritropoeze i splenomegalije, uz povećanje ukupnog nivoa hemoglobina. Iz ovih podataka, istraživači su sugerirali da terapija za povećanje nivoa hepcidina ili djelovanje kao hepcidinski agonist može pomoći u liječenju nenormalne apsorpcije gvožđa kod osoba sa β-talasemijom i srodnim poremećajima.[26] U kasnijim studijama na miševima,[27]eritroferon je predložen kao faktor koji je odgovoran za suzbijanje hepcidina. Korekcija nivoa hepcidina i gvožđa kod ovih miševa nije popravila njihovu anemiju.
Reference
[uredi | uredi izvor]- ^ a b c GRCh38: Ensembl release 89: ENSG00000105697 - Ensembl, maj 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000056978 - Ensembl, maj 2017
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b PDB 1M4F; Hunter HN, Fulton DB, Ganz T, Vogel HJ (oktobar 2002). "The solution structure of human hepcidin, a peptide hormone with antimicrobial activity that is involved in iron uptake and hereditary hemochromatosis". J. Biol. Chem. 277 (40): 37597–603. doi:10.1074/jbc.M205305200. PMID 12138110.
- ^ Ganz T (august 2003). "Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation". Blood. 102 (3): 783–8. doi:10.1182/blood-2003-03-0672. PMID 12663437.
- ^ Valore EV, Ganz T (2008). "Posttranslational processing of hepcidin in human hepatocytes is mediated by the prohormone convertase furin". Blood Cells Mol. Dis. 40 (1): 132–8. doi:10.1016/j.bcmd.2007.07.009. PMC 2211381. PMID 17905609.
- ^ Pandur E, Nagy J, Poór VS, Sarnyai A, Huszár A, Miseta A, Sipos K (april 2009). "Alpha-1 antitrypsin binds preprohepcidin intracellularly and prohepcidin in the serum". FEBS J. 276 (7): 2012–21. doi:10.1111/j.1742-4658.2009.06937.x. PMID 19292870. S2CID 28974553.
- ^ PDB 3H0T; Jordan JB, Poppe L, Haniu M, Arvedson T, Syed R, Li V, Kohno H, Kim H, Schnier PD, Harvey TS, Miranda LP, Cheetham J, Sasu BJ (septembar 2009). "Hepcidin revisited, disulfide connectivity, dynamics, and structure". J. Biol. Chem. 284 (36): 24155–67. doi:10.1074/jbc.M109.017764. PMC 2782009. PMID 19553669.
- ^ Rossi E (august 2005). "Hepcidin--the iron regulatory hormone". Clin Biochem Rev. 26 (3): 47–9. PMC 1240030. PMID 16450011.
- ^ Gulec S, Anderson GJ, Collins JF (august 2014). "Mechanistic and regulatory aspects of intestinal iron absorption". American Journal of Physiology. Gastrointestinal and Liver Physiology. 307 (4): G397–409. doi:10.1152/ajpgi.00348.2013. PMC 4137115. PMID 24994858.
- ^ Ashby DR, Gale DP, Busbridge M, Murphy KG, Duncan ND, Cairns TD, Taube DH, Bloom SR, Tam FW, Chapman RS, Maxwell PH, Choi P (maj 2009). "Plasma hepcidin levels are elevated but responsive to erythropoietin therapy in renal disease". Kidney Int. 75 (9): 976–81. doi:10.1038/ki.2009.21. PMID 19212416.
- ^ Core AB, Canali S, Babitt JL (2014). "Hemojuvelin and bone morphogenetic protein (BMP) signaling in iron homeostasis". Frontiers in Pharmacology. 5: 104. doi:10.3389/fphar.2014.00104. PMC 4026703. PMID 24860505.
- ^ Iron-Deficiency Anemia: New Insights for the Healthcare Professional: 2011 Edition. Scholarly Media LLC. Dec 2012. ISBN 978-1-4649-8960-5.
- ^ "Hepcidin P81172". UniProt. 15. 12. 1998.
- ^ Zhao N, Zhang AS, Enns CA (2013). "Iron regulation by hepcidin". J Clin Invest. 123 (6): 2337–43. doi:10.1172/JCI67225. PMC 3668831. PMID 23722909.
- ^ Koury, M.J. "Erythroferrone: A Missing Link in Iron Regulation". The Hematologist. American Society of Hematology. Arhivirano s originala, 28. 1. 2019. Pristupljeno 26. 8. 2015.
- ^ Kautz L, Jung G, Valore EV, Rivella S, Nemeth E, Ganz T (Jul 2014). "Identification of erythroferrone as an erythroid regulator of iron metabolism". Nature Genetics. 46 (7): 678–84. doi:10.1038/ng.2996. PMC 4104984. PMID 24880340.
- ^ Bacchetta J, Zaritsky JJ, Sea JL, Chun RF, Lisse TS, Zavala K, Nayak A, Wesseling-Perry K, Westerman M, Hollis BW, Salusky IB, Hewison M (2014). "Suppression of iron-regulatory hepcidin by vitamin D". J. Am. Soc. Nephrol. 25 (3): 564–72. doi:10.1681/ASN.2013040355. PMC 3935584. PMID 24204002.
- ^ Krause A, Neitz S, Mägert HJ, Schulz A, Forssmann WG, Schulz-Knappe P, Adermann K (septembar 2000). "LEAP-1, a novel highly disulfide-bonded human peptide, exhibits antimicrobial activity". FEBS Lett. 480 (2–3): 147–50. doi:10.1016/S0014-5793(00)01920-7. PMID 11034317. S2CID 9161764.
- ^ Park CH, Valore EV, Waring AJ, Ganz T (mart 2001). "Hepcidin, a urinary antimicrobial peptide synthesized in the liver". J. Biol. Chem. 276 (11): 7806–10. doi:10.1074/jbc.M008922200. PMID 11113131.
- ^ Bekri S, Gual P, Anty R, Luciani N, Dahman M, Ramesh B, Iannelli A, Staccini-Myx A, Casanova D, Ben Amor I, Saint-Paul MC, Huet PM, Sadoul JL, Gugenheim J, Srai SK, Tran A, Le Marchand-Brustel Y (septembar 2006). "Increased adipose tissue expression of hepcidin in severe obesity is independent from diabetes and NASH". Gastroenterology. 131 (3): 788–96. doi:10.1053/j.gastro.2006.07.007. PMID 16952548.
- ^ Kemna EH, Tjalsma H, Willems HL, Swinkels DW (januar 2008). "Hepcidin: from discovery to differential diagnosis". Haematologica. 93 (1): 90–7. doi:10.3324/haematol.11705. PMID 18166790.
- ^ Bregman DB, Morris D, Koch TA, He A, Goodnough LT (februar 2013). "Hepcidin levels predict nonresponsiveness to oral iron therapy in patients with iron deficiency anemia". Am. J. Hematol. 88 (2): 97–101. doi:10.1002/ajh.23354. PMID 23335357. S2CID 42656065.
- ^ Gardenghi S, Ramos P, Marongiu MF, Melchiori L, Breda L, Guy E, Muirhead K, Rao N, Roy CN, Andrews NC, Nemeth E, Follenzi A, An X, Mohandas N, Ginzburg Y, Rachmilewitz EA, Giardina PJ, Grady RW, Rivella S (decembar 2010). "Hepcidin as a therapeutic tool to limit iron overload and improve anemia in β-thalassemic mice". J. Clin. Invest. 120 (12): 4466–77. doi:10.1172/JCI41717. PMC 2993583. PMID 21099112.
- ^ Kroot JJ, Tjalsma H, Fleming RE, Swinkels DW (decembar 2011). "Hepcidin in human iron disorders: diagnostic implications". Clin. Chem. 57 (12): 1650–69. doi:10.1373/clinchem.2009.140053. PMID 21989113.
- ^ Moura IC, Hermine O (2015). "Erythroferrone: the missing link in β-thalassemia?". Blood. 126 (17): 1974–5. doi:10.1182/blood-2015-09-665596. PMID 26494918.
Dopunska literatura
[uredi | uredi izvor]- Camaschella C (2005). "Understanding iron homeostasis through genetic analysis of hemochromatosis and related disorders". Blood. 106 (12): 3710–7. doi:10.1182/blood-2005-05-1857. PMID 16030190.
Vanjski linkovi
[uredi | uredi izvor]- hepcidin na US National Library of Medicine Medical Subject Headings (MeSH)
- Intrinsic LifeSciences - Hepcidin Research Facility, The BioIron Company
- Hepcidinanalysis.com - Service for Hepcidin measurements: Scientific Research, Patients and Clinical Trials
- Protein Data Bank Page
- PDBe-KB provides an overview of all the structure information available in the PDB for Human Hepcidin