Helicobacter pylori
| Helicobacter pylori | |
|---|---|
| Drugi nazivi | Campylobacter pylori |
 | |
| Imunohistohemijsko bojenje H. pylori (smeđe) iz biopsije želuca | |
| Izgovor |
|
| Specijalnost | Infektivna medicina, gastroenterologija |
| Simptomi | Hematemeza, melena, bol u trbuhu, mučnina[1][2] |
| Komplikacije | Gastritis, čir na želucu, rak želuca |
| Uzroci | Širenje Helicobacter pylori fekalno-oralnim putem[2] |
| Dijagnostička metoda | Test daha na ureu, analiza fekalnog antigena (stolica), biopsija tkiva[2] |
| Frekvencija | >50% (2015)[3] |
Helicobacter pylori (skraćeno H. pylori), ranije poznata kao Campylobacter pylori, gram-negativna je bakterija, mikroaerofilna, spiralna (helikoidna) bakterija koja se često nalazi u želucu.[4] Njezin helikoidni oblik (odakle potiče gensko ime helicobacter) smatra se rezultatom evolucije u cilju penetracije sluznice želuca kako bi proizvela infekciju.[5][6] Bakteriju su prvi put otkrili 1982. godine australski doktori Barry Marshall i Robin Warren.[7][8][9] H. pylori je bila povezana s limfomima limfoidnog tkiva povezanog sa sluznicom koju imaju želudac, jednjak, debelo crijevo, rektum, kao i tkiva oko očiju (nazvano ekstranodalni limfom B-ćelije rubne zone navedenog organa),[10][11] te limfoidnog tkiva u stomaku (nazvano difuzni veliki limfom B-ćelija).[12]
Infekcija bakterijom H. pylori obično nema simptoma, ali ponekad uzrokuje gastritis (upalu želuca) ili čireve na početku tankog crijeva. Infekcija je također povezana s razvojem određenih karcinoma koji se javljaju u manje od 20% slučajeva.[13] Nekoliko ispitivanja je sugerisalo da H. pylori uzrokuje široki spektar ostalih bolesti (npr. idiopatska trombocitopenična purpura, anemija nedostatka željeza, ateroskleroza, Alzheimerova bolest,[14] multipla skleroza, bolest koronarnih arterija, parodontoza,[15] Parkinsonova bolest, Guillain-Barréov sindrom, rozacea, psorijaza, hronična urtikarija, opadanje kose na pojedinim mjestima, nekoliko autoimunih bolesti kože, Henoch–Schönleinova purpura, nizak nivo vitamina B12 u krvi, autoimuna neutropenija, antifosfolipidni sindrom, diskrazija plazminih ćelija, reaktivni artritis, centralna serozna retinopatija, glaukom otvorenog ugla, blefaritis, dijabetes melitus, metabolički sindrom, različiti tipovi alergija, ne-alkoholna bolest masne jetre, ne-alkoholni steatohepatitis, hepatička fibroza te karcinom jetre[16]). Smatra se da bakterijska infekcija ima zaštitne efekte nosioca zaraze protiv infekcija od ostalih patogena, astme, gojaznosti,[14] celijakije, upalne bolesti crijeva,[15] rinitisa, atopijskog dermatitisa,[17] gastroezofagealne refluksne bolesti,[18] i raka jednjaka.[18] Ipak, ova istraživanja štetnih i zaštitnih efekata su se često zasnivala na korelaciji umjesto na direktnoj vezi[15] i često su bila u suprotnosti s drugim istraživanjima koja pokazuju suprotan ili nikakav učinak na navedenu bolest,[16] tako da je dosta ovih tvrdnji ostalo kontroverzno.[14]
Neka istraživanja sugeriraju da H. pylori igra važnu ulogu u prirodnoj stomačnoj ekologiji, npr. uticajem tipa bakterija koje koloniziraju probavni sistem.[13][16] Ostala istraživanja sugeriraju da ne-patogeni sojevi H. pylori mogu korisno normalizirati lučenje želučane kiseline[19] i regulisati apetit.[19]
2015. godine procijenjeno je da je više od pola svjetske populacije imalo H. pylori u svom gornjem probavnom traktu[3] sa infekcijom (ili kolonizacijom) kao češćom pojavom u zemljama u razvoju.[2] U zadnjim decenijama, ipak, u više zemalja svijeta smanjila se rasprostranjenost H. pylori u probavnom sistemu.[20]
Znakovi i simptomi
[uredi | uredi izvor]Čak do 90% osoba sa H. pylori nikad ne osjeti simptome i komplikacije.[21] Ipak, osobe zaražene sa H. pylori imaju 10% do 20% rizika da u periodu života razviju stomačne čireve.[22][23] Akutna infekcija može se javiti kao akutni gastritis sa bolom u trbuhu ili mučninom.[1] Kada se ovo stanje razvije u hronični gastritis, simptomi, ako su prisutni, često su jednaki onima od neulcerozne dispepsije: stomačni bolovi, mučnina, nadimanje, podrigivanje i ponekad povraćanje.[24][25] Bol se obično javlja kada je želudac prazan, između obroka, kao i u ranim jutarnjim satima, mada se može javiti i u ostalim dijelovima dana. Manje česti simptomi čira uključuju mučninu, povraćanje te gubitak apetita.
Krvarenje u želucu se također može pojaviti, što se zapaža izlučivanjem tamne stolice; produženo krvarenje može uzrokovati anemiju što dovodi do slabosti i umora. Ako se desi teško krvarenje, mogu se javiti hematemeza, hematohezija ili melena. Upala piloričnog antruma, koji spaja želudac sa dvanaestopalačnim crijevom, često dovodi do duodenalnih čireva, dok upala sluznice želuca često dovodi do čireva na želucu.[26][27] Osobe zaražene sa H. pylori mogu također razviti kolorektalne[28][29] ili želučane[30] polipe, a to su nekancerozne izrasline tkiva, koje izrastaju iz sluznice ovih organa. Obično su ovi polipi bez simptoma, ali želučani polipi mogu biti uzrok dispepsije, žgaravice, krvarenja iz gornjeg probavnog trakta, i, rijetko, opstrukcije želučanog izlaza,[30] dok kolorektalni polipi mogu uzrokovati rektalno krvarenje, anemiju, konstipaciju, proljev, gubitak težine i bolove u trbuhu.[31]
Osobe sa hroničnom infekcijom H. pylori imaju povećan rizik od razvijanja karcinoma koji je direktno povezan s ovom infekcijom.[10][11][22][23] Ovi karcinomi su želučani adenokarcinomi, rjeđe difuzni veliki B-stanični limfom želuca[12] ili ekstranodalni limfomi B-ćelija rubne zone želuca,[32][33] ili, još rjeđe, debelog crijeva,[11][33] rektuma,[34] jednjaka,[35] ili očnih adneksa (npr. orbita, konjuktiva, i/ili očnih kapaka).[36][37]
Mikrobiologija
[uredi | uredi izvor]| Helicobacter pylori | |
|---|---|
 Mikroskopski izgled H. pylori | |
| Sistematika | |
| Carstvo | Bakterije |
| Divizija | Proteobacteria |
| Red | Campylobacterales |
| Porodica | Helicobacteraceae |
| Rod | Helicobacter |
| Vrsta | H. pylori |
| Dvojno ime | |
| Helicobacter pylori (Marshall et al. 1985) Goodwin et al., 1989 | |
Morfologija
[uredi | uredi izvor]Helicobacter pylori je Gram-negativna bakterija spiralnog oblika (klasificirana kao zakrivljeno-štapičasta, ali ne spirohetna), dužine oko 3 μm i prečnika oko 0,5 μm. H. pylori može biti otkrivena u tkivu metodom bojenja po Gramu, Giemsu, hematoksilin–eosinu, Warthin–Starry srebrnom bojenju, akridinskom narandžastom bojenju te pomoću fazno-kontrasne mikroskopije. Bakterija može formirati biofilmove[38] i može se pretvoriti iz spiralnog u održiv, ali nekulturabilan kokoidan oblik.[39]
Helicobacter pylori ima četiri do šest bičeva na istoj lokaciji; sve želučane i enterohepatološke vrste Helicobacter su jako pokretne zahvaljujući bičevima.[40] Karakteristični omotani bičeviti filamenti Helicobacter sastoje se od dva kopolimerizirana flagelina, FlaA i FlaB.[41]
Fiziologija
[uredi | uredi izvor]Helicobacter pylori je mikroaerofil – što znači da joj je potreban kisik, ali na nižoj koncentraciji nego u atmosferi. Bakterija sadrži hidrogenazu koja može proizvesti energiju oksidiranjem molekularnog vodika (H2) koju pravi crijevna bakterija[42] te proizvodi oksidazu, katalazu i ureazu.
H. pylori posjeduje pet velikih porodica proteina vanjske membrane.[23] Najveća porodica uključuje poznate i pretpostavljene adhezive. Ostale četiri porodice su porini, transporteri željeza, proteini povezani s bičevima, kao i proteini nepoznate funkcije. Kao kod ostalih tipova gram-negativnih bakterija, vanjska membrana H. pylori sastoji se od fosfolipida i lipopolisaharida (LPS). O antigen LPS-a može biti fukoziliran i može oponašati Lewisove antigene krvne grupe koji se nalaze na želučanom epitelu.[23] Vanjska membrana također sadrži holesterolne glukozide, koji su prisutni u nekoliko drugih bakterija.[23]
Genom
[uredi | uredi izvor]Helicobacter pylori se sastoji od sojeva velike raznolikosti, te je stotine genoma potpuno sekvencirano.[43][44][45][46][47][48] Genom soja "26695" sastoji se od oko 1,7 miliona baznih parova, sa 1.576 gena. Pangenom, koji je kombinirani set od 30 sekvenciranih sojeva, enkodira 2.239 proteinskih porodica (ortološke grupe, OG). Među njima, 1.248 OG-ova je konzervirano u svih 30 sojeva, te predstavljaju univerzalno jezgro. Ostatak od 991 OG-ova korespondira akcesornom genomu u kojem je 277 OG-ova unikatno (npr. OG-ovi predstavljeni u samo jednom soju).[49]
Transkriptom
[uredi | uredi izvor]2010. godine, Sharma et al. predstavili su sveobuhvatnu analizu transkripcije sa rezolucijom jednog nukleotida diferenciranjem RNA-seq što je potvrdilo poznatu kiselinsku indukciju majora virulencije lokusa, poput ureaze (ure) operona ili cag ostrva patogenosti.[50] Još važnije, ova studija je identificirala ukupno 1.907 početnih stranica transkripcije, 337 primarnih operona, i 126 dodatnih suboperona, te 66 monocistrona. Do 2010. godine, samo je oko 55 početnih stranica transkripcije (TSS) bilo poznato u ovoj vrsti. Znatno, 27% primarnih TSS-ova su također antisensni TSS-ovi, što ukazuje – slično kao i kod E. coli – da se antisensna transkripcija javlja kroz cijeli H. pylori genom. Najmanje jedan antisensni TSS povezan je sa oko 46% svih otvorenih okvira čitanja, uključujući više održavajućih gena.[50] Veći dio (oko 50%) 5′-nih UTR-ova je 20–40 nukleotida (nt) u dužini i podržava AAGGag motiv lociran oko 6 nt (srednje udaljenosti) uzvodno od startnih kodona kao konsenzusa Shine–Dalgarno sekvence kod H. pylori.[50]
Geni uključeni u virulenciju i patogenezu
[uredi | uredi izvor]Istraživanje H. pylori genoma je fokusirano na pokušaje razumijevanja patogeneze, mogućnosti ovog organizma da uzrokuje bolest. Oko 29% lokusa ima defekt kolonizacije pri mutaciji. Dva sekvencirana soja ima oko 40 kb dugo Cag ostrvo patogenosti (česta genska sekvenca za koju se vjeruje da je odgovorna za patogenezu) koji sadrže preko 40 gena. Ovo ostrvo patogenosti je obično bez sojeva H. pylori koji su izolirani od ljudi koji su nosioci H. pylori bez simptoma.[51]
Patofiziologija
[uredi | uredi izvor]Adaptacija na želudac
[uredi | uredi izvor]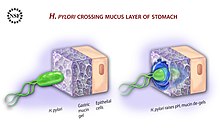
Da bi izbjegla kiselu sredinu unutrašnjosti želuca (lumen), H. pylori koristi svoje bičeve za zakopavanje u sluznicu želuca kako bi dosegla epitelne ćelije ispod, područje s manjom kiselosti.[52] H. pylori može osjetiti pH vrijednost u sluznici i pomjerati se prema manje kiselom dijelu (hemotaksija). Ovo također održava bakteriju da ne bude gurnuta unutar lumena sa bakterijskom sluznom sredinom, koja se neprekidno pomjera od mjesta nastanka na epitelu do razlaganja na sučelju lumena.[53]

H. pylori se nalazi u sluznici, na unutarnjoj površini epitela, a ponekad unutar samih ćelija epitela.[54] Prijanja na epitelne ćelije proizvodeći adhezive, koji se vežu na lipide i ugljikohidrate u epitelnoj ćelijskoj membrani. Jedan takav adheziv, BabA, veže se na Lewis b antigen koji se nalazi na površini ćelija želučanog epitela.[55] Prijanjanje H. pylori preko BabA zavisi od kiselosti i može se potpuno reverzirati smanjenjem pH. Predloženo je da BabA reakcija na kiselinu omogućava prijanjanje dok istovremeno dopušta efektivan bijeg iz nepovoljne okoline na pH vrijednost koja je štetna za organizam.[56] Drugi takav adheziv, SabA, veže se na povećane nivoe sialyl-Lewis x antigena koji je izražen na sluznici želuca.[57]
Uz korištenje hemotaksija da bi izbjegla područja niskog pH, H. pylori također neutralizira kiselinu u svojoj okolini proizvodeći velike količine ureaze, koja razlaže ureu prisutnu u želucu na ugljik-dioksid i amonijak. Oni reaguju s jakim kiselinama u okolini da proizvedu neutralnu okolinu oko H. pylori.[58] Nokautni mutanti ureaze nisu sposobni za kolonizaciju. Ustvari, izraz ureaze nije samo neophodan za uspostavljanje prvobitne kolonizacije nego i za održavanje hronične infekcije.[59]
Adaptacija H. pylori na visoku kiselost želuca
[uredi | uredi izvor]H. pylori proizvodi velike količine ureaze za proizvodnju amonijaka kao jedne od njenih adaptacijskim metoda za savladavanje želučane kiselosti. H. pylori arginaza, bimetalni enzim binuklearne Mn2-metaloenzim arginaze, presudan za patogenezu bakterije u ljudskom želucu,[60] član porodice ureohidrolaze, katalizira konverziju L-arginina u L-ornitin i uree, gdje se ornitin dalje pretvara u poliamine, koji su neophodni za različite kritične metaboličke procese.[60]
To osigurava otpornost na kiseline i stoga je važno za kolonizaciju bakterije u epitelnim ćelijama želuca. Arginaza od H. pylori također igra ulogu u utajivanju patogena iz imunološkog sistema domaćina uglavnom različitim predloženim mehanizmima, arginaza se natječe sa sintetazom dušičnog oksida (NO) inducibilnom domaćinom za uobičajeni supstrat L-arginin i na taj način smanjuje sintezu NO, važne komponente urođenog imuniteta i efikasnog antimikrobnog agensa koji je u stanju da direktno ubije patogene koji napadaju.[60]
Promjene u dostupnosti L-arginina i njegovog metabolizma u poliaminima značajno doprinose poremećaju regulacije imunološkog odgovora domaćina na infekciju "H. pylori".[60]
Upala, gastritis i čir
[uredi | uredi izvor]Helicobacter pylori nanosi štetu želucu i dvanaestopalačnom crijevu oblogama pomoću nekoliko mehanizama. Amonijak proizveden za regulaciju pH je toksičan za epitelne ćelije, kao i biohemikalije proizvedene od H. pylori kao što su proteaze, vakuoliziranje citotoksina A (VacA) (ovo oštećuje epitelne ćelije, narušava uske spojeve i uzrokuje apoptozu), kao i određene fosfolipaze.[61] Gen povezan sa citotoksinom "CagA" također može izazvati upalu i potencijalno je kancerogen.[62]
Kolonizacija želuca od H. pylori može dovesti do hroničnog gastritisa, upale sluznice želuca, na mjestu infekcije. Helicobacter proteini bogati cisteinom (Hcp), posebno HcpA (hp0211), poznato je da pokreću imunološki odgovor, izazivajući upalu.[63] H. pylori pokazalo se da povećava nivo COX2 u gastritisu pozitivnom na H. pylori.[64] Hronični gastritis vjerovatno će biti osnova bolesti povezane sa H. pylori.[65]
Čir na želucu i dvanaestopalačnom crijevu nastaje kada posljedice upale omoguće da želučana kiselina i probavni enzim pepsin nadvladaju mehanizme koji štite sluznicu želuca i dvanaesnika. Mjesto kolonizacije H. pylori, koje utječe na mjesto čira, ovisi o kiselosti želuca.[66] Kod osoba koji proizvode velike količine kiseline, H. pylori kolonizira u blizini piloričnog antruma (izlaz prema duodenumu) kako bi se izbjeglo lučenje kiseline parijetalnih ćelija na fundusu (pored ulaza u želudac).[23] Kod ljudi koji proizvode normalne ili smanjene količine kiseline, H. pylori također može kolonizirati ostatak želuca.
Upalni odgovor izazvan bakterijama koje se koloniziraju u blizini piloričnog antruma indukuje G ćelije u antrumu da luče hormon gastrin, koji putuje kroz krvotok do parijetalnih ćelija fundusa.[67] Gastrin stimulira parijetalne ćelije da luče više kiseline u lumen želuca, a vremenom povećava i broj parijetalnih ćelija.[68] Povećano opterećenje kiselinom oštećuje duodenum, što na kraju može rezultirati stvaranjem čira na dvanaesniku.
Kada H. pylori kolonizira druga područja želuca, upalni odgovor može rezultirati atrofijom sluznice želuca i na kraju čir na želucu. Ovo također može povećati rizik od raka želuca.[26]
Ostrvo patogenosti "Cag"
[uredi | uredi izvor]Patogenost H. pylori može se povećati genima cag ostrva patogenosti (PAI); oko 50–70% sojeva H. pylori u Zapadnim državama nosi to, ali ga gotovo nema u sojevima istočne Azije.[69] Zapadnjaci zaraženi sojevima koji nose cag PAI imaju jači upalni odgovor u želucu i imaju veći rizik od razvoja peptičnih čireva ili karcinoma želuca nego oni zaraženi sojevima kojima nedostaje ostrvo.[23] Nakon vezivanja H. pylori na epitelne ćelije želuca, tip IV sistema lučenja izražen preko cag PAI "ubrizgava" agens koji izaziva upalu, peptidoglikan, od svojih ćelijskih zidova u epitelne ćelije. Citoplazmični receptor za prepoznavanje uzorka (imuni senzor) Nod1 prepoznaje ubrizgani peptidoglikan, što onda stimuliše izražavanje citokina koji promoviraju upalu.[70]
Dijagnoza
[uredi | uredi izvor]
Kolonizacija H. pylori nije bolest sama po sebi, nego stanje povezano s više poremećaja gornjeg gastrointestinalnog trakta.[23] Testiranje na H. pylori nije rutinski preporučljivo.[23] Testiranje se preporučuje ako su prisutni čir na želucu ili slabiji želučani MALT limfom (MALToma), nakon endoskopske resekcije ranog raka želuca, za srodnike prvog stepena s rakom želuca, kao i u određenim slučajevima dispepsije.[71] Postoji nekoliko metoda testiranja, koje se dijele na neinvazivne i invazivne testne metode.
Neinvazivni testovi na H. pylori infekciju mogu biti podesni i uključuju testove krvnih antitijela, antigen testa stolice ili test daha ugljične uree (u kojoj pacijent popije 14C – ili 13C ureu, koju bakterija metabolizira, proizvodeći označeni ugljik-dioksid koji se može otkriti u dahu).[71][72] Nije poznato koji je neinvazivni test precizniji za dijagnosticiranje infekcije s H. pylori, pa klinički značaj rezultata dobijenih ovim testovima nije jasan.[72]
Endoskopska biopsija je invazivni način za testiranje na infekciju H. pylori. Infekcije niskog nivoa mogu biti promašene biopsijom, tako da se preporučuje uzimanje više uzoraka. Najpreciznija metoda za otkrivanje infekcije sa H. pylori jeste histološko ispitivanje na dvije lokacije nakon endoskopske biopsije, kombinirano sa brzim testom na ureazu ili mikrobnu kulturu.[73]
Prenošenje
[uredi | uredi izvor]Helicobacter pylori je zarazna bakterija, mada tačan put prenosa nije poznat.[74][75] Prenos s osobe na osobu je najvjerovatnije preko oralno-oralne ili fekalno-oralne rute. U skladu s ovim rutama prenosa, bakterija je izolirana iz fekalija, pljuvačke i zubnog kamenca nekih zaraženih osoba. Nalazi ukazuju na to da se H. pylori lakše prenosi preko sluznice želuca nego preko pljuvačke.[6] Prenos se dešava uglavnom unutar porodica u razvijenim zemljama, ali se mogu zadobiti u društvu u zemljama u razvoju.[76] H. pylori se također može oralno prenijeti gutanjem otpadnih voda s fekalnom materijom, tako da higijenska okolina može smanjiti rizik infekcije od H. pylori.[6]
Prevencija
[uredi | uredi izvor]Zbog uloge H. pylori kao velikog uzročnika određenih bolesti (posebno karcinoma) i njene povećane otpornosti na antibiotike, postoji jasna potreba za novim terapeutskim strategijama radi prevencije ili uklanjanja bakterije koja kolonizira ljude.[77] Dosta rada je uloženo na razvoj održive vakcine s ciljem omogućivanja alternativne strategije za kontrolu infekcije H. pylori i ostalih bolesti.[78] Istraživači istražuju različite pomoćnike (katalizatore), antigene i rute imunizacije da se utvrdi najprikladniji sistem imunološke zaštite; ipak, većina istraživanja je tek nedavno prešla sa testiranja životinja na testiranje ljudi.[79] Ekonomska evaluacija korištenja potencijalne vakcine za H. pylori kod beba našla je da bi uvođenje vakcina bilo, barem u Holandiji, isplativo rješenje za prevenciju peptičnih čireva i stomačnih adenokarcinoma.[80] Sličan pristup također je proučavan u SAD.[81] Bez obzira na ovaj dokaz o konceptu (npr. vakcinacija štiti djecu od zaraze sa H. pylori), krajem 2019. nije bilo naprednih kandidata vakcine te je vakcina tek u prvoj fazi kliničkog ispitivanja. Nadalje, razvoj vakcine protiv H. pylori nije bio trenutni prioritet velikih farmaceutskih kompanija.[82]
Mnoge istrage su pokušale spriječiti razvoj bolesti povezanih s Helicobacter pylori iskorijenjivanjem bakterije tokom ranih faza njene zaraze korištenjem antibiotika. Studije su našle da takvi tretmani, ako efektivno iskorijene H. pylori iz želuca, smanjuju upalu i neke od histopatoloških abnormalnosti povezanih sa zarazom. Ipak se studije ne slažu oko mogućnosti ovih tretmana da ublaže ozbiljnije histopatološke abnormalnosti kod infekcija s H. pylori, npr. atrofija želuca i metaplazija, od kojih su oboje prethodnici želučanom adenokarcinomu.[83] Postoji slično neslaganje oko mogućnosti antibiotskih tretmana za prevenciju želučanog adenokarcinoma. Meta-analiza (npr. statistička analiza koja kombinira rezultate višestrukih nasumičnih kontroliranih ispitivanja) objavljena 2014. godine našla je da ovi tretmani nisu spriječili razvoj ovog adenokarcinoma.[84] Ipak, dvije naknadne prospektivne kohortne studije provedene na visokorizičnim osobama iz Kine i Tajvana našle su da iskorijenjivanje bakterije daje značajno smanjenje u broju osoba koje razviju bolest. Ovi rezultati se slažu s retrospektivnom kohortnom studijom urađenom u Japanu i objavljenom 2016. godine[14] kao i meta-analiza, isto objavljena 2016. godine, od 24 studije provedene na osobama sa različitim rizikom od razvoja bolesti.[85] Novije studije sugeriraju da iskorijenjivanje H. pylori infekcije smanjuje pojavu želučanih adenokarcinoma povezanih s H. pylori kod osoba sa bilo kojim nivoima baznog rizika.[85] Dalje studije su neophodne za razjašnjenje ovog problema. U svakom slučaju, studije se slažu da antibiotski režimi efektivno smanjuju pojavu metahronog želučanog karcinoma povezanog s H. pylori.[83] (Metahroni karcinomi su karcinomi koji se ponovo pojavljuju 6 mjeseci ili kasnije nakon resekcije (operacije) početnog karcinoma.) Sugeriše se da antibiotski režim može biti korišten nakon resekcije želučanog karcinoma uzrokovanog s H. pylori u cilju smanjenja metahrone ponovne pojave.[86]
Tretman
[uredi | uredi izvor]Gastritis
[uredi | uredi izvor]Akutni ili hronični površinski gastritis je najčešća manifestacija infekcije od H. pylori. Pokazalo se da znakovi i simptomi ovog gastritisa spontano nestanu kod dosta osoba bez pribjegavanja protokolima za iskorjenjivanje Helicobacter pylori. U ovih slučajeva, bakterijska infekcija H. pylori ostaje i nakon remisije. Za iskorjenjivanje bakterije koriste se različiti antibiotici zajedno sa inhibitorom protonske pumpe, što dovodi do izliječenja,[84] što je obično "trojna terapija" koja se sastoji od klaritromicina, amoksicilina, te inhibitora protonske pumpe u trajanju 14–21 dan (2–3 sedmice), što se često smatra tretmanom prve linije.[87]
Peptični čirevi
[uredi | uredi izvor]Kada se ustanovi postojanje H. pylori kod osobe sa peptičnim ulkusom, standardna procedura je iskorijenjivanje bakterije, što omogućuje zaliječenje čira. Standardna terapija prve linije jeste jednosedmična "trojna terapija" koja se sastoji od inhibitora protonske pumpe (IPP) poput omeprazola i antibiotika klaritromicina i amoksicilina.[88] (Dejstvo IPP-a protiv H. pylori može se označiti kao direktan bakteriostatski efekt zbog inhibicije bakterijske P-tip ATPaze i/ili ureaze.[20]) Vremenom su se razvile varijante trojne terapije, poput različite vrste IPP-a, kao što je pantoprazol ili rabeprazol, kao i zamjena amoksicilina sa metronidazolom za osobe alergične na penicilin.[89] U područjima s povećanom otpornošću bakterije na klaritromicin preporučljive su druge opcije.[90] Ova terapija je revolucionizirala tretman peptičnih čireva i omogućila liječenje bolesti. Prethodno, jedina opcija bila je kontrola simptoma korištenjem antacida H2-antagonista ili samog inhibitora protonske pumpe.[91][92]
Otpornost na antibiotike
[uredi | uredi izvor]Rastući broj zaraženih pacijenata ima bakteriju otpornu na antibiotike. Ovo je dovelo do toga da prvobitni tretman ne uspije te zahtijeva nekoliko serija antibiotskih terapija ili alternativnih strategija, kao što je četverostruka terapija, koja dodaje bizmutov koloid, kao što je bizmut-subsalicilat.[71][93][94] Za tretman sojeva H. pylori otpornih na klaritromicin, preporučuje se korištenje levofloksacina kao jednog dijela terapije.[95][96]
Unos bakterija mliječne kiseline vrši supresivni efekat na infekciju s H. pylori kod životinja i ljudi, te suplementi jogurtoma sa laktobacilima i bifidobakterijama povećali su stopu iskorijenivanja H. pylori kod ljudi.[97] Simbiotske bakterije koje proizvode butirat, koje su obično prisutne u crijevima, ponekad se koriste kao probiotici koji pomažu zaustavljanje infekcija H. pylori kao dodatak antibiotskoj terapiji.[98] Buterna kiselina sama po sebi ima antimikrobe koji uništavaju ćelijski omotač H. pylori induciranjem izražaja regulatorne T-ćelije (posebno, FOXP3) i sintezu antimikrobskih peptida koji se zovu LL-37, koji nastaju njenim djelovanjem inhibitora histonske deacetilaze.[a][100][101]
Sulforafan, tvar koja se pojavljuje u brokulama i karfiolu, predložena je kao tretman.[102][103][104] Parodontalna terapija skaliranja i planiranja korijena također je predložena kao dodatni tretman.[105]
Rak
[uredi | uredi izvor]Ekstranodalni limfom B-ćelije rubne zone
[uredi | uredi izvor]Ekstranodalni limfomi B-ćelije rubne zone (poznati kao MALT limfomi) su generalno indolentni maligniteti. Preporučen tretman za H. pylori-pozitivne ekstranodalnog limfoma marginalne zone B-ćelija želuca, kada je lokaliziran (npr. Ann Arbor stage I i II), sastoji se od primjene režima kombinacije antibiotik-IPP koji obuhvataju režime iskorijenjivanja bakterije. Ako početni režim ne uspije iskorijeniti patogena, pacijenti se tretiraju alternativnim protokolima. Iskorijenjivanje patogena je uspješno u 70–95% slučajeva.[106] Otprilike 50-80% pacijenata koji uspiju iskorijeniti patogena nakon 3–28 mjeseci razviju remisiju i dugotrajnu kliničku kontrolu njihovog limfoma. Radijacijska terapija za želudac i okolne (npr. perigastrične) limfne čvorove također se uspješno koristi za ovakve lokalizirane slučajeve. Pacijenti sa nelokaliziranim (npr. sistematski Ann Arbor faza III i IV) bolestima koje su bez simptoma pažljivo se promatraju, a ako su simptomatski, tretiraju se imunoterapiskim tabletama, rituximabom, (koji se uzima 4 sedmice) zajedno sa hemoterapijom, kloroambucilom, u trajanju od 6–12 mjeseci; 58% ovih pacijenata dostignu 58% stopu preživljavanja bez progresije bolesti za 5 godina. Pacijenti faze III/IV se uspješno liječe sa rituximabom ili samom hemoterapijom, kao što je ciklofosfamid.[107] Samo su se rijetki H. pylori pozitivni slučajevi ekstranodalnog limfoma marginalne zone B-ćelije debelog crijeva uspješno liječili režimom antibiotik-inhibitor protonske pumpe; trenutno preporučeni tretmani za ovu bolest jesu operativna resekcija, endoskopska resekcija, radijacija, hemoterapija, ili, odnedavno, rituximab.[11] U nekoliko prijavljenih H. pylori pozitivnih slučajeva ekstranodalni limfom rubne zone B-ćelije jednjaka, lokalizirana bolest se uspješno tretira režimom antibiotik-IPP; ipak, uznapredovala bolest je manje responzivna na ove režime, ali djelimično je responzivna na rituximab.[35] Terapija sa antibioticima i inhibitorom protonske pumpe i lokaliziranom radijacijom se uspješno koriste za tretiranje H. pylori pozitivnog ekstranodalnog limfoma rubne zone B-ćelije rektuma; mada je radijacijska terapija dala malo bolje rezultate te se tako preporučuje kao preferirani tretman za bolest.[34] Tretman lokaliziranog H. pylori pozitivnog ekstranodalnog limfoma rubne zone B-ćelije očnih adneksa sa režimom antibiotika i inhibitora protonske pumpe postigao je dvogodišnju i petogodišnju stopu preživljavanja bez greške od 67%, odnosno 55%, a petogodišnju stopu bez napredovanja bolesti od 61%.[36] Ipak, generalno prepoznat izabrani tretman za pacijente sa sistemskim uključivanjem koristi razne hemoterapijske medikamente često u kominaciji sa rituximabom.[108]
Difuzni veliki B-ćelijski limfom
[uredi | uredi izvor]Difuzni veliki B-ćelijski limfom je daleko agresivniji karcinom u odnosu na ekstranodularni limfom marginalne zone B-ćelija. Uzroci ovog maligniteta koji su H. pylori pozitivni mogu se izvesti iz drugog navedenog limfoma[109] i manje su agresivni kao i podložniji liječenju u odnosu na H. pylori negativne slučajeve.[110][111] Nekoliko novijih studija snažno predlaže da se u ranoj fazi, lokalizirani, Helicobacter pylori pozitivni difuzni veliki limfom B-ćelija, kada je ograničen na želudac, može uspješno tretirati antibiotik-IPP režimom.[12][110][111][112] Ipak, ove studije se također slažu da se pacijenti koji se tretiraju jednim od tretmana za iskorijenjivanje H. pylori moraju dodatno pratiti, s obzirom na agresivnost difuznog velikog B-ćelijskog limfoma. Ako se nađe neresponzivnost ili kliničko pogoršanje na tim režimima, ovim pacijenti se prebacuju na konvencijalnije terapije kao što je hemoterapija (npr. CHOP ili tretman sličan CHOP-u), imunoterapija (npr. rituximab), operativni zahvat, i/ili lokalna radioterapija.[110] H. pylori pozitivni difuzni veliki B-ćelijski limfom uspješno se tretira sa jednom ili kombinacijom navedenih metoda.[111]
Adenokarcinom želuca
[uredi | uredi izvor]Helicobacter pylori je povezana sa većinom slučajeva adekarcinoma želuca, posebno oni koji se nalaze van želučanog kardija (spoj jednjaka i želuca).[14] Tretman ovog karcinoma je jako agresivan čak i sad lokaliziranom bolesti koja se naknadno tretira sa hemoterapijom i radijacijom prije operativne resekcije.[113] Pošto je ovaj karcinom, jednom kada se razvije, nezavisan od zaraze s H. pylori, režim s antibioticima i inhibitorom protonske pumpe ne koristi se u ovom tretmanu.[14]
Prognoza
[uredi | uredi izvor]Helicobacter pylori kolonizira želudac i izaziva hronični gastritis, tj. dugotrajno zapaljenje želuca. Bakterija kod većine osoba opstaje u stomaku decenijama. Većina osoba zaraženih sa H. pylori nikad ne osjeti kliničke simptome, iako imaju hronični gastritis. Oko 10–20% osoba koje imaju H. pylori vremenom razviju želučane i duodenalne čireve.[23] H. pylori infekcija također je povezana sa 1–2% rizika tokom života od raka želuca i manje od 1% rizika od želučanog MALT limfoma.[23]
Uveliko se smatra da neliječena infekcija sa H. pylori ostaje čitav život jednom kad se uspostavi u želucu.[6] Kod starijih, ipak, infekcija može nestati jer želučana sluznica postaje uveliko atrofična i negostoljubiva za kolonizaciju. Proporcija akutnih infekcija koje opstaju nije poznat, ali nekoliko istraživanja koji su pratili prirodnu historiju kod stanovništva prijavilo je očiglednu spontanu eliminaciju.[114][115]
Sve više dokaza sugerira da H. pylori ima važnu ulogu u zaštiti od nekih bolesti.[116] Učestalost refluksne kiseline, Barrettovog ezofagusa i raka jednjaka dramatično se povećala sa istovremenim smanjenjem prisustva H. pylori.[117] Godine 1996, Martin J. Blaser je iznio hipotezu da H. pylori ima koristan efekat regulisanjem kiselosti sadržaja želuca.[67][117] Ova hipoteza nije univerzalno prihvaćena jer nasumična kontrolirana ispitivanja nisu uspjela pokazati pogoršanje simptoma bolesti refluksne kiseline prateći iskorjenjivanje H. pylori.[118][119] Ipak, Blaser je potvrdio svoj stav da je H. pylori član normalne flore želuca.[13] Pretpostavio je da su promjene u fiziologiji želuca uzrokovane gubitkom H. pylori doprinijele porastu javljanja nekoliko bolesti, poput dijabetesa tipa 2, pretilosti i astme.[13][120] Njegova grupa je nedavno pokazala da je kolonizacija H. pylori povezana s nižom učestalošću dječije astme.[121]
Epidemiologija
[uredi | uredi izvor]Najmanje pola svjetske populacije je zaraženo bakterijom, što je čini najrasprostranjenijom infekcijom u svijetu.[122] Trenutna stopa zaraze varira zavisno od lokacije; gdje zemlje u razvoju imaju mnogo veću stopu zaraze u odnosu na Zapad (Zapadna Evropa, Sjeverna Amerika, Australazija), gdje su procijenjene stope oko 25%.[122]
Smatra se da dob pri kojoj neko zadobije ovu bakteriju utiče na patološki ishod infekcije. Osobe zaražene u ranoj dobi imaju veće šanse razviti jače upale koje mogu biti praćene atrofičnim gastritisom sa većim naknadnim rizikom od želučanog čira, želučanog raka, ili oboje. Sticanje infekcije u starijoj dobi dovodi do različitih želučanih promjena koje veoma često dovode do dvanaestopalačnog (duodenalnog) čira.[6] Infekcije se često zadobijaju u ranom djetinjstvu u svim državama.[23] Ipak, stopa zaraze kod djece u zemalja u razvoju je veća nego u industrijaliziranim nacijama, vjerovatno zbog lošijih sanitarnih uslova, kombinirano sa slabijom primjenom antibiotika za nevezane patologije. U razvijenim zemljama, trenutno je rijetko moguće pronaći zaraženo dijete, ali procenat zaraženih osoba povećava se sa godinama, sa oko 50% zaraženih osoba dobi preko 60 godina u odnosu na 10% kod osoba između 18 i 30 godina.[122] Veća prevalencija kod starijih odražava veće stope infekcije u prošlosti kada su te osobe bile djeca prije nego se desila infekcija u kasnijoj dobi tih osoba.[23] U Sjedinjenim Državama, rasprostranjenost zaraze je veća kod afroameričkog i hispanoameričkog stanovništva, najviše zbog socioekonomskih faktora.[123][124] Niža stopa infekcije na Zapadu je uglavnom zbog većeg higijenskog standarda i raširene upotrebe antibiotika. Bez obzira na infekciju u određenim dijelovima svijeta, opća učestalost infekcije H. pylori se smanjuje.[125] Ipak, otpornost na antibiotike se pojavljuje kod H. pylori; pronađeno je više sojeva otpornih na metronidazol i klaritromicin u više dijelova svijeta.[126]
Historija
[uredi | uredi izvor]Helicobacter pylori je migrirala iz Afrike zajedno sa njenim ljudskim nosiocem (domaćinom) približno prije 60.000 godina.[127] Nedavna istraživanja tvrde da se genetička raznolikost kod H. pylori, poput one u domaćina, smanjuje sa fizičkom udaljenošću od istočne Afrike. Korištenjem podataka genetične raznolikosti, istraživači su napravili simulacije koje pokazuju da se bakterija raširila iz istočne Afrike prije oko 58.000 godina. Njihovi rezultati pokazuju da su savremeni ljudi već bili zaraženi sa H. pylori prije njihove migracije iz Afrike, te da je bakterija ostala povezana sa ljudskim nosiocima od tog vremena.[128]
H. pylori je prvi put otkrivena u stomaku pacijenata sa gastritisom i čirevima 1982. godine, a otkrili su je doktori Barry Marshall i Robin Warren u Perthu, Zapadna Australija. U to vrijeme, konvencionalno razmišljanje bilo je da bakterija može živjeti u kiseloj okolini ljudskog želuca. Zbog njihovog otkrića, Marshall i Warren su 2005. godine dobili Nobelovu nagradu za fiziologiju ili medicinu.[129]
Prije istraživanja Marshalla i Warrena, njemački naučnici našli su bakteriju spiralnog oblika u sluznici ljudskog želuca 1875. godine, ali nisu bili u mogućnosti uzgojiti je, te su rezultati na kraju zaboravljeni.[117] Italijanski istraživač Giulio Bizzozero opisao je bakterije sličnog oblika koje žive u kiseloj okolini želuca kod pasa 1893. godine.[130] Profesor Walery Jaworski sa Jagelonskog univerziteta u Krakówu ispitivao je sedimente želuca koji su uzeti ispiranjem želuca kod ljudi 1899. godine. Među nekim štapičastim bakterijama, on je također našao bakteriju sa karakterističnim spiralnim oblikom, koje je zvao Vibrio rugula. On je bio prvi koji je sugerisao na moguću ulogu ovog organizma u patogenezi želučanih bolesti. Njegov rad je uvršten u knjizi Handbook of Gastric Diseases, ali je imao mali uticaj, jer je bio napisan na poljskom jeziku.[131] Nekoliko manjih studija izvršenih u ranom 20. vijeku pokazalo je prisustvo zakrivljenih štapića u želucu kod više osoba sa čirem ili rakom na želucu.[132] Interes za bakterijom je opadao, jer američka studija objavljena 1954. godine nije uspjela vidjeti bakteriju kod 1180 slučajeva želučane biopsije.[133]
Interes za razumijevanjem uloge bakterije kod stomačnih bolesti nastavljena je u 1970-im, sa vizualizacijom bakterija u želucu kod osoba sa stomačnim čirevima.[134] Bakteriju je također posmatrao 1979. godine Robin Warren, koji ju je istražio dalje sa Barryjem Marshallom 1981. godine. Nakon neuspješnih pokušaja u uzgoju bakterije iz želuca, oni su konačno uspjeli vizualizirati kolonije 1982. godine, kada su nenamjerno ostavili Petrijeve zdjelice na inkubaciji pet dana tokom uskršnjeg vikenda. U njihovim originalnim dokumentima, Warren i Marshall su tvrdili da stomačne čireve i gastritis uzrokuje bakterijska infekcija, a ne stres ili začinjena hrana, kako se ranije pretpostavljalo.[8]
Sprva je izražen skepticizam, ali nekoliko godina kasnije više istraživačkih grupa je verificiralo povezanost H. pylori sa gastritisom i, u manjem omjeru, čirom.[135] Za dokaz da H. pylori uzrokuje gastritis i da nije samo slučajni prolaznik, Marshall je popio čašu sa kulturom H. pylori. Obolio je sa mučninom i povraćanjem nekoliko dana kasnije. Endoskopija 10 dana nakon inokulacije pokazala je znakove gastritisa i prisustvo H. pylori. Ovi rezultati su sugerisali da je H. pylori uzročnik. Marshall i Warren su nastavili pokazivati da su antibiotici učinkoviti u liječenju više slučajeva gastritisa. 1987. godine, sidnejski gastroenterolog Thomas Borody izumio je prvu trojnu terapiju za liječenje duodenalnih čireva.[136] 1994. godine, Nacionalni instituti za zdravlje navode da su najčešći čirevi dvanaesnika i želuca bili uzrokovani infekcijom H. pylori, te su preporučili uključivanje antibiotika u tretman.[137]
Bakterija je sprva nazivana Campylobacter pyloridis, a zatim preimenovana u C. pylori 1987. godine (pylori je genitiv od pylorus, kružni otvor koji vodi želudac u dvanaesnik, od starogrčke riječi πυλωρός (pilorus), što znači vratar.[138]).[139] Kada su 16S ribosomska RNK, sekvenciranje gena i ostala istraživanja pokazala 1989. godine da bakterija ne pripada rodu Campylobacter, bakterija je prebačena u svoj rod, Helicobacter, od starogrčke riječi έλιξ (heliks) što znači "spirala" ili "kalem".[138][140]
U oktobru 1987, grupa stručnjaka sastala se u Kopenhagenu radi osnivanja Evropske Helicobacter studijske grupe (EHSG), međunarodne multidisciplinarne istraživačke grupe i jedine institucije fokusirane na H. pylori.[141] Grupa je uključena u Godišnju međunarodnu radionicu za Helikobakteriju i slične bakterije,[142] Izvještaje iz Maastrichtskog konsenzusa (Evropski konsenzus za upravljanje H. pylori),[89][143][144][145] i ostale obrazovne i istraživačke grupe, uključujući dva međunarodna dugoročna projekta:
- Evropski registar za upravljanje sa H. pylori (Hp-EuReg) – baza podataka koja sistematski registrira rutinske kliničke prakse evropskih gastroenterologa.[146]
- Optimalno upravljanje s H. pylori u primarnoj njezi (OptiCare) – dugoročni obrazovni projekt koji cilja na širenje preporuka iz Maastrichta zasnovanim na dokazima IV konsenzusa za ljekare primarne njege u Evropi, koji finansira grant za obrazovanje iz United European Gastroenterology.[147][148]
Istraživanja
[uredi | uredi izvor]Rezultati in vitro studija sugeriraju da masne kiseline, uglavnom polinezasićene masne kiseline, imaju baktericidni efekat protiv H. pylori, ali njihovi in vivo efekti nisu dokazani.[149]
Napomene
[uredi | uredi izvor]- ^ Uspostavljanje veze između svjetlosne terapije, vitamina D i ekspresije humanog katelicidina LL-37 pruža potpuno drugačiji način liječenja infekcije. Umjesto liječenja pacijenata tradicionalnim antibioticima, liječnici će možda moći koristiti svjetlost ili vitamin D. Zaista, koristeći uskopojasnu UV B svjetlost, nivo vitamina D povećan je kod pacijenata sa psorijazom (psorijaza je česta autoimuna bolest na koži). Pored toga, drugi mali molekuli, poput butirata, mogu inducirati ekspresiju LL-37. Komponente tradicionalne kineske medicine mogu takođe regulirati izraz AMP. Ovi faktori mogu inducirati ekspresiju jednog peptida ili višestrukih AMP-a. Također je moguće da određeni faktori mogu zajedno raditi na indukovanju ekspresije AMP. Dok ciklični AMP i butirat sinergijski stimuliraju ekspresiju pilećeg β-defensina 9, 4-fenilbutirat (PBA) i 1,25-dihidroksivitamin D3 (ili laktoza) mogu sinergijski inducirati ekspresiju gena AMP. Čini se da stimulacija ekspresije LL-37 inhibitorima histon deacetilaze (HDAC) ovisi o ćelijama. Trihostatin i natrijum butirat povećali su ekspresiju peptida u ljudskim epitelnim ćelijama NCI-H292, ali ne i u primarnim kulturama normalnih epitelnih ćelija nosa. Međutim, indukcija ekspresije humanog LL-37 možda nije opći pristup za bakterijski klirens. Tokom infekcije Salmonella enterica makrofaga izvedenih iz ljudskih monocita, LL-37 nije niti indukovan niti potreban za bakterijski klirens.[99]
Table 3:[99] human antimicrobial peptides and their proposed targets.
Table 4:[99] Some known factors that induce antimicrobial peptide expression.
Reference
[uredi | uredi izvor]- ^ a b Butcher, Graham P. (2003). Gastroenterology: An illustrated colour text. Elsevier Health Sciences. str. 25. ISBN 978-0-443-06215-5.
- ^ a b c d e Helicobacter pylori – Chapter 3. wwwnc.cdc.gov (Report). Travelers' Health. 2016 Yellow Book. Center for Disease Control. 9. 6. 2015. Pristupljeno 25. 4. 2017.
- ^ a b Hooi JK, Lai WY, Ng WK, Suen MM, Underwood FE, Tanyingoh D, et al. (august 2017). "Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis". Gastroenterology. 153 (2): 420–429. doi:10.1053/j.gastro.2017.04.022. PMID 28456631.
- ^ a b Alfarouk KO, Bashir AH, Aljarbou AN, Ramadan AM, Muddathir AK, AlHoufie ST, et al. (22. 2. 2019). "Helicobacter pylori in Gastric Cancer and Its Management". Frontiers in Oncology. 9: 75. doi:10.3389/fonc.2019.00075. PMC 6395443. PMID 30854333.
- ^ Yamaoka, Yoshio (2008). Helicobacter pylori: Molecular Genetics and Cellular Biology. Caister Academic Press. ISBN 978-1-904455-31-8.
- ^ a b c d e Brown LM (2000). "Helicobacter pylori: epidemiology and routes of transmission". Epidemiologic Reviews. 22 (2): 283–97. doi:10.1093/oxfordjournals.epirev.a018040. PMID 11218379.
- ^ Warren JR, Marshall B (juni 1983). "Unidentified curved bacilli on gastric epithelium in active chronic gastritis". Lancet. 1 (8336): 1273–5. doi:10.1016/S0140-6736(83)92719-8. PMID 6134060.
- ^ a b Marshall BJ, Warren JR (juni 1984). "Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration". Lancet. 1 (8390): 1311–5. doi:10.1016/S0140-6736(84)91816-6. PMID 6145023.
- ^ Sweet, Melissa (2. 8. 1997). "Smug as a bug". The Sydney Morning Herald. Arhivirano s originala, 18. 7. 2014. Pristupljeno 28. 1. 2007.
- ^ a b Nocturne G, Pontarini E, Bombardieri M, Mariette X (mart 2019). "Lymphomas complicating primary Sjögren's syndrome: from autoimmunity to lymphoma". Rheumatology. Oxford, UK. doi:10.1093/rheumatology/kez052. PMID 30838413.
- ^ a b c d Abbas H, Niazi M, Makker J (maj 2017). "Mucosa-Associated Lymphoid Tissue (MALT) Lymphoma of the Colon: A Case Report and a Literature Review". The American Journal of Case Reports. 18: 491–497. doi:10.12659/AJCR.902843. PMC 5424574. PMID 28469125.
- ^ a b c Paydas S (april 2015). "Helicobacter pylori eradication in gastric diffuse large B cell lymphoma". World Journal of Gastroenterology. 21 (13): 3773–6. doi:10.3748/wjg.v21.i13.3773. PMC 4385524. PMID 25852262.
- ^ a b c d Blaser MJ (oktobar 2006). "Who are we? Indigenous microbes and the ecology of human diseases". EMBO Reports. 7 (10): 956–60. doi:10.1038/sj.embor.7400812. PMC 1618379. PMID 17016449.
- ^ a b c d e f Laird-Fick HS, Saini S, Hillard JR (august 2016). "Gastric adenocarcinoma: the role of Helicobacter pylori in pathogenesis and prevention efforts". Postgraduate Medical Journal. 92 (1090): 471–7. doi:10.1136/postgradmedj-2016-133997. PMID 27222587.
- ^ a b c Bravo D, Hoare A, Soto C, Valenzuela MA, Quest AF (juli 2018). "Helicobacter pylori in human health and disease: Mechanisms for local gastric and systemic effects". World Journal of Gastroenterology. 24 (28): 3071–3089. doi:10.3748/wjg.v24.i28.3071. PMC 6064966. PMID 30065554.
- ^ a b c Gravina AG, Zagari RM, De Musis C, Romano L, Loguercio C, Romano M (august 2018). "Helicobacter pylori and extragastric diseases: A review". World Journal of Gastroenterology (Review). 24 (29): 3204–3221. doi:10.3748/wjg.v24.i29.3204. PMC 6079286. PMID 30090002.
- ^ Salama NR, Hartung ML, Müller A (juni 2013). "Life in the human stomach: persistence strategies of the bacterial pathogen Helicobacter pylori". Nature Reviews. Microbiology. 11 (6): 385–99. doi:10.1038/nrmicro3016. PMC 3733401. PMID 23652324.
- ^ a b Blaser M (august 2011). "Antibiotic overuse: Stop the killing of beneficial bacteria". Nature. 476 (7361): 393–4. Bibcode:2011Natur.476..393B. doi:10.1038/476393a. PMID 21866137.
- ^ a b Ackerman J (juni 2012). "The ultimate social network". Scientific American. Vol. 306 no. 6. str. 36–43. doi:10.1038/scientificamerican0612-36. PMID 22649992.
- ^ a b Minalyan A, Gabrielyan L, Scott D, Jacobs J, Pisegna JR (august 2017). "The Gastric and Intestinal Microbiome: Role of Proton Pump Inhibitors". Current Gastroenterology Reports. 19 (8): 42. doi:10.1007/s11894-017-0577-6. PMC 5621514. PMID 28733944.
- ^ Bytzer P, Dahlerup JF, Eriksen JR, Jarbøl DE, Rosenstock S, Wildt S (april 2011). "Diagnosis and treatment of Helicobacter pylori infection". Danish Medical Bulletin. 58 (4): C4271. PMID 21466771. Arhivirano s originala, 5. 1. 2014.
- ^ a b Chang AH, Parsonnet J (oktobar 2010). "Role of bacteria in oncogenesis". Clinical Microbiology Reviews. 23 (4): 837–57. doi:10.1128/CMR.00012-10. PMC 2952975. PMID 20930075.
- ^ a b c d e f g h i j k l m Kusters JG, van Vliet AH, Kuipers EJ (juli 2006). "Pathogenesis of Helicobacter pylori infection". Clinical Microbiology Reviews. 19 (3): 449–90. doi:10.1128/CMR.00054-05. PMC 1539101. PMID 16847081.
- ^ Butcher 2003, str. 24–5
- ^ Ryan, Kenneth (2010). Sherris Medical Microbiology. McGraw-Hill. str. 573, 576. ISBN 978-0-07-160402-4.
- ^ a b Suerbaum S, Michetti P (oktobar 2002). "Helicobacter pylori infection". The New England Journal of Medicine. 347 (15): 1175–86. CiteSeerX 10.1.1.572.9262. doi:10.1056/NEJMra020542. PMID 12374879.
- ^ Wagner AD, Syn NL, Moehler M, Grothe W, Yong WP, Tai BC, et al. (august 2017). "Chemotherapy for advanced gastric cancer". The Cochrane Database of Systematic Reviews. 8: CD004064. doi:10.1002/14651858.cd004064.pub4. PMC 6483552. PMID 28850174.
- ^ Wu Q, Yang ZP, Xu P, Gao LC, Fan DM (juli 2013). "Association between Helicobacter pylori infection and the risk of colorectal neoplasia: a systematic review and meta-analysis". Colorectal Disease. 15 (7): e352-64. doi:10.1111/codi.12284. PMID 23672575.
- ^ "Helicobacter pylori" (PDF). cdc.gov. Center for Disease Control. Pristupljeno 7. 10. 2017.
- ^ a b Markowski AR, Markowska A, Guzinska-Ustymowicz K (oktobar 2016). "Pathophysiological and clinical aspects of gastric hyperplastic polyps". World Journal of Gastroenterology. 22 (40): 8883–8891. doi:10.3748/wjg.v22.i40.8883. PMC 5083793. PMID 27833379.
- ^ Soetikno RM, Kaltenbach T, Rouse RV, Park W, Maheshwari A, Sato T, et al. (mart 2008). "Prevalence of nonpolypoid (flat and depressed) colorectal neoplasms in asymptomatic and symptomatic adults". JAMA. 299 (9): 1027–35. doi:10.1001/jama.299.9.1027. PMID 18319413.
- ^ Schreuder MI, van den Brand M, Hebeda KM, Groenen PJ, van Krieken JH, Scheijen B (decembar 2017). "Novel developments in the pathogenesis and diagnosis of extranodal marginal zone lymphoma". Journal of Hematopathology. 10 (3–4): 91–107. doi:10.1007/s12308-017-0302-2. PMC 5712330. PMID 29225710.
- ^ a b Smedby KE, Ponzoni M (novembar 2017). "The aetiology of B-cell lymphoid malignancies with a focus on chronic inflammation and infections". Journal of Internal Medicine. 282 (5): 360–370. doi:10.1111/joim.12684. PMID 28875507.
- ^ a b Kobayashi T, Takahashi N, Hagiwara Y, Tamaru J, Kayano H, Jin-nai I, et al. (januar 2008). "Successful radiotherapy in a patient with primary rectal mucosa-associated lymphoid tissue lymphoma without the API2-MALT1 fusion gene: a case report and review of the literature". Leukemia Research. 32 (1): 173–5. doi:10.1016/j.leukres.2007.04.017. PMID 17570523.
- ^ a b Ma Q, Zhang C, Fang S, Zhong P, Zhu X, Lin L, Xiao H (mart 2017). "Primary esophageal mucosa-associated lymphoid tissue lymphoma: A case report and review of literature". Medicine. 96 (13): e6478. doi:10.1097/MD.0000000000006478. PMC 5380272. PMID 28353588.
- ^ a b Guffey Johnson J, Terpak LA, Margo CE, Setoodeh R (april 2016). "Extranodal Marginal Zone B-cell Lymphoma of the Ocular Adnexa". Cancer Control. 23 (2): 140–9. doi:10.1177/107327481602300208. PMID 27218791.
- ^ Saccà SC, Vagge A, Pulliero A, Izzotti A (decembar 2014). "Helicobacter pylori infection and eye diseases: a systematic review". Medicine. 93 (28): e216. doi:10.1097/md.0000000000000216. PMC 4603085. PMID 25526440.
- ^ Stark RM, Gerwig GJ, Pitman RS, Potts LF, Williams NA, Greenman J, et al. (februar 1999). "Biofilm formation by Helicobacter pylori". Letters in Applied Microbiology. 28 (2): 121–6. doi:10.1046/j.1365-2672.1999.00481.x. PMID 10063642.
- ^ Chan WY, Hui PK, Leung KM, Chow J, Kwok F, Ng CS (oktobar 1994). "Coccoid forms of Helicobacter pylori in the human stomach". American Journal of Clinical Pathology. 102 (4): 503–7. doi:10.1093/ajcp/102.4.503. PMID 7524304.
- ^ Josenhans C, Eaton KA, Thevenot T, Suerbaum S (august 2000). "Switching of flagellar motility in Helicobacter pylori by reversible length variation of a short homopolymeric sequence repeat in fliP, a gene encoding a basal body protein". Infection and Immunity. 68 (8): 4598–603. doi:10.1128/IAI.68.8.4598-4603.2000. PMC 98385. PMID 10899861.
- ^ Rust M, Schweinitzer T, Josenhans C (2008). "Helicobacter Flagella, Motility and Chemotaxis". u Yamaoka, Y. (ured.). Helicobacter pylori: Molecular Genetics and Cellular Biology. Caister Academic Press. ISBN 978-1-904455-31-8.
- ^ Olson JW, Maier RJ (novembar 2002). "Molecular hydrogen as an energy source for Helicobacter pylori". Science. 298 (5599): 1788–90. Bibcode:2002Sci...298.1788O. doi:10.1126/science.1077123. PMID 12459589.
- ^ Tomb JF, White O, Kerlavage AR, Clayton RA, Sutton GG, Fleischmann RD, et al. (august 1997). "The complete genome sequence of the gastric pathogen Helicobacter pylori". Nature. 388 (6642): 539–47. Bibcode:1997Natur.388..539T. doi:10.1038/41483. PMID 9252185.
- ^ "Genome information for the H. pylori 26695 and J99 strains". Institut Pasteur. 2002. Pristupljeno 1. 9. 2008.
- ^ "Helicobacter pylori 26695, complete genome". National Center for Biotechnology Information. Pristupljeno 1. 9. 2008.
- ^ "Helicobacter pylori J99, complete genome". National Center for Biotechnology Information. Pristupljeno 1. 9. 2008.
- ^ Oh JD, Kling-Bäckhed H, Giannakis M, Xu J, Fulton RS, Fulton LA, et al. (juni 2006). "The complete genome sequence of a chronic atrophic gastritis Helicobacter pylori strain: evolution during disease progression". Proceedings of the National Academy of Sciences of the United States of America. 103 (26): 9999–10004. Bibcode:2006PNAS..103.9999O. doi:10.1073/pnas.0603784103. PMC 1480403. PMID 16788065.
- ^ van Vliet AH (januar 2017). "Use of pan-genome analysis for the identification of lineage-specific genes of Helicobacter pylori". FEMS Microbiology Letters. 364 (2): fnw296. doi:10.1093/femsle/fnw296. PMID 28011701.
- ^ Uchiyama I, Albritton J, Fukuyo M, Kojima KK, Yahara K, Kobayashi I (9. 8. 2016). "A Novel Approach to Helicobacter pylori Pan-Genome Analysis for Identification of Genomic Islands". PLOS ONE. 11 (8): e0159419. Bibcode:2016PLoSO..1159419U. doi:10.1371/journal.pone.0159419. PMC 4978471. PMID 27504980.
- ^ a b c Sharma CM, Hoffmann S, Darfeuille F, Reignier J, Findeiss S, Sittka A, et al. (mart 2010). "The primary transcriptome of the major human pathogen Helicobacter pylori". Nature. 464 (7286): 250–5. Bibcode:2010Natur.464..250S. doi:10.1038/nature08756. PMID 20164839.
- ^ Baldwin DN, Shepherd B, Kraemer P, Hall MK, Sycuro LK, Pinto-Santini DM, Salama NR (februar 2007). "Identification of Helicobacter pylori genes that contribute to stomach colonization". Infection and Immunity. 75 (2): 1005–16. doi:10.1128/IAI.01176-06. PMC 1828534. PMID 17101654.
- ^ Amieva MR, El-Omar EM (januar 2008). "Host-bacterial interactions in Helicobacter pylori infection". Gastroenterology. 134 (1): 306–23. doi:10.1053/j.gastro.2007.11.009. PMID 18166359.
- ^ Schreiber S, Konradt M, Groll C, Scheid P, Hanauer G, Werling HO, et al. (april 2004). "The spatial orientation of Helicobacter pylori in the gastric mucus". Proceedings of the National Academy of Sciences of the United States of America. 101 (14): 5024–9. Bibcode:2004PNAS..101.5024S. doi:10.1073/pnas.0308386101. PMC 387367. PMID 15044704.
- ^ Petersen AM, Krogfelt KA (maj 2003). "Helicobacter pylori: an invading microorganism? A review". FEMS Immunology and Medical Microbiology (Review). 36 (3): 117–26. doi:10.1016/S0928-8244(03)00020-8. PMID 12738380.
- ^ Ilver D, Arnqvist A, Ogren J, Frick IM, Kersulyte D, Incecik ET, et al. (januar 1998). "Helicobacter pylori adhesin binding fucosylated histo-blood group antigens revealed by retagging". Science. 279 (5349): 373–7. Bibcode:1998Sci...279..373I. doi:10.1126/science.279.5349.373. PMID 9430586.
- ^ Bugaytsova JA, Björnham O, Chernov YA, Gideonsson P, Henriksson S, Mendez M, et al. (mart 2017). "Helicobacter pylori Adapts to Chronic Infection and Gastric Disease via pH-Responsive BabA-Mediated Adherence". Cell Host & Microbe. 21 (3): 376–389. doi:10.1016/j.chom.2017.02.013. PMC 5392239. PMID 28279347.
- ^ Mahdavi J, Sondén B, Hurtig M, Olfat FO, Forsberg L, Roche N, et al. (juli 2002). "Helicobacter pylori SabA adhesin in persistent infection and chronic inflammation". Science. 297 (5581): 573–8. Bibcode:2002Sci...297..573M. doi:10.1126/science.1069076. PMC 2570540. PMID 12142529.
- ^ Mobley HL (1. januar 2001). Mobley HL, Mendz GL, Hazell SL (ured.). Helicobacter pylori: Physiology and Genetics. Washington, DC: ASM Press. ISBN 978-1-55581-213-3. PMID 21290719.
- ^ Debowski AW, Walton SM, Chua EG, Tay AC, Liao T, Lamichhane B, et al. (juni 2017). "Helicobacter pylori gene silencing in vivo demonstrates urease is essential for chronic infection". PLOS Pathogens. 13 (6): e1006464. doi:10.1371/journal.ppat.1006464. PMC 5500380. PMID 28644872.
- ^ a b c d George G, Kombrabail M, Raninga N, Sau AK (mart 2017). "Arginase of Helicobacter Gastric Pathogens Uses a Unique Set of Non-catalytic Residues for Catalysis". Biophysical Journal. 112 (6): 1120–1134. Bibcode:2017BpJ...112.1120G. doi:10.1016/j.bpj.2017.02.009. PMC 5376119. PMID 28355540.
- ^ Smoot DT (decembar 1997). "How does Helicobacter pylori cause mucosal damage? Direct mechanisms". Gastroenterology. 113 (6 Suppl): S31-4, discussion S50. doi:10.1016/S0016-5085(97)80008-X. PMID 9394757.
- ^ Hatakeyama M, Higashi H (decembar 2005). "Helicobacter pylori CagA: a new paradigm for bacterial carcinogenesis". Cancer Science. 96 (12): 835–43. doi:10.1111/j.1349-7006.2005.00130.x. PMID 16367902. S2CID 5721063.
- ^ Dumrese C, Slomianka L, Ziegler U, Choi SS, Kalia A, Fulurija A, et al. (maj 2009). "The secreted Helicobacter cysteine-rich protein A causes adherence of human monocytes and differentiation into a macrophage-like phenotype". FEBS Letters. 583 (10): 1637–43. doi:10.1016/j.febslet.2009.04.027. PMC 2764743. PMID 19393649.
- ^ Sajib S, Zahra FT, Lionakis MS, German NA, Mikelis CM (februar 2018). "Mechanisms of angiogenesis in microbe-regulated inflammatory and neoplastic conditions". Angiogenesis. 21 (1): 1–14. doi:10.1007/s10456-017-9583-4. PMID 29110215. S2CID 3346742.
- ^ Shiotani A, Graham DY (novembar 2002). "Pathogenesis and therapy of gastric and duodenal ulcer disease". The Medical Clinics of North America. 86 (6): 1447–66, viii. CiteSeerX 10.1.1.550.8580. doi:10.1016/S0025-7125(02)00083-4. PMID 12510460.
- ^ Dixon MF (februar 2000). "Patterns of inflammation linked to ulcer disease". Bailliere's Best Practice & Research. Clinical Gastroenterology. 14 (1): 27–40. doi:10.1053/bega.1999.0057. PMID 10749087.
- ^ a b Blaser MJ, Atherton JC (februar 2004). "Helicobacter pylori persistence: biology and disease". The Journal of Clinical Investigation. 113 (3): 321–33. doi:10.1172/JCI20925. PMC 324548. PMID 14755326.
- ^ Schubert ML, Peura DA (juni 2008). "Control of gastric acid secretion in health and disease". Gastroenterology. 134 (7): 1842–60. doi:10.1053/j.gastro.2008.05.021. PMID 18474247. S2CID 206210451.
- ^ Peek RM, Crabtree JE (januar 2006). "Helicobacter infection and gastric neoplasia". The Journal of Pathology. 208 (2): 233–48. doi:10.1002/path.1868. PMID 16362989. S2CID 31718278.
- ^ Viala J, Chaput C, Boneca IG, Cardona A, Girardin SE, Moran AP, et al. (novembar 2004). "Nod1 responds to peptidoglycan delivered by the Helicobacter pylori cag pathogenicity island". Nature Immunology. 5 (11): 1166–74. doi:10.1038/ni1131. PMID 15489856. S2CID 2898805.
- ^ a b c Stenström B, Mendis A, Marshall B (august 2008). "Helicobacter pylori--the latest in diagnosis and treatment". Australian Family Physician. 37 (8): 608–12. PMID 18704207.
- ^ a b Best LM, Takwoingi Y, Siddique S, Selladurai A, Gandhi A, Low B, et al. (mart 2018). "Non-invasive diagnostic tests for Helicobacter pylori infection". The Cochrane Database of Systematic Reviews. 3: CD012080. doi:10.1002/14651858.CD012080.pub2. PMC 6513531. PMID 29543326.
- ^ Logan RP, Walker MM (oktobar 2001). "ABC of the upper gastrointestinal tract: Epidemiology and diagnosis of Helicobacter pylori infection". BMJ. 323 (7318): 920–2. doi:10.1136/bmj.323.7318.920. PMC 1121445. PMID 11668141.
- ^ Mégraud F (1995). "Transmission of Helicobacter pylori: faecal-oral versus oral-oral route". Alimentary Pharmacology & Therapeutics. 9 Suppl 2 (Suppl 2): 85–91. PMID 8547533.
- ^ Cave DR (maj 1996). "Transmission and epidemiology of Helicobacter pylori". The American Journal of Medicine. 100 (5A): 12S–17S, discussion 17S-18S. doi:10.1016/s0002-9343(96)80224-5. PMID 8644777.
- ^ Delport W, van der Merwe SW (2007). "The transmission of Helicobacter pylori: the effects of analysis method and study population on inference". Best Practice & Research. Clinical Gastroenterology. 21 (2): 215–36. doi:10.1016/j.bpg.2006.10.001. hdl:2263/4083. PMID 17382274.
- ^ Selgrad M, Malfertheiner P (oktobar 2008). "New strategies for Helicobacter pylori eradication". Current Opinion in Pharmacology. 8 (5): 593–7. doi:10.1016/j.coph.2008.04.010. PMID 18555746.
- ^ Blanchard TG, Nedrud JG (2010). "9. Helicobacter pylori Vaccines". u Sutton P, Mitchell H (ured.). Helicobacter pylori in the 21st Century. CABI. str. 167–189. ISBN 978-1-84593-594-8. Pristupljeno 7. 8. 2013.
- ^ Kabir S (april 2007). "The current status of Helicobacter pylori vaccines: a review". Helicobacter (Review). 12 (2): 89–102. doi:10.1111/j.1523-5378.2007.00478.x. PMID 17309745. S2CID 45104989.
- ^ de Vries R, Klok RM, Brouwers JR, Postma MJ (februar 2009). "Cost-effectiveness of a potential future Helicobacter pylori vaccine in the Netherlands: the impact of varying the discount rate for health". Vaccine. 27 (6): 846–52. doi:10.1016/j.vaccine.2008.11.081. PMID 19084566.
- ^ Rupnow MF, Chang AH, Shachter RD, Owens DK, Parsonnet J (oktobar 2009). "Cost-effectiveness of a potential prophylactic Helicobacter pylori vaccine in the United States". The Journal of Infectious Diseases. 200 (8): 1311–7. doi:10.1086/605845. PMID 19751153.
- ^ Sutton P, Boag JM (novembar 2019). "Status of vaccine research and development for Helicobacter pylori". Vaccine. 37 (50): 7295–7299. doi:10.1016/j.vaccine.2018.01.001. PMC 6892279. PMID 29627231.
- ^ a b Tsukamoto T, Nakagawa M, Kiriyama Y, Toyoda T, Cao X (august 2017). "Prevention of Gastric Cancer: Eradication of Helicobacter Pylori and Beyond". International Journal of Molecular Sciences. 18 (8): 1699. doi:10.3390/ijms18081699. PMC 5578089. PMID 28771198.
- ^ a b Burkitt MD, Duckworth CA, Williams JM, Pritchard DM (februar 2017). "Helicobacter pylori-induced gastric pathology: insights from in vivo and ex vivo models". Disease Models & Mechanisms. 10 (2): 89–104. doi:10.1242/dmm.027649. PMC 5312008. PMID 28151409.
- ^ a b Lee YC, Chiang TH, Chou CK, Tu YK, Liao WC, Wu MS, Graham DY (maj 2016). "Association Between Helicobacter pylori Eradication and Gastric Cancer Incidence: A Systematic Review and Meta-analysis". Gastroenterology. 150 (5): 1113–1124.e5. doi:10.1053/j.gastro.2016.01.028. PMID 26836587.
- ^ Li L, Yu C (2019). "Helicobacter pylori Infection following Endoscopic Resection of Early Gastric Cancer". BioMed Research International. 2019: 9824964. doi:10.1155/2019/9824964. PMC 6816031. PMID 31737682.
- ^ Azer, S. A.; Akhondi, H. (2019). "Gastritis". StatPearls. PMID 31334970.
- ^ Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon AT, Bazzoli F, et al. (European Helicobacter Study Group) (maj 2012). "Management of Helicobacter pylori infection--the Maastricht IV/ Florence Consensus Report". Gut. 61 (5): 646–64. doi:10.1136/gutjnl-2012-302084. PMID 22491499.
- ^ a b Malfertheiner P, Megraud F, O'Morain C, Bazzoli F, El-Omar E, Graham D, et al. (juni 2007). "Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report". Gut. 56 (6): 772–81. doi:10.1136/gut.2006.101634. PMC 1954853. PMID 17170018.
- ^ Malfertheiner P, Megraud F, O'Morain CA, Gisbert JP, Kuipers EJ, Axon AT, et al. (European Helicobacter and microbiota study group and consensus panel) (januar 2017). "Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report". Gut. 66 (1): 6–30. doi:10.1136/gutjnl-2016-312288. PMID 27707777.
- ^ Rauws EA, Tytgat GN (maj 1990). "Cure of duodenal ulcer associated with eradication of Helicobacter pylori". Lancet. 335 (8700): 1233–5. doi:10.1016/0140-6736(90)91301-P. PMID 1971318.
- ^ Graham DY, Lew GM, Evans DG, Evans DJ, Klein PD (august 1991). "Effect of triple therapy (antibiotics plus bismuth) on duodenal ulcer healing. A randomized controlled trial". Annals of Internal Medicine. 115 (4): 266–9. doi:10.7326/0003-4819-115-4-266. PMID 1854110.
- ^ Fischbach L, Evans EL (august 2007). "Meta-analysis: the effect of antibiotic resistance status on the efficacy of triple and quadruple first-line therapies for Helicobacter pylori". Alimentary Pharmacology & Therapeutics (Meta-analysis). 26 (3): 343–57. doi:10.1111/j.1365-2036.2007.03386.x. PMID 17635369.
- ^ Graham DY, Shiotani A (juni 2008). "New concepts of resistance in the treatment of Helicobacter pylori infections". Nature Clinical Practice. Gastroenterology & Hepatology. 5 (6): 321–31. doi:10.1038/ncpgasthep1138. PMC 2841357. PMID 18446147.
- ^ Perna F, Zullo A, Ricci C, Hassan C, Morini S, Vaira D (novembar 2007). "Levofloxacin-based triple therapy for Helicobacter pylori re-treatment: role of bacterial resistance". Digestive and Liver Disease. 39 (11): 1001–5. doi:10.1016/j.dld.2007.06.016. PMID 17889627.
- ^ Hsu PI, Wu DC, Chen A, Peng NJ, Tseng HH, Tsay FW, et al. (juni 2008). "Quadruple rescue therapy for Helicobacter pylori infection after two treatment failures". European Journal of Clinical Investigation. 38 (6): 404–9. doi:10.1111/j.1365-2362.2008.01951.x. PMID 18435764.
- ^ Wang KY, Li SN, Liu CS, Perng DS, Su YC, Wu DC, et al. (septembar 2004). "Effects of ingesting Lactobacillus- and Bifidobacterium-containing yogurt in subjects with colonized Helicobacter pylori". The American Journal of Clinical Nutrition. 80 (3): 737–41. doi:10.1093/ajcn/80.3.737. PMID 15321816.
- ^ Franceschi F, Cazzato A, Nista EC, Scarpellini E, Roccarina D, Gigante G, et al. (novembar 2007). "Role of probiotics in patients with Helicobacter pylori infection". Helicobacter. 12 Suppl 2 (Suppl 2): 59–63. doi:10.1111/j.1523-5378.2007.00565.x. PMID 17991178.
- ^ a b c Wang G (maj 2014). "Human antimicrobial peptides and proteins". Pharmaceuticals. 7 (5): 545–94. doi:10.3390/ph7050545. PMC 4035769. PMID 24828484.
- ^ Yonezawa H, Osaki T, Hanawa T, Kurata S, Zaman C, Woo TD, et al. (april 2012). "Destructive effects of butyrate on the cell envelope of Helicobacter pylori". Journal of Medical Microbiology. 61 (Pt 4): 582–589. doi:10.1099/jmm.0.039040-0. PMID 22194341.
- ^ McGee DJ, George AE, Trainor EA, Horton KE, Hildebrandt E, Testerman TL (juni 2011). "Cholesterol enhances Helicobacter pylori resistance to antibiotics and LL-37". Antimicrobial Agents and Chemotherapy. 55 (6): 2897–904. doi:10.1128/AAC.00016-11. PMC 3101455. PMID 21464244.
- ^ Moon JK, Kim JR, Ahn YJ, Shibamoto T (juni 2010). "Analysis and anti-Helicobacter activity of sulforaphane and related compounds present in broccoli ( Brassica oleracea L.) sprouts". Journal of Agricultural and Food Chemistry. 58 (11): 6672–7. doi:10.1021/jf1003573. PMID 20459098.
- ^ Fahey JW, Haristoy X, Dolan PM, Kensler TW, Scholtus I, Stephenson KK, et al. (maj 2002). "Sulforaphane inhibits extracellular, intracellular, and antibiotic-resistant strains of Helicobacter pylori and prevents benzo[a]pyrene-induced stomach tumors". Proceedings of the National Academy of Sciences of the United States of America. 99 (11): 7610–5. Bibcode:2002PNAS...99.7610F. doi:10.1073/pnas.112203099. PMC 124299. PMID 12032331.
- ^ Haristoy X, Angioi-Duprez K, Duprez A, Lozniewski A (decembar 2003). "Efficacy of sulforaphane in eradicating Helicobacter pylori in human gastric xenografts implanted in nude mice". Antimicrobial Agents and Chemotherapy. 47 (12): 3982–4. doi:10.1128/aac.47.12.3982-3984.2003. PMC 296232. PMID 14638516.
- ^ Ren Q, Yan X, Zhou Y, Li WX (februar 2016). "Periodontal therapy as adjunctive treatment for gastric Helicobacter pylori infection". The Cochrane Database of Systematic Reviews. 2: CD009477. doi:10.1002/14651858.CD009477.pub2. PMID 26852297.
- ^ Violeta Filip P, Cuciureanu D, Sorina Diaconu L, Maria Vladareanu A, Silvia Pop C (2018). "MALT lymphoma: epidemiology, clinical diagnosis and treatment". Journal of Medicine and Life. 11 (3): 187–193. doi:10.25122/jml-2018-0035. PMC 6197515. PMID 30364585.
- ^ Bron D, Meuleman N (septembar 2019). "Marginal zone lymphomas: second most common lymphomas in older patients". Current Opinion in Oncology. 31 (5): 386–393. doi:10.1097/CCO.0000000000000554. PMID 31246587.
- ^ Sassone M, Ponzoni M, Ferreri AJ (2017). "Ocular adnexal marginal zone lymphoma: Clinical presentation, pathogenesis, diagnosis, prognosis, and treatment". Best Practice & Research. Clinical Haematology. 30 (1–2): 118–130. doi:10.1016/j.beha.2016.11.002. PMID 28288706.
- ^ Casulo C, Friedberg J (2017). "Transformation of marginal zone lymphoma (and association with other lymphomas)". Best Practice & Research. Clinical Haematology. 30 (1–2): 131–138. doi:10.1016/j.beha.2016.08.029. PMID 28288708.
- ^ a b c Kuo SH, Yeh KH, Chen LT, Lin CW, Hsu PN, Hsu C, et al. (juni 2014). "Helicobacter pylori-related diffuse large B-cell lymphoma of the stomach: a distinct entity with lower aggressiveness and higher chemosensitivity". Blood Cancer Journal. 4 (6): e220. doi:10.1038/bcj.2014.40. PMC 4080211. PMID 24949857.
- ^ a b c Cheng Y, Xiao Y, Zhou R, Liao Y, Zhou J, Ma X (august 2019). "Prognostic significance of helicobacter pylori-infection in gastric diffuse large B-cell lymphoma". BMC Cancer. 19 (1): 842. doi:10.1186/s12885-019-6067-5. PMC 6712724. PMID 31455250.
- ^ Tsai HJ, Tai JJ, Chen LT, Wu MS, Yeh KH, Lin CW, et al. (juli 2020). "A multicenter prospective study of first-line antibiotic therapy for early-stage gastric mucosa-associated lymphoid tissue lymphoma and diffuse large B-cell lymphoma with histological evidence of mucosa-associated lymphoid tissue". Haematologica. 105 (7): e349–e354. doi:10.3324/haematol.2019.228775. PMC 7327622. PMID 31727764.
- ^ Badgwell B, Das P, Ajani J (august 2017). "Treatment of localized gastric and gastroesophageal adenocarcinoma: the role of accurate staging and preoperative therapy". Journal of Hematology & Oncology. 10 (1): 149. doi:10.1186/s13045-017-0517-9. PMC 5558742. PMID 28810883.
- ^ Goodman KJ, O'rourke K, Day RS, Wang C, Nurgalieva Z, Phillips CV, et al. (decembar 2005). "Dynamics of Helicobacter pylori infection in a US-Mexico cohort during the first two years of life". International Journal of Epidemiology. 34 (6): 1348–55. doi:10.1093/ije/dyi152. PMID 16076858.
- ^ Goodman KJ, Cockburn M (mart 2001). "The role of epidemiology in understanding the health effects of Helicobacter pylori". Epidemiology. 12 (2): 266–71. doi:10.1097/00001648-200103000-00023. PMID 11246592.
- ^ Testerman TL, Morris J (septembar 2014). "Beyond the stomach: an updated view of Helicobacter pylori pathogenesis, diagnosis, and treatment". World Journal of Gastroenterology (Review). 20 (36): 12781–808. doi:10.3748/wjg.v20.i36.12781. PMC 4177463. PMID 25278678.
- ^ a b c Blaser MJ (februar 2005). "An endangered species in the stomach". Scientific American. 292 (2): 38–45. Bibcode:2005SciAm.292b..38B. doi:10.1038/scientificamerican0205-38. PMID 15715390.
- ^ Graham DY, Yamaoka Y, Malaty HM (novembar 2007). "Contemplating the future without Helicobacter pylori and the dire consequences hypothesis". Helicobacter. 12 Suppl 2 (Suppl 2): 64–8. doi:10.1111/j.1523-5378.2007.00566.x. PMC 3128250. PMID 17991179.
- ^ Delaney B, McColl K (august 2005). "Review article: Helicobacter pylori and gastro-oesophageal reflux disease". Alimentary Pharmacology & Therapeutics (Review). 22 Suppl 1 (Suppl 1): 32–40. doi:10.1111/j.1365-2036.2005.02607.x. PMID 16042657.
- ^ Blaser MJ, Chen Y, Reibman J (maj 2008). "Does Helicobacter pylori protect against asthma and allergy?". Gut. 57 (5): 561–7. doi:10.1136/gut.2007.133462. PMC 3888205. PMID 18194986.
- ^ Chen Y, Blaser MJ (august 2008). "Helicobacter pylori colonization is inversely associated with childhood asthma". The Journal of Infectious Diseases. 198 (4): 553–60. doi:10.1086/590158. PMC 3902975. PMID 18598192.
- ^ a b c Pounder RE, Ng D (1995). "The prevalence of Helicobacter pylori infection in different countries". Alimentary Pharmacology & Therapeutics. 9 Suppl 2 (Suppl 2): 33–9. PMID 8547526.
- ^ Smoak BL, Kelley PW, Taylor DN (mart 1994). "Seroprevalence of Helicobacter pylori infections in a cohort of US Army recruits". American Journal of Epidemiology. 139 (5): 513–9. doi:10.1093/oxfordjournals.aje.a117034. PMID 8154475.
- ^ Everhart JE, Kruszon-Moran D, Perez-Perez GI, Tralka TS, McQuillan G (april 2000). "Seroprevalence and ethnic differences in Helicobacter pylori infection among adults in the United States". The Journal of Infectious Diseases. 181 (4): 1359–63. doi:10.1086/315384. PMID 10762567.
- ^ Malaty HM (2007). "Epidemiology of Helicobacter pylori infection". Best Practice & Research. Clinical Gastroenterology. 21 (2): 205–14. doi:10.1016/j.bpg.2006.10.005. PMID 17382273.
- ^ Mégraud F (septembar 2004). "H pylori antibiotic resistance: prevalence, importance, and advances in testing". Gut. 53 (9): 1374–84. doi:10.1136/gut.2003.022111. PMC 1774187. PMID 15306603.
- ^ Correa P, Piazuelo MB (januar 2012). "Evolutionary History of the Helicobacter pylori Genome: Implications for Gastric Carcinogenesis". Gut and Liver. 6 (1): 21–8. doi:10.5009/gnl.2012.6.1.21. PMC 3286735. PMID 22375167.
- ^ Linz B, Balloux F, Moodley Y, Manica A, Liu H, Roumagnac P, et al. (februar 2007). "An African origin for the intimate association between humans and Helicobacter pylori". Nature. 445 (7130): 915–918. Bibcode:2007Natur.445..915L. doi:10.1038/nature05562. PMC 1847463. PMID 17287725.
- ^ "The Nobel Prize in Physiology or Medicine 2005". Pristupljeno 30. 8. 2018.
- ^ Bizzozero G (1893). "Ueber die schlauchförmigen Drüsen des Magendarmkanals und die Beziehungen ihres Epitheles zu dem Oberflächenepithel der Schleimhaut". Archiv für Mikroskopische Anatomie. 42: 82–152. doi:10.1007/BF02975307.
- ^ Konturek JW (decembar 2003). "Discovery by Jaworski of Helicobacter pylori and its pathogenetic role in peptic ulcer, gastritis and gastric cancer" (PDF). Journal of Physiology and Pharmacology. 54 Suppl 3 (Suppl 3): 23–41. PMID 15075463. Arhivirano s originala (PDF), 30. 9. 2004. Pristupljeno 25. 8. 2008.
- ^ Egan BJ, O'Morain CA (2007). "A historical perspective of Helicobacter gastroduodenitis and its complications". Best Practice & Research. Clinical Gastroenterology. 21 (2): 335–46. doi:10.1016/j.bpg.2006.12.002. PMID 17382281.
- ^ Palmer ED (august 1954). "Investigation of the gastric mucosa spirochetes of the human". Gastroenterology. 27 (2): 218–20. doi:10.1016/S0016-5085(19)36173-6. PMID 13183283.
- ^ Steer HW (august 1975). "Ultrastructure of cell migration throught [sic] the gastric epithelium and its relationship to bacteria". Journal of Clinical Pathology. 28 (8): 639–46. doi:10.1136/jcp.28.8.639. PMC 475793. PMID 1184762.
- ^ Atwood, K.C. IV (2004). "Bacteria, Ulcers, and Ostracism? H. pylori and the making of a myth". Pristupljeno 2. 8. 2008.
- ^ Borody TJ, Cole P, Noonan S, Morgan A, Lenne J, Hyland L, et al. (oktobar 1989). "Recurrence of duodenal ulcer and Campylobacter pylori infection after eradication". The Medical Journal of Australia. 151 (8): 431–5. doi:10.5694/j.1326-5377.1989.tb101251.x. PMID 2687668.
- ^ Helicobacter pylori in peptic ulcer disease (Report). NIH Consensus Statement Online. 12. 7. 1. 1994. str. 1–23. Arhivirano s originala, 19. 8. 2011. Pristupljeno 21. 12. 2004.
- ^ a b Liddell, Henry G.; Scott, Robert (1966). A Lexicon: Abridged from Liddell and Scott's Greek-English Lexicon. Oxford, UK: Oxford University Press. ISBN 978-0-19-910207-5.
- ^ Marshall BS, Goodwin CS (1987). "Revised nomenclature of Campylobacter pyloridis". International Journal of Systematic Bacteriology. 37 (1): 68. doi:10.1099/00207713-37-1-68.
- ^ Goodwin CS, Armstrong JA, Chilvers T, Peters M, Collins MD, Sly L, et al. (1989). "Transfer of Campylobacter pylori and Campylobacter mustelae to Helicobacter gen. nov. as Helicobacter pylori comb. nov. and Helicobacter mustelae comb. nov. respectively". International Journal of Systematic Bacteriology. 39 (4): 397–405. doi:10.1099/00207713-39-4-397.
- ^ Buckley MJ, O'Morain CA (1998). "Helicobacter biology--discovery". British Medical Bulletin. 54 (1): 7–16. doi:10.1093/oxfordjournals.bmb.a011681. PMID 9604426.
- ^ Mégraud F, et al. (European Helicobacter Study Group) (novembar 2007). "Evolution of Helicobacter pylori research as observed through the workshops of the European Helicobacter Study Group". Helicobacter. 12 Suppl 2 (Suppl 2): 1–5. doi:10.1111/j.1523-5378.2007.00581.x. PMID 17991169.
- ^ Malfertheiner P, Megraud F, O'Morain CA, Atherton J, Axon AT, Bazzoli F, et al. (European Helicobacter Study Group) (maj 2012). "Management of Helicobacter pylori infection--the Maastricht IV/ Florence Consensus Report". Gut. 61 (5): 646–64. doi:10.1136/gutjnl-2012-302084. PMID 22491499.
- ^ Malfertheiner P, Mégraud F, O'Morain C, Hungin AP, Jones R, Axon A, et al. (European Helicobacter Pylori Study Group (EHPSG)) (februar 2002). "Current concepts in the management of Helicobacter pylori infection--the Maastricht 2-2000 Consensus Report". Alimentary Pharmacology & Therapeutics. 16 (2): 167–80. doi:10.1046/j.1365-2036.2002.01169.x. PMID 11860399.
- ^ Malfertheiner P, Mégraud F, O'Morain C, Bell D, Bianchi Porro G, Deltenre M, et al. (European Helicobacter Pylori Study Group (EHPSG)) (januar 1997). "Current European concepts in the management of Helicobacter pylori infection--the Maastricht Consensus Report. The European Helicobacter Pylori Study Group (EHPSG)". European Journal of Gastroenterology & Hepatology. 9 (1): 1–2. doi:10.1097/00042737-199701000-00002. PMID 9031888.
- ^ McNicholl AG, Gasbarrini A, Tepes B, et al. (septembar 2014). "Pan-European registry on H. pylori management (Hp-EuReg): Interim analysis of 5,792 patients". Helicobacter. 2014: 69.
- ^ "Management of Helicobacter pylori infection". Online courses. United European Gastroenterology. Arhivirano s originala, 2. 4. 2015.
- ^ "Annual Report 2012". United European Gastroenterology. Arhivirano s originala, 4. 6. 2016. Pristupljeno 2. 3. 2021.
- ^ Jung SW, Lee SW (januar 2016). "The antibacterial effect of fatty acids on Helicobacter pylori infection". The Korean Journal of Internal Medicine (Review). 31 (1): 30–5. doi:10.3904/kjim.2016.31.1.30. PMC 4712431. PMID 26767854.
Vanjski linkovi
[uredi | uredi izvor]- "Information on tests for H. pylori". National Institutes of Health. U.S. Department of Health and Human Services. Arhivirano s originala, 13. 6. 2013.
- "European Helicobacter Study Group (EHSG)".
- "Type strain of Helicobacter pylori at BacDive". Bacterial Diversity Metadatabase.
- "Helicobacter pylori". Genome. KEGG. Japan. 26695.

