Hordom
| Hordom | |
|---|---|
 | |
| Klasifikacija i vanjski resursi | |
| ICD-O: | M9370/3 |
| OMIM | 215400 |
| DiseasesDB | 31483 |
| eMedicine | med/2992 radio/169 orthoped/49 |
| MeSH | D002817 |
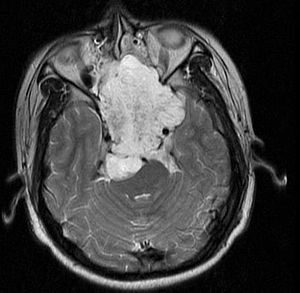
Hordom je rijetka spororastuća neoplazma za koju se smatra da nastaje iz ćelijskih ostataka notohorda. Dokaz za to je lokacija tumora (duž nervne osovine), sa sličnim imunohistohemijskim obrascims bojenja i demonstracijom da su notohordne ćelije prvenstveno zaostale u klivusu (kosini iza sella turcica = turskog sedla) i regiji krstačnotrtične simffize, kada se ostatak notohorda povuče tokom fetusnog života.
Laički rečeno, hordom je tip karcinoma kičme.[1]
Ispoljavanje
[uredi | uredi izvor]
Hordomi mogu nastati iz kostiju u bazi lobanje i bilo gdje duž kičme. Dvije najčešće lokacije su kranijski na klivusu i u sakrumu na dnu kičmenog stuba.[2]
Genetika
[uredi | uredi izvor]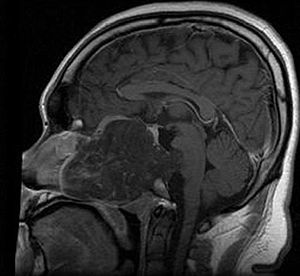
Prijavljen je mali broj porodica u kojima je više srodnika zahvaćeno hordomom. U četiri od ovih porodica otkriveno je da je za izazivanje hordoma odgovorna duplikacija brahiurijskog gena.[3]
Predložena je moguća povezanost sa kompleksom tuberozne skleroze (TSC1 ili TSC2).[4]
Mehanizam
[uredi | uredi izvor]- mTOR signalizacija je hiperaktivna u sporadičnim sakralnim hordomima: u jednoj imunohistohemijskoj studiji, 10 od 10 krstačnih hordoma pokazalo je osforilaciju ribosomskog proteina s6 i EIF4EBP1 .[5]
- Djelimični ili potpuni nedostatak gena PTEN uočen je u gotovo svim krstačnim hordomima [5]
- U studiji od 49 hordoma Akt, TSC2 i EIF4EBP1 su fosforilirani u 92%, 96% i 98% slučajeva.[6]
- U mikromreži tkiva koja sadrži 21 hordomski receptor trombocitnog faktora rasta – beta (PDGFR-b), receptor epidermnog faktora rasta (EGFR), KIT (CD117) i HER2 otkrivene su u 100%, 67%, 33% i 0% slučajeva.[7]
- U hordomima, često su deletirani lokusi CDKN2A (p16) i CDKN2B (p15) na hromosomu 9, sekvenca p21.[8] Another study found CDKN2A immunoreactivity in just 4% of cases.[6]
- Oko 62% hordoma eksprimira antigen povezan s melanomom visoke molekulske težine, također poznat kao hondroitinski sulfat-proteoglikan 4 (CSPG4) koji je bio meta imunološke terapije.[9]
- U 2009., otkriveno je da je za porodični oblik ovog poremećaja odgovorna naslijeđena duplikacija gena.[10] Porodični hordomi su rijetki, s procijenjenom stopom od 0,4% svih hordoma.[11]
Dijagnoza
[uredi | uredi izvor]Prve konsenzusne smjernice za dijagnozu i liječenje hordoma objavljene su 2015. u The Lancet Oncology.[12] Ovi tumori eksprimiraju brahiuriju, što se može otkriti [imunohistohemija|[imunohistohemijskom]] analizom.
Klasifikacija
[uredi | uredi izvor]
Postoje tri histološke varijante hordoma: klasična (ili "konvencijska"),[13] hondroidna i dediferencirana.
- Histološki izgled klasičnog hordoma je režnjeviti tumor sastavljen od grupa ćelija koje su razdvojene fibroznim septama. Ćelije imaju mala okrugla jedra i obilno vakuoliziranu citoplazmu, koja se ponekad opisuje kao fizaliferna (imaju mehuriće ili vakuole).
- Hondroidni hordomi histološki pokazuju karakteristike i hordoma i hondrosarkoma.
Liječenje
[uredi | uredi izvor]U većini slučajeva, potpuna hirurška resekcija praćena zračenjem nudi najbolje šanse za dugotrajnu kontrolu.[14] Nepotpuna resekcija primarnog tumora otežava kontrolu bolesti i povećava izglede za recidiv. Odluka da li treba izvršiti potpunu ili nepotpunu operaciju prvenstveno zavisi od anatomske lokacije tumora i njegove blizine vitalnim dijelovima centralnog nervnog sistema.
Hordomi su relativno radiorezistentni i zahtijevaju kontrolu nad visokim dozama zračenja. Blizina hordoma vitalnim nervnim strukturama kao što su moždano stablo i nervi ograničava dozu zračenja koja se može bezbedno isporučiti. Stoga su visoko fokusirano zračenje kao što je protonska terapija i terapija ugljikovim ionima učinkovitije od konvencijskog rendgenskog zračenja.[15]
Još uvijek ne postoje odobreni lijekovi za liječenje hordoma, ali kliničko ispitivanje provedeno u Italiji korištenjem PDGFR inhibitora Imatinib pokazalo je skroman odgovor kod nekih pacijenata s hordomom.[16] Ista grupa u Italiji otkrila je da je kombinacija imatiniba i sirolimusa izazvala odgovor kod nekoliko pacijenata čiji su tumori napredovali samo na imatinibu. Zabilježeno je da su erlotinib poput EGFR inhibitora djelotvorni kod hordoma.[17] Iako mutacija EGFR nije prisutna u hordomu, ekspresija EGFR-a može predvidjeti odgovor na erlotinib (kao što je prikazano u izvještaju dr. Sameera Rastogija).[17]
Objavljen je i izvještaj o odgovoru na olaparib.[18]
Prognoza
[uredi | uredi izvor]U jednoj studiji, 10-godišnja stopa preživljavanja tumor bez sakralnog hordoma bila je 46%.[19]
Epidemiologija
[uredi | uredi izvor]U Sjedinjenim Državama, godišnja incidencija hordoma je otprilike 1/ milion (300 novih pacijenata svake godine).[20]
Zasad ne postoje poznati faktori rizika iz okoline za hordom. Kao što je gore navedeno, duplikacija brahiurijske zametne linije identificirana je kao glavni mehanizam osjetljivosti u nekoliko porodica sa hordomom.[21]
Dok većina ljudi sa hordomom nema drugih članova porodice sa ovom bolešću, dokumentovane su rijetke pojave više slučajeva unutar porodica. Ovo sugerira da neki ljudi mogu biti genetički predisponirani za razvoj hordoma. Budući da nasljedni faktori rizika za hordom mogu postojati, naučnici s Nacionalnog instituta za rak sprovode studiju o porodičnom hordomu kako bi tražili gene uključene u razvoj ovog tumora.[22]
Reference
[uredi | uredi izvor]- ^ National Cancer Institute (27. 2. 2019). "Chordoma".
- ^ "Primary Malignant Bone Tumors: Tumors of Bones and Joints: Merck Manual Professional". Pristupljeno 4. 1. 2009.
- ^ Walcott BP, Nahed BV, Mohyeldin A, Coumans JV, Kahle KT, Ferreira MJ (2012). "Chordoma: current concepts, management, and future directions". Lancet Oncol. 13 (2): e69–76. doi:10.1016/S1470-2045(11)70337-0. PMID 22300861.
- ^ Lee-Jones L, Aligianis I, Davies PA, et al. (septembar 2004). "Sacrococcygeal chordomas in patients with tuberous sclerosis complex show somatic loss of TSC1 or TSC2". Genes Chromosomes Cancer. 41 (1): 80–5. doi:10.1002/gcc.20052. PMID 15236319.
- ^ a b Han S, Polizzano C, Nielsen GP, Hornicek FJ, Rosenberg AE, Ramesh V (mart 2009). "Aberrant Hyperactivation of Akt and Mammalian Target of Rapamycin Complex 1 Signaling in Sporadic Chordomas". Clinical Cancer Research. 15 (6): 1940–6. doi:10.1158/1078-0432.CCR-08-2364. PMC 2701205. PMID 19276265.
- ^ a b Presneau N, Shalaby A, Idowu B, Gikas P, Cannon SR, Gout I, Diss T, Tirabosco R, Flanagan AM (maj 2009). "Potential therapeutic targets for chordoma: PI3K/AKT/TSC1/TSC2/mTOR pathway". British Journal of Cancer. 100 (9): 1406–14. doi:10.1038/sj.bjc.6605019. PMC 2694420. PMID 19401700.
- ^ Fasig JH, Dupont WD, LaFleur BJ, Olson SJ, Cates JM (februar 2008). "Immunohistochemical analysis of receptor tyrosine kinase signal transduction activity in chordoma". Neuropathology and Applied Neurobiology. 34 (1): 95–104. doi:10.1111/j.1365-2990.2007.00873.x. PMID 17973908.
- ^ Hallor KH, Staaf J, Jönsson G, Heidenblad M, Vult von Steyern F, Bauer HC, Ijszenga M, Hogendoorn PC, Mandahl N, Szuhai K, Mertens F (januar 2008). "Frequent deletion of the CDKN2A locus in chordoma: analysis of chromosomal imbalances using array comparative genomic hybridisation". British Journal of Cancer. 98 (2): 434–42. doi:10.1038/sj.bjc.6604130. PMC 2361468. PMID 18071362.
- ^ Schwab JH, Boland PJ, Agaram NP, Socci ND, Guo T, O'Toole GC, Wang X, Ostroumov E, Hunter CJ, Block JA, Doty S, Ferrone S, Healey JH, Antonescu CR (mart 2009). "Chordoma and chondrosarcoma gene profile: implications for immunotherapy". Cancer Immunology, Immunotherapy. 58 (3): 339–49. doi:10.1007/s00262-008-0557-7. PMC 3426285. PMID 18641983.
- ^ "Gene Duplication Identified in an Uncommon Form of Bone Cancer". 2009. Arhivirano s originala, 9. 10. 2009. Pristupljeno 9. 10. 2009.
- ^ Wang, Ke; Zhen, Wu; Tian, Kaibing; Hao, Shuyu; Zhang, Liwei; Zhang, Junting (November 2015). "Familial Chordoma: a case report and review of the literature". Oncology Letters. Oncology Letters 10(5). 10 (5): 2937–2940. doi:10.3892/ol.2015.3687. PMC 4665336. PMID 26722267.
- ^ [http: //www.chordomafoundation.org/latest-updates/first-clinical-guidelines -for-chordoma-treatment-published-in-lancet-oncology/ "First clinical guidelines for chordoma treatment published in The Lancet Oncology"] Provjerite vrijednost parametra
|url=(pomoć). 19. 2. 2015.[mrtav link] - ^ Chugh R, Tawbi H, Lucas DR, Biermann JS, Schuetze SM, Baker LH (novembar 2007). "Chordoma: the nonsarcoma primary bone tumor". The Oncologist. 12 (11): 1344–50. doi:10.1634/theoncologist.12-11-1344. hdl:2027.42/139965. PMID 18055855.
- ^ Park L, Delaney TF, Liebsch NJ, Hornicek FJ, Goldberg S, Mankin H, Rosenberg AE, Rosenthal DI, Suit HD (2006). "Sacral chordomas: Impact of high-dose proton/photon-beam radiation therapy combined with or without surgery for primary versus recurrent tumor". Int J Radiat Oncol Biol Phys. 65: 1514–21. doi:10.1016/j.ijrobp.2006.02.059. PMID 16757128.
- ^ Delaney TF, Liebsch NJ, Pedlow FX, Adams J, Dean S, Yeap BY, McManus P, Rosenberg AE, Nielsen GP, Harmon DC, Spiro IJ, Raskin KA, Suit HD, Yoon SS, Hornicek FJ (2009). "Sacral chordomas: Phase II Study of High-Dose Photon/Proton Radiotherapy in the Management of Spine Sarcomas". Int J Radiat Oncol Biol Phys. 74: 732–9. doi:10.1016/j.ijrobp.2008.08.058. PMC 2734911. PMID 19095372.
- ^ Casali PG, Messina A, Stacchiotti S, et al. (2004). "Imatinib mesylate in chordoma" (PDF). Cancer. 101 (9): 2086–97. doi:10.1002/cncr.20618. hdl:2434/642716. PMID 15372471.
- ^ a b Verma, S., Vadlamani, S.P., Shamim, S.A. Rastogi S et al. Partial response to erlotinib in a patient with imatinib-refractory sacral chordoma. Clin Sarcoma Res 10, 28 (2020). https://doi.org/10.1186/s13569-020-00149-1
- ^ Gröschel S, Hübschmann D, Raimondi F, Horak P, Warsow G, Fröhlich M, Klink B, Gieldon L, Hutter B, Kleinheinz K, Bonekamp D, Marschal O, Chudasama P10,11, Mika J, Groth M, Uhrig S, Krämer S, Heining C, Heilig CE, Richter D, Reisinger E, Pfütze K, Eils R, Wolf S, von Kalle C, Brandts C, Scholl C, Weichert W, Richter S, Bauer S, Penzel R, Schröck E, Stenzinger A, Schlenk RF, Brors B, Russell RB, Glimm H, Schlesner M, Fröhling S (2019) Defective homologous recombination DNA repair as therapeutic target in advanced chordoma. Nat Commun 10(1):1635
- ^ Fuchs B, Dickey ID, Yaszemski MJ, Inwards CY, Sim FH (2005). "Operative management of sacral chordoma". The Journal of Bone and Joint Surgery. American Volume. 87 (10): 2211–6. doi:10.2106/JBJS.D.02693. PMID 16203885.
- ^ "College student fights his own cancer - Yahoo! News". Arhivirano s originala, 26. 2. 2008. Pristupljeno 20. 2. 2008.
- ^ Kelley MJ, Shi J, Ballew B, Hyland PL, Li WQ, Rotunno M, Alcorta DA, Liebsch NJ, Mitchell J, Bass S, Roberson D, Boland J, Cullen M, He J, Burdette L, Yeager M, Chanock SJ, Parry DM, Goldstein AM, Yang XR (2014). "Familial Chordoma Study of the T Gene". Hum Genet. 133 (10): 1289–97. doi:10.1007/s00439-014-1463-z. PMC 6938388. PMID 24990759.
- ^ "Familial Chordoma Study". Arhivirano s originala, 14. 2. 2009. Pristupljeno 3. 2. 2009.
Vanjski linkovi
[uredi | uredi izvor]- Images of Chordoma - mostly radiological (CT and MRI scans), one autopsy image
- Research information on chordoma (WikiGenes)
