Hronična mijeloidna leukemija
 | |
| Klasifikacija i vanjski resursi | |
|---|---|
| ICD-10 | C92.1 |
| ICD-9 | 205.1 |
| ICD-O: | M9875/3 |
| DiseasesDB | 2659 |
| MedlinePlus | 000570 |
| eMedicine | med/371 |
| MeSH | [http://www.nlm.nih.gov/cgi/mesh/2010/MB_cgi?field=uid&term=D015464
|
Definicija i simptomi
[uredi | uredi izvor]Hronična mijelogena leukemija (CML), znana i kao hronična mijeloidna leukemija, je rak bijelih krvnih zrnaca. To je oblik leukemija koji karakterizira povećani i neregulirani rast mijeloidnih ćelija u koštanoj srži i akumulacija tih ćelija u krvi. CML je poremećaj klonskih matičnih ćelija koštane srži kod kojeg dolazi do širenja zrelih granulocita (neutrofila, eozinofila i bazofila i njihovih prekursora. To je tip mijeloproliferativne neoplazme povezan sa hromosomskom translokacijom koja se naziva hromosom Filadelfija.
Liječenje
[uredi | uredi izvor]CML se uglavnom liječi ciljanim lijekovima zvanim tirozin-kinazni inhibitori (TKI) koji su doveli do dramatično poboljšanih stopa dugoročnog preživljavanja od 2001. Ovi lijekovi su revolucionirali liječenje ove bolesti i omogućavaju većini pacijenata da imaju dobar kvalitet života u odnosu na nekadašnje lijekove za hemoterapiju. U zapadnim zemljama HML čini 15-25% svih leukemija odraslih i 14% leukemija ukupno (uključujući pedijatrijsku populaciju, gdje je HML rjeđi).
Znakovi i simptomi
[uredi | uredi izvor]Način ispoljavanja CML ovisi o stadiju bolesti u dijagnozi, jer je poznato da u nekim slučajevima preskače faze.
Većini pacijenata (~ 90%) dijagnosticira se tokom hronične faze koja je najčešće asimptomatska. U tim slučajevima može se slučajno dijagnosticirati povišenim brojem bijelih krvnih zrnaca na rutinskom laboratorijskom testu. Također se može pojaviti sa simptomima koji ukazuju na hepatosplenomegaliju i rezultirajuću bol u gornjem kvadrantu koju to uzrokuje. Povećana slezina može vršiti pritisak na želudac, uzrokujući gubitak apetita i rezultirajući gubitkom težine. Može se pojaviti i s blagom groznicom i noćnim znojenjem, zbog povišenog baznog nivoa metabolizma.[2]
Nekima (<10%) se dijagnosticira u ubrzanom stadiju koji najčešće predstavlja krvarenje, petehijapetehije i ekhimozu. U ovih je pacijenata vrućica najčešće rezultat oportunističkih infekcija.
Nekim pacijentima se inicijalno dijagnosticira u fazi eksplozije u kojoj su simptomi najvjerojatnije vrućica, bol u kostima i porast fibroze koštane srži.
Uzrok
[uredi | uredi izvor]U većini slučajeva ne može se izdvojiti očigledan uzrok za CML.
Faktori rizika
[uredi | uredi izvor]CML je češći kod muškaraca nego kod žena (omjer muškaraca i žena od 1,4: 1), a češće se javlja kod starijih osoba sa srednjom dobom u dijagnozi od 65 godina.[3] Faktor rizika je izloženost ionizirajućem zračenju, na osnovu 50 puta veće incidencije HML-a u preživjelima nuklearnog napada u Hirošimi i Nagasakiju. Čini se da stopa HML-a kod ovih osoba doseže vrhunac oko 10 godina nakon izloženosti.
Patofiziologija
[uredi | uredi izvor]
CML je prvi karcinom koji je povezan sa očitom genetičkom abnormalnošću, hromosomska translokacija poznata kao hromosom Filadelfija. Ova hromosomska abnormalnost je tako nazvana jer su je prvi put otkrili i opisali 1960. godine dva naučnika iz Filadelfije, Pennsylvania, SAD: Peter Nowell sa University of Pennsylvania i David Hungerford iz Fox Chase Cancer Center.[4]
U ovoj translokaciji, dijelovi dva hromosoma (9. i 22.) mijenjaju mjesta. Kao rezultat toga, dio gena BCR ("regija klastera tačaka prekida") iz 22. hromosoma stopljen je sa ABL gen na hromosomu 9. Ovaj abnormalni "fuzioni" gen generira protein s težinom p210 ili ponekad p185 (p210 je kratica za protein 210 kDa, skraćenica koja se koristi za karakterizaciju proteina zasnovanih isključivo na veličini). Budući da abl nosi domen koji može dodati fosfatne grupe na ostatke tirozina (tirozin-kinaza), produkt fuzije bcr-abl je takođe tirozin-kinaza.[5][6]

Spojeni protein BCR-ABL komunicira sa interleukinskim 3beta (c) receptorom pogođene osobe. BCR-ABL transkript kontinuirano je aktivan i ne zahtijeva aktivaciju putem drugih ćelijskih proteina za razmjenu poruka. Zauzvrat, BCR-ABL aktivira kaskadu proteina koji kontroliraju ćelijski ciklus, ubrzavajući ćelijsku diobu. Štaviše, BCR-ABL protein inhibira popravak DNK, uzrokujući genomsku nestabilnost i čineći ćeliju podložnijom razvoju daljnjih genetičkih abnormalnosti. Djelovanje BCR-ABL proteina je patofiziološki uzročnik hronične mijelogene leukemije. Sa poboljšanim razumijevanjem prirode BCR-ABL proteina i njegovog djelovanja kao ciljane terapije tirozin-kinazom, (od kojih je prva bila imatinib) koji specifično inhibiraju aktivnost BCR- Razvijeni su ABL proteini. Ovi inhibitori tirozin kinaze mogu izazvati potpune remisije u CML-u, potvrđujući središnju važnost bcr-abl kao uzroka CML-a.
Dijagnoza
[uredi | uredi izvor]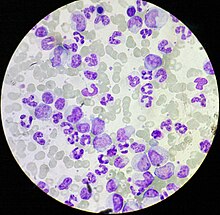


Na CML se često sumnja na osnovu kompletne krvne slike, koja pokazuje povećane granulocite svih tipova, obično uključujući zrele mijeloidne ćelije. Bazofili i eozinofili su gotovo univerzalno povećani; ova značajka može pomoći u razlikovanju CML od leukemoidne reakcije. Biopsija koštane srži često se izvodi kao dio procjene CML-a, a CML dijagnosticira citogenetički, što otkriva translokaciju t (9; 22) (q34; q11.2) koja uključuje gen ABL1 u hromosomu 9 i BCR gen u hromosomu 22.[7] Kao rezultat ove translokacije, hromosom izgleda manie od svog homolognog hromosoma, a ovaj izgled poznat je kao hromosom Filadelfija hromosomska abnormalnost. Stoga se ova abnormalnost može otkriti rutinskom citogenetičkom analizom, a uključeni geni BCR-ABL1 mogu se otkriti pomoću fluorescentne hibridizacije "in situ", kao i lančane polimerazne reakcije (PCR).
Postoje kontroverze oko takozvanog Ph-negativnog CML-a ili slučajeva sumnje na CML u kojima Filadelfija hromosom nije moguće otkriti. Mnogi takvi pacijenti u stvari imaju složene hromosomske abnormalnosti koje prikrivaju translokaciju (9; 22) ili imaju dokaze o translokaciji FISH ili RT-PCR, uprkos normalnom rutinskom kariotipu.[8] Mali podskup pacijenata bez molekulskih dokaza o fuziji BCR-ABL1 može se bolje klasificirati kao nediferencirani mijelodisplazijski/ mijeloproliferativni poremećaj, jer se njihov klinički tok obično razlikuje od pacijenata s CML.[9]
HML se mora razlikovati od leukemoidne reakcije, koja može imati sličan izgled na razmaz krvi.y[10]
Klasifikacija
[uredi | uredi izvor]CML se često dijeli u tri faze, na osnovu kliničkih karakteristika i laboratorijskih nalaza. U nedostatku intervencije, HML obično započinje u „hroničnoj“ fazi i tokom nekoliko godina prelazi u „ubrzanu“ fazu i na kraju u „blast krizu“. Blast kriza je završna faza HML-a i klinički se ponaša poput akutne leukemije. Liječenje lijekovima obično će zaustaviti ovaj napredak ako se započne rano. Jedan od pokretača napredovanja iz hronične faze kroz ubrzanje i blast krizu je sticanje novih hromosomskih abnormalnosti (uz hromosom iz Filadelfija). Neki pacijenti su možda već u ubrzanoj fazi ili eksplozivnoj krizi do trenutka kada im se dijagnosticira.
Hronična faza
[uredi | uredi izvor]Otprilike 85% pacijenata sa CML je u hroničnoj fazi u vrijeme postavljanja dijagnoze. Tokom ove faze pacijenti su obično asimptomatski ili imaju samo blage simptome umora, bolova na lijevoj strani, bolova u zglobovima i / ili kukovima ili trbuhu. Trajanje hronične faze je različito i ovisi o tome koliko je rano dijagnosticirana bolest kao i korištenim terapijama. U nedostatku liječenja, bolest prelazi u ubrzanu fazu. Precizno postavljanje dijagnoze na osnovu kliničkih markera i ličnog genomskog profila, vjerojatno će se pokazati korisnim u procjeni povijesti bolesti s obzirom na rizik od progresije.[11]
Faza ubrzavanja
[uredi | uredi izvor]Kriteriji za dijagnosticiranje prelaska u fazu ubrzanja donekle su promjenjivi; najkorišteniji kriteriji su kriteriji koje su postavili istražitelji u "M.D. Anderson Cancer Center",[12] by Sokal et al.,[13] i Svjetskoj zdravstvenoj organizaciji.[9][14] Kruteziji SZO[15] su možda najčešće korišteni, a ubrzanu fazu definiraju prisustvom ≥1 sljedećih hematoloških / citogenetskih kriterija ili privremenih kriterija koji se odnose na odgovor na terapiju inhibitorima tirozin kinaze (TKI)
- Haematološki/citogenetički kriteriji
- Perzistentni ili povećani visoki broj bijelih krvnih zrnaca (> 10 × 109/L), ne reagira na terapiju
- Perzistentna ili rastuća splenomegalija, ne reaguje na terapiju
- Perzistentna trombocitoza (> 1000 × 109/L), ne reaguje na terapiju
- Perzistentna trombocitopenija (<100 × 109/L), koja nije povezana sa terapijom
- ≥ 20% bazofila u perifernoj krvi
- 10―19% eksplozija u perifernoj krvi i/ili koštanoj srži
- Dodatne klonske hromosomske abnormalnosti u Filadelfija (Ph) ćelijama pozitivnim (Ph) hromosomima (Ph +) u dijagnozi, uključujući takozvane glavne abnormalnosti puta (drugi Ph hromosom, trisomija 8, izohromosom 17q, trisomija 19), složeni kariotip i abnormalnosti 3q26.2
- Svaka nova klonska hromosomska abnormalnost u Ph + ćelijama koja se dogodi tokom terapije
- Privremeni odgovor na TKI kriterije
- Hematološka rezistencija (ili neuspjeh u postizanju potpunog hematološkog odgovora d) na prvi TKI
- Bilo koja hematološka, citogenetička ili molekulska indicija rezistencije na dva uzastopna TKI
- Pojava dvije ili više mutacija u BCR-ABL1 fuzijskom genu tokom terapije TKI
Smatra se da je pacijent u ubrzanoj fazi ako je prisutno nešto od navedenog. Ubrzana faza je značajna jer signalizira da bolest napreduje i da predstoji transformacija u blast (eksplozivnu) krizu. Uzimanje lijekova često postaje manje efikasno u naprednim fazama.[9]
Eksplozivna kriza
[uredi | uredi izvor]Eksplozivna ili blast kriza je završna faza u evoluciji CML-a i ponaša se poput akutne leukemije, s brzim napredovanjem i kratkim preživljavanjem. Blast kriza dijagnosticira se ako je nešto od sljedećeg prisutno kod pacijenta s CML:[16]
- >20% eksplozija u krvi ili koštanoj srži
- Prisustvo eksplozija vanmedulske proliferacije
Liječenje
[uredi | uredi izvor]Jedini kurativni tretman za HML je transplantacija koštane srži ili alogena transplantacija matičnih ćelija.[17] Osim ovoga, postoje četiri glavna oslonca za liječenje KML: liječenje inhibitorima tirozin-kinaze, mijelosupresivna terapija ili leukofereza terapija (za suzbijanje leukocitoze tokom ranog liječenja), splenektomija i liječenje interferonom alfa-2b. Zbog visoke medijane starosti pacijenata s HML-om relativno je rijetko da se KML primijeti u trudnica; unatoč tome, međutim, hronična mijelogena leukemija može se liječiti s relativnom sigurnošću u bilo koje vrijeme trudnoće hormonima interferona-alfa.[18]
Hronična faza
[uredi | uredi izvor]U prošlosti, antimetaboliti (npr. citarabin, hidroksiurea), alkilirajuće sredstvo, interferon alfa 2b i steroidi su korišteni kao tretmani KML u hroničnoj fazi, ali od 2000-ih zamjenjuje ih Bcr-Abl inhibitor tirozin-kinaze[19] lijekovi koji specifično ciljaju BCR-ABL, konstitutivno aktivirani fuzijski protein tirozin-kinaze izazvan translokacijom hromosoma Filadelfija. Uprkos prelasku na zamjenu citotoksične antineoplazije (standardni antikancerogeni lijekovi) inhibitorima tirozin-kinaze, za suzbijanje visokog broja leukocita ponekad se i dalje koristi hidroksiurea, koja se susreće tokom lečenja inhibitorima tirozin-kinaze poput imatiniba; u ovim situacijama može biti poželjno mijelosupresivno sredstvo, zbog njegovog relativnog nedostatka leukemogenih efekata, a time i relativnog nedostatka potencijala da sekundarni hematološki maligni tumori proizađu iz liječenja.[20] IRIS, an international study that compared interferon/cytarabine combination and the first of these new drugs imatinib, with long-term follow up, demonstrated the clear superiority of tyrosine-kinase-targeted inhibition over existing treatments.[21]
Vakcinacija
[uredi | uredi izvor]U 2005. godine zabilježeni su ohrabrujući, ali mješoviti rezultati vakcinacija s fuzijskim proteinom BCR / ABL1 p210 kod pacijenata sa stabilnom bolešću, s GM-CSF kao dodatkom.[22]
Prognoza
[uredi | uredi izvor]Prije pojave inhibitora tirozin-kinaze, srednje vrijeme preživljavanja kod pacijenata s HML bilo je oko 3-5 godina od trenutka dijagnoze.[23]
Uz upotrebu inhibitora tirozin-kinaze, stope preživljavanja su se dramatično poboljšale. U praćenju 2006. godine 553 pacijenta koji su koristili imatinib (Gleevec) utvrđena je ukupna stopa preživljavanja od 89% nakon pet godina.[24]
Praćenje iz 2011. godine od 832 pacijenta koji su koristili imatinib i koji su postigli stabilan citogenetski odgovor utvrdio je ukupnu stopu preživljavanja od 95,2% nakon 8 godina, što je slično stopi u općoj populaciji. Manje od 1% pacijenata umrlo je zbog progresije leukemije.
Epidemiologija
[uredi | uredi izvor]Velika Britanija
[uredi | uredi izvor]CML čini 8% svih leukemija u Velikoj Britaniji, a oko 680 ljudi dijagnosticirano je u 2011.[25]
Sjedinjene Države
[uredi | uredi izvor]Američko društvo za rak procjenjuje da je 2014. godine dijagnosticirano oko 5.980 novih slučajeva hronične mijeloidne leukemije, a oko 810 ljudi je umrlo od te bolesti. To znači da će nešto više od 10% svih novootkrivenih slučajeva leukemije biti hronična mijeloidna leukemija. Prosječni rizik da osoba oboli od ove bolesti je 1/588. Bolest je češća kod muškaraca nego kod žena, a češća kod bijelaca nego kod Afroamerikanaca. Prosječna dob kod postavljanja dijagnoze je 64 godine, a ova bolest se rijetko viđa kod djece.[26]
Reference
[uredi | uredi izvor]- ^ Vos T, Allen C, Arora M, Barber RM, Bhutta ZA, Brown A, et al. (GBD 2015 Disease and Injury Incidence and Prevalence Collaborators) (oktobar 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ^ Besa EC, Buehler B, Markman M, Sacher RA (27. 12. 2013). Krishnan K (ured.). "Chronic Myelogenous Leukemia Clinical Presentation". Medscape Reference. WebMD. Pristupljeno 3. 1. 2014.
- ^ Provan D, Gribben JG (2010). "Chapter 7 Chronic myelogenous leukemia". Molecular Hematology (3rd izd.). Singapore: Wiley-Blackwell. str. 76. ISBN 9781444318548.
- ^ Nowell PC (august 2007). "Discovery of the Philadelphia chromosome: a personal perspective". The Journal of Clinical Investigation. 117 (8): 2033–5. doi:10.1172/JCI31771. PMC 1934591. PMID 17671636.
- ^ Faderl S, Talpaz M, Estrov Z, Kantarjian HM (august 1999). "Chronic myelogenous leukemia: biology and therapy". Annals of Internal Medicine. 131 (3): 207–19. doi:10.7326/0003-4819-131-3-199908030-00008. PMID 10428738.
- ^ Hehlmann R, Hochhaus A, Baccarani M (juli 2007). "Chronic myeloid leukaemia". Lancet. 370 (9584): 342–50. doi:10.1016/S0140-6736(07)61165-9. PMID 17662883.
- ^ Rowley JD (juni 2013). "Genetics. A story of swapped ends". Science. 340 (6139): 1412–3. Bibcode:2013Sci...340.1412R. doi:10.1126/science.1241318. PMID 23788787.
- ^ Savage DG, Szydlo RM, Goldman JM (januar 1997). "Clinical features at diagnosis in 430 patients with chronic myeloid leukaemia seen at a referral centre over a 16-year period". British Journal of Haematology. 96 (1): 111–6. doi:10.1046/j.1365-2141.1997.d01-1982.x. PMID 9012696.
- ^ a b c Tefferi A, Thiele J, Orazi A, Kvasnicka HM, Barbui T, Hanson CA, et al. (august 2007). "Proposals and rationale for revision of the World Health Organization diagnostic criteria for polycythemia vera, essential thrombocythemia, and primary myelofibrosis: recommendations from an ad hoc international expert panel". Blood. 110 (4): 1092–7. doi:10.1182/blood-2007-04-083501. PMID 17488875.
- ^ Tefferi A (2006). "Classification, diagnosis and management of myeloproliferative disorders in the JAK2V617F era". Hematology. American Society of Hematology. Education Program. 2006: 240–5. doi:10.1182/asheducation-2006.1.240. PMID 17124067.
- ^ Brehme M, Koschmieder S, Montazeri M, Copland M, Oehler VG, Radich JP, et al. (april 2016). "Combined Population Dynamics and Entropy Modelling Supports Patient Stratification in Chronic Myeloid Leukemia". Scientific Reports. 6: 24057. Bibcode:2016NatSR...624057B. doi:10.1038/srep24057. PMC 4822142. PMID 27048866.
- ^ Kantarjian HM, Dixon D, Keating MJ, Talpaz M, Walters RS, McCredie KB, Freireich EJ (april 1988). "Characteristics of accelerated disease in chronic myelogenous leukemia". Cancer. 61 (7): 1441–6. doi:10.1002/1097-0142(19880401)61:7<1441::AID-CNCR2820610727>3.0.CO;2-C. PMID 3162181.
- ^ Sokal JE, Baccarani M, Russo D, Tura S (januar 1988). "Staging and prognosis in chronic myelogenous leukemia". Seminars in Hematology. 25 (1): 49–61. PMID 3279515.
- ^ Vardiman JW, Harris NL, Brunning RD (oktobar 2002). "The World Health Organization (WHO) classification of the myeloid neoplasms". Blood. 100 (7): 2292–302. doi:10.1182/blood-2002-04-1199. PMID 12239137.
- ^ Arber DA, Orazi A, Hasserjian R, Thiele J, Borowitz MJ, Le Beau MM, et al. (maj 2016). "The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia". Blood. 127 (20): 2391–405. doi:10.1182/blood-2016-03-643544. PMID 27069254.
- ^ Karbasian Esfahani M, Morris EL, Dutcher JP, Wiernik PH (maj 2006). "Blastic phase of chronic myelogenous leukemia". Current Treatment Options in Oncology. 7 (3): 189–99. doi:10.1007/s11864-006-0012-y. PMID 16615875.
- ^ Besa EC, Buehler B, Markman M, Sacher RA (27. 12. 2013). Krishnan K (ured.). "Chronic Myelogenous Leukemia Treatment & Management". Medscape Reference. WebMD. Pristupljeno 4. 1. 2014.
- ^ Shapira T, Pereg D, Lishner M (septembar 2008). "How I treat acute and chronic leukemia in pregnancy". Blood Reviews. 22 (5): 247–59. doi:10.1016/j.blre.2008.03.006. PMID 18472198.
- ^ Kufe DW; Pollack RE; Weichselbaum RR; et al., ured. (2003). "Tyrosine Kinase Inhibitors: Targeting Considerations". Holland-Frei Cancer Medicine (NCBI bookshelf book) (6th izd.). Hamilton, Ontario: B.C. Decker. ISBN 978-1-55009-213-4. Pristupljeno 27. 10. 2012.
- ^ Besa EC, Buehler B, Markman M, Sacher RA (27. 12. 2013). Krishnan K (ured.). "Chronic Myelogenous Leukemia". Medscape Reference. WebMD. Pristupljeno 3. 1. 2014.
- ^ DeAngelo DJ, Ritz J (januar 2004). "Imatinib therapy for patients with chronic myelogenous leukemia: are patients living longer?" (PDF). Clinical Cancer Research. 10 (1 Pt 1): 1–3. doi:10.1158/1078-0432.CCR-1218-3. PMID 14734443.
- ^ Bocchia M, Gentili S, Abruzzese E, Fanelli A, Iuliano F, Tabilio A, et al. (2005). "Effect of a p210 multipeptide vaccine associated with imatinib or interferon in patients with chronic myeloid leukaemia and persistent residual disease: a multicentre observational trial" (PDF). Lancet. 365 (9460): 657–62. doi:10.1016/S0140-6736(05)17945-8. hdl:2108/41872. PMID 15721470.
- ^ Besa EC, Buehler B, Markman M, Sacher RA (27. 12. 2013). Krishnan K (ured.). "Chronic Myelogenous Leukemia". Medscape Reference. WebMD. Pristupljeno 3. 1. 2014.
- ^ Druker BJ, Guilhot F, O'Brien SG, Gathmann I, Kantarjian H, Gattermann N, et al. (decembar 2006). "Five-year follow-up of patients receiving imatinib for chronic myeloid leukemia". The New England Journal of Medicine. 355 (23): 2408–17. doi:10.1056/NEJMoa062867. PMID 17151364.
- ^ "Chronic myeloid leukaemia (CML) statistics". Cancer Research UK. Pristupljeno 28. 10. 2014.
- ^ "What are the key statistics about chronic myeloid leukemia?". cancer.org. American Cancer Society. Arhivirano s originala, 9. 2. 2015. Pristupljeno 6. 1. 2015.
Vanjski linkovi
[uredi | uredi izvor]- Chronic Myeloid Leukemia at American Cancer Society
- CML information from The Leukemia & Lymphoma Society
Chronic Myelocytic Leukemia (CML) na Merck Manual of Diagnosis and Therapy Home Edition