Lac operon
Laktozni operon (lac operon) je operon potreban za transport i metabolizam laktoze u E. coli i mnogim drugim crijevnim bakterijama. Iako je glukoza preferirani izvor ugljika za većinu bakterija, lac operon omogućava efikasnu probavu laktoze kada glukoza nije dostupna putem aktivnosti beta-galaktozidaze.[1] Genska regulacija lac operona bio je prvi genetički regulatorni mehanizam koji je jasno shvaćen, tako da je postao najistaknutiji primjer prokariotske regulacije gena. Iz tog razloga se često raspravlja u uvodnim časovima molekulske i ćelijske biologije. Ovaj sistem metabolizma laktoze koristili su François Jacob i Jacques Monod da odrede kako biološka ćelija zna koji enzim da sintetizira. Njihov rad na lac operonu donio im je Nobelovu nagradu za fiziologiju 1965. godine.[1]
Bakterijski operoni su policistronski transkripti koji su u stanju da proizvedu više proteina iz jednog iRNK transkripta. U ovom slučaju, kada je laktoza potrebna kao izvor šećera za bakteriju, tri gena lac operona mogu biti eksprimirana i njihovi kasniji proteini prevedeni: lacZ, lacY i lacA. Genski proizvod lacZ je β-galaktozidaza koja cijepa disaharid laktozu, na glukozu i galaktozu. lacY kodira beta-galaktozidnu permeazu, membranski protein koji se ugrađuje u citoplazmatsku membranu, kako bi omogućio ćelijski transport laktoze u ćeliju. Konačno, lacA kodira galaktozid- acetiltransferazu.


1: RNK-polimeraza, 2: Represor, 3: Promotor, 4: Operator, 5: Laktoza, 6: lacZ , 7: lacY, 8: lacA.
Bilo bi rasipno proizvoditi enzime kada laktoza nije dostupna ili kada bi bio dostupan poželjan izvor energije kao što je glukoza. "lac" operon koristi dvodijelni kontrolni mehanizam kako bi osigurao da ćelija troši energiju na proizvodnju enzima koje kodira lac operon samo kada je to potrebno.[2] U nedostatku laktoze, lac represor, lacI, zaustavlja proizvodnju enzima kodiranih lac operonom.[3] Lac represor je uvijek eksprimiran, osim ako se koinduktor ne veže za njega. Drugim riječima, transkribuje se samo u prisustvu malih koinduktorskih molekula. U prisustvu glukoze, proteina aktivatora katabolita (CAP), potreban za proizvodnju enzima, ostaje neaktivan, a EIIAGlc isključuje permeazu laktoze, kako bi se spriječio transport laktoze u ćeliju. Ovaj dvostruki mehanizam kontrole uzrokuje sekvencno korištenje glukoze i laktoze u dvije različite faze rasta, poznate kao diauxie.
Struktura
[uredi | uredi izvor]
- Operon lac sastoji se od 3 strukturna gena i promotora, terminatora, regulatora i operatora. Tri strukturna gena su: lacZ, lacY i lacA.
- lacZ kodira β-galaktozidazu (LacZ), unutarćelijski enzim koji cijepa disaharid laktozu u glukozu i galaktozu.
- lacY kodira beta-galaktozidnu permeazu (LacY), transmembranski simporter koji pumpa β-galaktozide, uključujući laktozu u ćeliju koristeći protonski gradijent u istom smjeru. Permeaza povećava permeabilnost ćelije za β-galaktozide.
- lacA kodira β-galaktozid transacetilazu (LacA), enzim koji prenosi acetil grupu sa acetil-CoA na tiogalaktozid.
Čini se da su samo "lacZ" i "lacY" neophodni za laktozni katabolički put.
Genetička nomenklatura
[uredi | uredi izvor]Skraćenice od tri slova koriste se za opisivanje fenotipova u bakterijama uključujući E. coli.
Primjeri uključuju:
- Lac (sposobnost upotrebe laktoze),
- His (sposobnost sintetiziranja aminokiseline histidina)
- Mot (pokretljivost plivanja)
- SmR (otpornost na antibiotik streptomicin)
U slučaju Lac, ćelije divljeg tipa su Lac+ i mogu koristiti laktozu za ugljik i izvor energije, dok mutantni derivati Lac– ne mogu koristiti laktozu. Ista tri slova se obično koriste (mala slova, kurziv) za označavanje gena uključenih u određeni fenotip, pri čemu se svaki gen dodatno razlikuje dodatnim slovom. "lac" geni koji kodiraju enzime su "lacZ", "lacY" i "lacA". Četvrti "lac" gen je "lacI", koji kodira laktozni represor – "I" označava "inducibilnost".
Može se napraviti razlika između "strukturnih" gena koji kodiraju enzime i regulatornih gena koji kodiraju proteine koji utiču na ekspresiju gena. Sadašnja upotreba proširuje fenotipsku nomenklaturu kako bi se primijenila na proteine: tako je LacZ proteinski proizvod "lacZ" gena, β-galaktozidaze. Različite kratke sekvence koje nisu geni također utiču na ekspresiju gena, uključujući "lac" promotor, "lac p" i "lac" operator, "lac o". Iako to nije striktno standardna upotreba, mutacije koje utiču na lac o nazivaju se lac oc, iz historijskih razloga.
Regulacija
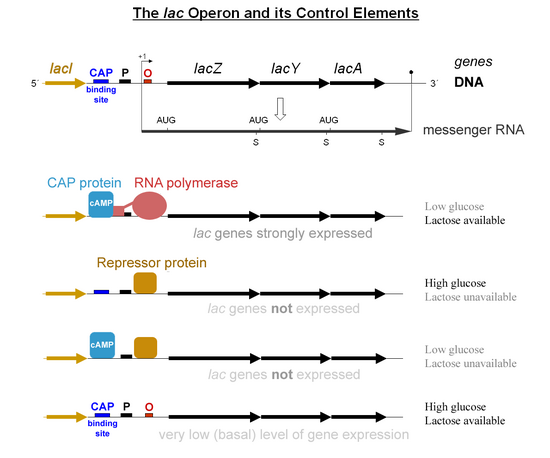
[uredi | uredi izvor]Specifična kontrola "lac" gena zavisi od dostupnosti supstrata laktoze za bakteriju. Bakterija ne proizvodi proteine kada laktoza nije dostupna kao izvor ugljika. "lac" geni su organizovani u operon; to jest, oni su orijentirani u istom pravcu neposredno pored hromosoma i kotranskribovani su u jednu policistronsku molekulu iRNK. Transkripcija svih gena počinje vezivanjem enzima RNK-polimeraza (RNAP), DNK-vezujući protein, koji se vezuje za specifično mjesto vezivanja DNK, promotora, odmah uzvodno od gena. Vezivanje RNK-polimeraze za promotor potpomaže cAMP vezan protein aktivatora katabolita (CAP, također poznat kao protein cAMP receptora).[4] Međutim, "lacI" gen (regulatorni gen za "lac" operon) proizvodi protein koji blokira RNAP od vezivanja za operonskog operatora. Ovaj protein se može ukloniti samo kada se alolaktoza veže za njega i inaktivira ga. Protein koji formira "lacI" gen poznat je kao lac represor. Tip regulacije kojoj operon lac prolazi naziva se negativno inducibilnom, što znači da je gen isključen regulatornim faktorom (lac represor) osim ako se ne doda neka molekula (laktoza). Zbog prisustva proteina represora lac, genetički inženjeri koji zamjene lacZ gen drugim genom morat će uzgajati eksperimentalne bakterije na agaru s dostupnom laktozom. Ako to ne urade, gen koji pokušavaju da eksprimiraju neće biti eksprimiran jer proteinski represor još uvijek blokira RNAP da se veže za promotor i transkribira gen. Kada se represor ukloni, RNAP zatim nastavlja sa transkripcijom sva tri gena (lacZYA) u iRNK. Svaki od tri gena na lancu iRNK ima svoju Shine-Dalgarnovu sekvencu, tako da se geni nezavisno prevode.[5] DNK sekvenca E. coli lac operona, lacZYA iRNK i lacI geni su dostupni od GenBank (view).
Prvi kontrolni mehanizam je regulatorni odgovor na laktozu, koji koristi unutarćelijski regulatorni protein zvani laktozni represor da ometa proizvodnju β-galaktozidaze u odsustvu laktoze. "lacI" gen koji kodira represor nalazi se u blizini "lac" operona i uvijek je eksprimiran ("konstitutivan"). Ako laktoza nedostaje u mediju za rast, represor se vrlo čvrsto vezuje za kratku sekvencu DNK, odmah nizvodno od promotora blizu početka "lacZ" koji se naziva "lac operator". Vezivanje represora za operatora ometa vezivanje RNAP-a za promotor, i stoga se iRNK koja kodira LacZ i LacY stvara samo na vrlo niskim nivoima. Međutim, kada se ćelije uzgajaju u prisutnosti laktoze, laktozni metabolit zvani alolaktoza, napravljen od laktoze produktom "lacZ" gena, veže se za represor, uzrokujući alosterni pomak. Tako izmijenjen, represor nije u stanju da se veže za operatera, dozvoljavajući RNAP-u da transkribira "lac" gene i na taj način dovodi do viših nivoa kodiranih proteina.
Drugi kontrolni mehanizam je odgovor na glukozu, koji koristi protein aktivatora katabolita (CAP), homodimer za značajno povećanje proizvodnje β-galaktozidaze u odsustvu glukoze. Ciklični adenozin monofosfat (cAMP) je signalna molekula čija je prevalencija obrnuto proporcionalna onoj glukoze. Veže se za CAP, što zauzvrat omogućava CAP-u da se veže za mjesto vezivanja CAP (sekvenca DNK od 16 bp uzvodno od promotora na donjem dijagramu, oko 60 bp uzvodno od mjesta početka transkripcije),[6] koji pomaže RNAP-u u vezivanju za DNK. U nedostatku glukoze, koncentracija cAMP-a je visoka i vezivanje CAP-cAMP za DNK značajno povećava proizvodnju β-galaktozidaze, omogućavajući ćeliji da hidrolizira laktozu i oslobađa galaktozu i glukozu.
Nedavno je pokazano da isključenje induktora blokira ekspresiju "lac" operona kada je prisutna glukoza. Glukoza se transportuje u ćeliju pomoću PEP-ovisnog fosfotransferaznog sistema. Fosfatna grupa fosfoenolpiruvat prenosi se putem fosforilacijske kaskade koja se sastoji od općeg PTS (fosfotransferazni sistem) proteina HPr i EIA i PTS-proteina specifičnih za glukozu EIIAGlc sup>Glc, citoplazmatski domen EII transportera glukoze. Transport glukoze je praćen njenom fosforilacijom pomoću EIIBGlc, drenirajući fosfatnu grupu iz drugih PTS proteina, uključujući EIIAGlc. Nefosforilirani oblik EIIAGlc se vezuje za lac permeazu i sprečava je da unese laktozu u ćeliju. Stoga, ako su prisutni i glukoza i laktoza, transport glukoze blokira transport induktora "lac" operona.[7]
Struktura represora
[uredi | uredi izvor]
lac repressor je četverodijelni protein, tetramer, sa identičnim podjedinicama. Svaka podjedinica sadrži motiv heliks-petlja-heliks (HTH) sposoban da se veže za DNK. Operatorsko mjesto gdje se represor vezuje je DNK sekvenca sa invertiranom simetrijom ponavljanja. Dva polumjesta DNK operatora zajedno se vezuju za dvije podjedinice represora. Iako druge dvije podjedinice represora ne rade ništa u ovom modelu, ovo svojstvo nije shvaćeno dugi niz godina.
Na kraju je otkriveno da su u lac regulaciju uključena još dva operatera.[8] Jedan (O3) leži oko -90 bp uzvodno od O1 na kraju lacI gena, a drugi (O2< /sub>) je oko +410 bp nizvodno od O1 u ranom dijelu lacZ. Ova dva mjesta nisu pronađena u ranim radovima jer imaju redundantne funkcije i pojedinačne mutacije ne utiču mnogo na potiskivanje. Pojedinačne mutacije na O2 ili O3 imaju samo 2 do 3 puta efekta. Međutim, njihov značaj pokazuje činjenica da je dvostruki mutant defektan u O2 i O3 dramatično derepresiran (oko 70 puta).
U sadašnjem modelu, lac represor je vezan istovremeno za glavni operator O1 i za O2 ili O3. Intervenirajuća DNK izlazi iz kompleksa. Redundantna priroda dva manja operatora sugerira da nije važan specifičan kompleks petlje. Jedna ideja je da sistem radi preko povezivanja; ako se vezani represor otpusti iz O1 trenutno, vezivanje za manjeg operatora ga zadržava u blizini, tako da se može brzo ponovo povezati. Ovo bi povećalo afinitet represora za O1.
Mehanizam indukcije
[uredi | uredi izvor]
Gore: Gen je u suštini isključen. Ne postoji alolaktoza koja bi inhibirala lac represor, tako da se represor čvrsto vezuje za operatora, što sprečava RNK-polimerazu da se veže za promotor, što rezultira bez laczya transkripata iRNK.
Dolje: Gen je uključen. Alolaktoza inhibira represor, dozvoljavajući RNK-polimerazi da se veže za promotor i eksprimira gene, što rezultira proizvodnjom LacZYA. Na kraju, enzimi će razložiti svu laktozu, sve dok ne postoji alolaktoza koja se može vezati za represor. Represor će se tada vezati za operatora, zaustavljajući transkripciju LacZYA gena.
Represor je alosterni protein, tj. može imati jedan od dva malo različita oblika, koji su u ravnoteži jedan s drugim. U jednom obliku represor će se vezati za DNK operatora sa visokom specifičnošću, a u drugom obliku je izgubio svoju specifičnost. Prema klasičnom modelu indukcije, vezivanje induktora, bilo alolaktoze ili IPTG, za represor utiče na distribuciju represora između dva oblika. Dakle, represor sa vezan induktorom se stabilizuje u konformaciji koja se ne vezuje za DNK. Međutim, ovaj jednostavan model ne može biti cijela priča, jer je represor prilično stabilno vezan za DNK, ali se brzo oslobađa dodavanjem induktora. Stoga se čini jasnim da se induktor također može vezati za represor kada je represor već vezan za DNK. Još uvijek nije sasvim poznato koji je tačan mehanizam vezivanja.[9]
Uloga nespecifičnog vezivanja
[uredi | uredi izvor]Nespecifično vezivanje represora za DNK ima ključnu ulogu u potiskivanju i indukciji Lac-operona. Specifično mjesto vezivanja za Lac-represorski protein je operator. Nespecifična interakcija je posredovana uglavnom interakcijama naboj-naboj, dok je vezivanje za operatora pojačano hidrofobnim interakcijama. Osim toga, postoji obilje nespecifičnih DNK sekvenci za koje se represor može vezati. U suštini, svaka sekvenca koja nije operator, smatra se nespecifičnom. Istraživanja su pokazala da bez prisustva nespecifičnog vezivanja, indukcija (ili nerepresija) Lac-operona ne bi mogla da se dogodi čak ni sa zasićenim nivoima induktora. Pokazalo se da je, bez nespecifičnog vezivanja, bazni nivo indukcije deset hiljada puta manji od uobičajenog. To je zato što nespecifična DNK djeluje kao neki tip "slivnika" za proteine represora, odvlačeći ih od operatera. Nespecifične sekvence smanjuju količinu raspoloživog represora u ćeliji. Ovo zauzvrat smanjuje količinu induktora koja je potrebna za depresiju sistema.[10]
Analozi laktoze
[uredi | uredi izvor]



Opisani su brojni derivati ili analozi laktoze koji su korisni za rad sa "lac" operonom. Ova spoja su uglavnom supstituirani galaktozidi, gde je glukozni dio laktoze zamenjen drugom hemijskom grupom.
- Izopropil-β-D-tiogalaktopiranozid (IPTG) koristi se često kao induktor lac operona za fiziološki rad.[1] IPTG se vezuje za represor i inaktivira ga, ali nije supstrat za β-galaktozidazu. Jedna od prednosti IPTG-a za studije in vivo je to što ga ne može metabolisati E. coli. Njegova koncentracija ostaje konstantna i stopa ekspresije lac p/o-kontroliranih gena nije varijabla u eksperimentu. Unos IPTG zavisi od djelovanja laktozne permeaze u P. fluorescens, ali ne i u „E. coli.[11]
- Fenil-β-D-galaktoza (fenil-Gal) je supstrat za β-galaktozidazu, ali ne inaktivira represor i stoga nije induktor. Budući da ćelije divljeg tipa proizvode vrlo malo β-galaktozidaze, ne mogu rasti na fenil-Gal-u kao ugljiku i izvoru energije. Mutanti kojima nedostaje represor mogu rasti na fenil-Gal. Dakle, minimalni medij koji sadrži samo fenil-Gal kao izvor ugljika i energije je selektivan za mutante represora i mutante operatera. Ako se 108 ćelija soja divljeg tipa stavi na agarne ploče koje sadrže fenil-Gal, rijetke kolonije koje rastu su uglavnom spontani mutanti koji utiču na represor. Relativna distribucija mutanata represora i operatora je pod uticajem ciljane veličine. Pošto je represor koji kodira lacI gen oko 50 puta veći od operatora, u selekciji preovlađuju mutanti represora.
- Tiometil galaktozid (TMG) je još jedan analog laktoze. Inhibira lacI represor. Pri niskim koncentracijama induktora, i TMG i IPTG mogu ući u ćeliju preko laktozne permeaze. Međutim, pri visokim koncentracijama induktora, oba analoga mogu nezavisno ući u ćeliju. TMG može smanjiti stope rasta pri visokim vanćelijskim koncentracijama.[12]
- Ostali spojevi služe kao šareni indikatori aktivnosti β-galaktozidaze.
- ONPG se cijepa kako bi se dobio intenzivno žuti spoj, ortonitrofenol i galaktoza, i obično se koristi kao supstrat za ispitivanje β-galaktozidaze in vitro.[13]
- Kolonije koje proizvode β-galaktozidazu postaju plave od X-gala (5-bromo-4-kloro-3-indolil-β-D-galaktozida) koji je vještački supstrat za B-galaktozidazu čije cijepanje rezultira u galaktozi i 4-Cl,3-Br indigo stvarajući tamnoplavu boju.[14]
- Alolackoza je izomer laktoze i induktor je "lac" operona. Laktoza je galaktoza-β(1→4)-glukoza, dok je alolaktoza galaktoza-β(1→6)-glukoza. Laktoza se pretvara u alolaktozu pomoću β-galaktozidaze u alternativnoj reakciji na hidrolizu. Fiziološki eksperiment koji pokazuje ulogu LacZ u proizvodnji "pravog" induktora u E. coli" je zapažanje da nulti mutant "lacZ" još uvijek može proizvesti LacY permeazu, kada se uzgaja sa IPTG, analogom alolaktoze koji se ne može hidrolizirati, ali ne i kada se uzgaja sa laktozom. Objašnjenje je da je prerada laktoze u alolaktozu (koju katalizira β-galaktozidaza) potrebna da bi se unutar ćelije proizveo induktor.
Razvoj klasičnog modela
[uredi | uredi izvor]Eksperimentalni mikroorganizam koji su koristili François Jacob i Jacques Monod bila je uobičajena laboratorijska bakterija, E. coli, ali mnogi od osnovnih regulatornih koncepta koje su otkrili Jacob i Monod su fundamentalni za ćelijsku regulaciju u svim organizmima.[15] Ključna ideja je da se proteini ne sintetiziraju kada nisu potrebni—E. coli čuva ćelijske resurse i energiju tako što ne proizvodi tri Lac proteina kada nema potrebe za metabolizmom laktoze, kao kada su dostupni drugi šećeri poput glukoze. Sljedeći dio govori o tome kako E. coli kontroliše određene gene kao odgovor na metaboličke potrebe.
Tokom Drugog svjetskog rata, Monod je testirao efekte kombinacija šećera kao izvora nutrijenata za E. coli i B. subtilis. Monod je pratio slične studije koje su proveli drugi naučnici sa bakterijama i kvascem. Otkrio je da bakterije uzgajane s dva različita šećera često pokazuju dvije faze rasta. Naprimjer, ako su obezbijeđene glukoza i laktoza, glukoza se prvo metabolizira (faza rasta I, vidi sliku 2), a zatim laktoza (faza rasta II). Laktoza se nije metabolizirala tokom prvog dijela dijauksične krivulje rasta jer β-galaktozidaza nije stvorena kada su i glukoza i laktoza bile prisutne u mediju. Monod je ovaj fenomen nazvao diauxie.[16]

Monod je zatim usredsredio svoju pažnju na indukciju stvaranja β-galaktozidaze do koje je došlo kada je laktoza bila jedini šećer u mediju kulture.[17]
Klasifikacija regulatornih mutanata
[uredi | uredi izvor]Konceptni proboj Jacoba i Monoda [18] prepoznaje razliku između regulatornih supstanci i mjesta na kojima djeluju na promjenu ekspresije gena. Bivši vojnik, Jacob je koristio analogiju bombardera koji bi oslobodio svoj smrtonosni teret po prijemu specijalnog radio prijenosa ili signala. Za radni sistem potrebni su i zemaljski predajnik i prijemnik u avionu. Sada, pretpostavimo da je uobičajeni predajnik pokvaren. Ovaj sistem može se učiniti da radi uvođenjem drugog, funkcionalnog predajnika. Nasuprot tome, rekao je, razmislite o bombarderu sa neispravnim prijemnikom. Ponašanje ovog bombardera ne može se promijeniti uvođenjem drugog, funkcionalnog aviona.
Da bi analizirao regulatorne mutante "lac" operona, Jacob je razvio sistem pomoću kojeg je druga kopija "lac" gena ("lacI" sa svojim promotorom i "lacZYA" sa promotorom i operatorom ) može se uvesti u jednu ćeliju. Kultura takvih bakterija, koje su diploidne za "lac" gene, ali inače normalne, se zatim testira na regulatorni fenotip. Konkretno, utvrđuje se da li se LacZ i LacY stvaraju čak iu odsustvu IPTG-a (zbog nefunkcionalnosti „laktoznog represora“ koji proizvodi mutantni gen). Ovaj eksperiment, u kojem se geni ili klasteri gena testiraju u paru, naziva se komplementacijski test.

Ovaj test je ilustrovan na slici (lacA je izostavljen radi jednostavnosti). Prvo su prikazana određena haploidna stanja (tj. ćelija nosi samo jednu kopiju "lac" gena). Panel (a) prikazuje represiju, (b) prikazuje indukciju IPTG-om, i (c) i (d) pokazuju efekt mutacije na "lacI" gen ili na operatera. U panelu (e) prikazan je test komplementacije za represor. Ako jedna kopija "lac" gena nosi mutaciju u "lacI", ali je druga kopija divljeg tipa za "lacI", rezultirajući fenotip je normalan – ali lacZ se eksprimira kada je izložen induktoru IPTG . Za mutacije koje utiču na represor kaže se da su „recesivne“ u odnosu na divlji tip (a taj divlji tip je „dominantan“), a to se objašnjava činjenicom da je represor mali protein koji može difundirati u ćeliji. Kopija "lac" operona pored defektnog "lacI" gena je efektivno isključena proteinom proizvedenim iz druge kopije "lacI".
Ako se isti eksperiment izvede upotrebom mutacije operatora, dobije se drugačiji rezultat (panel (f)). Fenotip ćelije koja nosi jednog mutanta i jedno operatorsko mjesto divljeg tipa je da se LacZ i LacY proizvode čak i u odsustvu induktora IPTG; oštećeno mjesto operatera ne dozvoljava vezivanje represora da inhibira transkripciju strukturnih gena. Mutacija operatora je dominantna. Kada je mjesto operatera gdje se represor mora vezati oštećeno mutacijom, prisustvo drugog funkcionalnog mjesta u istoj ćeliji ne čini nikakvu razliku u ekspresiji gena koje kontrolira mutantno mjesto.
Sofisticiranija verzija ovog eksperimenta koristi označene operone da napravi razliku između dviju kopija lac gena i pokaže da je/su neregulirani strukturni gen(i) onaj(i) pored mutantnog operatora (panel (g). Naprimjer, pretpostavimo da je jedna kopija označena mutacijom koja inaktivira lacZ tako da može proizvesti samo protein LacY, dok druga kopija nosi mutaciju koja utiče na lacY i može proizvesti samo LacZ. U ovoj verziji, samo kopija operona lac koja je susjedna mutantnom operatoru eksprimirana je bez IPTG. Kaže se da je mutacija operatora cis-dominantna, dominantna je u odnosu na divlji tip, ali utiče samo na kopiju operona koja je neposredno uz njega.
Ovo objašnjenje je pogrešno u važnom smislu, jer polazi od opisa eksperimenta, a zatim objašnjava rezultate u terminima modela. Ali u stvari, često je istina da je model na prvom mjestu, a eksperiment je napravljen posebno za testiranje modela. Jacob i Monod su prvo zamislili da u DNK mora postojati "mjesto" sa svojstvima operatora, a zatim su dizajnirali svoje komplementarne testove da to pokažu.
Dominacija operatorskih mutanata također sugerira proceduru za njihov poseban odabir. Ako su regulatorni mutanti odabrani iz kulture divljeg tipa koristeći fenil-Gal, kao što je gore opisano, mutacije operatora su rijetke u usporedbi s represorskim mutantima jer je ciljna veličina tako mala. Ali ako se umjesto toga počne sa sojem koji nosi dvije kopije cijele regije "lac" (što je diploidno za "lac"), mutacije represora (koje se još uvijek događaju) neće se oporaviti jer komplementacija drugom, gen divljeg tipa lacI daje fenotip divljeg tipa. Nasuprot tome, mutacija jedne kopije operatora daje mutantni fenotip jer je dominantan u odnosu na drugu kopiju divljeg tipa.
Regulacija cikličkim AMP-om[19]
[uredi | uredi izvor]Objašnjenje diauxie ovisi o karakterizaciji dodatnih mutacija koje utiču na lac gene, osim onih objašnjenih klasičnim modelom. Dva druga gena, cya i crp, naknadno su identifikovana koji su mapirani daleko od lac, i koji, kada su mutirani, rezultiraju smanjenim nivoom ekspresije u prisutnosti IPTG, pa čak i kod sojeva bakterija kojima nedostaje represor ili operater. Otkriće cAMP-a u E. coli dovelo je do demonstracije da se mutanti koji defektiraju cya gen, ali ne i crp gen mogu vratiti u punu aktivnost dodavanjem cAMP-a u mediju.
Gen cya kodira adenilat ciklazu, koja proizvodi cAMP. Kod cya mutanata, odsustvo cAMP čini ekspresiju lacZYA gena više od deset puta nižom od normalne. Dodavanje cAMP koriguje nisku ekspresiju Lac karakterističnu za cya mutante. Drugi gen, crp, kodira protein nazvan protein aktivatora katabolita (CAP) ili protein cAMP receptora (CRP).[20]
Međutim, enzimi metabolizma laktoze nastaju u malim količinama u prisutnosti i glukoze i laktoze (ponekad se naziva nepropusna ekspresija) zbog činjenice da se LacI represor brzo povezuje/odvaja od DNK umjesto da se čvrsto vezuje za nju, što može omogućiti vrijeme da RNAP veže i transkribira iRNK od lacZYA. Nepropusna ekspresija je neophodna kako bi se omogućio metabolizam neke laktoze nakon što se izvor glukoze potroši, ali prije nego što se ekspresija lac u potpunosti aktivira.
U sažetku:
- Kada je laktoza odsutna, postoji vrlo mala proizvodnja Lac enzima (operater ima Lac represor vezan za nju).
- Kada je laktoza prisutna, ali je takođe prisutan preferirani izvor ugljika (kao što je glukoza), tada se proizvodi mala količina enzima (Lac represor nije vezan za operatera).
- Kada je glukoza odsutna, CAP-cAMP se vezuje za specifično mjesto DNK uzvodno od promotora i ostvaruje direktnu interakciju protein-protein sa RNAP-om što olakšava vezivanje RNAP-a za promotor.
Kašnjenje između faza rasta odražava vrijeme potrebno za proizvodnju dovoljnih količina enzima koji metaboliziraju laktozu. Prvo, CAP regulatorni protein se mora sastaviti na lac promotoru, što rezultira povećanjem proizvodnje lac iRNK. Više dostupnih kopija lac iRNK rezultira proizvodnjom (vidi translacija) znatno više kopija LacZ (β-galaktozidaze, za metabolizam laktoze) i LacY (laktozna permeaza za transport laktoze u ćeliju). Nakon kašnjenja potrebnog za povećanje razine enzima koji metaboliziraju laktozu, bakterije ulaze u novu brzu fazu ćelijskog rasta.
Dvije zagonetke represije katabolita odnose se na to kako su nivoi cAMP-a povezani sa prisustvom glukoze, i drugo, zašto bi ćelije uopće trebale smetati. Nakon što se laktoza cijepa, ona zapravo stvara glukozu i galaktozu (lahko se pretvara u glukozu). U metaboličkom smislu, laktoza je jednako „dobar“ izvor ugljika i energije kao i glukoza. Nivo cAMP nije povezan sa unutarćelijskom koncentracijom glukoze, već sa brzinom transporta glukoze, koja utiče na aktivnost adenilat ciklaze. (Pored toga, transport glukoze dovodi i do direktne inhibicije laktozne permeaze.) Zašto to E. coli radi na ovaj način, može se samo nagađati. Sve enterične bakterije fermentiraju glukozu, što sugerira da se s njom često susreću. Moguće je da mala razlika u efikasnosti transporta ili metabolizma glukoze u odnosu na laktozu čini korisnim za ćelije da regulišu lac operon na ovaj način.[21]
Upotreba u molekulskoj biologiji
[uredi | uredi izvor]"lac" gen i njegovi derivati mogu se koristiti kao gen reporter u brojnim tehnikama selekcije zasnovanim na bakterijama kao što je analiza dva hibrida, u kojoj je uspješno vezivanje transkripcijskog aktivatora na specifičnu sekvencu promotora mora se odrediti.[14] U LB pločama koje sadrže X-gal, promjena boje od bijelih kolonija do nijanse plave odgovara oko 20-100 jedinica β-galaktozidaze, dok tetrazolij laktoza i MacConkeyev laktozni medij imaju raspon od 100–1000 jedinica, najosjetljiviji su u visokom i niskom dijelu ovog raspona, redom.[14] Od MacConkeyeve laktoze i tetrazolij laktoznog medija oba se oslanjaju na proizvode razgradnje laktoze, zahtijevaju prisustvo i "lacZ" i "lacY" gena. Mnoge "lac" tehnike fuzije koje uključuju samo "lacZ" gen su stoga prikladne za X-gal ploče.[14] ili ONPG tečne bujone.[22]
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ a b Griffiths, Anthony J.F.; Wessler, Susan R.; Carroll, Sean B.; Doebley, John (2015). An Introduction to Genetic Analysis (11 izd.). Freeman, W.H. & Company. str. 400–412. ISBN 9781464109485.
- ^ McClean, Phillip (1997). "Prokaryotic Gene Expression". ndsu.edu. Pristupljeno 19. 5. 2017.
- ^ "Prokaryotic Gene Expression". ndsu.edu. Pristupljeno 19. 5. 2017.
- ^ Busby S., Richard H. Ebright (2001). "Transcription activation by catabolite activator protein (CAP)". J. Mol. Biol. 293 (2): 199–213. doi:10.1006/jmbi.1999.3161. PMID 10550204.
- ^ Kennell, David; Riezman, Howard (juli 1977). "Transcription and translation initiation frequencies of the Escherichia coli lac operon". Journal of Molecular Biology. 114 (1): 1–21. doi:10.1016/0022-2836(77)90279-0. PMID 409848.
- ^ Malan, T. Philip; Kolb, Annie; Buc, Henri; McClure, William (decembar 1984). "Mechanism of CRP-cAMP Activation of lac Operon Transcription Initiation Activation of the P1 Promoter". J. Mol. Biol. 180 (4): 881–909. doi:10.1016/0022-2836(84)90262-6. PMID 6098691.
- ^ Görke B, Stülke J (august 2008). "Carbon catabolite repression in bacteria: many ways to make the most out of nutrients". Nature Reviews. Microbiology. 6 (8): 613–24. doi:10.1038/nrmicro1932. PMID 18628769. S2CID 8782171.
- ^ Oehler, S.; Eismann, E. R.; Krämer, H.; Müller-Hill, B. (1990). "The three operators of the lac operon cooperate in repression". The EMBO Journal. 9 (4): 973–979. doi:10.1002/j.1460-2075.1990.tb08199.x. PMC 551766. PMID 2182324.
- ^ Griffiths, Anthony JF; Gelbart, William M.; Miller, Jeffrey H.; Lewontin, Richard C. (1999). "Regulation of the Lactose System". Modern Genetic Analysis (jezik: engleski). New York: W. H. Freeman. ISBN 0-7167-3118-5.
- ^ von Hippel, P.H.; Revzin, A.; Gross, C.A.; Wang, A.C. (decembar 1974). "Non-specific DNA binding of genome regulating proteins as a biological control mechanism: I. The lac operon: equilibrium aspects". PNAS. 71 (12): 4808–12. doi:10.1073/pnas.71.12.4808. PMC 433986. PMID 4612528.
- ^ Hansen LH, Knudsen S, Sørensen SJ (juni 1998). "The effect of the lacY gene on the induction of IPTG inducible promoters, studied in Escherichia coli and Pseudomonas fluorescens". Curr. Microbiol. 36 (6): 341–7. doi:10.1007/s002849900320. PMID 9608745. S2CID 22257399. Arhivirano s originala, 18. 10. 2000.
- ^ Marbach A, Bettenbrock K (Jan 2012). "lac operon induction in Escherichia coli: Systematic comparison of IPTG and TMG induction and influence of the transacetylase LacA". Journal of Biotechnology. 157 (1): 82–88. doi:10.1016/j.jbiotec.2011.10.009. PMID 22079752.
- ^ "ONPG (β-Galactosidase) test". septembar 2000. Arhivirano s originala, 3. 11. 2007. Pristupljeno 25. 10. 2007.
- ^ a b c d Joung J, Ramm E, Pabo C (2000). "A bacterial two-hybrid selection system for studying protein–DNA and protein–protein interactions". Proc Natl Acad Sci USA. 97 (13): 7382–7. Bibcode:2000PNAS...97.7382J. doi:10.1073/pnas.110149297. PMC 16554. PMID 10852947.
- ^ "Milestone 2 – A visionary pair : Nature Milestones in gene expression". www.nature.com. Pristupljeno 27. 12. 2015.
- ^ Muller-Hill, Benno (1996). The lac Operon, a Short History of a Genetic Paradigm. Berlin: Walter de Gruyter. str. 7–10. ISBN 3-11-014830-7.
- ^ McKnight, Steven L. (1992). Transcriptional Regulation. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. str. 3–24. ISBN 0-87969-410-6.
- ^ Jacob F.; Monod J (juni 1961). "Genetic regulatory mechanisms in the synthesis of proteins". J Mol Biol. 3 (3): 318–56. doi:10.1016/S0022-2836(61)80072-7. PMID 13718526.
- ^ Montminy, M. (1997). "Transcriptional regulation by cyclic AMP". Annual Review of Biochemistry. 66: 807–822. doi:10.1146/annurev.biochem.66.1.807. ISSN 0066-4154. PMID 9242925.
- ^ Botsford, J L; Harman, J G (mart 1992). "Cyclic AMP in prokaryotes". Microbiological Reviews. 56 (1): 100–122. doi:10.1128/MMBR.56.1.100-122.1992. ISSN 0146-0749. PMC 372856. PMID 1315922.
- ^ Vazquez A, Beg QK, Demenezes MA, et al. (2008). "Impact of the solvent capacity constraint on E. coli metabolism". BMC Syst Biol. 2: 7. doi:10.1186/1752-0509-2-7. PMC 2270259. PMID 18215292.
- ^ "Induction of the lac operon in E. coli" (PDF). SAPS. Arhivirano s originala (PDF), 20. 1. 2022. Pristupljeno 29. 6. 2016.
Vanjski linkovi
[uredi | uredi izvor]- Lac Operon na US National Library of Medicine Medical Subject Headings (MeSH)
- lac operon in NCBI Bookshelf [2]
- Virtual Cell Animation Collection Introducing: The Lac Operon Arhivirano 2. 1. 2014. na Wayback Machine
- The lac Operon: Bozeman Science
- Staining Whole Mouse Embryos for β-Galactosidase (lacZ) Activity