Laktaza
| Laktaza | |
|---|---|
 Laktazni tetramer E. coli | |
| Identifikatori | |
| Simbol | Lac |
| CAS broj | |
| Glikozilkeramidaza (Florizin hidrolaza) | |
|---|---|
 | |
| Identifikatori | |
| Simbol | LAC |
| CAS broj | |
| Laktaza | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatori | |||||||
| Simbol | LCT | ||||||
| Alt. simboli | LAC; LPH; LPH1 | ||||||
| NCBI gen | 3938 | ||||||
| HGNC | 6530 | ||||||
| OMIM | 603202 | ||||||
| RefSeq | NM_002299 | ||||||
| UniProt | P09848 | ||||||
| Ostali podaci | |||||||
| EC broj | 3.2.1.108 | ||||||
| Lokus | Hrom. 2 q21 | ||||||
| |||||||
Laktaza je enzim koji proizvode mnogi organizmi. Nalazi se u četkastoj granici tankog crijeva ljudi i drugih sisara. Laktaza je neophodna za potpunu probavu punomasnog mlijeka; razgrađuje laktozni, šećer koji daje mlijeku slatkoću. U nedostatku laktaze, osoba koja konzumira mliječne proizvode može osjetiti simptome intolerancije na laktozu.[1] Laktaza se može kupiti kao dodatak hrani i dodaje se mlijeku za proizvodnju mliječnih proizvoda "bez laktoze".
Laktaza (također poznata kao laktaza-florizin hidrolaza, ili LPH), dio porodice β-galaktozidaznih enzima, je glikozidna hidrolaza uključena u hidrolizu disaharida laktoze u sastavnog monomera galaktoze i glukoze . Laktaza je pretežno prisutna duž četkaste granice membrane diferenciranih enterocita koji oblažu resice tankog crijeva.[2] Kod ljudi, laktaza je kodirana genom LCT na hromosomu 2.[3][4]
Upotreba
[uredi | uredi izvor]Hrana
[uredi | uredi izvor]Laktaza je enzim koji neki ljudi nisu u stanju proizvesti u svom tankom crijevu.[5] Bez toga ne mogu razgraditi prirodnu mliječnu laktozu, zbog čega imaju dijareje, plinove i nadimanje kada piju obično mlijeko. Tehnologiju za proizvodnju mlijeka, sladoleda i jogurta bez laktoze razvila je Služba za poljoprivredna istraživanja USDA, 1985. godine.[6] Ova tehnologija koristi se za dodavanje laktaze u mlijeko, čime se hidrolizira laktoza koja se prirodno nalazi u mlijeku, ostavljajući je pomalo slatkastom, ali svarljivom za sve.[7] Bez laktaze, ljudi s intolerancijom na laktozu prenose laktozu nesvarenu u debelo crijevo[8] gdje ja bakterije razgrađuju stvarajući ugljik-dioksid i to dovodi do nakupljanja plinova i nadimanja.
Medicinska upotreba
[uredi | uredi izvor]Suplementi laktaze se ponekad koriste za liječenje netolerancije na laktozu.[9]
Industrijska upotreba
[uredi | uredi izvor]Laktaza proizvedena komercijalno može se ekstrahirati i iz kvasaca kao što su Kluyveromyces fragilis i Kluyveromyces lactis i iz plijesni, kao što su Aspergillus niger i Aspergillus oryzae.[10] Njegova primarna komercijalna upotreba je razgradnja laktoze u mlijeku kako bi bila pogodna za osobe s intolerancijom na laktozu, u suplementima i proizvodima kao što su oni sa Lacteeze i Lactaid.[11][12] Američka Agencija za hranu i lijekove nije odmah odobrila ovaj reoizvod.[13]
Laktaza (ili sličan oblik beta-galaktozidaza) se također koristi za skrining na plavo bijele kolonije u mjestu višestrukog kloniranja različitih plazmidnih vektora u Escherichia coli ili drugim bakterijama.[14][15]
Mehanizam
[uredi | uredi izvor]Optimalna temperatura za ljudsku laktazu je oko 37 °C[16] a optimalni pH je 6.[2]
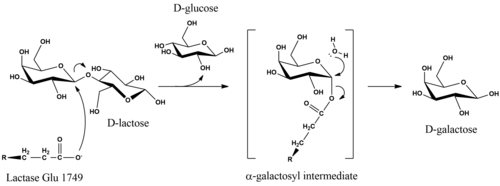
U metabolizmu, β-glikozidna veza u D-laktozi se hidrolizira i formira D-galaktozu i D-glukozu, koje mogu se apsorbirati kroz crijevne zidove i u krvotok. Ukupna reakcija koju laktaza katalizira je C12H22O11 + H2O → C 6H12O6 + C6H12O6 + toplota.
Katalitski mehanizam hidrolize D-laktoze u proizvodima zadržava anomernu konfiguraciju supstrata.[17] Iako su detalji mehanizma nesigurni, stereohemijsko zadržavanje postiže se reakcijom dvostrukog pomaka. Studije laktaza E. coli predložile su da se hidroliza pokreće kada glutamatni nukleofil na enzimu napadne sa aksijalne strane galaktozilnj ugljika u β-glikozidnoj vezi.[18] Uklanjanje odlazeće grupe D-glukoze može biti olakšano kiselinskom katalizom zavisnom od Mg.[18] Enzim se oslobađa iz α-galaktozilnog dijela, nakon ekvatorskog nukleofilnog napada pomoću vode, koja proizvodi D-galaktozu.[17]
Studije modifikacije supstrata pokazale su da su 3'-OH i 2'-OH dijelovi na galaktopiranoznom prstenu bitni za enzimsko prepoznavanje i hidrolizu.[19] 3'-hidroksi grupa je uključena u početno vezivanje za supstrat, dok 2'- grupa nije neophodna za prepoznavanje, ali je potrebna u narednim koracima. Ovo se pokazuje činjenicom da je 2-dezoksi analog efikasan kompetitivni inhibitor (Ki = 10mM).[19] Eliminacija specifičnih hidroksilnih grupa na glukopiranoznom dijelu čini ne eliminiše katalizu.[19]
Laktaza također katalizira konverziju florizina u floretin i glukozu.
Struktura i biosinteza
[uredi | uredi izvor]Preprolaktaza, primarni translacijski proizvod, ima jednu polipeptidnu primarnu strukturu koja se sastoji od 1927 aminokiselina.[3] Može se podijeliti na pet domena: (1) 19-amino-kiselina cijepanje signalna sekvenca, (2) veliki domen prosekvencije koji nije prisutan u zreloj laktazi, (3) segment zrele laktaze, (4) hidrofobno sidro koje se proteže kroz membranu i (5) kratki hidrofilni karboksilni završetak.[3] Signalna sekvenca cijepa se u endoplazmatskom retikulumu (ER), a rezultirajući pro-LPH od 215 kDa se šalje u Golgijev aparat , gdje je jako glikoziliran i proteolitski obrađen do svog zrelog oblika.[20] Pokazalo se da prodomen djeluje kao unutarmolekulsk šaperon u ER-u, sprečavajući cijepanje tripsina i omogućavajući LPH-u da dobije potrebnu 3-D strukturu za transport do Golgijevog aparata..[21]

Zrela ljudska laktaza sastoji se od jednog polipeptidnog lanca od 160 kDa koji se nalazi na membranskoj četkici crijevnih epitelnih ćelija. Orijentiran je a N-terminalom izvan ćelije i C-terminalom u citosolu.[3] LPH sadrži dva mjesta katalitske glutaminske kiseline. U ljudskom enzimu, aktivnost laktaze je povezana sa Glu-1749, dok je Glu-1273 mjesto funkcije florizin hidrolaze.[22]
Genetička ekspresija i regulacija
[uredi | uredi izvor]Laktaza je kodirana jednim genskim lokusom na kromosomu 2.[23] Eksprimira se isključivo putem enterocita tankog crijeva sisara i to u vrlo niskim razinama u debelom crijevu, tokom fetusnog razvoja.[23] Ljudi se rađaju s visokim nivoom ekspresije laktaze. U većini svjetske populacije, transkripcija laktaze je smanjena nakon odbijanja, što rezultira smanjenom ekspresijom laktaze u tankom crijevu,[23] i uzrokuje uobičajene simptome hipolaktazije odraslog tipa ili netolerancije na laktozu.[24]
Neki segmenti populacije pokazuju perzistenciju laktaze koja je posljedica mutacije za koju se pretpostavlja da se dogodila prije 5.000–10.000 godina, što se poklapa s porastom pripitomljavanja goveda.[25] Ova mutacija omogućila je skoro polovini svjetske populacije da metabolizira laktozu bez simptoma. Studije su povezale pojavu perzistencije laktaze sa dva različita jednonukleotidna polimorfizma od oko 14 i 22 kilobaze uzvodno od 5'-kraja LPH gena.[26] Obje mutacije, C→T na poziciji -13910 i G→ A na poziciji -22018, nezavisno su povezane sa perzistencijom laktaze.[27]
Promotor laktaze je dug 150 [bazni par|[parova baza]] i nalazi se odmah uzvodno od mjesta inicijacije transkripcije.[27] Sekvenca je visoko konzervirana kod sisara, što sugerira da se kritični cis-transkripcijski regulatori nalaze u blizini.[27] Cdx-2, HNF-1α i GATA identifikovani su kao faktori transkripcije.][27] Studije o početku hipolaktazije pokazale su da uprkos polimorfizmima, postoji mala razlika u ekspresiji laktaze kod novorođenčadi, ispoljavajući da mutacije postaju sve relevantnije tokom razvoja.[28] Razvojno regulirani proteini koji se vezuju za DNK mogu smanjiti transkripciju ili destabilizirati transkripte iRNK, uzrokujući smanjenu ekspresiju LPH nakon odvikavanja.[28]
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ Järvelä I, Torniainen S, Kolho KL (2009). "Molecular genetics of human lactase deficiencies". Annals of Medicine. 41 (8): 568–75. doi:10.1080/07853890903121033. PMID 19639477. S2CID 205586720.
- ^ a b Skovbjerg H, Sjöström H, Norén O (Mar 1981). "Purification and characterisation of amphiphilic lactase/phlorizin hydrolase from human small intestine". European Journal of Biochemistry. 114 (3): 653–61. doi:10.1111/j.1432-1033.1981.tb05193.x. PMID 6786877.
- ^ a b c d Mantei N, Villa M, Enzler T, Wacker H, Boll W, James P, Hunziker W, Semenza G (Sep 1988). "Complete primary structure of human and rabbit lactase-phlorizin hydrolase: implications for biosynthesis, membrane anchoring and evolution of the enzyme". The EMBO Journal. 7 (9): 2705–13. doi:10.1002/j.1460-2075.1988.tb03124.x. PMC 457059. PMID 2460343.
- ^ Harvey CB, Fox MF, Jeggo PA, Mantei N, Povey S, Swallow DM (Jul 1993). "Regional localization of the lactase-phlorizin hydrolase gene, LCT, to chromosome 2q21". Annals of Human Genetics. 57 (Pt 3): 179–85. doi:10.1111/j.1469-1809.1993.tb01593.x. PMID 8257087. S2CID 38604778.
- ^ "Lactose Intolerance". Mayo Clinic. Mayo Clinic. Pristupljeno 13. 3. 2018.
- ^ Porch, Kaitlyn (12. 4. 2018). "Lactose-Free Milk, Low-Fat Cheese, and More Dairy Breakthroughs". www.federallabs.org (jezik: engleski). Pristupljeno 26. 10. 2018.
- ^ "Asked: How do dairies make lactose free milk?". USA Today. 3. 9. 2014. Pristupljeno 13. 3. 2018.
- ^ "Lactose intolerance - Symptoms and causes". Mayo Clinic (jezik: engleski). Pristupljeno 8. 11. 2020.
- ^ "Lactose Intolerance". NIDDK. juni 2014. Pristupljeno 25. 10. 2016.
- ^ Seyis I, Aksoz N (2004). "Production of Lactase by Trichoderma sp". Food Technology and Biotechnology. 42 (2): 121–124.
- ^ DSM Food Specialties (3. 4. 2014). "GRAS Notification for Acid Lactase from Aspergillus oryzae Expressed in Aspergillus niger" (PDF). str. 1. Arhivirano s originala, 31. 10. 2017 – preko U.S. Food and Drug Administration.
- ^ Holsinger VH (1992). "Innovative Products for Food Industries: The Lactaid Story". New Crops, New Uses, New Markets: 1992 Yearbook of Agriculture. U.S. Department of Agriculture. str. 256–258. Arhivirano s originala, 17. 7. 2022. Pristupljeno 1. 4. 2022.
- ^ Tarantino, LM (12. 12. 2003). "Agency Response Letter GRAS Notice No. GRN 000132". U.S. Food and Drug Administration. Arhivirano s originala, 26. 3. 2011.
- ^ Lau HM, Lee LS, Soh WC, Tue SW (mart 2013). "Introduction". Lactase. Universiti Teknologi Malaysia. Pristupljeno 16. 11. 2018.
- ^ "pBluescript II KS(+/−), pBluescript II SK(+/−): description & restriction map". Fermentas. Arhivirano s originala, 19. 10. 2008.
- ^ Hermida C, Corrales G, Cañada FJ, Aragón JJ, Fernández-Mayoralas A (Jul 2007). "Optimizing the enzymatic synthesis of beta-D-galactopyranosyl-D-xyloses for their use in the evaluation of lactase activity in vivo". Bioorganic & Medicinal Chemistry. 15 (14): 4836–40. doi:10.1016/j.bmc.2007.04.067. hdl:10261/81580. PMID 17512743.
- ^ a b Sinnott M (novembar 1990). "Catalytic mechanisms of enzymic glycosyl transfer". Chem. Rev. 90 (7): 1171–1202. doi:10.1021/cr00105a006.
- ^ a b Juers DH, Heightman TD, Vasella A, McCarter JD, Mackenzie L, Withers SG, Matthews BW (Dec 2001). "A structural view of the action of Escherichia coli (lacZ) beta-galactosidase". Biochemistry. 40 (49): 14781–94. doi:10.1021/bi011727i. PMID 11732897.
- ^ a b c Fernandez P, Cañada FJ, Jiménez-Barbero J, Martín-Lomas M (Jul 1995). "Substrate specificity of small-intestinal lactase: study of the steric effects and hydrogen bonds involved in enzyme-substrate interaction". Carbohydrate Research. 271 (1): 31–42. doi:10.1016/0008-6215(95)00034-Q. PMID 7648581.
- ^ Naim HY, Sterchi EE, Lentze MJ (Jan 1987). "Biosynthesis and maturation of lactase-phlorizin hydrolase in the human small intestinal epithelial cells". The Biochemical Journal. 241 (2): 427–34. doi:10.1042/bj2410427. PMC 1147578. PMID 3109375.
- ^ Naim HY, Jacob R, Naim H, Sambrook JF, Gething MJ (Oct 1994). "The pro region of human intestinal lactase-phlorizin hydrolase". The Journal of Biological Chemistry. 269 (43): 26933–43. doi:10.1016/S0021-9258(18)47109-8. PMID 7523415.
- ^ Zecca L, Mesonero JE, Stutz A, Poirée JC, Giudicelli J, Cursio R, Gloor SM, Semenza G (Sep 1998). "Intestinal lactase-phlorizin hydrolase (LPH): the two catalytic sites; the role of the pancreas in pro-LPH maturation". FEBS Letters. 435 (2–3): 225–8. doi:10.1016/S0014-5793(98)01076-X. PMID 9762914. S2CID 33421778.
- ^ a b c Troelsen JT, Mitchelmore C, Spodsberg N, Jensen AM, Norén O, Sjöström H (Mar 1997). "Regulation of lactase-phlorizin hydrolase gene expression by the caudal-related homoeodomain protein Cdx-2". The Biochemical Journal. 322 ( Pt 3) (Pt. 3): 833–8. doi:10.1042/bj3220833. PMC 1218263. PMID 9148757.
- ^ Reference, Genetics Home. "LCT gene". Genetics Home Reference. Pristupljeno 3. 4. 2018.
- ^ Bersaglieri T, Sabeti PC, Patterson N, Vanderploeg T, Schaffner SF, Drake JA, Rhodes M, Reich DE, Hirschhorn JN (Jun 2004). "Genetic signatures of strong recent positive selection at the lactase gene". American Journal of Human Genetics. 74 (6): 1111–20. doi:10.1086/421051. PMC 1182075. PMID 15114531.
- ^ Kuokkanen M, Enattah NS, Oksanen A, Savilahti E, Orpana A, Järvelä I (maj 2003). "Transcriptional regulation of the lactase-phlorizin hydrolase gene by polymorphisms associated with adult-type hypolactasia". Gut. 52 (5): 647–52. doi:10.1136/gut.52.5.647. PMC 1773659. PMID 12692047.
- ^ a b c d Troelsen JT (maj 2005). "Adult-type hypolactasia and regulation of lactase expression". Biochimica et Biophysica Acta (BBA) - General Subjects. 1723 (1–3): 19–32. doi:10.1016/j.bbagen.2005.02.003. PMID 15777735.
- ^ a b Wang Y, Harvey CB, Hollox EJ, Phillips AD, Poulter M, Clay P, Walker-Smith JA, Swallow DM (Jun 1998). "The genetically programmed down-regulation of lactase in children". Gastroenterology. 114 (6): 1230–6. doi:10.1016/S0016-5085(98)70429-9. PMID 9609760.
Vanjski linkovi
[uredi | uredi izvor]- The Lactase Protein
- E. coli β-galactosidase: PDB 1JYY
- Gene Ontology for Lactase
- Making of the Fittest: Got Lactase? The Co-evolution of Genes and Culture Arhivirano 10. 3. 2019. na Wayback Machine
- Lactase persistence shows indication of association with Obesity
- PDBe-KB provides an overview of all the structure information available in the PDB for Human Beta-galactosidase
- PDBe-KB provides an overview of all the structure information available in the PDB for Escherichia coli Beta-galactosidase
Šablon:Metabolizam fruktoze i galaktoze Šablon:Hidroliza šećera
