Metagenomika
| Dio članaka o |
| Genetici |
|---|
 |
| Ključne komponente |
| Historija i teme |
| Istraživanje |
| Personalizovana medicina |
| Personalizovana medicina |

Metagenomika je proučavanje genetičkog materijala dobijenog direktno iz okruženja ili kliničkih uzoraka, metodom zvanom sekvenciranje. Široko polje se također može nazvati genomika okoline, ekogenomika, genomika zajednice ili mikrobiomika.
Dok se tradicionalna mikrobiologija i mikrobno sekvenciranje genoma i genomika oslanjaju na kultivirane klonske kulture, rano sekvenciranje gena u okolini kloniralo je specifične gene (često 16S rRNK) za proizvodnju profila raznolikosti u prirodnom uzorku. Takav rad je otkrio da je velika većina mikrobne bioraznolikosti propuštena metodama zasnovanim na uzgoju.[2]
Zbog svoje sposobnosti da otkrije prethodno skrivenu raznolikost mikroskopskog života, metagenomika nudi moćno sočivo za sagledavanje mikrobnog svijeta, koje ima potencijal da revolucionira razumijevanjem cijelog živog svijeta.[3] Kako cijena sekvenciranja DNK nastavlja da opada, metagenomika sada omogućava da se mikrobna ekologija istražuje u mnogo većoj skali i detaljima nego prije. Nedavne studije koriste ili "nasumićno sekvenciranje" ili PCR usmjereno sekvenciranje kako bi se dobili uglavnom nepristrasni uzorci svih gena od svih članova uzorkovanih zajednica.[4]
Etimologija
[uredi | uredi izvor]Termin "metagenomika" prvi su upotrijebili Jo Handelsman, Robert M. Goodman, Michelle R. Rondon, Jon Clardy i Sean F. Brady, a prvi put se pojavio u publikaciji 1998.[5] Termin metagenom se odnosio na ideju da se kolekcija gena sekvenciranih iz okoline može analizirati na način analogan proučavanju jednog genoma. Godine 2005., Kevin Chen i Lior Pachter (istraživači na Univerzitetu Kalifornije, Berkeley) definisali su metagenomiku kao "primenu moderne tehnike genomike bez potrebe za izolacijom i laboratorijskim uzgojem pojedinačnih vrsta".< ref name="Chen2005"/>
Historija
[uredi | uredi izvor]Šablon:DNK barkodiranje Konvencijsko sekvenciranje počinje kulturom identičnih ćelija kao izvora DNK. Međutim, rane metagenomske studije otkrile su da vjerovatno postoje velike grupe mikroorganizama u mnogim sredinama koje se ne mogu kultivisati i stoga ne mogu sekvencirati. Ove rane studije fokusirale su se na sekvence 16S ribosomske RNK (rRNK) koje su relativno kratke, često konzervirane unutar vrsta, i općenito različite među vrstama. Pronađene su mnoge sekvence 16S rRNK koje ne pripadaju nijednoj poznatoj kultivisanoj vrsti, što ukazuje da postoje brojni neizolovani organizmi. Ova istraživanja gena ribosomske RNK uzetih direktno iz okoline otkrila su da metode zasnovane na kultivaciji pronalaze manje od 1% bakterijskih i Archaeal vrsta u uzorku.[2] Veliki dio interesovanja za metagenomiku potiče od ovih otkrića koja su pokazala da je velika većina mikroorganizama ranije prošla nezapaženo. Ranih 1980-ih molekulska istraživanja na terenu su vodili Norman R. Pace i kolege, koji su koristili PCR za istraživanje raznolikosti sekvenci ribosomske RNK.[6] Uvidi stečeni iz ovih revolucionarnih studija naveli su Pacea da predloži ideju kloniranja DNK direktno iz uzoraka okoliša još 1985.[7] Ovo je dovelo do prvog izvještaja o izolaciji i kloniranja masovne DNK iz uzorka okoliša, koji su objavili Pace i kolege 1991.[8] dok je Pace bio na Odsjeku za biologiju u Univerziteta Indijana. Značajni napori su osigurali da ovo nisu PCR lažno pozitivni i podržali postojanje složene zajednice neistraženih vrsta. Iako je ova metodologija bila ograničena na istraživanje visoko konzerviranih, gena koji ne kodiraju proteine, ona je podržala rana zapažanja zasnovana na mikrobnoj morfologiji da je raznolikost daleko složenija nego što je to bilo poznato metodama uzgoja. Ubrzo nakon toga, 1995. godine, Healy je izvijestio o metagenomskoj izolaciji funkcionalnih gena iz "zooliblioteka" konstruiranih od kompleksne kulture ekoloških organizama uzgojenih u laboratoriji na osušenim travama.[9] Nakon odlaska Laboratorija Pace, Edward DeLong nastavio je na terenu i objavio rad koji je u velikoj mjeri postavio temelje za filogenije životne sredine, zasnovane na signaturnim sekvencama 16S, počevši od njegove grupe izgradnjom biblioteka iz morskih uzoraka .[10]
Godine 2002. Mya Breitbart, Forest Rohwer i kolege su koristili nasumično sekvenciranje (vidi dolje) kako bi pokazali da 200 litara morske vode sadrži preko 5000 različitih virusa.[11] Naknadne studije su pokazale da postoji više od hiljadu vrsta virusa u ljudskoj stolici i možda milion različitih virusa po kilogramu morskog sedimenta, uključujući mnoge bakteriofage. U suštini svi virusi u ovim studijama bili su nove vrste. Godine 2004, Gene Tyson, Jill Banfield i kolege sa Univerzitet Kalifornije, Berkeley i Joint Genome Institute su sekvencionirali DNK ekstrahiranu iz acid mine drainage sistema.[12] Ovaj napor je rezultirao kompletnim, ili gotovo potpunim, genomima za šačicu bakterija i archaea koji su se ranije odupirali pokušajima njihovog uzgoja.[13]
Počevši od 2003. godine, Craig Venter, vođa privatno finansirane paralele Projekta ljudskog genoma, predvodi Globalnu ekspediciju za uzorkovanje okeana (GOS), obilazeći svijet i prikupljajući metagenomske uzorke širom svijeta putovanje. Svi ovi uzorci su sekvencionirani pomoću nasumičnog sekvenciranja, u nadi da će novi genomi (a samim tim i novi organizmi) biti identificirani. Pilot projekat, sproveden u Sargaškom moru, pronašao je DNK od skoro 2000 različitih vrsta, uključujući 148 tipova bakterija koje nikada ranije nisu viđene.[14] Venter je temeljito istražio Zapadnu obalu Sjedinjenih Država, i završio dvogodišnju ekspediciju da istraži Baltik, Mediteran i Crno more. Analiza metagenomskih podataka prikupljenih tokom ovog putovanja otkrila je dvije grupe organizama, jednu sastavljenu od taksona prilagođenih ekološkim uvjetima 'gozba ili glad', a drugu sastavljenu od relativno manjeg broja, ali obilnije i šire rasprostranjenih taksona prvenstveno sastavljenih od planktona.[15]
Godine 2005. Stephan C. Schuster i kolege sa Penn State University objavili su prve sekvence uzorka okoline generirane pomoću visokopropusnog sekvenciranja, u ovom slučaju masovno paralelnog pirosekvenciranja koje je razvio 454 Life Sciences.[16] Još jedan rani rad u ovoj oblasti pojavio se 2006. Robert Edwards, Forest Rohwer, i kolege sa San Diego State Univerziteta.[17]
Sekvenciranje
[uredi | uredi izvor]
Oporavak DNK sekvenci dužih od nekoliko hiljada baznih parovas iz okoline uzoraka bio je veoma težak sve dok nedavni napredak u molekularno biološkim tehnikama nije omogućio konstrukciju biblioteke u bakterijski umjetni hromozom (BAC), što je omogućilo bolje vektore za molekularno kloniranje.[19]
Nasumična metagenomika
[uredi | uredi izvor]Napredak u bioinformatici, poboljšanja amplifikacije DNK i širenje računarske snage uveliko su pomogli analizi sekvenci DNK dobijenih iz uzoraka okoline, omogućavajući prilagođavanje nasumičnog sekvenciranja metagenomskim uzorcima (poznatim i kao cjeloviti metagenomska sačmarica ili WMGS sekvenciranje). Pristup, koji se koristi za sekvenciranje mnogih kultiviranih mikroorganizama i ljudski genom, nasumično siječe DNK, sekvencira mnogo kratkih sekvenci i rekonstruiše ih u konsenzusnu sekvencu. Nasumično sekvenciranje otkriva gene prisutne u uzorcima okoliša. Historijski gledano, biblioteke klonova su korištene da bi se olakšalo ovo sekvenciranje. Međutim, s napretkom u tehnologijama sekvenciranja visoke propusnosti, korak kloniranja više nije neophodan i veći prinosi podataka sekvenciranja mogu se dobiti bez ovog napornog koraka uskog grla. Ova metagenomika pruža informacije o tome koji su organizmi prisutni i koji su metabolički procesi mogući u zajednici.[20] Budući da je prikupljanje DNK iz okoline uglavnom nekontrolisano, najzastupljeniji organizmi u uzorku životne sredine su najzastupljeniji u rezultujućim podacima sekvence. Da bi se postigla visoka pokrivenost koja je potrebna za potpuno rješavanje genoma nedovoljno zastupljenih članova zajednice, potrebni su veliki uzorci, često pretjerano. S druge strane, nasumična priroda sekvenciranja osigurava da će mnogi od ovih organizama, koji bi inače ostali nezapaženi koristeći tradicijske tehnike uzgoja, biti predstavljeni barem nekim malim segmentima sekvence.[12]
Visokopropusno sekvenciranje
[uredi | uredi izvor]Prednost sekvenciranja visoke propusnosti je ta što ova tehnika ne zahtijeva kloniranje DNK prije sekvenciranja, uklanjajući jednu od glavnih predrasuda i uskih grla u uzorkovanju okoliša. Prve metagenomske studije sprovedene korišćenjem visokopropunsnog sekvenciranja koristile su masovno paralelno sa 454 pirosekvenciranjem.[16] Tri druge tehnologije koji se uobičajeno primenjuju na uzorkovanje životne sredine su Ionske Torrentove personalne genomske mašine, Illumina MiSeq ili HiSeq i Applied Biosystems SOLiD sistem.[21] Ove tehnike sekvenciranja DNK stvaraju kraće fragmente od Sangerovskog sekvenciranja; Ion Torrent PGM sistem i 454 pirosekvenci obično daju ~400 bp čitanja, Illumina MiSeq proizvodi 400-700bp čitanja (u zavisnosti od toga da li se koriste uparene krajnje opcije), a SOLiD proizvodi 25-75 bp čitanja.<20 name="schu" /> Istorijski gledano, ove dužine čitanja su bile znatno kraće od tipične dužine čitanja Sanger sekvence od ~750 bp, međutim Illumina tehnologija se brzo približava ovom standardu. Međutim, ovo ograničenje je nadoknađeno mnogo većim brojem čitanja sekvence. U 2009. metagenomi s pirosekvenciranjem generiraju 200–500 megabaza, a Illumina platforme generiraju oko 20–50 gigabaza, ali su se ti rezultati posljednjih godina povećali za redove veličine.[22]
Pristup u nastajanju kombinuje nasumično sekvenciranje i hvatanje konformacije hromosoma (Hi-C), koji mjeri blizinu bilo koje dvije DNK sekvence unutar iste ćelije, kako bi se usmjerio sklop mikrobnog genoma.[23] Tehnologije za sekvenciranje dugog čitanja, uključujući PacBio RSII i PacBio Sequel od Pacific Biosciences, i Nanopore MinION, GridION, PromethION od Oxford Nanopore Technologies, je još jedan izbor za dobijanje dugih čitanja sekvenci sačmarica koja bi trebala olakšati proces sastavljanja.[24]
Bioinformatika
[uredi | uredi izvor]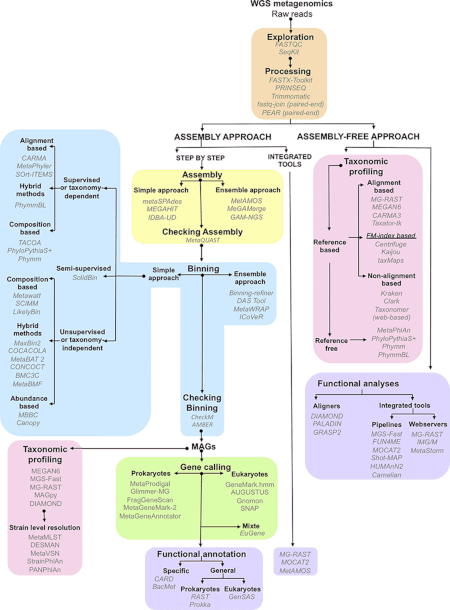
Podaci dobijeni metagenomskim eksperimentima su ogromni i inherentno bogati, sadrže fragmentirane podatke koji predstavljaju čak 10.000 vrsta.[[1] Sekvenciranje metagenoma kravljeg rumena generiralo je 279 gigabaza, ili 279 milijardi baznih parova podataka o sekvenci nukleotida,[26] dok je katalog gena mikrobioma ljudskog crijeva identificirao 3,3 miliona gena sastavljenih iz 567,7 gigabaza podataka o sekvenci.[27] Prikupljanje, kuriranje i izdvajanje korisnih bioloških informacija iz skupova podataka ove veličine predstavljaju značajan računski izazov za istraživače.[20][28][29][30]
Prefiltriranje sekvence
[uredi | uredi izvor]Prvi korak analize metagenomskih podataka zahtijeva izvršenje određenih koraka prethodnog filtriranja, uključujući uklanjanje suvišnih, nekvalitetnih sekvenci i sekvenci vjerovatnog eukariotskog porijekla (posebno u metagenomima ljudskog porijekla).[31][32] Dostupni metodi za uklanjanje kontaminirajućih eukariotskih genomskih DNK sekvenci uključuju Eu-Detect i DeConseq.[33][34]
Sklapanje
[uredi | uredi izvor]Podaci o sekvenci DNK iz genomskih i metagenomskih projekata su u suštini isti, ali podaci o genomskoj sekvenci nude veću pokrivenost dok su metagenomski podaci obično vrlo nesuvišni.[29] Nadalje, povećane upotreba tehnologije sekvenciranja druge generacije s kratkim dužinama čitanja znači da će veliki dio budućih metagenomskih podataka biti sklon greškama. Uzeti u kombinaciji, ovi faktori čine sklapanje čitanja metagenomskih sekvenci u genome teškim i nepouzdanim. Pogrešne sastavljanja su uzrokovane prisustvom ponavljajućih sekvenci DNK koje posebno otežavaju sastavljanje, zbog razlike u relativnoj brojnosti vrsta prisutnih u uzorku.[35] Pogrešne sklapanje također može uključivati kombinaciju sekvenci iz više od jedne vrste u himerne kontige.[35]
Postoji nekoliko programa za sklapanje, od kojih većina može koristiti informacije iz forme upareni kraj sa krajem, kako bi se poboljšala tačnost sklopova. Neki programi, kao što su Phrap ili Celera Assembler, dizajnirani su da se koriste za sastavljanje pojedinačnih genoma, ali ipak daju dobre rezultate pri sastavljanju skupova metagenomskih podataka.[1] Ostali programi, kao što je Velvet asembler, optimizirani su za kraća čitanja proizvedena sekvenciranjem druge generacije korištenjem de Brujinovih grafikona.[36][37] Upotreba referentnih genoma omogućava istraživačima da poboljšaju sastavljanje najzastupljenijih mikrobnih vrsta, ali ovaj pristup je ograničen malim podskupom mikrobnih tipova za koje su dostupni sekvencirani genomi.[35] Nakon sklapanja stvoren, dodatni izazov je "metagenomska dekonvolucija", ili određivanje koje sekvence potiču od koje vrste u uzorku.[38]
Gensko predviđanje
[uredi | uredi izvor]Metagenomska analiza Pipelinea koristi dva pristupa u označavanju regiona kodiranja u sastavljenim kontigama.[35] Prvi pristup je da se identifikuju geni na osnovu homologije sa genima koji su već javno dostupni u bazi podataka sekvenci, obično BLAST pretragama. Ovaj tip pristupa implementiran je u programu MEGAN4.[39] Drugi, ab initio, koristi unutrašnje karakteristike sekvence za predviđanje regiona kodiranja na osnovu na setove za obuku gena iz srodnih organizama. Ovo je pristup koji koriste programi kao što su GeneMark[40] i GLIMMER. Glavna prednost ab initio predviđanja je da omogućava detekciju kodirajućih regiona kojima nedostaju homolozi u bazama podataka sekvenci; međutim, najprecizniji je kada postoje velike regije susjedne genomske DNK dostupne za poređenje.[1]
Raznolikost vrsta
[uredi | uredi izvor]Metagenomska analiza pipelines koristi dva pristupa u označavanju regiona kodiranja u sastavljenim kontigama.[35] Prvi pristup je da se identifikuju geni na osnovu homologija sa genima koji su već javno dostupni u bazi podataka sekvencis, obično BLAST pretragama. Ovaj tip pristupa implementiran je u programu MEGAN4.[39] Drugi, ab initio, koristi intrinzične karakteristike sekvence za predviđanje regiona kodiranja na osnovu na setove za obuku gena iz srodnih organizama. Ovo je pristup koji koriste programi kao što su GeneMark[40] i GLIMMER. Glavna prednost ab initio predviđanja je da omogućava detekciju kodirajućih regiona kojima nedostaju homolozi u bazama podataka sekvenci; međutim, najprecizniji je kada postoje velike regije susedne genomske DNK dostupne za poređenje.[1]
Različitost vrsta
[uredi | uredi izvor]Anotacije gena daju "šta", dok mjerenja raznolikost vrsta daju "ko".[41] Da bi se povezao sastav zajednice i funkcija u metagenomima, sekvence moraju biti binirane. Bining je proces povezivanja određene sekvence sa organizmom.[35] U biningu zasnovanom na sličnosti, metodi kao što je BLAST koriste se za brzo pretraživanje za filogenetske markere ili na drugi način slične sekvence u postojećim javnim bazama podataka. Ovaj pristup je implementiran u MEGAN.[42] Drugi alat, PhymmBL, koristi interpolirani Markovljev model za dodjelu čitanja.[1] MetaPhlAn i AMPHORA su metodi zasnovani na jedinstvenim markerima specifičnim za kladuse za procjenu relativne zastupljenosti organizma uz poboljšane računarske performanse.[43] Ostali alati, poput mOTUs[44][45] i MetaPhyler,[46] koriste univerzalne markerske gene za profiliranje prokariotskih vrsta. Pomoću mOTUs profilera moguće je profilirati vrste bez referentnog genoma, poboljšavajući procjenu raznolikosti mikrobne zajednice.[45] Najnoviji metodi, kao npr. SLIMM, koristite pejzaž pokrivenosti čitanja pojedinačnih referentnih genoma da minimiziraju lažno pozitivne pogotke i dobiju pouzdane relativno bogate podatke.[47] U grupisanju zasnovanom na kompoziciji, metodi koriste unutrašnjee karakteristike sekvence, kao što su frekvencije oligonukleotida ili kodon pristranosti upotrebe.[1] Kada se sekvence sakupe, moguće je izvršiti komparativnu analizu raznolikosti i bogatstva.
Integracija podataka
[uredi | uredi izvor]Ogromna količina eksponencijalno rastućih podataka o sekvenci je zastrašujući izazov koji je komplikovan zbog složenosti metapodataka povezanih s metagenomskim projektima. Metapodaci uključuju detaljne informacije o trodimenzijskoj (uključujući dubinu ili visinu) geografiji i karakteristikama okoliša uzorka, fizičke podatke o mjestu uzorkovanja i metodologiju uzorkovanja.[29] Ove informacije su neophodne kako bi se osigurala replikacija i omogućila nizvodna analiza. Zbog svoje važnosti, metapodaci i kolaborativni pregled i kuriranje podataka zahtijevaju standardizirane formate podataka koji se nalaze u specijaliziranim bazama podataka, kao što je Genomes OnLine Database (GOLD).[48]
Razvijeno je nekoliko alata za integraciju metapodataka i podataka o sekvenci, omogućavajući nizvodno komparativne analize različitih skupova podataka korištenjem brojnih ekoloških indeksa. Godine 2007, Folker Meyer i Robert Edwards i tim u Argonne National Laboratory i Univerzitet u Chicagu objavili su Metagenomics Rapid Annotation koristeći server Subsystem Technology (MG-RAST) resurs zajednice za Analize skupova podataka metagenoma.[49] Od juna 2012. analizirano je više od 14,8 terabaza (14x1012 baza) DNK, sa više od 10.000 javnih skupova podataka koji su slobodno dostupni za poređenje u okviru MG-RAST. Preko 8.000 korisnika je sada dostavilo ukupno 50.000 metagenoma MG-RAST-u. Integrisani mikrobiološki genomi/metagenomi (IMG/M) također obezbeđuje kolekciju alata za funkcionalnu analizu mikrobnih zajednica, na osnovu njihove metagenomske sekvence, zasnovane na referentnim genomima izolata uključenih iz Integrated Microbial Genomes (IMG) sistem i Genomic Encyclopedia of Bacteria and Archaea (GEBA) projekt.[50]
Jedan od prvih samostalnih alata za analizu podataka o metagenomskim pretragama visoke propusnosti bio je MEGAN (MEta Genome ANAlyzer).[39][42] Prva verzija programa je korištena 2005. za analizu metagenomskog konteksta DNK sekvenci dobijenih iz kosti mamuta.[16] Na osnovu BLASTnog poređenja sa referentnom bazom podataka, ovaj alat obavlja taksonomski i funkcionalni bining, postavljanjem očitavanja na čvorove NCBI taksonomije, koristeći jednostavan algoritam najnižeg zajedničkog pretka (LCA) ili na čvorove SEED ili KEGG klasifikacije.< ref name="mitra2011"/>
Sa pojavom brzih i jeftinih instrumenata za sekvenciranje, rast baza podataka sekvenci DNK sada je eksponencijalan (npr. NCBI GenBank baza podataka [51]). Potrebni su brži i efikasniji alati da bi se držao korak sa sekvenciranjem visoke propusnosti, jer pristupi zasnovani na BLAST-u, kao što su MG-RAST ili MEGAN, rade sporo za označavanje velikih uzoraka (npr. nekoliko sati za obradu skupa podataka/uzorka male/srednje veličine [52]). Tako su se nedavno pojavili ultrabrzi klasifikatori, zahvaljujući pristupačnijim moćnim serverima. Ovi alati mogu izvršiti taksonomsko označavanje izuzetno velikom brzinom, na primjer CLARK [53] (prema CLARK-ovim autorima, može precizno klasificirati "32 miliona metagenomskih kratkih čitanja u minuti"). Pri takvoj brzini, veoma veliki skup podataka/uzoraka od milijardu kratkih čitanja može se obraditi za oko 30 minuta.
Uz sve veću dostupnost uzoraka koji sadrže drevnu DNK i zbog nesigurnosti povezane s prirodom tih uzoraka (oštećenja drevne DNK),[54] brz alat sposoban za proizvodnju konzervativnih procjena sličnosti je stavljen na raspolaganje. Prema FALCON-ovim autorima, može koristiti opuštene pragove i uređivati udaljenosti bez utjecaja na memoriju i performanse brzine.
Komparativna metagenomika
[uredi | uredi izvor]Komparativne analize metagenoma mogu pružiti dodatni uvid u funkciju složenih mikrobnih zajednica i njihovu ulogu u zdravlju domaćina.[55] Uparena ili višestruka poređenja između metagenoma mogu se napraviti na nivou sastava sekvence (upoređivanje GC-sadržaja ili veličina genoma), taksonomska raznolikost ili funkcionalna dopuna. Poređenja strukture populacije i filogenetske raznolikosti mogu se napraviti na osnovu 16S rRNA i drugih gena filogenetskih markera, ili — u slučaju zajednica sa niskim diverzitetom — rekonstrukcijom genoma iz metagenomskog skupa podataka.< ref name="simon2011"/> Funkcionalna poređenja između metagenoma mogu se napraviti poređenjem sekvenci sa referentnim bazama podataka kao što su COG ili KEGG, i tabelariziranjem brojnosti po kategorijama i procjenom svih razlika za statističke značaj.[56] Ovaj gen-centrični pristup naglašava funkcionalnu dopunu zajednice u cjelini, a ne taksonomske grupe, i pokazuje da su funkcionalni komplementi analogni u sličnim uvjetima okoline.[57] Posljedično, metapodaci o okolišnom kontekstu metagenomskog uzorka posebno su važni u komparativnim analizama, jer istraživačima pružaju mogućnost proučavanja uticaja staništa, prema strukturi i funkciji zajednice.[1]
Osim toga, nekoliko studija je također koristilo obrasce upotrebe oligonukleotida, kako bi se identificirale razlike između različitih mikrobnih zajednica. Primjeri takvih metodologija uključuju pristup relativnog obilja dinukleotida kod Willner et al.[58] and the HabiSign approach of Ghosh et al.[59] Ova potonja studija je također pokazala da se razlike u obrascima upotrebe tetranukleotida mogu koristiti za identifikaciju gena (ili metagenomskih očitanja) koji potiču iz specifičnih staništa. Pored toga, neki metodi, kao što su TriageTools[60] ili Compareads[61] otkrivaju slična čitanja između dva skupa čitanja. Mjera sličnosti koju primjenjuju na čitanja zasniva se na broju identičnih riječi dužine koje dijele parovi čitanja.
Ključni cilj u komparativnoj metagenomici je da se identifikuju mikrobne grupe koje su odgovorne za davanje specifičnih karakteristika datom okruženju. Međutim, zbog problema u tehnologijama sekvenciranja artefakte treba uzeti u obzir kao u metagenomeSeq.[28] Drugi su karakterizirali međumikrobne interakcije između rezidentnih mikrobnih grupa. Aplikaciju za komparativnu metagenomsku analizu zasnovanu na GUI pod nazivom Community-Analyzer razvili su Kuntal et al.[62] koji implementira algoritam rasporeda grafikona zasnovan na korelaciji koji ne samo da olakšava brzu vizualizaciju razlika u analiziranim mikrobnim zajednicama (u smislu njihovog taksonomskog sastava), već također pruža uvid u inherentne međumikrobne interakcije koje se u njima dešavaju. Značajno je da ovaj algoritam rasporeda takođe omogućava grupiranje metagenoma na osnovu vjerovatnih obrazaca međumikrobne interakcije, a ne jednostavno upoređivanje vrednosti obilja različitih taksonomskih grupa. Osim toga, alat implementira nekoliko interaktivnih GUI-baziranih funkcionalnosti koje omogućavaju korisnicima da izvrše standardne komparativne analize kroz mikrobiome.
Analiza podataka
[uredi | uredi izvor]Metabolizam zajednice
[uredi | uredi izvor]U mnogim bakterijskim zajednicama, prirodnim ili napravljenim (kao što su bioreaktor), postoji značajna podjela rada u metabolizmu (sintrofija), tokom koje su otpadni proizvodi nekih organizama metaboliti za druge.<ref. name="werner2011"/> U jednom takvom sistemu, metanogeni bioreaktor, funkcionalna stabilnost zahtijeva prisustvo nekoliko sintrofijskih redova (Syntrophobacterales i Synergistia) koje rade zajedno kako bi se sirovi resursi pretvorili u potpuno metabolizirani otpad (metan).[63] Koristeći komparativne studije gena i eksperimenata ekspresije sa mikročipovima ili proteomikom istraživači mogu sastaviti metaboličku mrežu koja nadilazi granice vrsta. Takve studije zahtijevaju detaljno znanje o tome koje su verzije kojih proteina kodirane od strane koje vrste, pa čak i od kojih sojeva koje vrste. Stoga su genomske informacije zajednice još jedno osnovno sredstvo (sa metabolomikom i proteomikom) u potrazi za određivanjem kako se metaboliti prenose i transformiraju od strane zajednice.[64]
Metatranskriptomika
[uredi | uredi izvor]Metagenomika omogućava istraživačima da pristupe funkcionalnoj i metaboličkoj raznolikosti mikrobnih zajednica, ali ne može pokazati koji su od ovih procesa aktivni.[57] Ekstrakcija i analiza metagenomske iRNK (' metatranskriptom) pruža informacije o regulaciji i ekspresijskim profilima složenih zajednica. Zbog tehničkih poteškoća (kratki poluživot iRNK, naprimjer) u prikupljanju okolinske RNK bilo je relativno malo in situ metatranskriptomske studije mikrobnih zajednica do danas.[57] Iako su prvobitno ograničene na tehnologiju mikronizne, metatranskriptomske studije su koristile tehnologije transkriptomike za mjerenje ekspresije cijelog genoma i kvantifikacije mikrobne zajednice,[57] prvi put korišten u analizi oksidacije amonijaka u tlu.[65]
Virusi
[uredi | uredi izvor]Metagenomsko sekvenciranje je posebno korisno u proučavanju virusnih zajednica. Kako virusima nedostaje zajednički univerzalni filogenetski marker (kao 16S RNK za bakterije i arheje i 18S RNK za eukariote), jedini način da se pristupi genetičkoj raznolikosti virusnih zajednica iz uzorka životne sredine je putem metagenomike. Virusni metagenomi (koji se nazivaju i viromi) bi stoga trebali pružiti sve više i više informacija o virusnoj raznolikosti i evoluciji.[66][67][68][69][70] Naprimjer, metagenomski cjevovod pod nazivom Gigantski pretraživač virusa pokazao je prvi dokaz postojanja gigantskih virusa u slanoj pustinji [71] and in Antarctic dry valleys.[72]
Aplikacije
[uredi | uredi izvor]Metagenomika ima potencijal da unapredi znanje u raznim oblastima. Može se primijeniti i za rješavanje praktičnih izazova u medicini, inženjersrtvu, poljoprivredi, održivosti i ekologiji.[29][73]
Poljoprivreda
[uredi | uredi izvor]Tla u kojima biljke rastu naseljene su mikrobnim zajednicama, pri čemu jedan gram tla sadrži oko 109-1010 mikrobnih ćelija koje čine oko jedne gigabaze informacija o sekvenci.[74][75] Zajednice mikroba koje naseljavaju tlo su neke od najsloženijih poznatih nauci i ostaju slabo shvaćene uprkos njihovoj ekonomskoj važnosti.[76] Mikrobni konzorciji obavljaju širok spektar ekosistemskih usluga, neophodnih za rast biljaka, uključujući fiksiranje atmosferskog dušika, kruženje nutrijenata, suzbijanje bolesti i sekvester gvožđe i druge metale.[77] Funkcionalne metagenomske strategije se koriste za istraživanje interakcija između biljaka i mikroba, proučavanjem ovih mikrobnih zajednica neovisno o uzgoju.[78][79] Omogućujući uvid u ulogu prethodno neobrađenih ili rijetkih članova zajednice u kruženju [nutrijent|nutrijenata]] i promociji rasta biljaka, metagenomski pristupi mogu doprinijeti poboljšanom otkrivanju bolesti u usjevima i stoci i prilagođavanju poboljšanih poljoprivredbih praksi koje poboljšavaju zdravlje usjeva iskorištavanjem odnosa između mikroba i biljaka.[29]
Biogorivo
[uredi | uredi izvor]Biogoriva su goriva izvedena iz konverzije biomase, kao u konverziji celuloze sadržane u stabljikama kukuruza, smetnjača i druge biomase u celulozni etanol.[29] Ovaj proces zavisi od konzorcija (udruženja) mikroba koji pretvaraju celulozu u šećer, nakon čega slijedi fermentacija šećera u etanol. Mikrobi također proizvode različite izvore bioenergije, uključujući metan i vodik.[29] Efikasna dekonstrukcija u industrijskim razmjerima biomase zahtijevaju nove enzime sa većom produktivnošću i nižom cijenom.[26] Metagenomski pristupi analizi složenih mikrobnih zajednica omogućavaju ciljani skrining enzima sa industrijskom primjenom u proizvodnji biogoriva, kao što su glikozidne hidrolaze.[80] Nadalje, znanje o tome kako ove mikrobne zajednice funkcionišu kako bi ih kontrolisale, a metagenomika je ključno oruđe u njihovom razumevanju. Metagenomski pristupi omogućavaju komparativne analize između konvergentna mikrobnih sistema kao što su biogasni fermentori[81] ili insekti biljojedi kao što je mravlja bašta gljiva mrav rezačas.[82]
Biotehnologija
[uredi | uredi izvor]Mikrobne zajednice proizvode široku lepezu biološki aktivnih hemikalija koje se koriste u nadmetanju i komunikaciji.[77] Mnogi od lijekova koji se danas koriste prvobitno su otkriveni u mikrobima; nedavni napredak u dobijanju bogatih genetičkih resursa nekultiviranih mikroba doveo je do otkrića novih gena, enzima i prirodnih proizvoda.[57][83] Primjena metagenomike omogućio je razvoj roba i finih hemikalija, agrohemikalija i farmaceutike, gdje je korist enzimski katalizirana hiralna sinteza se sve više prepoznaje.[84]
Dva tipa analiza koriste se u bioprospekcijama metagenomskih podataka: skrining vođen funkcijama za izraženu osobinu i skrining vođen sekvencijom za sekvence DNK od interesa.[85] Analiza vođena funkcijama nastoji identificirati klonove koji izražavaju željenu osobinu ili korisnu aktivnost, nakon čega slijedi biohemijska karakterizacija i analiza sekvence. Ovaj pristup je ograničen dostupnošću odgovarajućeg ekrana i zahtjevom da se željena osobina izrazi u ćeliji domaćinu. Štaviše, niska stopa otkrivanja (manje od jednog na 1.000 pregledanih klonova) i njegova radno intenzivna priroda dodatno ograničavaju ovaj pristup.[86] Nasuprot tome, analiza vođena sekvencom koristi konzervirana DNK sekvence do dizajna PCR prajmera za skrining klonova za sekvencu od interesa.[85] U poređenju sa pristupima zasnovanim na kloniranju, korištenje pristupa samo sekvenci dodatno smanjuje količinu potrebnog rada na stolu. Primjena masovnog paralelnog sekvenciranja također uveliko povećava količinu generiranih podataka o sekvenci, koji zahtijevaju visokopropusne bioinformatičke analize.[86] Pristup skriningu vođen sekvenciranjem ograničen je širinom i preciznošću funkcije gena prisutne u javnim bazama podataka sekvenci. U praksi, eksperimenti koriste kombinaciju i funkcionalnih i pristupa zasnovanih na sekvencama zasnovanih na funkciji od interesa, složenosti uzorka koji treba pregledati i drugim faktorima.[86][87] Primjer uspješnog korištenja metagenomike kao biotehnologije za otkrivanje lijekova je ilustrovan sa malacidinskim antibioticima.[88]
Ekologija
[uredi | uredi izvor]
Metagenomika može pružiti vrijedan uvid u funkcionalnu ekologiju ekoloških zajednica.[89] Metagenomska analiza bakterijskih zajednica pronađenih u defekaciji australskih morskih lavova sugerira da izmet morskog lava bogat nutrijentima može biti važan izvor hranjivih tvari za obalne ekosisteme. To je zato što su bakterije koje se izbacuju istovremeno s defekacijom sposobne razgraditi hranjive tvari u fecesu u bioraspoloživi oblik koji se može unijeti u lanac ishrane.[90]
Sekvenciranje DNK se također može koristiti šire za identifikaciju vrsta prisutnih u vodnom tijelu,[91] krhotine filtrirane iz zraka, uzoraka prljavštine ili životinjskog izmeta,[92] pa čak i detektovati dijetetske proizvode iz obroka iz krvi.[93] Ovo može utvrditi raspon invazivnih i ugroženih vrsta, te pratiti sezonske populacije.
Remedijacija životne sredine
[uredi | uredi izvor]Metagenomika može poboljšati strategije za praćenje uticaja zagađivača na ekosisteme i za čišćenje kontaminiranog okruženja. Povećano razumijevanje načina na koji se mikrobne zajednice nose sa zagađivačima poboljšava procjenu potencijala kontaminiranih lokacija da se oporave od zagađenja i povećava šanse za uspjeh pokušaja bioaugmentacija ili biostimulacija.[94]
Karakterizacija crijevnih mikroba
[uredi | uredi izvor]Mikrobne zajednice imaju ključnu ulogu u očuvanju ljudskog zdravlja, ali njihov sastav i mehanizam pomoću kojeg to čine ostaju misteriozni.[95] Metagenomsko sekvenciranje se koristi za karakterizaciju mikrobne zajednice sa 15-18 tjelesnih mjesta od najmanje 250 jedinki. Ovo je dio Inicijativa za ljudski mikrobiom s primarnim ciljevima da se utvrdi postoji li jezgro ljudskog mikrobioma, da se razumiju promjene u ljudskom mikrobiomu koje mogu biti povezane sa ljudskim zdravljem i razviti nove tehnološke i bioinformatičke alate za podršku ovim ciljevima.[96]
Još jedno medicinsko istraživanje u sklopu projekta MetaHit (Metagenomika ljudskog crijevnog trakta) sastojalo se od 124 osobe iz Danske i Španijee, koje su se sastojale od zdravih, gojaznih i iritabilnih pacijenata sa bolestima crijeva. Studija je pokušala kategorizirati dubinu i filogenetsku raznolikost gastrointestinalnih bakterija. Koristeći Illumina GA sekvencione podatke i SOAPdenovo, alatku zasnovanu na de Bruijnpvom grafikonu posebno dizajniranu za sklapanje kratkih čitanja, uspjeli su generirati 6,58 miliona kontiga većih od 500 bp za ukupnu dužinu kontiga od 10,3 Gb i dužinu N50 od 2,2 kb.
Studija je pokazala da dvije bakterijske divizije, Bacteroidetes i Firmicutes, čine preko 90% poznatih filogenetskih kategorija koje dominiraju bakterijama distalnog crijeva. Koristeći relativne frekvencije gena pronađene u crijevima, ovi istraživači su identificirali 1.244 metagenomska klastera koji su kritično važni za zdravlje crijevnog trakta. Postoje dva tipa funkcija u ovim grupama: održavanje i one specifične za crijeva. Klasteri gena za održavanje su potrebni svim bakterijama i često su glavni faktori u glavnim metaboličkim putevima, uključujući centralni metabolizam ugljika i sintezu aminokiselina. Funkcije specifične za crijeva uključuju adheziju na proteine domaćina i prikupljanje šećera iz glikolipida globoze. Pokazalo se da pacijenti sa sindromom iritabilnog crijeva pokazuju 25% manje gena i manju bakterijsku raznolikost od pojedinaca koji ne pate od sindroma iritabilnog crijeva, što ukazuje da promjene u raznolikosti bioma crijeva pacijenata mogu biti povezane s ovim stanjem. Iako ove studije naglašavaju neke potencijalno vrijedne medicinske primjene, samo 31–48,8% očitavanja moglo bi se uskladiti sa 194 javna bakterijska genoma ljudskog crijeva i 7,6–21,2% s bakterijskim genomima dostupnim u GenBank-u, što ukazuje da je još uvijek potrebno mnogo više istraživanja za uhvatanje novih bakterijskih genoma.[97]
U Projektu ljudskog mikrobioma (HMP), mikrobne zajednice crijeva su analizirane korištenjem sekvenciranja DNK visoke propusnosti. HMP je pokazao da su, za razliku od pojedinačnih mikrobnih vrsta, mnogi metabolički procesi prisutni u svim tjelesnim staništima s različitim frekvencijama. Mikrobne zajednice od 649 metagenoma sa sedam primarnih tjelesnih mjesta na 102 osobe proučavane su u sklopu projekta Ljudski mikrobiom. Metagenomska analiza otkrila je varijacije u obilju specifičnih za nišu među 168 funkcionalnih modula i 196 metaboličkih puteva unutar mikrobioma. To uključuje razgradnju glikozaminoglikana u crijevima, kao i transport fosfata i aminokiselina vezan za fenotip domaćina (vaginski pH) u stražnjem forniksu. HMP je iznio na vidjelo korisnost metagenomike u dijagnostici i medicini zasnovanoj na dokazima. Stoga je metagenomika moćan alat za rješavanje mnogih hitnih pitanja u području personalizirane medicine.[98]
Kod životinja, metagenomika se može koristiti za profiliranje njihovih crijevnih mikrobioma i omogućavanje otkrivanja bakterija otpornih na antibiotike.[99] Ovo može imati implikacije u praćenju širenja bolesti sa divljih životinja na životinje i ljude na farmama.
Dijagnoza zaraznih bolesti
[uredi | uredi izvor]Razlikovanje između infektivne i neinfektivne bolesti i utvrđivanje osnovne etiologije infekcija može biti izazovno. Naprimjer, više od polovine slučajeva encefalitisa ostaje nedijagnosticirano, uprkos opsežnim ispitivanjima korištenjem najsavremenijih kliničkih laboratorijskih metoda. Kliničko metagenomsko sekvenciranje obećava osjetljiv i brz metod za dijagnosticiranje infekcije, uspoređivanjem genetskog materijala pronađenog u uzorku pacijenta s bazama podataka svih poznatih mikroskopskih ljudskih patogena i hiljadama drugih bakterijskih, virusnih, gljivičnih i parazitskih organizama i baza podataka o sekvencama gena za antimikrobnu rezistenciju sa povezanim kliničkim fenotipovima.
Nadzor arbovirusa
[uredi | uredi izvor]Metagenomika je bila neprocjenjivo sredstvo koje pomaže u karakterizaciji raznolikosti i ekologije patogena koje prenose hematofagni insekti (koji se hrane krvlju), kao što su komarci i krpelji.[100][101][102] Metagenomiku danas rutinski koriste službenici javnog zdravstva i organizacije za nadzor arbovirusa.[103][104]
Također pogledate
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ a b c d e f g h Wooley JC, Godzik A, Friedberg I (februar 2010). Bourne PE (ured.). "A primer on metagenomics". PLOS Computational Biology. 6 (2): e1000667. Bibcode:2010PLSCB...6E0667W. doi:10.1371/journal.pcbi.1000667. PMC 2829047. PMID 20195499.
- ^ a b Hugenholtz P, Goebel BM, Pace NR (septembar 1998). "Impact of culture-independent studies on the emerging phylogenetic view of bacterial diversity". Journal of Bacteriology. 180 (18): 4765–74. doi:10.1128/JB.180.18.4765-4774.1998. PMC 107498. PMID 9733676.
- ^ Marco, D, ured. (2011). Metagenomics: Current Innovations and Future Trends. Caister Academic Press. ISBN 978-1-904455-87-5.
- ^ Eisen JA (mart 2007). "Environmental shotgun sequencing: its potential and challenges for studying the hidden world of microbes". PLOS Biology. 5 (3): e82. doi:10.1371/journal.pbio.0050082. PMC 1821061. PMID 17355177.
- ^ Handelsman J, Rondon MR, Brady SF, Clardy J, Goodman RM (oktobar 1998). "Molecular biological access to the chemistry of unknown soil microbes: a new frontier for natural products". Chemistry & Biology. 5 (10): R245-9. doi:10.1016/S1074-5521(98)90108-9. PMID 9818143..
- ^ Lane DJ, Pace B, Olsen GJ, Stahl DA, Sogin ML, Pace NR (oktobar 1985). "Rapid determination of 16S ribosomal RNA sequences for phylogenetic analyses". Proceedings of the National Academy of Sciences of the United States of America. 82 (20): 6955–9. Bibcode:1985PNAS...82.6955L. doi:10.1073/pnas.82.20.6955. PMC 391288. PMID 2413450.
- ^ Pace NR, Stahl DA, Lane DJ, Olsen GJ (1986). "The Analysis of Natural Microbial Populations by Ribosomal RNA Sequences". u Marshall KC (ured.). Advances in Microbial Ecology. 9. Springer US. str. 1–55. doi:10.1007/978-1-4757-0611-6_1. ISBN 978-1-4757-0611-6.
- ^ Schmidt TM, DeLong EF, Pace NR (juli 1991). "Analysis of a marine picoplankton community by 16S rRNA gene cloning and sequencing". Journal of Bacteriology. 173 (14): 4371–8. doi:10.1128/jb.173.14.4371-4378.1991. PMC 208098. PMID 2066334.
- ^ Healy FG, Ray RM, Aldrich HC, Wilkie AC, Ingram LO, Shanmugam KT (1995). "Direct isolation of functional genes encoding cellulases from the microbial consortia in a thermophilic, anaerobic digester maintained on lignocellulose". Applied Microbiology and Biotechnology. 43 (4): 667–74. doi:10.1007/BF00164771. PMID 7546604. S2CID 31384119.
- ^ Stein JL, Marsh TL, Wu KY, Shizuya H, DeLong EF (februar 1996). "Characterization of uncultivated prokaryotes: isolation and analysis of a 40-kilobase-pair genome fragment from a planktonic marine archaeon". Journal of Bacteriology. 178 (3): 591–9. doi:10.1128/jb.178.3.591-599.1996. PMC 177699. PMID 8550487.
- ^ Breitbart M, Salamon P, Andresen B, Mahaffy JM, Segall AM, Mead D, et al. (oktobar 2002). "Genomic analysis of uncultured marine viral communities". Proceedings of the National Academy of Sciences of the United States of America. 99 (22): 14250–5. Bibcode:2002PNAS...9914250B. doi:10.1073/pnas.202488399. PMC 137870. PMID 12384570.
- ^ a b Tyson GW, Chapman J, Hugenholtz P, Allen EE, Ram RJ, Richardson PM, et al. (mart 2004). "Community structure and metabolism through reconstruction of microbial genomes from the environment". Nature. 428 (6978): 37–43. Bibcode:2004Natur.428...37T. doi:10.1038/nature02340. PMID 14961025. S2CID 4420754.(Pretplata potrebna)
- ^ Hugenholtz P (2002). "Exploring prokaryotic diversity in the genomic era". Genome Biology. 3 (2): REVIEWS0003. doi:10.1186/gb-2002-3-2-reviews0003. PMC 139013. PMID 11864374.
- ^ Venter JC, Remington K, Heidelberg JF, Halpern AL, Rusch D, Eisen JA, et al. (april 2004). "Environmental genome shotgun sequencing of the Sargasso Sea". Science. 304 (5667): 66–74. Bibcode:2004Sci...304...66V. CiteSeerX 10.1.1.124.1840. doi:10.1126/science.1093857. PMID 15001713. S2CID 1454587.
- ^ Yooseph S, Nealson KH, Rusch DB, McCrow JP, Dupont CL, Kim M, et al. (novembar 2010). "Genomic and functional adaptation in surface ocean planktonic prokaryotes". Nature. 468 (7320): 60–6. Bibcode:2010Natur.468...60Y. doi:10.1038/nature09530. PMID 21048761.(Pretplata potrebna)
- ^ a b c Poinar HN, Schwarz C, Qi J, Shapiro B, Macphee RD, Buigues B, et al. (januar 2006). "Metagenomics to paleogenomics: large-scale sequencing of mammoth DNA". Science. 311 (5759): 392–4. Bibcode:2006Sci...311..392P. doi:10.1126/science.1123360. PMID 16368896. S2CID 11238470.
- ^ Edwards RA, Rodriguez-Brito B, Wegley L, Haynes M, Breitbart M, Peterson DM, et al. (mart 2006). "Using pyrosequencing to shed light on deep mine microbial ecology". BMC Genomics. 7: 57. doi:10.1186/1471-2164-7-57. PMC 1483832. PMID 16549033.
- ^ Thomas T, Gilbert J, Meyer F (februar 2012). "Metagenomics - a guide from sampling to data analysis". Microbial Informatics and Experimentation. 2 (1): 3. doi:10.1186/2042-5783-2-3. PMC 3351745. PMID 22587947.
- ^ Béjà O, Suzuki MT, Koonin EV, Aravind L, Hadd A, Nguyen LP, et al. (oktobar 2000). "Construction and analysis of bacterial artificial chromosome libraries from a marine microbial assemblage". Environmental Microbiology. 2 (5): 516–29. doi:10.1046/j.1462-2920.2000.00133.x. PMID 11233160. S2CID 8267748.
- ^ a b Segata N, Boernigen D, Tickle TL, Morgan XC, Garrett WS, Huttenhower C (maj 2013). "Computational meta'omics for microbial community studies". Molecular Systems Biology. 9 (666): 666. doi:10.1038/msb.2013.22. PMC 4039370. PMID 23670539.
- ^ Rodrigue S, Materna AC, Timberlake SC, Blackburn MC, Malmstrom RR, Alm EJ, Chisholm SW (juli 2010). Gilbert JA (ured.). "Unlocking short read sequencing for metagenomics". PLOS ONE. 5 (7): e11840. Bibcode:2010PLoSO...511840R. doi:10.1371/journal.pone.0011840. PMC 2911387. PMID 20676378.
- ^ "Metagenomics versus Moore's law". Nature Methods. 6 (9): 623. 2009. doi:10.1038/nmeth0909-623.
- ^ Stewart RD, Auffret MD, Warr A, Wiser AH, Press MO, Langford KW, et al. (februar 2018). "Assembly of 913 microbial genomes from metagenomic sequencing of the cow rumen". Nature Communications. 9 (1): 870. Bibcode:2018NatCo...9..870S. doi:10.1038/s41467-018-03317-6. PMC 5830445. PMID 29491419.
- ^ Hiraoka S, Yang CC, Iwasaki W (septembar 2016). "Metagenomics and Bioinformatics in Microbial Ecology: Current Status and Beyond". Microbes and Environments. 31 (3): 204–12. doi:10.1264/jsme2.ME16024. PMC 5017796. PMID 27383682.
- ^ Pérez-Cobas AE, Gomez-Valero L, Buchrieser C (2020). "Metagenomic approaches in microbial ecology: an update on whole-genome and marker gene sequencing analyses". Microbial Genomics. 6 (8). doi:10.1099/mgen.0.000409. PMC 7641418. PMID 32706331.
- ^ a b Hess M, Sczyrba A, Egan R, Kim TW, Chokhawala H, Schroth G, et al. (januar 2011). "Metagenomic discovery of biomass-degrading genes and genomes from cow rumen". Science. 331 (6016): 463–7. Bibcode:2011Sci...331..463H. doi:10.1126/science.1200387. PMID 21273488. S2CID 36572885.
- ^ Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, et al. (mart 2010). "A human gut microbial gene catalogue established by metagenomic sequencing". Nature. 464 (7285): 59–65. Bibcode:2010Natur.464...59.. doi:10.1038/nature08821. PMC 3779803. PMID 20203603.(Pretplata potrebna)
- ^ a b Paulson JN, Stine OC, Bravo HC, Pop M (decembar 2013). "Differential abundance analysis for microbial marker-gene surveys". Nature Methods. 10 (12): 1200–2. doi:10.1038/nmeth.2658. PMC 4010126. PMID 24076764.
- ^ a b c d e f g Committee on Metagenomics: Challenges and Functional Applications, National Research Council (2007). The New Science of Metagenomics: Revealing the Secrets of Our Microbial Planet. Washington, D.C.: The National Academies Press. doi:10.17226/11902. ISBN 978-0-309-10676-4. PMID 21678629.
- ^ Oulas A, Pavloudi C, Polymenakou P, Pavlopoulos GA, Papanikolaou N, Kotoulas G, et al. (2015). "Metagenomics: tools and insights for analyzing next-generation sequencing data derived from biodiversity studies". Bioinformatics and Biology Insights. 9: 75–88. doi:10.4137/BBI.S12462. PMC 4426941. PMID 25983555.
- ^ Mende DR, Waller AS, Sunagawa S, Järvelin AI, Chan MM, Arumugam M, et al. (23. 2. 2012). "Assessment of metagenomic assembly using simulated next generation sequencing data". PLOS ONE. 7 (2): e31386. Bibcode:2012PLoSO...731386M. doi:10.1371/journal.pone.0031386. PMC 3285633. PMID 22384016.
- ^ Balzer S, Malde K, Grohme MA, Jonassen I (april 2013). "Filtering duplicate reads from 454 pyrosequencing data". Bioinformatics. 29 (7): 830–6. doi:10.1093/bioinformatics/btt047. PMC 3605598. PMID 23376350.
- ^ Mohammed MH, Chadaram S, Komanduri D, Ghosh TS, Mande SS (septembar 2011). "Eu-Detect: an algorithm for detecting eukaryotic sequences in metagenomic data sets". Journal of Biosciences. 36 (4): 709–17. doi:10.1007/s12038-011-9105-2. PMID 21857117. S2CID 25857874.
- ^ Schmieder R, Edwards R (mart 2011). "Fast identification and removal of sequence contamination from genomic and metagenomic datasets". PLOS ONE. 6 (3): e17288. Bibcode:2011PLoSO...617288S. doi:10.1371/journal.pone.0017288. PMC 3052304. PMID 21408061.
- ^ a b c d e f Kunin V, Copeland A, Lapidus A, Mavromatis K, Hugenholtz P (decembar 2008). "A bioinformatician's guide to metagenomics". Microbiology and Molecular Biology Reviews. 72 (4): 557–78, Table of Contents. doi:10.1128/MMBR.00009-08. PMC 2593568. PMID 19052320.
- ^ Namiki T, Hachiya T, Tanaka H, Sakakibara Y (novembar 2012). "MetaVelvet: an extension of Velvet assembler to de novo metagenome assembly from short sequence reads". Nucleic Acids Research. 40 (20): e155. doi:10.1093/nar/gks678. PMC 3488206. PMID 22821567.
- ^ Zerbino DR, Birney E (maj 2008). "Velvet: algorithms for de novo short read assembly using de Bruijn graphs". Genome Research. 18 (5): 821–9. doi:10.1101/gr.074492.107. PMC 2336801. PMID 18349386.
- ^ Burton JN, Liachko I, Dunham MJ, Shendure J (maj 2014). "Species-level deconvolution of metagenome assemblies with Hi-C-based contact probability maps". G3. 4 (7): 1339–46. doi:10.1534/g3.114.011825. PMC 4455782. PMID 24855317.
- ^ a b c Huson DH, Mitra S, Ruscheweyh HJ, Weber N, Schuster SC (septembar 2011). "Integrative analysis of environmental sequences using MEGAN4". Genome Research. 21 (9): 1552–60. doi:10.1101/gr.120618.111. PMC 3166839. PMID 21690186.
- ^ a b Zhu W, Lomsadze A, Borodovsky M (juli 2010). "Ab initio gene identification in metagenomic sequences". Nucleic Acids Research. 38 (12): e132. doi:10.1093/nar/gkq275. PMC 2896542. PMID 20403810.
- ^ Konopka A (novembar 2009). "What is microbial community ecology?". The ISME Journal. 3 (11): 1223–30. doi:10.1038/ismej.2009.88. PMID 19657372.
- ^ a b Huson DH, Auch AF, Qi J, Schuster SC (mart 2007). "MEGAN analysis of metagenomic data". Genome Research. 17 (3): 377–86. doi:10.1101/gr.5969107. PMC 1800929. PMID 17255551.
- ^ Segata N, Waldron L, Ballarini A, Narasimhan V, Jousson O, Huttenhower C (juni 2012). "Metagenomic microbial community profiling using unique clade-specific marker genes". Nature Methods. 9 (8): 811–4. doi:10.1038/nmeth.2066. PMC 3443552. PMID 22688413.
- ^ Sunagawa S, Mende DR, Zeller G, Izquierdo-Carrasco F, Berger SA, Kultima JR, et al. (decembar 2013). "Metagenomic species profiling using universal phylogenetic marker genes". Nature Methods. 10 (12): 1196–9. doi:10.1038/nmeth.2693. PMID 24141494. S2CID 7728395.
- ^ a b Milanese A, Mende DR, Paoli L, Salazar G, Ruscheweyh HJ, Cuenca M, et al. (mart 2019). "Microbial abundance, activity and population genomic profiling with mOTUs2". Nature Communications. 10 (1): 1014. Bibcode:2019NatCo..10.1014M. doi:10.1038/s41467-019-08844-4. PMC 6399450. PMID 30833550.
- ^ Liu B, Gibbons T, Ghodsi M, Treangen T, Pop M (2011). "Accurate and fast estimation of taxonomic profiles from metagenomic shotgun sequences". BMC Genomics. 12 Suppl 2 (Suppl 2): S4. doi:10.1186/1471-2164-12-S2-S4. PMC 3194235. PMID 21989143.
- ^ Dadi TH, Renard BY, Wieler LH, Semmler T, Reinert K (2017). "SLIMM: species level identification of microorganisms from metagenomes". PeerJ. 5: e3138. doi:10.7717/peerj.3138. PMC 5372838. PMID 28367376.
- ^ Pagani I, Liolios K, Jansson J, Chen IM, Smirnova T, Nosrat B, et al. (januar 2012). "The Genomes OnLine Database (GOLD) v.4: status of genomic and metagenomic projects and their associated metadata". Nucleic Acids Research. 40 (Database issue): D571-9. doi:10.1093/nar/gkr1100. PMC 3245063. PMID 22135293.
- ^ Meyer F, Paarmann D, D'Souza M, Olson R, Glass EM, Kubal M, et al. (septembar 2008). "The metagenomics RAST server - a public resource for the automatic phylogenetic and functional analysis of metagenomes". BMC Bioinformatics. 9: 386. doi:10.1186/1471-2105-9-386. PMC 2563014. PMID 18803844.
- ^ Markowitz VM, Chen IM, Chu K, Szeto E, Palaniappan K, Grechkin Y, et al. (januar 2012). "IMG/M: the integrated metagenome data management and comparative analysis system". Nucleic Acids Research. 40 (Database issue): D123-9. doi:10.1093/nar/gkr975. PMC 3245048. PMID 22086953.
- ^ Benson DA, Cavanaugh M, Clark K, Karsch-Mizrachi I, Lipman DJ, Ostell J, Sayers EW (januar 2013). "GenBank". Nucleic Acids Research. 41 (Database issue): D36-42. doi:10.1093/nar/gks1195. PMC 3531190. PMID 23193287.
- ^ Bazinet AL, Cummings MP (maj 2012). "A comparative evaluation of sequence classification programs". BMC Bioinformatics. 13: 92. doi:10.1186/1471-2105-13-92. PMC 3428669. PMID 22574964.
- ^ Ounit R, Wanamaker S, Close TJ, Lonardi S (mart 2015). "CLARK: fast and accurate classification of metagenomic and genomic sequences using discriminative k-mers". BMC Genomics. 16 (1): 236. doi:10.1186/s12864-015-1419-2. PMC 4428112. PMID 25879410.
- ^ Šablon:Cite bioRxiv
- ^ Kurokawa K, Itoh T, Kuwahara T, Oshima K, Toh H, Toyoda A, et al. (august 2007). "Comparative metagenomics revealed commonly enriched gene sets in human gut microbiomes". DNA Research. 14 (4): 169–81. doi:10.1093/dnares/dsm018. PMC 2533590. PMID 17916580.
- ^ Mitra S, Rupek P, Richter DC, Urich T, Gilbert JA, Meyer F, et al. (februar 2011). "Functional analysis of metagenomes and metatranscriptomes using SEED and KEGG". BMC Bioinformatics. 12 Suppl 1 (Suppl 1): S21. doi:10.1186/1471-2105-12-S1-S21. PMC 3044276. PMID 21342551.
- ^ a b c d e Simon C, Daniel R (februar 2011). "Metagenomic analyses: past and future trends". Applied and Environmental Microbiology. 77 (4): 1153–61. Bibcode:2011ApEnM..77.1153S. doi:10.1128/AEM.02345-10. PMC 3067235. PMID 21169428.
- ^ Willner D, Thurber RV, Rohwer F (juli 2009). "Metagenomic signatures of 86 microbial and viral metagenomes". Environmental Microbiology. 11 (7): 1752–66. doi:10.1111/j.1462-2920.2009.01901.x. PMID 19302541.
- ^ Ghosh TS, Mohammed MH, Rajasingh H, Chadaram S, Mande SS (2011). "HabiSign: a novel approach for comparison of metagenomes and rapid identification of habitat-specific sequences". BMC Bioinformatics. 12 Suppl 13 (Supplement 13): S9. doi:10.1186/1471-2105-12-s13-s9. PMC 3278849. PMID 22373355.
- ^ Fimereli D, Detours V, Konopka T (april 2013). "TriageTools: tools for partitioning and prioritizing analysis of high-throughput sequencing data". Nucleic Acids Research. 41 (7): e86. doi:10.1093/nar/gkt094. PMC 3627586. PMID 23408855.
- ^ Maillet N, Lemaitre C, Chikhi R, Lavenier D, Peterlongo P (2012). "Compareads: comparing huge metagenomic experiments". BMC Bioinformatics. 13 Suppl 19 (Suppl 19): S10. doi:10.1186/1471-2105-13-S19-S10. PMC 3526429. PMID 23282463.
- ^ Kuntal BK, Ghosh TS, Mande SS (oktobar 2013). "Community-analyzer: a platform for visualizing and comparing microbial community structure across microbiomes". Genomics. 102 (4): 409–18. doi:10.1016/j.ygeno.2013.08.004. PMID 23978768.
- ^ McInerney MJ, Sieber JR, Gunsalus RP (decembar 2009). "Syntrophy in anaerobic global carbon cycles". Current Opinion in Biotechnology. 20 (6): 623–32. doi:10.1016/j.copbio.2009.10.001. PMC 2790021. PMID 19897353.
- ^ Klitgord N, Segrè D (august 2011). "Ecosystems biology of microbial metabolism". Current Opinion in Biotechnology. 22 (4): 541–6. doi:10.1016/j.copbio.2011.04.018. PMID 21592777.
- ^ Leininger S, Urich T, Schloter M, Schwark L, Qi J, Nicol GW, et al. (august 2006). "Archaea predominate among ammonia-oxidizing prokaryotes in soils". Nature. 442 (7104): 806–9. Bibcode:2006Natur.442..806L. doi:10.1038/nature04983. PMID 16915287. S2CID 4380804.
- ^ Paez-Espino D, Eloe-Fadrosh EA, Pavlopoulos GA, Thomas AD, Huntemann M, Mikhailova N, et al. (august 2016). "Uncovering Earth's virome". Nature. 536 (7617): 425–30. Bibcode:2016Natur.536..425P. doi:10.1038/nature19094. PMID 27533034. S2CID 4466854.
- ^ Paez-Espino D, Chen IA, Palaniappan K, Ratner A, Chu K, Szeto E, et al. (januar 2017). "IMG/VR: a database of cultured and uncultured DNA Viruses and retroviruses". Nucleic Acids Research. 45 (D1): D457–D465. doi:10.1093/nar/gkw1030. PMC 5210529. PMID 27799466.
- ^ Paez-Espino D, Roux S, Chen IA, Palaniappan K, Ratner A, Chu K, et al. (januar 2019). "IMG/VR v.2.0: an integrated data management and analysis system for cultivated and environmental viral genomes". Nucleic Acids Research. 47 (D1): D678–D686. doi:10.1093/nar/gky1127. PMC 6323928. PMID 30407573.
- ^ Paez-Espino D, Pavlopoulos GA, Ivanova NN, Kyrpides NC (august 2017). "Nontargeted virus sequence discovery pipeline and virus clustering for metagenomic data" (PDF). Nature Protocols. 12 (8): 1673–1682. doi:10.1038/nprot.2017.063. PMID 28749930. S2CID 2127494.
- ^ Kristensen DM, Mushegian AR, Dolja VV, Koonin EV (januar 2010). "New dimensions of the virus world discovered through metagenomics". Trends in Microbiology. 18 (1): 11–9. doi:10.1016/j.tim.2009.11.003. PMC 3293453. PMID 19942437.
- ^ Kerepesi C, Grolmusz V (mart 2016). "Giant viruses of the Kutch Desert". Archives of Virology. 161 (3): 721–4. arXiv:1410.1278. doi:10.1007/s00705-015-2720-8. PMID 26666442. S2CID 13145926.
- ^ Kerepesi C, Grolmusz V (juni 2017). "The "Giant Virus Finder" discovers an abundance of giant viruses in the Antarctic dry valleys". Archives of Virology. 162 (6): 1671–1676. arXiv:1503.05575. doi:10.1007/s00705-017-3286-4. PMID 28247094. S2CID 1925728.
- ^ Copeland CS (Sep–Oct 2017). "The World Within Us" (PDF). Healthcare Journal of New Orleans: 21–26.
- ^ Jansson J (2011). "Towards "Tera-Terra": Terabase Sequencing of Terrestrial Metagenomes Print E-mail". Microbe. 6 (7). str. 309. Arhivirano s originala, 31. 3. 2012.
- ^ Vogel TM, Simonet P, Jansson JK, Hirsch PR, Tiedje JM, Van Elsas JD, Bailey MJ, Nalin R, Philippot L (2009). "TerraGenome: A consortium for the sequencing of a soil metagenome". Nature Reviews Microbiology. 7 (4): 252. doi:10.1038/nrmicro2119.
- ^ "TerraGenome Homepage". TerraGenome international sequencing consortium. Pristupljeno 30. 12. 2011.
- ^ a b Committee on Metagenomics: Challenges and Functional Applications, National Research Council (2007). Understanding Our Microbial Planet: The New Science of Metagenomics (PDF). The National Academies Press. Arhivirano s originala (PDF), 30. 10. 2012. Pristupljeno 5. 1. 2023.
- ^ Charles T (2010). "The Potential for Investigation of Plant-microbe Interactions Using Metagenomics Methods". Metagenomics: Theory, Methods and Applications. Caister Academic Press. ISBN 978-1-904455-54-7.
- ^ Bringel F, Couée I (22. 5. 2015). "Pivotal roles of phyllosphere microorganisms at the interface between plant functioning and atmospheric trace gas dynamics". Frontiers in Microbiology. 6: 486. doi:10.3389/fmicb.2015.00486. PMC 4440916. PMID 26052316.
- ^ Li LL, McCorkle SR, Monchy S, Taghavi S, van der Lelie D (maj 2009). "Bioprospecting metagenomes: glycosyl hydrolases for converting biomass". Biotechnology for Biofuels. 2: 10. doi:10.1186/1754-6834-2-10. PMC 2694162. PMID 19450243.
- ^ Jaenicke S, Ander C, Bekel T, Bisdorf R, Dröge M, Gartemann KH, et al. (januar 2011). Aziz RK (ured.). "Comparative and joint analysis of two metagenomic datasets from a biogas fermenter obtained by 454-pyrosequencing". PLOS ONE. 6 (1): e14519. Bibcode:2011PLoSO...614519J. doi:10.1371/journal.pone.0014519. PMC 3027613. PMID 21297863.
- ^ Suen G, Scott JJ, Aylward FO, Adams SM, Tringe SG, Pinto-Tomás AA, et al. (septembar 2010). Sonnenburg J (ured.). "An insect herbivore microbiome with high plant biomass-degrading capacity". PLOS Genetics. 6 (9): e1001129. doi:10.1371/journal.pgen.1001129. PMC 2944797. PMID 20885794.
- ^ Simon C, Daniel R (novembar 2009). "Achievements and new knowledge unraveled by metagenomic approaches". Applied Microbiology and Biotechnology. 85 (2): 265–76. doi:10.1007/s00253-009-2233-z. PMC 2773367. PMID 19760178.
- ^ Wong D (2010). "Applications of Metagenomics for Industrial Bioproducts". Metagenomics: Theory, Methods and Applications. Caister Academic Press. ISBN 978-1-904455-54-7.
- ^ a b Schloss PD, Handelsman J (juni 2003). "Biotechnological prospects from metagenomics" (PDF). Current Opinion in Biotechnology. 14 (3): 303–10. doi:10.1016/S0958-1669(03)00067-3. PMID 12849784. Arhivirano s originala (PDF), 4. 3. 2016. Pristupljeno 20. 1. 2012.
- ^ a b c Kakirde KS, Parsley LC, Liles MR (novembar 2010). "Size Does Matter: Application-driven Approaches for Soil Metagenomics". Soil Biology & Biochemistry. 42 (11): 1911–1923. doi:10.1016/j.soilbio.2010.07.021. PMC 2976544. PMID 21076656.
- ^ Parachin NS, Gorwa-Grauslund MF (maj 2011). "Isolation of xylose isomerases by sequence- and function-based screening from a soil metagenomic library". Biotechnology for Biofuels. 4 (1): 9. doi:10.1186/1754-6834-4-9. PMC 3113934. PMID 21545702.
- ^ Hover BM, Kim SH, Katz M, Charlop-Powers Z, Owen JG, Ternei MA, et al. (april 2018). "Culture-independent discovery of the malacidins as calcium-dependent antibiotics with activity against multidrug-resistant Gram-positive pathogens". Nature Microbiology. 3 (4): 415–422. doi:10.1038/s41564-018-0110-1. PMC 5874163. PMID 29434326.
- ^ Raes J, Letunic I, Yamada T, Jensen LJ, Bork P (mart 2011). "Toward molecular trait-based ecology through integration of biogeochemical, geographical and metagenomic data". Molecular Systems Biology. 7: 473. doi:10.1038/msb.2011.6. PMC 3094067. PMID 21407210.
- ^ Lavery TJ, Roudnew B, Seymour J, Mitchell JG, Jeffries T (2012). Steinke D (ured.). "High nutrient transport and cycling potential revealed in the microbial metagenome of Australian sea lion (Neophoca cinerea) faeces". PLOS ONE. 7 (5): e36478. Bibcode:2012PLoSO...736478L. doi:10.1371/journal.pone.0036478. PMC 3350522. PMID 22606263.
- ^ "What's Swimming in the River? Just Look For DNA". NPR.org. 24. 7. 2013. Pristupljeno 10. 10. 2014.
- ^ Chua, Physilia Y. S.; Crampton‐Platt, Alex; Lammers, Youri; Alsos, Inger G.; Boessenkool, Sanne; Bohmann, Kristine (25. 5. 2021). "Metagenomics: A viable tool for reconstructing herbivore diet". Molecular Ecology Resources. 21 (7): 1755–0998.13425. doi:10.1111/1755-0998.13425. PMC 8518049 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 33971086 Provjerite vrijednost parametra|pmid=(pomoć). - ^ Chua, Physilia Y. S.; Carøe, Christian; Crampton-Platt, Alex; Reyes-Avila, Claudia S.; Jones, Gareth; Streicker, Daniel G.; Bohmann, Kristine (4. 7. 2022). "A two-step metagenomics approach for the identification and mitochondrial DNA contig assembly of vertebrate prey from the blood meals of common vampire bats (Desmodus rotundus)". Metabarcoding and Metagenomics (jezik: engleski). 6: e78756. doi:10.3897/mbmg.6.78756. ISSN 2534-9708. S2CID 248041252 Provjerite vrijednost parametra
|s2cid=(pomoć). - ^ George I, Stenuit B, Agathos SN (2010). "Application of Metagenomics to Bioremediation". u Marco D (ured.). Metagenomics: Theory, Methods and Applications. Caister Academic Press. ISBN 978-1-904455-54-7.
- ^ Zimmer C (13. 7. 2010). "How Microbes Defend and Define Us". New York Times. Pristupljeno 29. 12. 2011.
- ^ Nelson KE and White BA (2010). "Metagenomics and Its Applications to the Study of the Human Microbiome". Metagenomics: Theory, Methods and Applications. Caister Academic Press. ISBN 978-1-904455-54-7.
- ^ Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, et al. (mart 2010). "A human gut microbial gene catalogue established by metagenomic sequencing". Nature. 464 (7285): 59–65. Bibcode:2010Natur.464...59.. doi:10.1038/nature08821. PMC 3779803. PMID 20203603.
- ^ Abubucker, Sahar; Segata, Nicola; Goll, Johannes; Schubert, Alyxandria M.; Izard, Jacques; Cantarel, Brandi L.; Rodriguez-Mueller, Beltran; Zucker, Jeremy; Thiagarajan, Mathangi; Henrissat, Bernard; White, Owen; Kelley, Scott T.; Methé, Barbara; Schloss, Patrick D.; Gevers, Dirk; Mitreva, Makedonka; Huttenhower, Curtis (2012). "PLOS Computational Biology: Metabolic Reconstruction for Metagenomic Data and Its Application to the Human Microbiome". PLOS Computational Biology. 8 (6): e1002358. Bibcode:2012PLSCB...8E2358A. doi:10.1371/journal.pcbi.1002358. PMC 3374609. PMID 22719234.
- ^ Chua, Physilia Ying Shi; Rasmussen, Jacob Agerbo (11. 5. 2022). "Taking metagenomics under the wings". Nature Reviews Microbiology (jezik: engleski). 20 (8): 447. doi:10.1038/s41579-022-00746-5. ISSN 1740-1534. PMID 35546350 Provjerite vrijednost parametra
|pmid=(pomoć). S2CID 248739527 Provjerite vrijednost parametra|s2cid=(pomoć). - ^ Zakrzewski M, Rašić G, Darbro J, Krause L, Poo YS, Filipović I; et al. (2018). "Mapping the virome in wild-caught Aedes aegypti from Cairns and Bangkok". Sci Rep. 8 (1): 4690. Bibcode:2018NatSR...8.4690Z. doi:10.1038/s41598-018-22945-y. PMC 5856816. PMID 29549363.CS1 održavanje: više imena: authors list (link)
- ^ Thoendel M (2020). "Targeted Metagenomics Offers Insights into Potential Tick-Borne Pathogens". J Clin Microbiol. 58 (11). doi:10.1128/JCM.01893-20. PMC 7587107. PMID 32878948.
- ^ Parry R, James ME, Asgari S (2021). "Uncovering the Worldwide Diversity and Evolution of the Virome of the Mosquitoes Aedes aegypti and Aedes albopictus". Microorganisms. 9 (8): 1653. doi:10.3390/microorganisms9081653. PMC 8398489 Provjerite vrijednost parametra
|pmc=(pomoć). PMID 34442732 Provjerite vrijednost parametra|pmid=(pomoć).CS1 održavanje: više imena: authors list (link) - ^ Batovska J, Mee PT, Lynch SE, Sawbridge TI, Rodoni BC (2019). "Sensitivity and specificity of metatranscriptomics as an arbovirus surveillance tool". Sci Rep. 9 (1): 19398. Bibcode:2019NatSR...919398B. doi:10.1038/s41598-019-55741-3. PMC 6920425. PMID 31852942.CS1 održavanje: više imena: authors list (link)
- ^ Batovska J, Lynch SE, Rodoni BC, Sawbridge TI, Cogan NO (2017). "Metagenomic arbovirus detection using MinION nanopore sequencing". J Virol Methods. 249: 79–84. doi:10.1016/j.jviromet.2017.08.019. PMID 28855093.CS1 održavanje: više imena: authors list (link)
Greška kod citiranja: <ref> oznaka s imenom "Chen2005" definirana u <references> nije korištena u ranijem tekstu.
Greška kod citiranja: <ref> oznaka s imenom "schuster2008" definirana u <references> nije korištena u ranijem tekstu.
<ref> oznaka s imenom "werner2011" definirana u <references> nije korištena u ranijem tekstu.Vanjski linkovi
[uredi | uredi izvor]- Focus on Metagenomics at Nature Reviews Microbiology journal website
- The “Critical Assessment of Metagenome Interpretation” (CAMI) initiative to evaluate methods in metagenomics
