Pirimidin
| Pirimidin | |
|---|---|
    | |
| Općenito | |
| Hemijski spoj | Pirimidin |
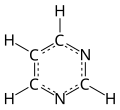
| Molekularna formula | C4H4N2 |
| CAS registarski broj | 289-95-2 |
| SMILES | C1=CN=CN=C1 |
| Osobine1 | |
| Molarna masa | 80,088 |
| Tačka topljenja | 20–22 °C |
| Tačka ključanja | 123–124 °C |
| Rizičnost | |
| NFPA 704 | |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |
Pirimidin je aromatski organski, heterociklični spoj koji je sličan benzenu i piridinu, a sadrži dva dušikova atoma na pozicijama 1 i 3 šestočlanog prstena. To je izomerni hemijski spoj sa dvije druge forme diazina.
Nukleotidi
[uredi | uredi izvor]U nukleinskim kiselinama, nađena su tri nukleobaze, koje su izvedenice pirimidina; to su:



U molekulama DNK i RNK ove baze stvaraju vodikove veze sa odgovarajućim komplementarnim bazama – derivatima purina. Purinski adenin (A) i guanin (G) ulaze u vodikovu vezu sa derivatima pirimidina: timinom (T) i citozinom (C). U molekuli RNK, umjesto timina (T), komplementarna baza adeninu je uracil (U), a normalni su adenin–uracil i citozin–guanin.
U rijetkim slučajevima, timin se javlja i u RNK ili uracil u DNK. Osim tri glavne pirimidinske baze, u nukleinskim kiselinama se mogu naći neke rijetke primidinske. To su uglavnom metilirani derivati glavnih baza, a dokazano je da imaju regulatornu funkciju.
Ovo uparivanje baza se označava kao Watson-Crickovo osnovno uparivanje baza. Moguće su i druge veze u uparivanja u molekulima DNK i RNK.
Hemijske osobenosti
[uredi | uredi izvor]Pirimidin ima mnoge osobine koje su opće sa piridinom. Sa povećanjem broja atoma dušika u prstenu π elektroni u njemu postaju slabiji i zbog čega se teže odvijaju reakcije elektrofilne aromatske supstitucije; nukleofilna aromatična supstitucija se odvija lakše. Primjer je zamjena amino grupe u 2-aminopirimidinu hlorom i reakcija u obratnom smjeru. Smanjenje rezonantne stabilizacije elektrona u prstenu pirimidina omogućava reakciju adicije i cijepanja prstena, kada se odvijaju lakše nego supstitucije.
Poredeći ga sa piridinom, čija se N-alkilacija i N-oksidacija se odigravaju teže, primidini imaju slabije izražena bazna svojstva. Konstanta disocijacije protoniziranog pirimidina je 1,23, a piridina 5,30.
Pirimidin je nađen u meteorima, ali se još ne zna njegovo tamošnje porijeklo. Međutim, poznato je da se fotolitski razlaže na uracil, pod djelovanjem UV svjetlosti.
Organska sinteza
[uredi | uredi izvor]Derivati pirimidina se mogu pripremiti i u laboratorijskim uvjetima, putem organske sinteze.
Osnovni metod tog postupka je omogućavanje reakcije određenih amida sa nitrilima, pri čemu dolazi do elektrofilne aktivacije amida 2-hloro-pirimidinom i anhidridom triflormetanosulfona.


