Trombska trombocitopenijska purpura
| Trombska trombocitopenijska purpura | |
|---|---|
| Drugi nazivi | Moschcowitzev sindrom,[1] idiopatska trombska trombocitopenija purpura[2] |
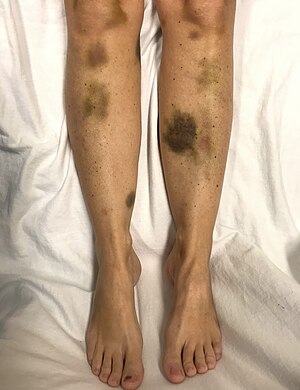 | |
| Spontane modrice kod žene sa kritično niskom razinom brojnosti trombocita | |
| Specijalnost | Hematologija |
| Simptomi | Velike modrice, groznica, slabost, kratak dah, zbunjenost, glavobolja[2][3] |
| Uobičajeno pojavljivanje | Odraslo doba[3] |
| Uzroci | Nepoznato, bakterijske infekcije, određeni lijekovi, autoimunska bolest, trudnoća[3] |
| Dijagnostička metoda | Na osnovu simptoma i krvnih pretraga[2] |
| Diferencijalna dijagnoza | Hemolitsko-uremijski sindrom (HUS), atipski hemolitsko-uremijski sindrom (aHUS)[4] |
| Tretman | Zamjena plazme, imunosupresivi[1] |
| Prognoza | < 20% rizik od smrti[1] |
| Frekvencija | 1/100.000 ljudi[3] |
Trombocitna trombocitopenijska purpura ili trombotska trombocitopenija purpura (TTP) je genetički poremećaj krvi koji rezultira stvaranjem krvnih ugrušaka u malim krvnim sudovima u cijelom tijelu.[2] To dovodi do niskog broja trombocita, niskog broja crvenih krvnih zrnaca zbog njihovog raspada, a često i disfunkcija bubrega, srce i mozga.[1] Simptomi mogu uključivati velike modrice, groznicu, slabost, kratko disanje, zbunjenost i glavobolje.[2][3] Mogu se pojaviti ponovljene epizode.[3]
U otprilike polovini slučajeva okidač je identificiran, dok u ostatku uzrok ostaje nepoznat.[3] Poznati okidači uključuju bakterijske infekcije, određene lijekove, autoimunske bolesti kao što su lupus i trudnoća.[3] Osnovni mehanizam obično uključuje antitijela koja inhibiraju enzim ADAMTS13.[1] Ovo rezultira smanjenom razgradnjom velikih multimera von Willebrandovog faktora (vWF) na manje jedinice.[1] Manje često TTP je naslijeđen od roditelja , poznat kao Upshaw-Schulmanov sindrom, tako da je disfunkcija ADAMTS13 prisutna od rođenja.[5] Diagnosis is typically based on symptoms and blood tests.[2] It may be supported by measuring activity of or antibodies against ADAMTS13.[2]
Sa izmjenom plazme rizik od smrti je smanjen sa više od 90% na manje od 20%.[1] Imunosupresivi, kao što su glukokortikoidi, i rituksimab također se mogu koristiti.[3] Transfuzija trombocita se općenito ne preporučuje.[6]
Pogođeno je otprilike 1/100.000 ljudi.[3] Početak je tipično u odrasloj dobi i češće su pogođene žene.[3] Oko 10% slučajeva počinje u djetinjstvu.[3] Stanje je prvi opisao Eli Moschcowitz 1924.[3] Osnovni mehanizam određen je 1980-ih i 1990-ih.[3]
Znakovi i simptomi
[uredi | uredi izvor]Znakovi i simptomi TTP-a mogu u početku biti suptilni i nespecifični. Mnogi ljudi dožive bolest sličnu gripi ili bolest dijareja, prije nego što razviju TTP.[7] Neurološki simptomi su vrlo česti i jako variraju u težini. Često prijavljeni simptomi uključuju osećaj jakog umora, konfuziju i glavobolje.[7] Također javljaju se i Napadi i simptomi slični onima kod moždanog udara.[7] Ostali simptomi uključuju, ali nisu ograničeni na žuticu ili bljedilo kože, ubrzan rad srca ili kratak dah ili ljubičaste ili crvenkaste tačke na koži, poznate kao petehije.
Kako TTP napreduje, krvni ugrušci se formiraju unutar malih krvnih žila (mikrovaskularna struktura), a trombociti (ćelije za zgrušavanje) se troše. Kao posljedica, mogu se pojaviti modrice, a rijetko i krvarenje. Modrice često imaju oblik purpura, dok je najčešće mjesto krvarenja, ako se pojavi, iz nosa ili desni. Mogu se razviti i veće modrice (ekhimoze). Klasična prezentacija TTP-a, koja se javlja kod manje od 10% ljudi, uključuje pet medicinskih znakova.[3] To su:
- Groznica
- Promjene u mentalnom statusu
- Trombocitopenija
- Smanjena funkcija bubrega
- Hemolitska anemija (mikroangiopatska hemolitička anemija).[7]
Prilikom pregleda može se utvrditi visok krvni pritisak (hipertenzija).[8]
Uzroci
[uredi | uredi izvor]TTP, kao i kod drugih mikroangiopatskih hemolitskih anemija (MAHA), uzrokovan je spontanim agregacijama trombocita i aktivacijom koagulacije u malim krvnim sudovima. Trombociti se troše u procesu agregacije i vezuju vWF. Ovi kompleksi trombociti-vWF formiraju male krvne ugruške koji cirkuliraju u krvnim žilama i uzrokuju smicanje crvenih krvnih zrnaca, što rezultira njihovom rasprskavanjem i stvaranjem shistocita.[9]
Autoimunski
[uredi | uredi izvor]TTP nepoznatog uzroka dugo je bio poznat kao idiopatski TTP, ali se 1998. pokazalo da je većina slučajeva uzrokovana inhibicijom enzima ADAMTS13 putem antitijela. Odnos reduciranog ADAMTS13 i patogeneze TTP-a poznat je kao Furlan-Tsaijeva hipoteza, nakon što su dvije nezavisne grupe istraživača objavile rezultate svojih istraživanja u istom broju časopisa New England Journal of Medicine.[10][11][12]
ADAMTS13 je metaloproteinaza odgovorna za razgradnju von Willebrandovog faktora (vWF), proteina koji povezuje trombocite, krvni ugrušak i zid krvnih sudova, u procesu zgrušavanja krvi. Veoma veliki vWF multimeri skloniji su koagulaciji. Stoga, bez pravilnog cijepanja vWF putem ADAMTS13, koagulacija se događa višom brzinom, posebno u mikrovaskulaturi, dijelu sistema krvnih sudova, gdje je vWF najaktivniji zbog visokog naprezanja smicanja.[5] Kod idiopatskog TTP-a, kod većine (80%) ljudi može se otkriti ozbiljno smanjena (<5% normalne) aktivnost ADAMTS13, a inhibitori se često nalaze u ovoj podgrupi (44–56%).
Genetički
[uredi | uredi izvor]
Ovo svojstvo može biti priroeno (kongenitalno). Takvi slučajeviu uzrokovani su mutacijama gena ADAMTS13. Teški slučaj kongenitalne trombotske trombocitopenije purpure koja je posljedica heterozigotnosti spoja koji uključuje novu ADAMTS13 patogenu varijantu.[15] Ovaj nasljedni oblik TTP-a naziva se Upshaw-Schulmanov sindrom.[16][17][18] Ljudi s ovim naslijeđenim nedostatkom ADAMTS13 imaju iznenađujuće blag fenotip, ali razvijaju TTP u kliničkim situacijama s povećanim nivoima von Willebrandovog faktora, npr. infekcija. Navodno, manje od 1% svih slučajeva TTP-a uzrokovano je Upshaw-Schulmanovim sindromom.[19] Osobe s ovim sindromom općenito imaju 5-10% normalne aktivnosti ADAMTS-13.[18][20]
Sekundarni
[uredi | uredi izvor]Sekundarni TTP se dijagnosticira kada se u anamnezi osobe spominje jedna od poznatih karakteristika povezanih s TTP-om. On čini oko 40% svih slučajeva TTP-a. Predisponirajući faktori su:[9]
- Kancer
- Transplantacija koštane srži
- Trudnoća
- Upotreba lijekova:
- Antivirusni lijekovi (aciklovir)
- Određeni hemoterapija lijekovi kao što su gemcitabin i mitomicin C
- Kvinin
- Oksimorfon
- Kvetiapin
- Bevacizumab
- Sunitinib
- Inhibitori agregacije trombocita (tiklopidin, klopidogrel i prasugrel)
- Imunosupresivi (ciklosporin, mitomicin, takrolimus/FK506, interferon-α)
- Lijekovi koji mijenjaju hormone (estrogeni, kontraceptivi, hormonska nadomjesna terapija)[21]
- Infekcije HIV-om-1.
Mehanizam sekundarnog TTP-a je slabo shvaćen, budući da aktivnost ADAMTS13 općenito nije tako depresivna kao kod idiopatskog TTP-a, a inhibitori se ne mogu otkriti. Vjerovatna etiologija može uključivati, barem u nekim slučajevima, oštećenje endotela,[22] iako stvaranje tromba koji rezultira okluzijom krvnih sudova možda nije bitno u patogenezi sekundarnog TTP.[23] Ovi faktori se također mogu smatrati oblikom sekundarnog aHUS-a; ljudi koji imaju ove karakteristike su, stoga, potencijalni kandidati za terapiju antikomplementom.
Patofiziologija
[uredi | uredi izvor]Osnovni mehanizam obično uključuje inhibiciju enzima ADAMTS13, posredovanu autoantitijelima, metaloproteazama odgovornim za cijepanje velikih multimera von Willebrandovog faktora (vWF) na manje jedinice. Povećanje cirkulirajućih multimera vWF povećava adheziju trombocita na područja ozljede endotela, posebno gdje se spajaju arteriole i kapilari, što zauzvrat rezultira stvaranjem malih trombocitnih ugrušaka koji se nazivaju trombovi. Kako se trombociti troše u formiranju trombove, to dovodi do smanjenja ukupnog broja trombocita koji cirkuliraju, što onda može uzrokovati krvarenje opasno po život. Crvena krvna zrnca koja prolaze kroz e ugruške mikroskopskih dimenzija podvrgnuta su naprezanju smicanja, koje oštećuje njihove membrane, što dovodi do rupture crvenih krvnih zrnaca unutar krvnih sudova, što izaziva anemije i formiranje shistocita. Prisustvo ovih krvnih ugrušaka u malim krvnim sudovima smanjuje dotok krvi u organe što dovodi do oštećenja ćelija i krajnjeg oštećenja organa.
Dijagnoza
[uredi | uredi izvor]Diferencijalna dijagnoza
[uredi | uredi izvor]TTP karakterizira trombocitna mikroangiopatija (TMA), stvaranje krvnih ugrušaka u malim krvnim žilama u cijelom tijelu, što može dovesti do mikroangiopatske hemolitske anemije i trombocitopenije. Ovu karakteristiku dijele dva srodna sindroma, hemolitsko-uremijski sindrom (HUS) i atipski hemolitsko-uremijski sindrom (aHUS).[4] Zbog toga je neophodna diferencijalna dijagnoza ovih bolesti koje uzrokuju TMA. Pored TMA, kod svake od ovih bolesti može biti prisutan jedan ili više od sljedećih simptoma: neurološki simptomi (npr.,[24][25] moždane konvulzije[25]epilepsijski napadi,[26]); oštećenje bubrega [27] (npr. povišen kreatinin,[28] smanjena procijenjena brzina glomerulske filtracije [eGFR],[28] abnormalna analiza urina [29]) i gastrointestinalni (GI) simptomi (npr. dijareja[24][30] mučnina/povraćanje,[26] bol u trbuhu,[26] gastroenteritis.[24][27] Za razliku od HUS-a i aHUS-a, poznato je da je TTP uzrokovan stečenim defektom u proteinu ADAMTS13, tako da laboratorijski test koji pokazuje ≤5% normalnih nivoa ADAMTS13 ukazuje na TTP.[31] Nivoi ADAMTS13 iznad 5%, zajedno sa pozitivnim testom na sjiga-toksin/enterohemoragijske E. coli (EHEC), vjerovatnije su indikativne za HUS,[32] dok odsustvo shiga-toksina/EHEC može potvrditi dijagnozu aHUS-a.[31]
Liječenje
[uredi | uredi izvor]Zbog visokog mortaliteta neliječenog TTP-a, pretpostavljena dijagnoza TTP-a se postavlja čak i kada se vide samo mikroangiopatska hemolitska anemija i trombocitopenija i započne terapija. Transfuzija krvi je kontraindicirana kod tromboznog TTP-a, jer podstiče koagulopatiju. Od ranih 1990-ih, plazmafereza je postala tretman izbora za TTP.[33][34] Ovo je razmjenska transfuzija koja uključuje uklanjanje krvne plazme osobe pomoću afereze i zamjenu plazmom donora (svježe smrznuta plazma ili kriosupernatant); postupak se mora ponavljati svakodnevno, kako bi se eliminirao inhibitor i ublažili simptomi. Ako afereza nije dostupna, može se infundirati svježe smrznuta plazma, ali volumen koji se može sigurno dati je ograničen zbog opasnosti od preopterećenja tekućinom.[35] Infuzija plazme sama po sebi nije toliko korisna kao izmjena plazme.[33] Obično se daju kortikosteroidi (prednizon ili prednizolon).[34] Rituksimab, monoklonsko antitijelo usmereno na molekulu CD20 na B limfocitima, može se koristiti u dijagnostici; Smatra se da ovo ubija B-ćelije i time smanjuje proizvodnju inhibitora.[34] Postoji jača preporuka za rituksimab kada TTP ne reaguje na kortikosteroide i plazmaferezu.[34]
Caplacizumab je alternativna opcija u liječenju TTP-a jer se pokazalo da brže rješava bolesti u usporedbi s onima koji su bili na placebu.[36]
Djeca sa Upshaw-Schülmanovim sindromom primaju profilaksnu plazmu svake dvije do tri sedmice; ovo održava adekvatne nivoe funkcionisanja ADAMTS13. Neki tolerišu duže intervale između infuzija plazme. Dodatne infuzije plazme mogu biti potrebne za pokretanje aktivnosti, kao što je operacija; alternativno, broj trombocita može se pažljivo pratiti oko ovih događaja uz primjenu plazme ako broj opadne.[37]
Mjerenja nivoa laktat-dehidrogenaze, trombocita i shistocita u krvi se koriste za praćenje progresije bolesti ili remisije. Aktivnost ADAMTS13 i nivoi inhibitora mogu se mjeriti tokom praćenja, ali kod onih bez simptoma upotreba rituksimaba se ne preporučuje.[34]
Prognoza
[uredi | uredi izvor]Stopa mortaliteta je oko 95% za neliječene slučajeve, ali je prognoza prilično povoljna (80-90% preživljavanja) za osobe s idiopatskim TTP koji je dijagnosticiran i liječen rano plazmaferezom.[38]
Epidemiologija
[uredi | uredi izvor]Incidencija TTP-a je oko 4–5 slučajeva na milion ljudi godišnje.[39] Idiopatski TTP se češće javlja kod žena i ljudi afričkog porijekla, a TTP sekundarni autoimunski poremećaji kao što je sistemski eritemski lupus češće se javljaju kod ljudi afričkog porijekla, iako drugi sekundarni oblici ne pokazuju ovu distribuciju.[40] Trudnice i žene u „postpartum“ periodu činile su značajan dio (12–31%) slučajeva u nekim studijama; TTP pogađa otprilike jednu od 25.000 trudnoća.[41]
Historija
[uredi | uredi izvor]TTP je prvobitno opisao Eli Moschcowitz u Beth Israel Medical Center u New York City 1925. Moschcowitz je bolest (netačno, kako je sada poznato) pripisao toksični uzrok. Primijetio jemda je njegova pacijentica, 16-godišnja djevojka, imala anemiju, male i velike modrice, mikroskopskih dimenzija hematuriju, i, na obdukciji, diseminirani mikrovaskularni trombi.[42] U 1966., pregled 16 novih slučajeva i 255 ranije prijavljenih doveo je do formulacije klasične pentade simptoma i nalaza (tj. trombocitopenija, mikroangiopatska hemolitska anemija, neurološki simptomi, zatajenje bubrega, groznica); u ovoj seriji, utvrđeno je da su stope mortaliteta veoma visoke (90%).[43]
Dok je odgovor na transfuziju krvi već bio zabilježen i ranije, izvještaj iz 1978. i naknadne studije pokazali su da je krvna plazma bila vrlo efikasna u poboljšanju procesa saniranja bolesti.[44] U 1991., izvješteno je da izmjena plazme daje bolje stope odgovora u poređenju sa njenom infuzijom.[45] Godine 1982, bolest je bila povezana sa abnormalno velikim multimerima von Willebrandovog faktora. Identifikacija deficita proteaze kod ljudi sa TTP-om izvršena je 1998. godine. Lokacija ADAMTS13 u ljudskom genomu identifikovana je u 2001.[44]
Reference
[uredi | uredi izvor]- ^ a b c d e f g Kremer Hovinga, JA; Coppo, P; Lämmle, B; Moake, JL; Miyata, T; Vanhoorelbeke, K (6. 4. 2017). "Thrombotic thrombocytopenic purpura". Nature Reviews. Disease Primers. 3: 17020. doi:10.1038/nrdp.2017.20. PMID 28382967. S2CID 11960153.
- ^ a b c d e f g "Thrombotic thrombocytopenic purpura, acquired". Genetic and Rare Diseases Information Center (GARD) – an NCATS Program (jezik: engleski). Arhivirano s originala, 20. 10. 2018. Pristupljeno 10. 10. 2018.
- ^ a b c d e f g h i j k l m n o Joly, BS; Coppo, P; Veyradier, A (25. 5. 2017). "Thrombotic thrombocytopenic purpura". Blood. 129 (21): 2836–2846. doi:10.1182/blood-2016-10-709857. PMID 28416507.
- ^ a b George JN (novembar 2010). "How I treat patients with thrombotic thrombocytopenic purpura: 2010". Blood. 116 (20): 4060–9. doi:10.1182/blood-2010-07-271445. PMID 20686117.
- ^ a b Moake JL (2004). "von Willebrand factor, ADAMTS-13, and thrombotic thrombocytopenic purpura". Semin. Hematol. 41 (1): 4–14. doi:10.1053/j.seminhematol.2003.10.003. PMID 14727254.
- ^ Wood, Marie E.; Philips, George K. (2003). Hematology/oncology Secrets (jezik: engleski). Elsevier Health Sciences. str. 68. ISBN 978-1560535164.
- ^ a b c d Shatzel, JJ; Taylor, JA (mart 2017). "Syndromes of Thrombotic Microangiopathy". The Medical Clinics of North America (Review). 101 (2): 395–415. doi:10.1016/j.mcna.2016.09.010. PMID 28189178.
- ^ Allford S, Machin S (2005). "Thrombotic thrombocytopenic purpura". NetDoctor.co.uk. Arhivirano s originala, 18. 9. 2015. Pristupljeno 22. 1. 2022.
- ^ a b Moake JL (2002). "Thrombotic microangiopathies". New England Journal of Medicine. 347 (8): 589–600. doi:10.1056/NEJMra020528. PMID 12192020.
- ^ Moake JL (1998). "Moschcowitz, multimers, and metalloprotease". New England Journal of Medicine. 339 (22): 1629–31. doi:10.1056/NEJM199811263392210. PMID 9828253.
- ^ Furlan M, Robles R, Galbusera M, et al. (1998). "von Willebrand factor-cleaving protease in thrombotic thrombocytopenic purpura and the hemolytic-uremic syndrome". New England Journal of Medicine. 339 (22): 1578–84. doi:10.1056/NEJM199811263392202. PMID 9828245.
- ^ Tsai HM, Lian EC (1998). "Antibodies to von Willebrand factor–cleaving protease in acute thrombotic thrombocytopenic purpura". New England Journal of Medicine. 339 (22): 1585–94. doi:10.1056/NEJM199811263392203. PMC 3159001. PMID 9828246.
- ^ "OMIM Entry -# 274150 - THROMBOTIC THROMBOCYTOPENIC PURPURA, CONGENITAL; TTP". www.omim.org (jezik: engleski). Pristupljeno 23. 10. 2017.
- ^ RESERVED, INSERM US14 -- ALL RIGHTS. "Orphanet: Thrombotic thrombocytopenic purpura". www.orpha.net (jezik: engleski). Pristupljeno 23. 10. 2017.
- ^ J Pediatr Hematol Oncol
- ^ Schulman I, Pierce M, Lukens A, Currimbhoy Z (juli 1960). "Studies on thrombopoiesis. I. A factor in normal human plasma required for platelet production; chronic thrombocytopenia due to its deficiency" (PDF). Blood. 16 (1): 943–57. doi:10.1182/blood.V16.1.943.943. PMID 14443744.
- ^ Upshaw JD (juni 1978). "Congenital deficiency of a factor in normal plasma that reverses microangiopathic hemolysis and thrombocytopenia". New England Journal of Medicine. 298 (24): 1350–2. doi:10.1056/NEJM197806152982407. PMID 651994.
- ^ a b Levy GG, Nichols WC, Lian EC, Foroud T, McClintick JN, McGee BM, Yang AY, Siemieniak DR, Stark KR, Gruppo R, Sarode R, Shurin SB, Chandrasekaran V, Stabler SP, Sabio H, Bouhassira EE, Upshaw JD, Ginsburg D, Tsai HM, et al. (oktobar 2001). "Mutations in a member of the ADAMTS gene family cause thrombotic thrombocytopenic purpura" (PDF). Nature. 413 (6855): 488–494. Bibcode:2001Natur.413..488L. doi:10.1038/35097008. hdl:2027.42/62592. PMID 11586351. S2CID 4380010.
- ^ Tsai HM (2009). "Thrombotic thrombocytopenic purpura, hemolytic uremic syndrome, and related disorders". u Greer JP, Foerster J, Rodgers GM, et al. (ured.). Wintrobe's Clinical Hematology (12th izd.). Philadelphia PA: Lippincott, Williams, and Wilkins. str. 1314–25. ISBN 978-0781765077.
- ^ Kokame, K.; Matsumoto, M; Soejima, K; Yagi, H; Ishizashi, H; Funato, M; Tamai, H; Konno, M; Kamide, K; Kawano, Y; Miyata, T; Fujimura, Y (14. 8. 2002). "Mutations and common polymorphisms in ADAMTS13 gene responsible for von Willebrand factor-cleaving protease activity". Proceedings of the National Academy of Sciences, USA. 99 (18): 11902–7. Bibcode:2002PNAS...9911902K. doi:10.1073/pnas.172277399. PMC 129366. PMID 12181489.
- ^ Menkes, John H.; Sarnat, Harvey B.; Maria, Bernard L. (2006). "Thrombotic Thrombocytopenic Purpura and Hemolytic-Uremic Syndrome". Child Neurology (7th izd.). Philadelphia: Lippincott Williams & Wilkins. str. 525. ISBN 9780781751049.
- ^ van Mourik JA, Boertjes R, Huisveld IA, et al. (juli 1999). "von Willebrand factor propeptide in vascular disorders: A tool to distinguish between acute and chronic endothelial cell perturbation". Blood. 94 (1): 179–85. doi:10.1182/blood.V94.1.179.413k18_179_185. PMID 10381511.
- ^ Iwata H, Kami M, Hori A, Hamaki T, Takeuchi K, Mutou Y (juni 2001). "An autopsy-based retrospective study of secondary thrombotic thrombocytopenic purpura". Haematologica. 86 (6): 669–70. PMID 11418383.
- ^ a b c Noris M, Caprioli J, Bresin E, et al. (oktobar 2010). "Relative role of genetic complement abnormalities in sporadic and familial aHUS and their impact on clinical phenotype". Clinical Journal of the American Society of Nephrology. 5 (10): 1844–59. doi:10.2215/CJN.02210310. PMC 2974386. PMID 20595690.
- ^ a b Neuhaus TJ, Calonder S, Leumann EP (juni 1997). "Heterogeneity of atypical haemolytic uraemic syndromes". Archives of Disease in Childhood. 76 (6): 518–21. doi:10.1136/adc.76.6.518. PMC 1717216. PMID 9245850.
- ^ a b c Dragon-Durey MA, Sethi SK, Bagga A, et al. (decembar 2010). "Clinical features of anti-factor H autoantibody-associated hemolytic uremic syndrome". Journal of the American Society of Nephrology. 21 (12): 2180–7. doi:10.1681/ASN.2010030315. PMC 3014031. PMID 21051740.
- ^ a b Caprioli J, Noris M, Brioschi S, et al. (august 2006). "Genetics of HUS: the impact of MCP, CFH, and IF mutations on clinical presentation, response to treatment, and outcome". Blood. 108 (4): 1267–79. doi:10.1182/blood-2005-10-007252. PMC 1895874. PMID 16621965.
- ^ a b Ariceta G, Besbas N, Johnson S, et al. (april 2009). "Guideline for the investigation and initial therapy of diarrhea-negative hemolytic uremic syndrome". Pediatric Nephrology. 24 (4): 687–96. doi:10.1007/s00467-008-0964-1. PMID 18800230.
- ^ Al-Akash SI, Almond PS, Savell VH, Gharaybeh SI, Hogue C (april 2011). "Eculizumab induces long-term remission in recurrent post-transplant HUS associated with C3 gene mutation". Pediatric Nephrology. 26 (4): 613–9. doi:10.1007/s00467-010-1708-6. PMID 21125405. S2CID 22334044.
- ^ Zuber J, Le Quintrec M, Sberro-Soussan R, Loirat C, Frémeaux-Bacchi V, Legendre C (januar 2011). "New insights into postrenal transplant hemolytic uremic syndrome". Nature Reviews. Nephrology. 7 (1): 23–35. doi:10.1038/nrneph.2010.155. PMID 21102542. S2CID 2054556.
- ^ a b Tsai HM (januar 2010). "Pathophysiology of thrombotic thrombocytopenic purpura". International Journal of Hematology. 91 (1): 1–19. doi:10.1007/s12185-009-0476-1. PMC 3159000. PMID 20058209.
- ^ Bitzan M, Schaefer F, Reymond D (septembar 2010). "Treatment of typical (enteropathic) hemolytic uremic syndrome". Seminars in Thrombosis and Hemostasis. 36 (6): 594–610. doi:10.1055/s-0030-1262881. PMID 20865636.
- ^ a b Michael, M; Elliott, EJ; Ridley, GF; Hodson, EM; Craig, JC (21. 1. 2009). "Interventions for haemolytic uraemic syndrome and thrombotic thrombocytopenic purpura". The Cochrane Database of Systematic Reviews. 1 (1): CD003595–CD003595–63. doi:10.1002/14651858.CD003595.pub2. hdl:10072/61440. PMC 7154575. PMID 19160220.
- ^ a b c d e Lim W, Vesely SK, George JN (5. 3. 2015). "The role of rituximab in the management of patients with acquired thrombotic thrombocytopenic purpura". Blood. 125 (10): 1526–31. doi:10.1182/blood-2014-10-559211. PMC 4351502. PMID 25573992.
- ^ Allford SL, Hunt BJ, Rose P, Machin SJ (februar 2003). "Guidelines on the diagnosis and management of the thrombotic microangiopathic haemolytic anaemias". British Journal of Haematology. 120 (4): 556–73. doi:10.1046/j.1365-2141.2003.04049.x. PMID 12588343. S2CID 38774829.
- ^ Peyvandi, Flora; Scully, Marie; Kremer Hovinga, Johanna A.; Cataland, Spero; Knöbl, Paul; Wu, Haifeng; Artoni, Andrea; Westwood, John-Paul; Mansouri Taleghani, Magnus (11. 2. 2016). "Caplacizumab for Acquired Thrombotic Thrombocytopenic Purpura" (PDF). New England Journal of Medicine. 374 (6): 511–522. doi:10.1056/NEJMoa1505533. ISSN 0028-4793. PMID 26863353.
- ^ Loirat, C; Girma, JP; Desconclois, C; Coppo, P; Veyradier, A (januar 2009). "Thrombotic thrombocytopenic purpura related to severe ADAMTS13 deficiency in children". Pediatric Nephrology (Berlin, Germany). 24 (1): 19–29. doi:10.1007/s00467-008-0863-5. PMID 18574602. S2CID 22209831.
- ^ Tsai, Han-Mou (februar 2006). "Current Concepts in Thrombotic Thrombocytopenic Purpura". Annual Review of Medicine. 57: 419–436. doi:10.1146/annurev.med.57.061804.084505. PMC 2426955. PMID 16409158.
- ^ Terrell DR, Williams LA, Vesely SK, Lämmle B, Hovinga JA, George JN (juli 2005). "The incidence of thrombotic thrombocytopenic purpura-hemolytic uremic syndrome: all patients, idiopathic patients, and patients with severe ADAMTS-13 deficiency". Journal of Thrombosis and Haemostasis. 3 (7): 1432–6. doi:10.1111/j.1538-7836.2005.01436.x. PMID 15978100. S2CID 24914279.
- ^ Terrell DR, Vesely SK, Kremer Hovinga JA, Lämmle B, George JN (novembar 2010). "Different disparities of gender and race among the thrombotic thrombocytopenic purpura and hemolytic-uremic syndromes". American Journal of Hematology. 85 (11): 844–7. doi:10.1002/ajh.21833. PMC 3420337. PMID 20799358.
- ^ X. Long Zheng; J. Evan Sadler (2008). "Pathogenesis of Thrombotic Microangiopathies". Annual Review of Pathology. 3: 249–277. doi:10.1146/annurev.pathmechdis.3.121806.154311. PMC 2582586. PMID 18215115.
- ^ Moschcowitz E (1924). "An acute febrile pleiochromic anemia with hyaline thrombosis of the terminal arterioles and capillaries: an undescribed disease". Proceedings of the New York Pathological Society. 24: 21–4. Reprinted in Moschcowitz E (oktobar 2003). "An acute febrile pleiochromic anemia with hyaline thrombosis of the terminal arterioles and capillaries: an undescribed disease. 1925". Mount Sinai Journal of Medicine. 70 (5): 352–5. PMID 14631522..
- ^ Amorosi EL, Ultmann JE (1966). "Thrombocytopic purpura: report of 16 cases and review of the literature". Medicine (Baltimore). 45 (2): 139–159. doi:10.1097/00005792-196603000-00003. S2CID 71943329.
- ^ a b Sadler, JE (2008). "Von Willerbrand factor, ADAMTS13, and thrombotic thrombocytopenic purpura". Blood. 112 (1): 11–18. doi:10.1182/blood-2008-02-078170. PMC 2435681. PMID 18574040.
- ^ Rock GA, Shumak KH, Buskard NA, et al. (august 1991). "Comparison of plasma exchange with plasma infusion in the treatment of thrombotic thrombocytopenic purpura. Canadian Apheresis Study Group". New England Journal of Medicine. 325 (6): 393–7. doi:10.1056/NEJM199108083250604. PMID 2062330.