Catenació

Catenació és el fenomen que experimenten alguns elements químics d'enllaçar-se mitjançant enllaç covalent tres o més àtoms iguals, un rere l'altre, formant estructures semblants a cadenes.
L'enllaç químic en cadenes d'àtoms d'un mateix element, es produeix només entre els àtoms d'un element que té una valència d'almenys dos i que forma enllaços relativament forts amb si mateix. La propietat és predominant entre els àtoms de carboni, significativa entre els àtoms de sofre i silici, i lleugerament present entre els àtoms de germani, nitrogen, seleni i tel·luri.[1]
El mot «catenació» prové del mot llatí catêna, —ae, que significa «cadena»; i del sufix —ió, del llatí —io, —iōnis, que significa «acció de».[2] Per tant, catenació significa acció d'encadenar-se.
Els elements químics que experimenten catenació han de tenir electronegativitats prou grans per atraure electrons per a l'enllaç covalent, però no tan grans per a atreure'ls amb massa força. Han de compartir electrons. Així, els elements amb valors de rang mitjà d'electronegativitats, és a dir, els elements de la regió central-superior dels grups principals de la taula periòdica, presenten catenació. El carboni i el sofre són els principals candidats. Quan els àtoms de dos elements diferents s'encadenen en alternança, la cadena guanya força per la disparitat d'electronegativitat entre ells. Els elements, però, han de tenir poca tendència a formar ions discrets, en cas contrari, resulta una xarxa iònica en lloc d'una cadena covalent.[3] També es pot deduir quins elements experimenten catenació a partir de les energies d'enllaç. Per exemple en el grup del carboni les energies d'enllaç disminueixen del carboni a l'estany ( 356 kJ/mol; 230 kJ/mol, 200 kJ/mol i 125 kJ/mol) i la tendència a la catenació disminueix en el mateix sentit.[4]
Elements dels grups 1 i 11
[modifica]Com que els elements dels grups 1 (hidrogen i elements alcalins) i 11 (coure, argent i or) de la taula periòdica són monovalents, no presenten catenació.
Elements dels grups 2, 12 i 13
[modifica]
En els grups dels alcalinoterris (el 2), del zinc (el 12) i del bor (el 13), el nombre d'electrons de valència fa teòricament possible la catenació unidimensional amb la hibridació sp o sp2 (per a sp2 amb un àtom auxiliar). No obstant això, excepte el bor, els elements d'aquests grups prefereixen la formació de fases metàl·liques. La formació de l'icosaedre , que és la base de totes les formes al·lotròpiques de bor, es pot considerar com una catenació bidimensional. Tanmateix, una millor descripció és en termes de formació de clústers. La formació de borans (hidrurs de bor) és un altre exemple de la tendència dels àtoms de bor a enllaçar-se entre ells. Del grup 12, el mercuri s'encadena amb relativa facilitat per formar cations de polimercuri lineals amb n = 2, 3 o 4. L'oxidació del mercuri per pentafluorur d'arsènic en proporcions baixes d' dona sòlids de fórmula general que contenen cadenes infinites d'àtoms de mercuri separats per columnes d'anions .[5]
Elements del grup 14
[modifica]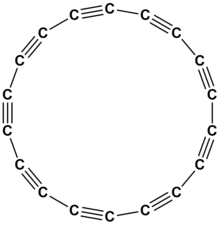
En aquest grup 14 destaca el carboni que és, sens dubte, l'element que presenta major catenació de tots els elements químics. Les diferents cadenes de carboni depenen de la hibridació dels àtoms de carboni.
Hibridació sp
[modifica]La hibridació sp es presenta amb àtoms de carboni a l'etí o acetilè, , que té un enllaç σ i dos pπ—pπ. Els àtoms d'hidrogen de l'etí es poden substituir per grups alquins successius , la qual cosa condueix a la formació de cadenes . A causa de les forces de van der Waals, aquestes cadenes s'apilen i formen la modificació al·lotròpica del carboni anomenada carboni chaoïta o carbí. La chaoïta és estable per sobre de 2600 °C, metaestable a temperatura ambient.
Hibridació sp2
[modifica]
En aquesta hibridació, cadascun dels tres orbitals híbrids sp2 està ocupat per un electró. El quart electró ocupa l'orbital p perpendicular al pla dels híbrids sp2. Dos àtoms de carboni hibridats sp2 poden formar la unitat estructural que conté un doble enllaç. La unió de quatre àtoms d'hidrogen dona lloc a la formació d'etè, . Si només dos àtoms d'hidrogen estan units a la unitat estructural , aleshores els tres elements es poden autoenllaçar formant l'anell de benzè. Es forma un nombre infinit d'àtoms de carboni hibridats amb sp2 autoenllaçant una capa plana que és un exemple de catenació bidimensional. Els electrons no aparellats en els orbitals p perpendiculars al pla formen enllaços pπ—pπ deslocalitzats. Les interaccions entre les capes condueixen a la formació de la forma al·lotròpica del carboni anomenada grafit. Els àtoms de carboni en l'estat sp2 formen una increïble varietat d'estructures anomenades ful·lerens i nanoestructures, com ara el grafè. No obstant això, a diferència del grafit, aquestes les estructures esfèriques (el·lipsoidals) o tubulars consten tant d'hexàgons com de pentàgons.[5]
Hibridació sp³
[modifica]
En aquesta forma d'hibridació, cadascun dels quatre orbitals híbrids sp³ de carboni està ocupat per un electró. L'enllaç entre àtoms de carboni mitjançant enllaços σ condueix a la formació de la xarxa dels diamants i és un exemple de catenació tridimensional. El silici i el germani s'encadenen de la mateixa manera. Alternativament, cada àtom de carboni en estat tetravalent pot unir dos àtoms d'hidrogen i formar la unitat estructural . Algunes d'aquestes unitats estructurals poden autoenllaçar-se i formar hidrocarburs alifàtics o hidrocarburs alicíclics, per exemple ciclohexà. Aquests són exemples clàssics de catenació monodimensional. De la mateixa manera es formen hidrurs de silicona (silans) i de germani (germans). A causa de la força decreixent dels respectius enllaços A—A, el silici forma fins al , el germani fins al (que és força inestable), l'estany només el , i el plom ja no forma cadenes.[5]
Elements del grup 15
[modifica]
En el grup 15, del nitrogen, la catenació és possible en l'estat de valència sp³. Això requereix la participació de l'hidrogen com a àtom auxiliar i condueix a la formació d'una cadena, amb un parell d'electrons solitari a cada àtom A: . Tanmateix, la tendència a encadenar-se és feble. Per al nitrogen n = 0 (hidrazina ), i per al fòsfor, el seu valor màxim és 2 (tetrafosfà). No obstant això, fent servir només els orbitals p, el fòsfor s'encadena fàcilment per formar anells[5] (, , …),[6] capes dobles o cadenes llargues. En aquestes estructures hi ha un parell d'electrons solitari (el parell s2) a cada àtom de fòsfor.[5]
Elements del grup 16
[modifica]
En el grup dels calcògens, el de l'oxigen, l'oxigen només forma la molècula estable d'ozó, , i la resta de molècules amb àtoms encadenats ( i ) són inestables.[7] Els àtoms d'oxigen, a causa de la seva petita mida, formen fàcilment enllaços pπ—pπ entre si. Sembla que la formació de petites molècules d'ozó, cadascuna amb un enllaç pπ—pπ deslocalitzat a més dels dos enllaços σ, és energèticament més eficient que la formació d'una cadena llarga.[5]
Els àtoms de sofre, molt més grans, són reticents a formar enllaços pπ—pπ, per tant, s'encadenen gairebé amb la mateixa força que els àtoms de carboni. Dels quatre orbitals sp³ hibridats de l'àtom de sofre dos estan ocupats per electrons individuals i dos per parells. En conseqüència, els àtoms de sofre es poden encadenar mitjançant enllaços per formar cadenes estables sense àtoms auxiliars. L'encadenament condueix a la formació de dues formes bàsiques:
- Ciclo-Sn on n pot variar de 6 a 20. La forma cíclica més important és , que és la base de moltes formes al·lotròpiques del sofre, entre elles les formes al·lotròpiques més estables, la forma ortoròmbica α i les monoclíniques β i γ.

Estructura de la molècula de l'àcid pentatiònic . - Catena-S∞. Es tracta de cadenes helicoidals que en unir-se formen l'anomenat sofre fibrós i estan presents en el sofre plàstic, polimèric i altres formes mal definides.[5]
Els polisulfurs , amb n = 2—6, i els àcids politiònics (n = 1—4) són altres exemples de la capacitat del sofre per encadenar-se. El seleni i el tel·luri també presenten catenació, però amb menys facilitat, perquè els radis més grans dels àtoms donen lloc a una energia d'enllaç reduïda.[5]
Elements del grup 17
[modifica]
Segons la teoria simple de la catenació, els àtoms d'halogen no s'han d'autoenllaçar perquè, com els metalls alcalins, només tenen un electró no aparellat. La formació d'anions de poliiodur de color marró (, , i ) és possible a causa de la formació d'enllaços multicèntrics, en lloc dels enllaços habituals de dos centres i dos electrons. A l'anió de poliiode més simple i estable és el triiodur(1–) , l'àtom de iode central està envoltat per tres parells d'electrons solitaris en posicions equatorials, amb els dos àtoms de iode exteriors que ocupen les posicions axials de la bipiràmide trigonal. L'enllaç axial és un enllaç de tres centres i quatre electrons i manté els dos electrons addicionals més enllà de l'octet a l'orbital no enllaçant, que només pertany als dos àtoms de iode apicals. Pel que fa a la disposició dels electrons al voltant de l'àtom central, l'ió és idèntic a la molècula de pentafluorur de fòsfor i és una espècie hipervalent. La formació d'anions de poliiodur superior es pot descriure formalment en termes d'addicions consecutives de molècules a l'anió .[5]
Elements dels grups 3 al 10 i 18
[modifica]Els metalls de transició dels grups 3 al 10, i els gasos nobles del grup 18, no tenen catenació.
Referències
[modifica]- ↑ «catenation» (en anglès). Encyclopædia Britannica, 2003.
- ↑ «io». Gran Diccionari de la Llengua Catalana. Barcelona: Grup Enciclopèdia Catalana. [Consulta: 9 gener 2023].
- ↑ Swaddle, T. W.. Inorganic chemistry : an industrial and environmental perspective. San Diego: Academic Press, 1997. ISBN 978-0-08-053468-8.
- ↑ Singh, D. N.. Basic concept of inorganic chemistry. 2a edició, 2011. ISBN 978-93-325-0320-5.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 5,7 5,8 Siekierski, Slawomir. Concise chemistry of the elements, 2012. ISBN 978-1-78242-045-3.
- ↑ Wiberg, Egon. Inorganic chemistry. 1st English ed.. San Diego: Academic Press, 2001. ISBN 0-12-352651-5.
- ↑ Rayner-Canham, Geoffrey. The periodic table : past, present, and future, 2020. ISBN 978-981-12-1848-4.












![{\displaystyle {\ce {[-C\!\equiv \!C{-}]_{n}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fab993e3afb25e5fed2bf3fecb970d5a8a0d1072)




























