Citocrom p450
| Identificadors | |
|---|---|
| Número CAS | 9035-51-2
|

Citocrom P450 Oxidasa (CYP2C9)
| IDENTIFICADORS | |
|---|---|
| Símbol | p450 |
| Pfram | PF001128 |
| InterPro | IPR001128 |
| PROSITE | PDOC00081 |
| SCOP | 2cpp |
| Familia | TOPM 41 |
| Proteïna OPM | 1w0f |
La súper família dels citocroms p450 (abreviat sovint com CYP) forma part d'un gran i divers grup d'enzims. La funció de la majoria dels enzims CYP consisteix a catalitzar les reaccions d'oxidació de les substàncies orgàniques. Els substrats que s'uneixen als enzims CYP inclou intermediaris metabòlics com per exemple els lípids i les hormones esteroides, i també xenobiòtics, tal com alguns fàrmacs s o altres substàncies químiques tòxiques com l'etanol. Les CYP són el grup més gran d'enzims que intervenen en el metabolisme dels fàrmacs i en la bioactivació, ja que representen aproximadament el 75% del total de les diferents reaccions metabòliques.[1] (En aquest context, metabolisme és la modificació química o degradació dels fàrmacs) La reacció més comuna catalitzada pel citocrom p450 correspon a les reaccions de monooxigenasa. Com per exemple, la inserció d'un àtom d'oxigen dins d'un substrat orgànic (RH) a la vegada que un altre àtom d'oxigen és reduït a aigua:
- RH + O2 + 2H+ + 2e- → ROH + H2O
Els citocroms P450 forma part de la súper família de les proteïnes que contenen un cofactor del grup Hemo, per la qual cosa es considera que són Hemoproteïnes. CYPs utilitzen una ampla varietat de molècules, tant grans com petites, com a substrat en les reaccions enzimàtiques. Normalment, formen part de multi-components de la cadena de transferència d'electrons, és a dir, de la cadena respiratòria, anomenats P450-containing systems. Els citocroms P450 han estat anomenats partint de la seva base cel·lular (cito), la seva localització i les seves característiques espectrofotomètriques (cromo): quan la forma reduïda del grup hemo del ferro forma un adduct amb el CO, el citocrom P450 absorbeix una llum amb una longitud d'ona que s'aproxima als 450 nm, fent que es pugui obtenir un pic d'absorció característic. Els enzims CYP s'han identificat en tots els dominis taxonòmics de vida, ja sigui en els animals, les plantes, els protistes, els fongs, els bacteris, en el domini archaea i fins i tot en els virus.[2] [3] Actualment es coneixen més d'11.500 proteïnes CYP diferents.[4]
Nomenclatura
[modifica]Els gens que estan relacionats amb els enzims CYP, i també els mateixos enzims, es designen amb l'abreviació CYP, seguit d'un nombre aràbic que identifica la família gènica, una lletra majúscula indicant la subfamília, i un altre nombre que indica el gen individual. Per conveni el nom s'escriu en cursiva quan es refereix al gen. Per exemple, CYP2E1 és el gen que codifica l'enzim CYP2E1 – un dels enzims que intervé en el metabolisme del paracetamol (acetaminofèn). La Nomenclatura del CYP és el nom oficial que se li dona per conveni, encara que ocasionalment (i de manera errònia) s'utilitza CYP450 o CYP450. Tot i així, alguns gens o enzims de CYP's difereixen d'aquesta nomenclatura, indicant l'activitat catalítica i el nom del component que utilitza com a substrat. Alguns exemples inclouen CYP5A1, la sintetasa A2 del tromboxà, abreviat TBXAS1 (de les sigles del nom en anglès ThromBoXane A2 Synthase 1) i CYP51A1, lanoesterol 14-α-dimetilasa, el qual de vegades s'anomena de manera extraoficial a partir de la seva abreviatura, LDM d'acord amb el seu substrat (Lanosterol) i la seva activitat, la Desmetilació. [5]
Les directrius actuals de la nomenclatura suggereixen que els membres d'una nova família de CYP comparteixen >40% dels aminoàcids, mentre que les subfamílies només haurien de compartir >55% dels aminoàcids. Els comitès que s'encarreguen de la nomenclatura que s'atribueix i que segueix tant el nom gènic base (CYtochome P450 Homepage) com el nom dels al·lels (Comitè de nomenclatura al·lèlica del CYP).
Mecanisme
[modifica]
El centre actiu del citocrom P450 conté un àtom de ferro unit a un grup hemo. El ferro està lligat a la proteïna P450 per mitjà d'un lligand de tiol derivat del residu de la cisteïna. Aquesta cisteïna i altres residus d'acompanyament són altament conservats en CYPs coneguts i tenen un patró formal que consta en la base de dades PROSITE. Aquest patró és: [FW] - [SGNH] - x - [GD] - {F} - [RKHPT] - {P} - C - [LIVMFAP] - [GAD].[6] Degut a la gran varietat de reaccions que estan catalitzades pels CYP, les activitats i les propietats de molts del CYPs difereixen en molts aspectes. En general, el cicle catalític del citocrom P450 es desenvolupa de la següent manera:
- El substrat en qüestió s'uneix al centre actiu de l'enzim, molt pròxim al grup hemo, que es troba a la banda oposada de la cadena peptídica. Aleshores, el substrat indueixun canvien la conformació del centre actiu, sovint provocant el desplaçament d'una molècula d'aigua des de la posició de coordinació distal axial de l'àtom de ferro del grup hemo[7] canviant de vegades l'estat de l'àtom de baix spin a alt spin.[8] Això dona lloc a un canvi en les propietats espectrals de l'enzim, amb un increment en l'absorbància a 390 nm i una disminució a 420 nm. Aquest fenomen se'l coneix com a fenomen de "Tipus I" de l'espectre diferencial, i es pot mesurar a través de l'espectrometria de diferència (vegeu el gràfic inserit en la figura). No obstant, cal dir que alguns substrats causen un canvi oposat en les propietats espectrals quan s'uneixen al centre actiu de l'enzim. A aquest fenomen se'l coneix com a "Tipus I invers" de l'espectre, i els processos que el desenvolupen encara no són gaire clars. Alguns inhibidors i determinats substrats que s'uneixen directament a l'àtom de ferro del grup hemo donen lloc a tot l'espectre de diferència de Tipus II, amb un màxim de 430 nm i un mínim de 390 nm (vegeu el gràfic inserit en la figura). Si no hi ha equivalents de reducció disponibles, aquest complex pot romandre estable permetent un grau d'unió, el qual serà determinat per les mesures d'absorbància in vitro.[9]
- El canvi de l'estat electrònic del centre actiu afavoreix la transferència d'un electró del NADPH al ferro del grup hemo, reduint-lo de l'estat fèrric a l'estat ferrós a través del citocrom P450 reductasa o bé d'una altra reductasa associada.[10]
Aquest procés es duu a terme a la cadena de transferència d'electrons.
- L'oxigen molecular s'uneix covalentment a l'àtom de ferro en la seva posició axial de coordinació distal. El lligand, que és la cisteïna, resulta ser un millor donant d'electrons que no pas la histidina, que és l'aminoàcid que es troba normalment en les proteïnes que contenen grups hemo. Com a conseqüència d'aquest fet, l'oxigen s'activa en major mesura en comparació amb altres proteïnes que contenen grups hemo. No obstant, a vegades aquest fet permet que el llaç format entre l'oxigen i el ferro es dissociï, tot causant l'anomenada "reacció de dissociació", que interromp el cicle catalític[7] i al final de la qual s'allibera un radical superòxid.
- Un segon electró del citocrom P450 reductasa, de la ferredoxina o del citocrom B5 es transfereix a través del sistema de transport d'electrons reduint el dioxígen “adduct” a un grup peròxid de càrrega negativa a un estat intermedi que té una durada molt curta.
- El grup peròxid (format en el pas 4) és protonat doblementper transferència local des de l'aigua o des dels voltants de les cadenes laterals dels aminoàcids, alliberant així una molècula d'aigua i formant una espècie altament reactiva. A aquesta espècie reactiva en llenguatge comú se la coneix com a Compost P450 I (o simplement Compost I). De fet, ningú va descobrir com actuava aquesta espècie fins al 2010,[11] tot i que havia estat estudiada durant molts anys.[7] El Compost P450 I és semblant a un ferro IV oxi (o Ferro). Les dues espècies tenen un equivalent oxidant addicional que es troba deslocalitzat a sobre la porfirina i els lligands tiolat. No hi ha evidència de l'existència d'un grup preferril hemo(V)-oxo alternatiu.[7][11]
- Depenent del substrat i de l'enzim implicat en el procés, els enzims del citocrom P450 poden catalitzar una gran quantitat de reaccions. Per exemple, en aquesta il·lustració es pot veure com catalitzen una hidroxilació hipotètica. Un cop el producte ha estat alliberat del centre actiu de l'enzim, aquest torna a la seva configuració inicial i una molècula d'aigua torna a ocupar la posició de coordinació distal del nucli de ferro.
Aclariments de la imatge:
S: Mostra una ruta alternativa per a la mono-oxigenació a través de la “derivació del peròxid”. La interacció amb donadors d'un sol oxigen com els peròxids i els hipoclorits pot conduir directament a la formació dels intermedis de ferro-oxo, permetent que el cicle catalític es completi sense necessitat que s'esdevinguin els passos 3,4 i 5.[9] El peròxid amb el qual hipotèticament es fa aquesta reacció (“XOOH”) es mostra al diagrama. C: Si l'òxid de carboni (CO) s'uneix al P450 reduït, el cicle catalític queda interromput. D'aquesta reacció s'obté l'espectre clàssic del CO amb un màxim de 450 nm.
Com que la majoria de CIPs requereixen una altra proteïna per repartir un o més electrons amb la finalitat de reduir el ferro (i de vegades també l'oxigen molecular), es consideren part de la família de proteïnes P450. Es coneixen cinc tipus d'aquesta classe de P450:
- CPR/cyb/P450: Són aquells sistemes de proteïnes emprats per la majoria de CIPs d'eucariotes microsomals. Aquests impliquen la reducció de la citocromP450-reductasa gràcies al NADPH, i per tant, la transferència de poder reductor al CIP. El citocrom b5 (cyb5) també pot contribuir transferint poder reductor a aquest sistema després d'haver estat reduït al seu torn pel citocrom b5 reductasa (CYBB5R).
- FR/fd/P450: Són sistemes utilitzats per CIPs que es troben en mitocondris i en alguns bacteris.
- CYB5R/cyb5/P450: Són sistemes on els dos electrons que es necessiten per al CIP provenen del citocrom b5.
- FMN/Fd/P450: Són sistemes trobats originalment en Rhodococcus spen els quals es fusiona una FMN reductasa amb un CIP.
- Només P450: Sistemes que no requereixen una font de poder reductor externa. Aquests contenen CIP5 (tromboxà sintasa), CIP8 (prostaciclina sintasa) i CIP74A (sintasa d'òxid alena).
P450 en humans
[modifica]Els CIPs humans són proteïnes associades a la membrana plasmàtica,[12] a la membrana interna dels mitocondris i també a la del reticle endoplasmàtic de les cèl·lules. Els CIPs metabolitzen milers de substàncies químiques endògenes i exògenes. Alguns CIPs són més específics i només metabolitzen un o molt pocs substrats, com per exemple el CIP19 (aromatasa), mentre que d'altres poden metabolitzar diversos substrats. Aquestes característiques tenen una certa importància en medicina. Els enzims citocrom P450 estan presents en la majoria dels teixits de l'organisme, i tenen un paper molt important en la síntesi hormonal (incloent-hi la síntesi d'estrogen, de testosterona i del metabolisme), en la síntesi de colesterol i en el metabolisme de la vitamina D. El citocrom P450 també fa la funció de metabolitzar en el fetge compostos potencialment tòxics, incloent-hi els fàrmacs i els productes del metabolisme endogen com la bilirubina o com l'etanol.
El Projecte Genoma Humà ha aconseguit identificar 57 gens humans que codifiquen per a diferents tipus de citocrom P450.[13]
Metabolisme dels fàrmacs
[modifica]Els CIP són els principals enzims involucrats en el metabolisme dels fàrmacs, representant aproximadament el 75% del metabolisme total. Guengerich FP (January 2008). "Cytochrome p450 and chemical toxicology". Chem. Res. Toxicol. 21 (1): 70–83. doi:10.1021/tx700079z PMID: 18052394
Interacció dels fàrmacs
[modifica]Molts fàrmacs poden incrementar o disminuir l'activitat de diversos isoenzims CIP, ja sigui induint la biosíntesi d'un isoenzim (inducció enzimàtica) o inhibint directament l'activitat del CIP (inhibició enzimàtica). Aquests dos mecanismes permeten dur a terme interaccions en contra dels medicaments, ja que els canvis en l'activitat dels enzims CIP poden afectar el metabolisme i la capacitat d'excreció renal de diversos fàrmacs. Per exemple, si un fàrmac inhibeix el metabolisme mediat pel CIP d'un altre fàrmac, el segon fàrmac es pot acumular dins el cos fins a nivells tòxics. Per tant, degut a aquestes interaccions entre fàrmacs es poden necessitar ajustaments de dosis o fins i tot, fàrmacs que no interaccionin amb el sistema CIP. Aquestes interaccions de medicaments caldrà tenir-les en compte sobretot quan s'utilitzen fàrmacs d'importància vital per al pacient, fàrmacs amb importants efectes secundaris o fàrmacs amb petita finestra terapèutica. Degut a un metabolisme dels fàrmacs alterat, la concentració del plasma pot variar degut a qualsevol fàrmac com a possible subjecte d'aquesta alteració.
Un exemple és el dels fàrmacs antiepilèptics. La fenitoïna, per exemple, indueix el CIP1A2, CIP2C9, CIP2C19 i el CIP3A4. Els segons substrats dels enzims poden ser fàrmacs amb una dosi crítica, com l'amidarona o la carbamezapina, que la seva concentració plasmàtica en sang pot, tant augmentar a causa de la inhibició de l'enzim, com disminuir degut a la inducció de l'enzim en el segon substrat.
Interacció d'altres substàncies
[modifica]Els compostos naturals també poden induir o inhibir l'activitat dels CIP. S'ha trobat que els compostos bioactius que es troben en el suc de raïm o en altres sucs de fruita inhibeixen el metabolisme mediat pel CIP3A4 de certs medicaments, donant lloc a un augment de la biodisponibilitat i, conseqüentment a una alta probabilitat de sobredosi[14] Degut a aquest risc normalment es recomana evitar el suc de raïm i el raïm, quan es prenen els fàrmacs.[15] Alguns exemples:
- L'herba de Sant Joan, un remei comú, indueix el CIP3A4, però, a més, inhibeix el CIP1A1, CIP1B1, CIP2D6 i el CIP3A4.[16][17]
- Fumar tabac indueix el CIP1A2 (la clozapina, l'olanzapina i la fluvoxamina són exemples de CIP1A2)[18]
Altres funcions dels CIPs específiques
[modifica]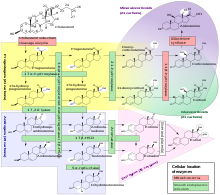
Un subconjunt d'enzims P450 tenen un paper important en la síntesi d'hormones esteroides (esteroidegènesis) per les glàndules suprarenals, les gònades i els teixits perifèrics:
- CIP11A1 (també conegut com a P450scc o P450c11al) en els mitocondris suprarenals afecta ”l'activitat anteriorment coneguda com a 20,22-desmolasa” (esteroide 20α-hidroxilasa, esteroide 22-hidroxilasa i escissió de la cadena lateral del colesterol).
- CIP11B1 (codificant la proteïna P450c11β), que es troba en la membrana mitocondrial interna de l'escorça suprarenal, té activitats dels esteroides 11β-hidroxilasa, 18-hidroxilasa i 18-methyloxidase.
- CIP11B2 (codifica la proteïna P450c11AS), que només es troba als mitocondris de la zona glomerular suprarenal, té activitats en els esteroides 11β-hidroxilasa, 18-hidroxilasa i 18-methyloxidase.
- CIP17A1, en el reticle endoplasmàtic de l'escorça suprarenal té activitats en els esteroides 17α-hidroxilasa i 17,20-liasa.
- CIP21A1 (P450c21) en l'escorça suprarenal porta a terme l'activitat de la 21-hidroxilasa.
- CIP19A (P450arom, aromatasa) en el reticle endoplasmàtic de les gònades, cervell, teixit adipós, i en altres llocs catalitza l'aromatització dels andrògens en estrògens.
Famílies CIP en els humans
[modifica]Els éssers humans tenen 57 gens i més de 59 pseudogens dividits entre 18 famílies de gens del citocrom P450 i 43 subfamílies.[19] A continuació es mostra un resum dels gens i de les proteïnes que codifiquen. Per obtenir més informació vegeu la pàgina principal del Comitè de Nomenclatura del citocrom P450.[13]
| Família | Funció | Membres | Noms |
|---|---|---|---|
| CIP1 | Metabolisme de fàrmacs i esteroides (especialment estrògens). | 3 subfamílies, 3 gens, 1 pseudogen | CIP1A1, CIP1A2, CIP1B1a |
| CIP2 | Metabolisme de fàrmacs i esteroides | 13 subfamílies, 16 gens, 16 pseudogens | CIP2A6, CIP2A7, CIP2A13, CIP2B6, CIP2C8, CIP2C9, CIP2C18, CIP2C19, CIP2D6, CIP2E1, CIP2F1, CIP2J2, CIP2R1, CIP2S1, CIP2U1, CIP2W1 |
| CIP3 | Metabolisme de fàrmacs i esteroides (incloent-hi testosterona). | 1 subfamília, 4 gens, 2 pseudogens | CIP3A4, CIP3A5, CIP3A7, CIP3A43 |
| CIP4 | etabolisme de l'àcid araquidònic o d'àcids grassos. | 6 subfamílies, 12 gens, 10 pseudogens | CIP4A11, CIP4A22, CIP4B1, CIP4F2, CIP4F3, CIP4F8, CIP4F11, CIP4F12, CIP4F22, CIP4V2, CIP4X1, CIP4Z1 |
| CIP5 | Tromboxà A2-sintetasa | 1 subfamília, 1 gen | CIP5A1 |
| CIP7 | Biosíntesi dels àcids biliars 7-α hidroxilasa del nucli esteroide. | 2 subfamílies, 2 gens | CIP7A1, CIP7B1 |
| CIP8 | diverses | 2 subfamílies, 2 gens | CIP8A1, CIP8B1 (biosíntesi dels àcids biliars) |
| CIP11 | biosíntesis d'esteroides | 2 subfamílies, 3 gens | CIP11A1, CIP11B1, CIP11B2 |
| CIP17 | Biosíntesis d'esteroides, 17-α hidroxilasa | T1 subfamília, 1 gen | CIP17A1 |
| CIP19 | Biosíntesis d'esteroides: Síntesi d'estrògens per part de l'aromatasa. | 1 subfamília, 1 gen | CIP19A1 |
| CIP20 | Funció desconeguda. | 1 subfamília, 1 gen | CIP20A1 |
| CIP21 | Biosíntesis d'esteroides. | 2 subfamílies, 1 gen, 1 pseudogen | CIP21A2 |
| CIP24 | Degradació de vitamina D. | 1 subfamília, 1 gen | CIP24A1 |
| CIP26 | Àcid retinoic 4-hidroxilasa 3 | subfamílies, 3 gens | CIP26A1, CIP26B1, CIP26C1 |
| CIP27 | variades | 3 subfamílies, 3 gens | CIP27A1 (biosintesi d'àcids biliars), CIP27B1 (la vitamina D3 1-α hidroxilasa, activa la vitamin D3), CIP27C1 (funció desconeguda) |
| CIP39 | 7-α-hidroxilació del 24-hidroxicolesterol. | 1 subfamília, 1 gen | CIP39A1 |
| CIP46 | Colesterol 24-hidroxilasa | 1 subfamília, 1 gen | CIP46A1 |
| CIP51 | Biosíntesis del colesterol. | 1 subfamília, 1 gen, 3 pseudogens | CIP51A1 (Lanosterol α-hidroxilasa) |
P450s en altres espècies
[modifica]Animals
[modifica]Molts animals tenen tants o més gens CIP que els humans. Per exemple, els ratolins tenen 101 gens per CIPs, i els eriçons de mar en tenen fins i tot més (potser arriben als 120 gens).[20] Se suposa que la majoria d'enzims CIP tenen activitat monooxigenasa, ja que és el cas que es dona en la majoria de mamífers que han estat investigats (excepte, per exemple, CIP19 i CIP5). Tot i així, els gens i la seqüència genètica estan encara poc estudiats com per poder definir la seva funció enzimàtica. Tot i que s'han trobat molts gens amb homologia propera als CIPs amb funció coneguda.
Les classes de CIP que s'investiguen més sovint en animals no-humans són aquells involucrats en el desenvolupament embrionari (com per exemple l'àcid retinoic d'hormones del sistema metabòlic) o en el metabolisme de components tòxics (tals com grups amins heterocíclics o hidrocarbonis poliaromàtics). Sovint hi ha diferències en la regulació genètica o funció enzimàtica dels CIPs relacionats amb els animals, el que explica les diferències observades en la susceptibilitat als components tòxics.
Els CIPs han estat extensament examinats en ratolins, rates, gossos i menys en el peix zebra, per tal d'utilitzar aquests organismes com a models per a descobriments farmacèutics o toxicològics. Els CIPs també han estat molt estudiats en insectes, habitualment per entendre la resistència als pesticides. Per exemple, el CIP6G1 està relacionat amb la resistència de Drosophila melanogaster al DDT,[21] i el CIP6Z1 al mosquit vector de la malària, Anopheles gambiae, que és capaç de metabolitzar el DDT directament.[22]
Microbis
[modifica]Els citocroms P450 dels microbis són habitualment solubles en enzims i estan involucrats en processos metabòlics crítics. A continuació es mostren tres exemples que han contribuït notablement als estudis mecanicistes i estructurals, encara que existeixen moltes més famílies.
- Citocrom P450cam (CIP101) originalment trobat en el Pseudomonas putida ha estat utilitzat com a model per a molts citocroms P450 i va ser el primer del qual es va determinar l'estructura tridimensional mitjançant la cristalografia de rajos X. Aquest enzim forma part del cicle catalític camfor-hidroxílic que consta de dues fases on els electrons transfereixen putidaredoxina a una proteïna cofactora de crostra 2Pe-2S.
- El citocrom P450 eryF (CIP107A1) aïllat de la bacteria Saccharopolyspora erythraea és responsable de la biosíntesi de l'antibiòtic eritromicina a partir de la C6-Hidroxilació de la macròlida 6-deoxieritronolida B.
- EL citocrom P450 BM3 (CIP102A1) del bacteri Bacillus megaterium catalitza la hidroxilació de diverses cadenes llargues d'àcids grassos de la ω–1 fins a ω–3, quan són dependents del NADPH. A diferència de gairebé tots els altres CIP coneguts, (excepte en el cas, entre d'altres, del CIP505A1, citocrom P450 foxy), hi ha una fusió proteica natural entre el domini del CIP i l'electró cofactor donant. Per això, el BM3 és molt útil en aplicacions biotecnològiques.[23][24]
- El citocrom P450 119 (CIP119) aïllat de l'arc termòfil de Sulfolobus acidocaldarius[25] ha estat utilitzat en una gran varietat d'estudis mecanístics.[11] Els enzims termofílics han evolucionat fins a funcionar a altes temperatures, mentre que a temperatures ambientals la seva activitat catalítica disminueix i per això són un model mecanístic excel·lent.
Fongs
[modifica]La classe d'azols que s'utilitzen normalment com a solucions antifúngiques funcionen inhibint el citocrom P450 fúngic 14α-desmetilasa. Això atura la conversió del lanosterol a ergosterol, un component de la membrana cel·lular dels fongs. Aquest mecanisme és útil perquè els humans tenim una sensibilitat diferent del P450, i és d'aquesta manera que els antifúngics són efectius.[26] Hi ha una certa investigació en marxa sobre els P450 fúngics, ja que molts fongs són patògens pels humans, com per exemple els fongs Candida i Aspergillus, i per les plantes.
Plantes
[modifica]Els citocroms P450 de les plantes estan relacionats amb una extensa gamma de reaccions biosintètiques, que acaben en diverses conjugacions d'àcids grassos, hormones vegetals, compostos defensius o fàrmacs importants per la medicina. Els terpenoides, que representen la classe més abundant de compostos naturals característics de les plantes, són molt sovint substrats per als CIPs vegetals.
Subfamílies InterPro
[modifica]Subfamilíes InterPro:
- Citocrom P450, classe BIPR002397
- Citocrom P450, mitocondrial IPR002399
- Citocrom P450, classe E, grup I IPR002401
- Citocrom P450, classe E, grup II IPR002402
- Citocrom P450, classe E, grup IV IPR002403
Utilitat dels P450
[modifica]La remarcable reactivitat i promisqüitat dels substrat dels P450s han atret l'atenció des de fa molts anys dels químics.[27] El descobriment recent del potencial de fer servir p450s de cara a oxidacions difícils ha permès substituir els cofactors naturals per molècules amb contingut de peròxids, que resulten més econòmics.[28] També ha permès l'exploració de la compatibilitat de p450 en solvents orgànics.[29]
Referències
[modifica]- ↑ Guengerich FP (January 2008). "Cytochrome p450 and chemical toxicology". Chem. Res. Toxicol. 21 (1): 70–83. doi:10.1021/tx700079z PMID: 18052394
- ↑ Roland Sigel; Sigel, Astrid; Sigel, Helmut (2007). The Ubiquitous Roles of Cytochrome P450 Proteins: Metal Ions in Life Sciences. Nova York: Wiley. ISBN 0-470-01672-8
- ↑ Danielson PB (December 2002). "The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans". Curr. Drug Metab. 3 (6): 561–97. doi:10.2174/1389200023337054 PMID: 12369887
- ↑ Nelson D. "Cytochrome P450 Homepage". University of Tennessee
- ↑ "NCBI sequence viewer"
- ↑ PROSITE consensus pattern for P450
- ↑ 7,0 7,1 7,2 7,3 Meunier B, de Visser SP, Shaik S (September 2004). "Mechanism of oxidation reactions catalyzed by cytochrome p450 enzymes". Chem. Rev. 104 (9): 3947–80. doi:10.1021/cr020443g PMID: 15352783
- ↑ Poulos TL, Finzel BC, Howard AJ (June 1987). "High-resolution crystal structure of cytochrome P450cam". J. Mol. Biol. 195 (3): 687–700. doi:10.1016/0022-2836(87)90190-2 PMID: 3656428
- ↑ 9,0 9,1 Ortiz de Montellano, Paul R.; Paul R. Ortiz de Montellano (2005). Cytochrome P450: structure, mechanism, and biochemistry (3rd ed.). New York: Kluwer Academic/Plenum Publishers. ISBN 0-306-48324-6
- ↑ Sligar SG, Cinti DL, Gibson GG, Schenkman JB (October 1979). "Spin state control of the hepatic cytochrome P450 redox potential". Biochem. Biophys. Res. Commun. 90 (3): 925–32. doi:10.1016/0006-291X(79)91916-8 PMID: 228675
- ↑ 11,0 11,1 11,2 Rittle J, Green MT (November 2010). "Cytochrome P450 Compound I: Capture, Characterization, and C-H Bond Activation Kinetics". Science 330 (6006): 933–937. doi:10.1126/science.1193478 PMID: 21071661
- ↑ Berka K et al. J. Phys. Chem. A, 2011 doi:10.1021/jp204488j
- ↑ 13,0 13,1 University of Tennessee Health Science Center, Human Cytochrome P450s
- ↑ Bailey DG, Dresser GK (2004). "Interactions between grapefruit juice and cardiovascular drugs". Am J Cardiovasc Drugs 4 (5): 281–97 doi:10.2165/00129784-200404050-00002 PMID: 15449971
- ↑ Zeratsky K (2008-11-06). "Grapefruit juice: Can it cause drug interactions?". Ask a food & nutrition specialist. MayoClinic.com
- ↑ Chaudhary A, Willett KL (January 2006). "Inhibition of human cytochrome CYP 1 enzymes by flavonoids of St. John's wort". Toxicology 217 (2–3): 194–205. doi:10.1016/j.tox.2005.09.010 PMID: 16271822
- ↑ Strandell J, Neil A, Carlin G (February 2004). "An approach to the in vitro evaluation of potential for cytochrome P450 enzyme inhibition from herbals and other natural remedies". Phytomedicine 11 (2–3): 98–104 doi:10.1078/0944-7113-00379 PMID: 15070158
- ↑ Leclercq I, Desager JP, Horsmans Y (August 1998). "Inhibition of chlorzoxazone metabolism, a clinical probe for CYP2E1, by a single ingestion of watercress". Clin Pharmacol Ther. 64 (2): 144–9. doi:10.1016/S0009-9236(98)90147-3 PMID: 9728894
- ↑ Nelson D (2003). Cytochromes P450 in humans
- ↑ Goldstone JV, Hamdoun A, Cole BJ, Howard-Ashby M, Nebert DW, Scally M, Dean M, Epel D, Hahn ME, Stegeman JJ (December 2006). "The chemical defensome: Environmental sensing and response genes in the Strongylocentrotus purpuratus genome". Dev. Biol. 300 (1): 366–84. doi:10.1016/j.ydbio.2006.08.066 PMC 3166225 PMID: 17097629
- ↑ McCart C, Ffrench-Constant RH (June 2008). "Dissecting the insecticide-resistance- associated cytochrome P450 gene Cyp6g1". Pest Manag Sci 64 (6): 639–45. doi:10.1002/ps.1567 PMID: 18338338
- ↑ Chiu TL, Wen Z, Rupasinghe SG, Schuler MA (1 Jul 2008). "Comparative molecular modeling of Anopheles gambiae CYP6Z1, a mosquito P450 capable of metabolizing DDT". Proc Natl Acad Sci USA 105 (26): 8855–60 doi:10.1073/pnas.0709249105 PMC 2449330 PMID: 18577597
- ↑ Narhi L, Fulco A (5 juny 1986). "Characterization of a catalytically self-sufficient 119,000-dalton cytochrome P-450 monooxygenase induced by barbiturates in Bacillus megaterium". J Biol Chem 261 (16): 7160–9. PMID: 3086309
- ↑ Girvan H, Waltham T, Neeli R, Collins H, McLean K, Scrutton N, Leys D, Munro A (2006). "Flavocytochrome P450 BM3 and the origin of CYP102 fusion species". Biochem Soc Trans 34 (Pt 6): 1173–7 doi:10.1042/BST0341173 PMID: 17073779
- ↑ R. L. Wright, K. Harris, B. Solow, R. H. White, P. J. Kennelly (1996). "Cloning of a potential cytochrome P450 from the archaeon Sulfolobus solfataricus". FEBS Lett 384 (3): 235–9 doi:10.1016/0014-5793(96)00322-5 PMID: 8617361
- ↑ Vanden Bossche H, Marichal P, Gorrens J, Coene MC (September 1990). "Biochemical basis for the activity and selectivity of oral antifungal drugs". Br J Clin Pract Suppl 71: 41–6 PMID: 2091733
- ↑ Chefson A, Auclair K (2006). "Progress towards the easier use of P450 enzymes". Mol Biosyst. 10 (10): 462–9 doi:10.1039/b607001a PMID: 17216026
- ↑ Chefson A, Zhao J, Auclair K (2006). "Replacement of natural cofactors by selected hydrogen peroxide donors or organic peroxides results in improved activity for CYP3A4 and CYP2D6". Chembiochem 6 (6): 916–9. doi:10.1002/cbic.200600006 PMID: 16671126
- ↑ Chefson A, Auclair K. (2007). "CYP3A4 activity in the presence of organic cosolvents, ionic liquids, or water-immiscible organic solvents". Chembiochem 10 (10): 1189–97. doi:10.1002/cbic.200700128 PMID: 17526062
Bibliografia
[modifica]- Estabrook R (2003). "10.1124/dmd.31.12.1461. A passion for p450s (remembrances of the early history of research on cytochrome p450)". Drug Metab Dispos 31 (12): 1461–73 PMID: 14625342
- Feyereisen R (2005-12-19). "The Insect P450 Site" Arxivat 2014-05-30 a Wayback Machine.. Institut National de la Recherche Agronomique
- Flockhart DA (2007). "Cytochrome p450 drug interaction table". Arxivat 2016-12-07 a Wayback Machine. University Indianapolis
- Fowler L, Mercer A. "Cytochrome p450 Animated Tutorial". Arxivat 2016-05-17 at the Portuguese Web Archive School of Pharmacy, London
- Preissner S (2010). "Cytochrome p450 database". Arxivat 2011-11-03 a Wayback Machine. Nucleic Acids Research.
- Nelson D (2005-04-08). "Cytochrome p450 Homepage". Arxivat 2018-01-29 a Wayback Machine. University of Tennessee Health Science Center
- Kroon LA (September 2007). "Drug interactions with smoking". Am J Health Syst Pharm 64 (18): 1917–21. doi:10.2146/ajhp060414 PMID: 17823102
- Zhang JW, Liu Y, Cheng J, Li W, Ma H, Liu HT, Sun J, Wang LM, He YQ, Wang Y, Wang ZT, Yang L (2007). "Inhibition of human liver cytochrome p450 by star fruit juice". J Pharm Pharm Sci 10 (4): 496–503 PMID: 18261370
Enllaços externs
[modifica]- Sim SC (2008-09-04). "Human Cytochrome p450 (CYP) Allele Nomenclature Committee". Arxivat 2009-02-08 a Wayback Machine. Karolinska Institutet