Col·lagen
 | |
| Substància | component cel·lular i família de complexos proteics |
|---|---|

El col·lagen és una molècula proteica que forma fibres, les fibres col·làgenes, que estan presents en quantitat variable en quasi tots els tipus de teixit conjuntiu. Les fibres de col·lagen són unes estructures que proporcionen resistència a la tensió i flexibilitat. Són acidòfiles. Estan formades per fibril·les. El punt de ruptura de les fibres col·làgenes dels tendons humans s'arriba amb una força de diversos centenars de quilograms per centímetre quadrat. Per a aquesta tensió solament s'han allargat un petit tant per cent de la seva longitud original. Quan el col·lagen es desnaturalitza per ebullició, es converteix en una substància coneguda com a gelatina.
El col·lagen està format per una proteïna precursora anomenada tropocol·lagen que amida al voltant de 300 nanòmetres de llargària i 1,4 nm de diàmetre. El tropocol·lagen està format per tres cadenes polipeptídiques anomenades cadenes alfa, cadascuna d'un pes molecular al voltant de 100.000 daltons. Aquestes cadenes tenen una característica configuració helicoidal levogira que s'ha anomenat precisament amb el seu nom hèlix de col·lagen. Les tres cadenes s'enrotllen i es fixen mitjançant enllaços transversals per formar una triple hèlix dextrogira amb una distància entre les voltes de 8,6 nanòmetres.
El col·lagen conforma una família de molècules estretament relacionades però genèticament distintes, descrivint-se diversos tipus de col·lagen i sent els principals quatre.
Característiques
[modifica]El col·lagen és una proteïna llarga, fibrosa i estructural amb funcions molt diferents de les que realitzen les proteïnes globulars, com els enzims. Les fibres de col·lagen són un component important de la matriu extracel·lular que suporta la majoria dels teixits i dona estructura a les cèl·lules des de l'exterior, tot i que també es troba dins de certes cèl·lules. El col·lagen té una gran resistència a la tracció, i és el principal component de la fàscia, els cartílags, els lligaments, els tendons, els ossos i la pell.[1][2] Juntament amb la queratina tova, és responsable de la força i l'elasticitat de la pell, i la seva degradació condueix a les arrugues que acompanyen l'envelliment humà.[3] El col·lagen enforteix els vasos sanguinis i té un paper en el desenvolupament dels teixits. És present a la còrnia i al cristal·lí de l'ull en forma cristal·lina.
Història i antecedents
[modifica]Les estructures moleculars i d'embalatge del col·lagen han eludit als científics durant dècades d'investigació. La primera evidència que el col·lagen posseeix una estructura regular a escala molecular va ser presentada a mitjans de 1930.[4][5] Des de llavors, molts acadèmics prominents, incloent-hi premis Nobel com Crick, Pauling, Rich i Yonath, i altres, incloent-hi Brodsky, Berman, i Ramachandran, es van concentrar en la conformació del monòmer de col·lagen. Diversos models, tractant correctament la conformació de cada cadena de pèptids individuals, van donar lloc al model de la triple hèlix "Madras", el qual explica correctament l'estructura quaternària de la molècula,[6][7][8] encara que en aquest model es requereixen alguns ajustaments.[9][10][11][12] L'estructura d'embalatge de col·lagen no s'ha definit amb el mateix grau fora dels tipus de col·lagen fibril·lar, encara que s'ha sabut per molt de temps que és hexagonal ... o quasihexagonal.[13][14][15] Igual que amb la seva estructura monomèrica, diversos models en conflicte al·leguen que la disposició d'embalatge de les molècules de col·lagen té "forma de làmina" o microfibril·lar.[16][17] L'estructura microfibril·lar de les fibril·les de col·lagen al tendó, còrnia i cartílag s'ha fotografiat directament amb el microscopi electrònic.[18][19][20] El 2006, l'estructura microfibril·lar del tendó d'adults, segons el descrit per Fraser, Miller, i Wess (entre d'altres), es va confirmar com la més propera a l'estructura observada, encara que simplifiqui la progressió topològica de les molècules de col·lagen veïnes, i per tant no predigui la correcta conformació discontínua de la disposició D-pentàmera periòdica, dita simplement: microfibril·la.[21]
Química del col·lagen
[modifica]El col·lagen és un compost format per una triple hèlix, que generalment consta de dues cadenes idèntiques (α1) i una cadena addicional que difereix lleugerament en la seva composició química (α2).[22] La composició d'aminoàcids del col·lagen és atípica per les proteïnes, en particular pel que fa al seu elevat contingut d'hidroxiprolina. Els motius més comuns en la seqüència d'aminoàcids del col·lagen són glicina-prolina-X i glicina-X-hidroxiprolina, on X és qualsevol aminoàcid diferent de glicina, prolina o hidroxiprolina. La composició mitjana d'aminoàcids per al peix i la pell de mamífers és coneguda.[22]
| Aminoàcid | Abundància en la pell dels mamífers (Residus/1000) | Abundància en la pell dels peixos(Residus/1000) |
|---|---|---|
| Asp | 47 | 47 |
| Hyp | 95 | 67 |
| Thr | 19 | 26 |
| Ser | 36 | 46 |
| Glu | 74 | 76 |
| Pro | 126 | 108 |
| Gly | 329 | 339 |
| Ala | 109 | 114 |
| Val | 22 | 21 |
| Met | 6 | 13 |
| Ile | 11 | 11 |
| Leu | 24 | 23 |
| Tyr | 3 | 3 |
| Phe | 13 | 14 |
| Hyl | 6 | 8 |
| Lys | 29 | 26 |
| His | 5 | 7 |
| Arg | 49 | 52 |
Síntesi de col·lagen
[modifica]La síntesi de col·lagen es produeix dins i fora de la cèl·lula. La formació de col·lagen que es tradueix en fibril·les de col·lagen (forma més comuna) es discuteix aquí. La malla de col·lagen, que sovint participa en la formació de sistemes de filtració és l'altra forma del col·lagen. Cal assenyalar que tots els tipus de col·làgens són hèlixs triples, i les diferències radiquen en la composició dels pèptids alfa creats en el pas 2.
- La transcripció d'ARNm: Hi ha aproximadament 34 gens associats amb la formació de col·lagen, cada un que codifica una seqüència d'ARNm específica, i solen tenir la "COL" com a prefix. L'inici de la síntesi de col·lagen comença amb l'activació dels gens que estan associats amb la formació d'un pèptid alfa en particular (en general alfa 1, 2 o 3).
- La formació del pro-pèptid: Una vegada que surt l'ARNm del nucli de la cèl·lula i entra al citoplasma, s'uneix amb les subunitats del ribosoma i es produeix el procés de traducció. La primera part de la cadena de pèptids formada es coneix com la seqüència senyal. La seqüència senyal situada a l'extrem N-terminal del pèptid és reconeguda per una partícula de reconeixement de senyal del reticle endoplasmàtic, que s'encarregarà de dirigir el nou pèptid en formació al reticle endoplasmàtic. Per tant, una vegada que s'acaba la síntesi del pèptid, entra directament en el reticle endoplasmàtic pel processament post-traduccional.
- De pèptid alfa a procol·lagen: Tres modificacions del pro-pèptid porten a la formació del pèptid alfa. Després, la triple hèlix coneguda com a procol·lagen es forma abans de ser transportada en una vesícula de transport cap a l'aparell de Golgi. 1) El pèptid senyal a la N-terminal es dissol, i la nova molècula es coneix com a pro-pèptid. 2) S'hidroxilen les lisines i prolines per l'acció dels enzims lisil hidroxilasa i prolin hidroxilasa (per produir hidroxiprolina i hidroxilisina) amb la finalitat d'ajudar a la reticulació dels pèptids alfa. Aquest és el pas enzimàtic que requereix la vitamina C com cofactor. En l'escorbut, la manca de la hidroxilació de prolines i lisines causa una triple hèlix defectuosa (que està formada per tres pèptids alfa). 3) La glicosilació es produeix per addició de monòmers de glucosa o galactosa en els grups hidroxil de les lisines, però no de les prolines. A partir d'aquí els pro-pèptids hidroxilats i glucosilats giren cap a l'esquerra i després la unió de tres pro-pèptids formen la triple hèlix. És important recordar que aquesta molècula, coneguda ara com a pro-col·lagen,es compon d'una part en forma d'hèlix (centre) i dos caps sense lligar a cada extrem. En aquest punt el pro-col·lagen, està contingut en una vesícula de transferència destinada a l'aparell de Golgi.
- Modificació a l'Aparell de Golgi: A l'aparell de Golgi, el pro-col·lagen passa a través d'una última modificació post-traduccional, abans de ser secretat fora de la cèl·lula. En aquest pas s'afegeixen oligosacàrids i, a continuació, el pèptid alfa s'empaqueta en vesícules secretores destinades a l'espai extracel·lular.
- Formació de tropocol·lagen: Un cop fora de la cèl·lula, els enzims units a la membrana coneguts com a peptidases del col·lagen, treuen el "caps sense lligar" de la molècula de pro-col·lagen. El que queda és conegut com a tropocol·lagen. Un defecte en aquest pas produeix una de les col·lagenopatíes conegudes com a síndrome d'Ehlers-Danlos. Aquest pas està absent quan se sintetitza el col·lagen de tipus IV o malla de col·lagen.
- Formació de les fibril·les de col·lagen: la lisil oxidasa i enzims extracel·lulars produeixen el pas final en la via de la síntesi de col·lagen. Aquest enzim actua sobre lisines i hidroxilisines per produir grups aldehid, que finalment formaran enllaços covalents entre les molècules de tropocol·lagen. Aquest polímer de tropocol·lagen es coneix com a fibril·la de col·lagen.
Estructura molecular
[modifica]
Cada fibril·la de col·lagen està formada per molècules de tropocol·lagen que es disposen de manera escalonada una al costat d'una altra de manera que s'aprecia:
- Una zona de bretxa en la qual hi ha buits
- Una zona de superposició
La molècula de tropocol·lagen o col·lagen és una subunitat d'agregats més grans. Amb aproximadament 300 nm de llarg i 1,5 nm de diàmetre, es compon de tres cadenes polipeptídiques (anomenades pèptids alfa), cada una amb la conformació d'una hèlix cap a l'esquerra (el seu nom no s'ha de confondre amb l'habitual estructura hèlix alfa, una estructura amb gir cap a la dreta). Aquestes tres hèlixs amb gir cap a l'esquerra formen una nova espiral amb gir cap a la dreta, una triple hèlix o "súper hèlix", una cooperativa estructura quaternària estabilitzada per molts ponts d'hidrogen. El col·lagen tipus I i, possiblement, tots els col·làgens fibril·lars, si no tots els col·làgens, formen aquestes triples hèlixs conegudes com a microfibril·les de col·lagen. Cada microfibril·la és interdigitada amb les seves microfibril·les veïnes fins al punt que podria suggerir que són inestables de forma individual, encara que cada fibril·la de col·lagen està perfectament ordenada.
Una característica distintiva de col·lagen és la disposició regular dels aminoàcids en cadascuna de les tres cadenes d'aquestes subunitats del col·lagen. La seqüència sovint segueix el patró Gly-Pro-X o Gly-X-Hyp, on X pot ser qualsevol de la resta de residus d'aminoàcids.[22] La prolina i la hidroxiprolina constitueixen aproximadament 1 / 6 de la seqüència total. Amb un terç de la seqüència formada per glicina, concloem que aproximadament la meitat de la seqüència de col·lagen no és glicina, prolina o hidroxiprolina, un fet sovint oblidat per la distracció de l'inusual caràcter GX1X₂ dels pèptids alfa del col·lagen. L'alt contingut en glicina al col·lagen és important pel que fa a l'estabilització de l'hèlix del col·lagen, ja que permet l'estreta associació de les fibres de col·lagen dins de la molècula, la qual cosa facilita l'enllaç d'hidrogen i la formació d'enllaços creuats intermoleculars.[22] Aquest tipus de repetició regular i d'alt contingut en glicina es troba en només unes quantes proteïnes fibroses, com la fibroïna de seda. El 75-80% de la seda és (aproximadament) -Gly-Ala-Gly-Ala- amb un 10% serina, mentre que l'elastina és rica en glicina, prolina i alanina (Ala), la cadena lateral de la qual està formada per grup petit, un metil inert. Aquesta concentració alta de glicina i les repeticions regulars no es troben en les proteïnes globulars, amb excepció de seccions molt curtes de la seva seqüència. Químicament reactius, els grups laterals no són necessaris en les proteïnes estructurals, com ho són als enzims i proteïnes de transport, però el col·lagen no és tan sols una proteïna estructural. A causa del seu paper clau en la determinació del fenotip cel·lular, l'adhesió cel·lular, la regulació del teixit i la infraestructura, moltes seccions de les no prolines, tenen el rol d'associació / regulació amb la matriu cel·lular. El contingut relativament alt dels anells de prolina i hidroxiprolina, juntament amb la rica abundància de la glicina, explica la tendència de les cadenes polipèptidiques individuals a formar hèlixs levogires de manera espontània, sense cap tipus d'enllaços d'hidrogen intracatenaris.
Pel fet que la glicina sigui l'aminoàcid més petit i no tingui cadena lateral, fa que jugui un paper únic en les proteïnes fibroses estructurals. En el col·lagen, la Gly es requereix en cada tercera posició pel fet que en la formació de la triple hèlix es posa aquest residu a l'interior de l'eix de l'hèlix, on no hi ha espai per a grups laterals més gran que el simple àtom d'hidrogen de la glicina. Per la mateixa raó, els anells dels Pro i Hyp han d'apuntar cap a fora. Aquests dos aminoàcids ajuden a estabilitzar la triple hèlix-Hyp fins i tot més que la Pro; en canvi, es requereix una menor quantitat d'aquests en animals com els peixos, que tenen temperatures corporals més baixes que la majoria dels animals de sang calenta. El menor contingut de prolina i hidroxiprolina als peixos d'aigua freda i d'altres animals peciloterms fa que el seu col·lagen tingui una menor estabilitat tèrmica que el col·lagen dels mamífers.[22] Aquesta menor estabilitat tèrmica té com a resultat que la gelatina derivada del col·lagen de peix no sigui convenient per a moltes gelatines.
Les subunitats de tropocol·lagen espontàniament s'autoacoblen, amb els extrems escalonats regularment, formant series encara més grans en els espais extracel·lulars dels teixits.[23][24] Al col·lagen fibril·lar, les molècules estan escalonades entre si a una distància de 67 nm (una unitat que es coneix com 'D' i els canvis de la qual varien en funció de l'estat d'hidratació). Cada període D té quatre més una fracció de la molècula del col·lagen, ja que els 300 nm dividits per 67 nm no dona un nombre enter (la longitud de la molècula de col·lagen dividida per la distància de l'esglaó D). Per tant, en cada repetició del període D de les microfibril·les, hi ha una part que conté cinc molècules a la secció transversal, anomenada de "solapament", i una part que conté només quatre molècules, anomenada la "fenedura".[21] Les triples hèlixs també estan disposats en forma hexagonal o quasi hexagonal en la seva secció transversal.[13][21]
Hi ha alguns enllaços covalents dins de la triple hèlix, i una quantitat variable d'enllaços covalents entre les hèlixs de tropocol·lagen, formant agregats ben organitzats (com les fibril·les).[25] Els grans empaquetaments fibril·lars estan formats amb l'ajuda de diverses classes de proteïnes (incloent-hi diferents tipus de col·lagen), glicoproteïnes i proteoglicans per formar els diferents tipus de teixits madurs a partir de combinacions alternatives dels principals components clau.[24] La insolubilitat del col·lagen ha estat una barrera per a l'estudi del col·lagen monomèric fins que es va trobar que el tropocol·lagen dels animals joves es pot extreure perquè els seus enllaços encara no estan completament formats. No obstant això, els avenços en microscòpia electrònica (ME) i microscòpia de força atòmica (AFM)) i difracció de raigs X han permès als investigadors obtenir imatges cada vegada més detallades de l'estructura in situ del col·lagen. Aquests avenços posteriors són particularment importants per comprendre millor la manera com afecta l'estructura de col·lagen en la interacció cèl·lula – cèl·lula i cèl·lula - matriu, i com es construeixen els teixits en creixement i la seva reparació, i com canvia en el desenvolupament de certes malalties.[26] [27] Per exemple, la microscòpia de força atòmica (AFM) basada en la nanoindentació s'ha demostrat que una sola fibril·la de col·lagen és un material heterogeni al llarg de la seva direcció axial amb propietats mecàniques molt diferents.[28]
Les fibril·les de col·lagen són agregats semicristal·lins de molècules de col·lagen. Les fibres de col·lagen són feixos de fibril·les.
Els agregats de fibril·les de col·lagen estan disposats en diferents combinacions i concentracions en diversos teixits per proporcionar-los diferents propietats. En l'os, les hèlixs de col·lagen, totes triples, es troben en una matriu amb disposició paral·lela. Quaranta nm de separació entre els extrems de les subunitats de tropocol·lagen (aproximadament igual a la regió del GAP) serveixen com llocs de nucleació per a la deposició de vidres llargs i durs del component mineral, que és (aproximadament) d'hidroxilapatita, Ca10(PO₄)₆(OH)₂, amb una mica de fosfat. És d'aquesta manera que certs tipus de cartílag es transformen en os. El col·lagen tipus I dona a l'os la seva la resistència a la tracció.
Tipus de col·lagen i trastorns associats
[modifica]El col·lagen es produeix en molts llocs del cos. Més del 90% d'aquest col·lagen, però, és del tipus I.[29] Fins ara, 28 tipus de col·lagen han estat identificats i descrits. Els cinc tipus més comuns són:
- Tipus I. Característic del Teixit conjuntiu pròpiament dit.
- Tipus II. Propi de cartílag i del Teixit cartilaginós.
- Tipus III. Propi de cèl·lules reticulars.
- Tipus IV. Propi de làmines basals.
- Tipus VII. Propi de fibril·les d'ancoratge.
Col·lagen tipus I
[modifica]Es troba abundantment al derma, a l'os, al tendó i a la còrnia. Es presenta en fibril·les estriades de 20 a 100 nm de diàmetre i s'agrupa per formar fibres col·làgenes majors. Les seves subunitats majors estan constituïdes per cadenes alfa de dos tipus, que difereixen lleugerament en la seva composició d'aminoàcids i en la seva seqüència: a una de les quals se la designa com a cadena alfa1 i a l'altra, cadena alfa2. És sintetitzat pels fibroblasts, condroblasts i osteoblasts. La seva funció principal és la de resistència a l'estirament.
Col·lagen tipus II
[modifica]Es troba sobretot al cartílag, però també es presenta a la còrnia embrionària i a la notocorda, en el nucli pulpòs i a l'humor vitri de l'ull. En el cartílag, forma fibril·les fines de 10 a 20 nanòmetres, però en altres microambients pot formar fibril·les més grans, indistingibles morfològicament del col·lagen tipus I. Estan constituïdes per tres cadenes alfa2 d'un únic tipus. És sintetitzat pels condroblasts. La seva funció principal és la resistència a la pressió intermitent.
Col·lagen tipus III
[modifica]Abunda en el teixit conjuntiu lax, en les parets dels vasos sanguinis, el derma de la pell i a l'estroma de diverses glàndules. Sembla un constituent important de les fibres de 50 nanòmetres que tradicionalment s'han anomenat fibres reticulars. Està constituït per una classe única de cadena alfa3. És sintetitzat per les cèl·lules del múscul llis, fibroblasts, glials. La seva funció és la de sosteniment dels òrgans expandibles.
Col·lagen tipus IV
[modifica]És el col·lagen que forma la làmina basal que subjeu als epitelis. És un col·lagen que no es polimeritza en fibril·les, sinó que forma un feltre de molècules orientades a l'atzar, associades a proteoglicans i amb les proteïnes estructurals laminina i fibronectina. És sintetitzat per les cèl·lules epitelials i endotelials. La seva funció principal és la de sustentació i filtració.
Respecte a les malalties que es produeixen més freqüentment relacionades amb el col·lagen sorgeixen de defectes genètics o deficiències nutricionals que afecten la biosíntesi, acoblament, modificació post-traduccional, secreció, o altres processos involucrats en la producció normal de col·lagen.
| Tipus | Notes | Gen(s) | Trastorns |
| I | Aquest és el col·lagen més abundant del cos humà. És present en els teixits que s'estan cicatritzant, ja que és el producte final que s'obté quan el teixit es repara. Es troba en tendons, la pell, parets de les artèries, l'endomisi de les miofibril·les, fibrocartílag, i la part orgànica dels ossos i les dents. | COL1A1, COL1A2 | osteogenesis imperfecta, Síndrome d'Ehlers–Danlos, Hiperostosis cortical infantil, i malaltia de Caffey |
| II | El cartílag hialí constitueix el 50% de totes les proteïnes del cartílag. L'humor vitri de l'ull. | COL2A1 | Col·lagenopatia de tipus II i XI |
| III | Aquest és el col·lagen del teixit granulat, i es produeix de pressa gràcies als fibroblasts joves, més ràpid que altres col·làgens de tipus més durs. Fibres reticulars. També es troba a les parets de les artèries, la pell, els intestins i l'úter. | COL3A1 | Síndrome d'Ehlers–Danlos, Contractura de Dupuytren |
| IV | Làmina basal; lent de l'ull. També serveix com a part del sistema de filtració dels capil·lars i els glomèruls de nefrones del ronyó. | COL4A1, COL4A2, COL4A3, COL4A4, COL4A5, COL4A6 | Síndrome d'Alport, Síndrome de Goodpasture |
| V | La majoria dels teixits intersticials, associat amb el tipus I, associat amb la placenta. | COL5A1, COL5A2, COL5A3 | Síndrome d'Ehlers–Danlos (Clàssic) |
| VI | La majoria dels teixits intersticials, associat amb el tipus I. | COL6A1, COL6A2, COL6A3 | Miopatia d'Ulrich i Miopatia de Bethlem |
| VII | Forma fibril·les d'ancoratge en unions de dermis i epidermis. | COL7A1 | Epidermolisis bullosa distròfica |
| VIII | Algunes cèl·lules endotelials. | COL8A1, COL8A2 | Distròfia corneal polimòrfica posterior 2 |
| IX | FACIT collagenCol·lagen FACIT, cartílag, associat amb fibril·les del tipus II i XI., cartilage, assoc. with type II and XI fibrils | COL9A1, COL9A2, COL9A3 | EDM2 i EDM3 |
| X | Cartílag hipertròfic i mineralitzant. | COL10A1 | Displàsia metafisial d'Schmid |
| XI | Cartílag | COL11A1, COL11A2 | Col·lagenopatia, tipus II i XI |
| XII | Col·lagen FACIT, interacciona amb el tipus I, conté fibril·les, decorina i glicosaminoglicans. | COL12A1 | – |
| XIII | Col·lagen transmembrana, interacciona amb integrines A1B1, fibronectines i components de les membranes basals com el nitrogen i el perlecan.t | COL13A1 | – |
| XIV | Col·lagen FACIT | COL14A1 | – |
| XV | – | COL15A1 | – |
| XVI | – | COL16A1 | – |
| XVII | També conegut com BPAG2 o BP180, és una proteïna de transmembrana que s'uneix a la làmina basal dels hemidesmosomes, en particular de l'epidermis. Les fibres de col·lagen tipus XVII estan disposades paral·lelament a les integrines α6β4. Aquestes dues proteïnes poden així reforçar l'ancoratge de la làmina basal. És una proteïna de 180kDa. | COL17A1 | Permigoid bullós i algunes formes d'epidermolisis bullosa |
| XVIII | Font d'endostatina | COL18A1 | – |
| XIX | Col·lagen FACIT | COL19A1 | – |
| XX | – | COL20A1 | – |
| XXI | Col·lagen FACIT | COL21A1 | – |
| XXII | – | COL22A1 | – |
| XXIII | Col·lagen MACIT | COL23A1 | – |
| XXIV | – | COL24A1 | – |
| XXV | – | COL25A1 | – |
| XXVI | – | EMID2 | – |
| XXVII | – | COL27A1 | – |
| XXVIII | – | COL28A1 | – |
| XXIX | Col·lagen epidèrmic | COL29A1 | Dermatits atòpica[30] |
A més dels trastorns esmentats anteriorment, la deposició excessiva de col·lagen produeix esclerodèrmia.
Síntesi
[modifica]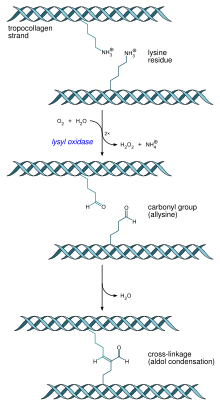
El col·lagen és sintetitzat pels fibroblasts, els quals el secreten unit a un polipèptid. Una vegada secretada a l'exterior aquesta molècula, el polipèptid es perd i el tropocol·lagen ja és lliure per a unir-se a altres molècules de tropocol·lagen formant fibril·les, i aquestes al seu torn, unint-se formant fibres menys en els casos del col·lagen tipus II i IV.
Aminoàcids
[modifica]El col·lagen té una composició i una seqüència inusual d'aminoàcids:
- La glicina (Gly) es troba en gairebé cada tres residus d'aminoàcids.
- La prolina (Pro) conforma al voltant del 17% de col·lagen.
- El col·lagen conté dos derivats d'aminoàcids infreqüents que no s'insereixen directament en la traducció. Aquests aminoàcids es troben en llocs específics relacionats amb glicines i pateixen modificacions post-traduccionals gràcies a diferents enzims, els quals requereixen la vitamina C com cofactor.
- Hidroxiprolina (Hyp), derivats de prolina.
- Hidroxilisina (Hyl), derivat de la lisina (Lys). En funció del tipus de col·lagen, una certa quantitat variable d'hidroxilisina és glicosilada (majoritàriament adjuntant-li disacàrids).
El cortisol estimula la degradació del col·lagen (de la pell) en aminoàcids.[31]
Formació
[modifica]
La majoria dels tipus de col·lagen es formen d'una manera similar, però el procés típic pel tipus I és el següent:
- Dins de la cèl·lula
- Es formen dos tipus de cadenes de pèptids que durant la traducció en els ribosomes al llarg del reticle endoplasmàtic rugós (RER): les cadenes alfa-1 i alfa-2. Aquestes cadenes de pèptids (conegudes com a preprocol·lagen) tenen pèptids de registre en cada extrem i un pèptid senyal.
- Les cadenes de polipèptids s'alliberen en el lumen del RER.
- Els pèptids senyal es tallen en l'interior del RER i passen a anomenar-se pro-alfa cadenes.
- Es produeix la hidroxilació dels aminoàcids lisina i prolina dins del lumen. Aquest procés és dependent d'àcid ascòrbic (vitamina C) com cofactor.
- Es produeix la glicosilació de residus d'hidroxilisina específics.
- Es forma una estructura de triple hèlix a l'interior del reticle endoplàsmic a partir de cada dues cadenes alfa-1 més una cadena alfa-2.
- El procol·làgen s'envia a l'aparell de Golgi, on s'envasa i se secreta per exocitosi fora de la cèl·lula.
- Fora de la cèl·lula:
- Els pèptids de registre es tallen i la peptidasa procol·lagen sintetitza tropocol·lagen.
- Múltiples molècules de tropocol·lagen formen fibril·les de col·lagen, a través d'enllaços creuats covalents (reacció aldòlica) per l'acció de la lisil oxidasa, que uneix els residus d'hidroxilisina i lisina. La unió de fibril·les de col·lagen formen fibres de col·lagen.
- El col·lagen pot estar unit a les membranes cel·lulars a través de diversos tipus de proteïnes, incloent-hi la fibronectina i la integrina.
Patogènesi sintètica
[modifica]La deficiència de vitamina C causa escorbut, una avitaminosi greu i dolorosa en la qual el col·lagen defectuós impedeix la formació de teixit connectiu fort. Les genives es deterioren i sagnen, acompanyades de la pèrdua de les dents; es decolora la pell i les ferides no es curen. Abans del segle xviii, aquesta patologia era comuna entre els militars que anaven a campanyes de llarga durada, especialment naval, expedicions en què els participants eren privats d'aliments que contenien vitamina C.
Una malaltia autoimmunitària com el lupus eritematós o l'artritis reumatoide[32] poden atacar les fibres de col·lagen sanes.
Molts dels bacteris i els virus tenen factors de virulència, que destrueixen el col·lagen o infereixen amb la seva producció.
Aplicacions del col·lagen
[modifica]Si el col·lagen està prou desnaturalitzat, per exemple per una pujada de temperatura, les 3 cadenes de tropocol·lagen se separen parcialment o totalment en dominis globulars, configurant així una estructura secundària diferent de l'estructura normal de col·lagen poliprolina II (PPII). Aquest procés descriu la formació de la gelatina, que s'utilitza en molts aliments, incloent-hi les [postres de gelatina]. A més del menjar, la gelatina s'utilitza en les indústries farmacèutica, cosmètica i fotogràfica.[33]
Des d'un punt de vista nutricional, el col·lagen i la gelatina són una font de proteïnes de mala qualitat, ja que no contenen tots els aminoàcids essencials en les proporcions que el cos humà necessita, no són "proteïnes completes" (segons la definició de la ciència dels aliments, no és que tinguin una estructura parcial). Les persones amb problemes en aquestes àrees és més probable que pateixin alguna altra condició subjacent (com l'envelliment normal, pell seca, artritis, etc.) que no pas que la causa sigui una deficiència de proteïnes.
De la paraula grega per cola, kolla, la paraula col·lagen significa "productor de cola" i es refereix al procés inicial d'ebullició de la pell i els tendons de cavalls i altres animals per obtenir cola. Els egipcis utilitzaven col·lagen adhesiu fa uns 4.000 anys, i els natius americans l'usaven en els arcs fa uns 1.500 anys. La cola més antiga del món, datada utilitzant la datació basada en el carboni 14, té més de 8.000 anys d'antiguitat, i es va trobar que era col·lagen utilitzat com a revestiment de protecció en les cistelles de cordes i les teles brodades, i també per subjectar diferents utensilis junts; també en la decoració de cranis humans.[34] El col·lagen normalment es converteix en gelatina, però s'ha mantingut gràcies a les condicions seques. Les coles d'origen animal són termoplàstiques, es tornen més gelatinoses i manejables quan se les escalfa, de manera que encara s'utilitzen en la fabricació d'instruments musicals com violins i guitarres, que pot ser que s'hagin de tornar a obrir per posteriors reparacions -una aplicació incompatible amb adhesius resistents fets de plàstic sintètic, que són permanents. Els tendons i les pells dels animals, incloent-hi el cuir, s'han utilitzat per a la fabricació d'articles útils diversos durant milers d'anys.
La cola de gelatina-resorcinol-formaldehid (i amb el formaldehid reemplaçat per productes menys tòxics com el pentandial i l'etandial) s'ha utilitzat per reparar incisions experimentals en els pulmons de conill.[35]
Aplicacions mèdiques
[modifica]Aplicacions cardíaques
[modifica]Els quatre anells densos de col·lagen que formen les vàlvules del cos central i l'esquelet del cor són histològicament imprescindibles en el miocardi. El col·lagen és essencial pel bon funcionament del cor, ja que li dona la rigidesa i la solidesa que necessita en contraposada amb la fluïdesa que comporta el moviment constant de la sang. Aquesta estructura és un tallafoc impermeable que exclou la sang i la influència de l'electricitat (excepte a través de canals anatòmics) des de les càmeres superiors a les inferiors del cor. Com a prova, es podria postular que la fibril·lació auricular gairebé mai es deteriora en fibril·lació ventricular. Les zones més primes de les vàlvules es mantenen en forma de vela de vaixell gràcies al col·lagen sota pressió variable. Com a conseqüència natural de l'envelliment apareixen dipòsits de calci emmagatzemats dins el col·lagen. Els punts fixos rics en calci ens poden mostrar el moviment de la sang i del múscul cardíac gràcies a la tecnologia actual d'imatge, i així podem distingir clarament la sang que entra i la que surt del cor. Imatges específiques com ara de la quantitat del calci en un punt ens mostren la utilitat d'aquest mètode, utilitzat per exemple en un pacient ancià que pateix una patologia que fa que el col·lagen no sigui prou fixant i resistent.
Cirurgia estètica
[modifica]El col·lagen ha estat àmpliament utilitzat en la cirurgia estètica, com una ajuda per la curació de pacients cremats, per la reconstrucció d'ossos i una gran varietat de propòsits dentals, ortopèdics i quirúrgics. El col·lagen, tant humà com boví, és àmpliament utilitzat per fer farcits dèrmics pel tractament d'arrugues i l'envelliment de la pell.[36]
Alguns punts d'interès són:
- Quan s'utilitza com a cosmètic, hi ha la possibilitat de patir reaccions al·lèrgiques que causen enrogiment prolongat; de totes maneres, això pot evitar-se realitzant unes proves simples abans d'utilitzar-lo com a cosmètic per veure si és adequat.
- La major part del col·lagen destinat a funcions mèdiques deriva del bestiar boví jove que ha passat proves i s'ha demostrat que no pateixen EEB (encefalopatia espongiforme bovina). La majoria dels fabricants utilitzen els animals donants de forma indiferent tant si provenen de "ramats tancats" que se sap que són sans, o de països que mai han tingut un cas d'EEB, com Austràlia, Brasil i Nova Zelanda.
- Els teixits porcins (de porcs) també són molt utilitzats per produir làmines de col·lagen per una gran varietat de finalitats quirúrgiques.
- Per fer reconstruccions quirúrgiques s'utilitzen materials del mateix pacient, com ara àcids grassos, àcid hialurònic o gels de poliacrilamida, ja que els trobem molt disponibles.
Cirurgia reconstructiva
[modifica]Els col·làgens són àmpliament utilitzats en la construcció de substituts de pell artificial utilitzats en el tractament de cremades greus. Aquests col·làgens poden provenir de les espècies bovina, equina o porcina, i fins i tot poden ser humans; s'utilitzen de vegades combinats amb silicones, glicosaminoglicans, fibroblasts, factors de creixement i altres substàncies.
El col·lagen també es ven en forma de píndola, com a complement de la mobilitat articular, però les referències sobre aquest punt són pobres.[37] Les proteïnes es descomponen en aminoàcids abans de l'absorció, i per tant no hi ha cap raó per la qual el col·lagen ingerit per via oral pugui afectar el teixit connectiu del cos, excepte com a suplement d'aminoàcids individuals.
Tot i que no pot ser absorbit per la pell, el col·lagen s'utilitza com a ingredient principal en alguns tipus de maquillatge cosmètic.
El col·lagen també s'utilitza freqüentment en la investigació científica per al cultiu cel·lular, l'estudi del comportament de les cèl·lules i les interaccions cel·lulars amb el medi extracel·lular.[38] Els fabricants com Trevigen[39] treballen amb el col·lagen I de rata o boví, i amb el col·lagen IV dels ratolins.
Tractament de les ferides
[modifica]El col·lagen és un dels principals recursos naturals del cos i un component del teixit de la pell que pot beneficiar totes les etapes del procés de cicatrització de la ferida. Quan la ferida pot disposar de col·lagen és quan es pot cicatritzar. El deteriorament de la ferida, seguida de vegades de procediments com l'amputament, poden ser evitats.
Al llarg de les 4 fases de cicatrització de la ferida, el col·lagen té les següents funcions:
- Orientar la funció: Les fibres de col·lagen serveixen de guia als fibroblasts. Els fibroblasts migren al llarg d'una matriu de teixit connectiu.
- Propietats quimiotàctiques: La gran superfície disponible en les fibres de col·lagen pot atraure les cèl·lules fibrogèniques que ajuden en la curació.
- Nucleació: El col·lagen, amb la presència de certes molècules de sal neutra, pot actuar com un agent de nucleació que causa la formació d'estructures fibril·lars. Un apòsit de col·lagen podria servir com una guia per orientar el dipòsit de col·lagen nou i el creixement capil·lar.
- Propietats hemostàtiques: Les plaquetes interaccionen amb el col·lagen per fer un tap hemostàtic.
Els registres fòssils
[modifica]A causa que la síntesi de col·lagen requereix un alt nivell d'oxigen de l'atmosfera, els animals complexos no poden haver estat capaços d'evolucionar fins que l'atmosfera fos suficientment oxigènica per a la síntesi de col·lagen.[40] L'origen de col·lagen pot haver permès la formació de la cutícula, la closca i el múscul. No obstant això, la preservació de col·lagen en el registre fòssil és molt escassa.[41] Cada vegada hi ha més evidència (cosa que causa controvèrsia) que el col·lagen s'ha conservat en les mostres de dinosaure tan antigues com fa 80 milions d'anys.[42]
També cal destacar les actinofibril·ls, les fibres de col·lagen presents en les ales dels pterosaures. El col·lagen sovint és extret dels ossos d'animals prehistòrics per utilitzar-lo en la datació per radioactivitat i anàlisi d'isòtops estables. La integritat de la molècula pot ser avaluada amb una sèrie de mesures (rendiment del col·lagen, relació C:N, C% i N%).[22] Pel que fa a la datació radiomètrica, el col·lagen extret produeix una forma de carboni “més pura” que es pot datar, i això fa que els ossos a granel, que contenen una alta quantitat d'apatita carbonada, la qual és propensa a intercanviar carboni amb les fonts ambientals d'aquest element, causin contaminació. Són comunes les anàlisis d'isòtops estables de carboni i nitrogen per tal d'estudiar la dieta de les poblacions humanes del passat, així com per reconstruir les condicions ecològiques passades.
Art
[modifica]Utilitzant les coordenades atòmiques dipositades al Banc de Dades de Proteïnes, l'alemany, artista nord-americà Julian Voss-Andreae ha creat escultures basades en l'estructura del col·lagen i altres proteïnes.[43] En Unraveling Collagen (Descobrint el col·lagen), les formes triangulars representen les línies de força dominant, amb reminiscències de la construcció amb acer contemporània.[44][45]
Referències
[modifica]- ↑ Fratzl, P. Collagen: Structure and Mechanics. Nova York: Springer, 2008. ISBN 038773905X.
- ↑ Buehler, M. J. «Nature designs tough collagen: Explaining the nanostructure of collagen fibrils». PNAS, 103, 33, 2006, pàg. 12285–12290. DOI: 10.1073/pnas.0603216103. PMC: 1567872. PMID: 16895989.
- ↑ Structure of Skin The Aging Skin[Enllaç no actiu]
- ↑ Wyckoff, R.; Corey, R.; Biscoe, J. «X-ray reflections of long spacing from tendon». Science, 82, 2121, 1935, pàg. 175–176. DOI: 10.1126/science.82.2121.175. PMID: 17810172.
- ↑ Clark, G.; Parker, E.; Schaad, J. [et al]. «New measurements of previously unknown large interplanar spacings in natural materials». Journal of the American Chemical Society, 57, 8, 1935, pàg. 1509. DOI: 10.1021/ja01311a504.
- ↑ «GNR — A Tribute - Resonance - October 2001».
- ↑ Leonidas, Demetres D.; et al., GB; Jardine, AM [et al]. «Binding of Phosphate and pyrophosphate ions at the active site of human angiogenin as revealed by X-ray crystallography». Protein Science, 10, 8, 2001, pàg. 1669–1676. DOI: 10.1110/ps.13601. PMC: 2374093. PMID: 11468363.
- ↑ Subramanian, Easwara «Obituary: G.N. Ramachandran». Nature Structural & Molecular Biology, 8, 6, 2001, pàg. 489–491. DOI: 10.1038/88544. PMID: 11373614.
- ↑ Fraser, R. D.; MacRae, T. P.; Suzuki, E. «Chain conformation in the collagen molecule». J Mol Biol, 129, 3, 1979, pàg. 463–481. DOI: 10.1016/0022-2836(79)90507-2. PMID: 458854.
- ↑ Okuyama, K.; et al., K; Arnott, S [et al]. «Crystal and molecular structure of a collagen-like polypeptide (Pro-Pro-Gly)10». J Mol Biol, 152, 2, 1981, pàg. 427–443. DOI: 10.1016/0022-2836(81)90252-7. PMID: 7328660.
- ↑ Traub, W.; Yonath, A.; Segal, D. M. «On the molecular structure of collagen». Nature, 221, 5184, 1969, pàg. 914–917. DOI: 10.1038/221914a0.
- ↑ Bella, J.; Eaton, M.; Brodsky, B. [et al]. «Crystal and molecular structure of a collagen-like peptide at 1.9 A resolution». Science, 266, 5182, 1994, pàg. 75–81. DOI: 10.1126/science.7695699. PMID: 7695699.
- ↑ 13,0 13,1 Hulmes, D. J.; Miller, A. «Quasi-hexagonal molecular packing in collagen fibrils». Nature, 282, 5741, 1979, pàg. 878–880. DOI: 10.1038/282878a0. PMID: 514368.
- ↑ Jesior, J. C.; Miller, A.; Berthet-Colominas, C. «Crystalline three-dimensional packing is general characteristic of type I collagen fibrils». FEBS Lett, 113, 2, 1980, pàg. 238–240. DOI: 10.1016/0014-5793(80)80600-4. PMID: 7389896.
- ↑ Fraser, R. D. B.; MacRae, T. P. «Unit cell and molecular connectivity in tendon collagen». Int. J. Biol. Macromol., 3, 3, 1981, pàg. 193–200. DOI: 10.1016/0141-8130(81)90063-5.
- ↑ Fraser, R. D.; MacRae, T. P.; Miller, A. «Molecular packing in type I collagen fibrils». J Mol Biol, 193, 1, 1987, pàg. 115–125. DOI: 10.1016/0022-2836(87)90631-0. PMID: 3586015.
- ↑ Wess, T. J.; et al., AP; Wess, L [et al]. «Molecular packing of type I collagen in tendon». J Mol Biol, 275, 2, 1998, pàg. 255–267. DOI: 10.1006/jmbi.1997.1449. PMID: 9466908.
- ↑ Raspanti, M.; Ottani, V.; Ruggeri, A. «Subfibrillar architecture and functional properties of collagen: a comparative study in rat tendons». J Anat., 172, 1990, pàg. 157–164. PMC: 1257211. PMID: 2272900.
- ↑ Holmes, D. F.; Gilpin, C. J.; Baldock, C. [et al]. «Corneal collagen fibril structure in three dimensions: Structural insights into fibril assembly, mechanical properties, and tissue organization». PNAS, 98, 13, 2001, pàg. 7307–7312. DOI: 10.1073/pnas.111150598. PMC: 34664. PMID: 11390960.
- ↑ Holmes, D. F.; Kadler, KE «The 10+4 microfibril structure of thin cartilage fibrils». PNAS, 103, 46, 2006, pàg. 17249–17254. DOI: 10.1073/pnas.0608417103. PMC: 1859918. PMID: 17088555.
- ↑ 21,0 21,1 21,2 Orgel, J. P.; et al., TC; Miller, A [et al]. «Microfibrillar structure of type I collagen in situ». PNAS, 103, 24, 2006, pàg. 9001–9005. DOI: 10.1073/pnas.0502718103. PMC: 1473175. PMID: 16751282.
- ↑ 22,0 22,1 22,2 22,3 22,4 22,5 Szpak, Paul «Fish bone chemistry and ultrastructure: implications for taphonomy and stable isotope analysis». Journal of Archaeological Science, 38, 12, 2011, pàg. 3358-3372. DOI: 10.1016/j.jas.2011.07.022.
- ↑ Hulmes, D. J. «Building collagen molecules, fibrils, and suprafibrillar structures». J Struct Biol, 137, 1–2, 2002, pàg. 2–10. DOI: 10.1006/jsbi.2002.4450. PMID: 12064927.
- ↑ 24,0 24,1 Hulmes, D. J. «The collagen superfamily—diverse structures and assemblies». Essays Biochem, 27, 1992, pàg. 49–67. PMID: 1425603.
- ↑ Perumal, S.; Antipova, O.; Orgel, J. P. «Collagen fibril architecture, domain organization, and triple-helical conformation govern its proteolysis». PNAS, 105, 8, 2008, pàg. 2824–2829. DOI: 10.1073/pnas.0710588105. PMC: 2268544. PMID: 18287018.
- ↑ Sweeney, S. M.; et al., JP; Fertala, A [et al]. «Candidate Cell and Matrix Interaction Domains on the Collagen Fibril, the Predominant Protein of Vertebrates». J Biol Chem, 283, 30, 2008, pàg. 21187–21197. DOI: 10.1074/jbc.M709319200. PMC: 2475701. PMID: 18487200.
- ↑ Twardowski, T.; et al., A.; Orgel, J. P.R.O. [et al]. «Type I collagen and collagen mimetics as angiogenesis promoting superpolymers». Curr Pharm Des, 13, 35, 2007, pàg. 3608–3621. DOI: 10.2174/138161207782794176.
- ↑ M. Minary-Jolandan and M.-F. Yu, "Nanomechanical Heterogeneity in the Gap and Overlap Regions of Type I Collagen Fibrils with Implications for Bone Heterogeneity", Biomacromolecules 10, 2565 (2009)
- ↑ Sabiston textbook of surgery board review, 7th edition. Chapter 5 wound healing, question 14
- ↑ Söderhäll, C.; Marenholz, I.; Kerscher, T. [et al]. «Variants in a Novel Epidermal Collagen Gene (COL29A1) Are Associated with Atopic Dermatitis». PLoS Biology, 5, 9, 2007, pàg. e242. DOI: 10.1371/journal.pbio.0050242. PMC: 1971127. PMID: 17850181.
- ↑ Houck, J. C.; Sharma, V. K.; Patel, Y. M. [et al]. «Induction of Collagenolytic and Proteolytic Activities by AntiInflammatory Drugs in the Skin and Fibroblasts». Biochemical Pharmacology, 17, 10, 1968, pàg. 2081–2090. DOI: 10.1016/0006-2952(68)90182-2. PMID: 4301453.
- ↑ Al-Hadithy, H.; et al., DA; Addison, IE [et al]. «Neutrophil function in systemic lupus erythematosus and other collagen diseases». Ann Rheum Dis, 41, 1, 1982, pàg. 33–38. DOI: 10.1136/ard.41.1.33. PMC: 1000860. PMID: 7065727.
- ↑ «Gelatin's Advantages: Health, Nutrition and Safety». Arxivat de l'original el 2012-06-09. [Consulta: 18 novembre 2011].
- ↑ Walker, Amélie A. «Oldest Glue Discovered». Archaeology, 21-05-1998.
- ↑ Ennker, Ina Carolin; et al., Jürgen; Schoon, Doris [et al]. «Formaldehyde-free collagen glue in experimental lung gluing». Annals of Thoracic Surgery, 57, 6, 1994, pàg. 1622–1627. Arxivat de l'original el 2012-07-08. DOI: 10.1016/0003-4975(94)90136-8. PMID: 8010812 [Consulta: 18 novembre 2011]. Arxivat 2012-07-08 at Archive.is
- ↑ Dermal Fillers | The Ageing Skin
- ↑ «Hydrolyzed Collagen pills usages».
- ↑ Blow, Nathan «Cell culture: building a better matrix». Nature Methods, 6, 8, 2009, pàg. 619–622. DOI: 10.1038/nmeth0809-619.
- ↑ http://www.trevigen.com/angiocell/cultrex.php Arxivat 2011-04-08 a Wayback Machine.
- ↑ http://facstaff.gpc.edu/~pgore/geology/geo102/cambrian.htm Arxivat 2012-10-29 a Wayback Machine.
- ↑ doi:10.1111/j.1502-3931.1996.tb01844.x
- ↑ doi:10.1126/science.1165069
- ↑ «PDB Community Focus: Julian Voss-Andreae, Protein Sculptor». Protein Data Bank Newsletter, 32, Winter 2007.
- ↑ Ward, Barbara «'Unraveling Collagen' structure to be installed in Orange Memorial Park Sculpture Garden». Expert Rev. Proteomics, 3 (2), 2, April 2006, pàg. 174. DOI: 10.1586/14789450.3.2.169.
- ↑ «Interview with J. Voss-Andreae "Seeing Below the Surface" in Seed Magazine». Arxivat de l'original el 2012-06-29. [Consulta: 18 novembre 2011].
Vegeu també
[modifica]- Osteoide, col·lagen que conté components dels ossos
- Col·lagen hidrolitzat, una forma comuna en la qual el col·lagen es ven com un suplement.
- Lisil oxidasa i LOXL1, LOXL2, LOXL3, LOXL4 en la formació de col·lagen
- Col·lagenasa, l'enzim implicat en la degradació del col·lagen i la seva remodelació. Per a més informació sobre altres proteases que actuen sobre el col·lagen, vegeu El Mapa de proteòlisi
- Cola d'animal
- Síndrome d'Ehlers-Danlos
- Síndrome de Hiperlaxitud
- Síndrome de Marfan, una malaltia genètica amb fibrilina 1 defectuosa
