Enllaç disulfur
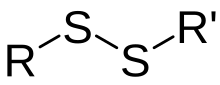
Un enllaç pont disulfur, o només pont disulfur, enllaç disulfur o enllaç SS (enllaç sofre-sofre) és un fort enllaç covalent entre grups tiol. Aquest enllaç és molt important en l'estructura, plegament i funció de les proteïnes, quan forma la cistina.
Característiques del pont disulfur
[modifica]El pont disulfur és un enllaç covalent, d'una energia de 60 kcal/mol. Encara que és considerat un enllaç fort, l'afinitat S-S és menor a la que hi ha entre un C i un H o bé entre dos C, i per tant, també més reactiu. L'enllaç disulfur té una longitud d'uns 2,05 Å. Aquest tipus d'enllaç té molta importància en l'estructura i l'estabilitat proteica, pel fet que hi ha bases nitrogenades, com la cisteïna, que poden formar, a partir de la deshidrogenació dels seus grups sulfhidril, enllaços S-S. De la mateixa manera, la hidrogenació d'un enllaç S-S dona lloc a dos grups sulfhidril. També és molt important en la funció d'algunes proteïnes i enzims.[1]
Formació del pont disulfur
[modifica]Els ponts disulfur es formen normalment per oxidació de grups sulfhidril, en la següent reacció:
2 RSH → RS-SR + 2 H+ + 2 e-
Hi ha dues classes de ponts disulfur: els símetrics (on els grups R són iguals) i els asímetrics (on els grups R són diferents).
Una gran varietat d'oxidants promouen la reacció de formació del pont disulfur. A continuació es presenten alguns exemples de formació de ponts S-S.
- Reacció d'un tiol (-SH) amb un 1-clorobenzetriazol (BtCl), que dona lloc a un tiol benzotriazolat (RBSt). Aquest compost reacciona amb un altre tiol i forma un disulfur asimètric.
- En presència de quantitats catalítiques de iodina, grups tiol poden ser oxidats formant un enllaç S-S mitjançant peròxid d'hidrogen o aigua oxigenada.
- Es pot usar 1,3-dibromo-5,5-dimetilhidantoin (DBDMH) com a oxidant per formar enllaços S-S a partir de tiols.
- També l'aire pot induir a la formació de ponts disulfur, funcionant com a oxidant.[2]
En les proteïnes, cal parar especial atenció al grup R de la cisteïna, que conté un grup sulfhidril. Aquest grup és un àcid dèbil molt reactiu. El grup tiol de la cisteïna s'oxida fàcilment i es transforma en disulfur, formant cistina, que conté un enllaç disulfur. L'enllaç pot produir-se en una única cadena per formar un anell o entre dues cadenes separades per formar un pont intermolecular.
El grup tiol dels grups R de la cisteïna té gran importància en el centre actiu de molts enzims. És per això que aquests poden inactivar-se per formació de mercàptids.[3]
Escissió del pont disulfur
[modifica]Els ponts disulfur poden desfer-se fàcilment per reducció a partir de l'acció de reductors com l'hidrur de liti, l'alumini en èter sec o l'hidrur de bor liti, donant lloc a dos grups -SH.
El grup tiol dels grups R de la cisteïna té gran importància en el centre actiu de molts enzims. És per això que aquests poden inactivar-se per formació de mercàptids, en la següent reacció:[4]
RS-SR + 2 Na → 2 NaSR

Importància biològica
[modifica]Els enllaços disulfur tenen un paper clau en la maduració i funció de les diferents proteïnes (per tant, té un paper determinant en l'estabilitat de l'estructura final). És un procés complex, ja que no només s'han de formar, sinó que a més ha de trencar els enllaços que s'han format a llocs incorrectes (per reducció) o arreglar la seva disposició (isomerització).[5]
Formació de ponts disulfur en eucariotes
[modifica]En les cèl·lules eucariotes, el plegament de la proteïna es fa en el reticle endoplasmàtic (ER), ja que és on hi ha l'entorn més òptim. Actualment hi ha proves que demostren que la formació de disulfur està conduïda per l'Ero1p, un enzim lligat al FAD (és, per tant, FADdependent), i la família de proteïnes PDI (Protein Disulphide Isomerase), enzims multidominis i multifuncionals pertanyents a la superfamília de les tiorredoxines, que tenen la capacitat d'isomerar els enllaços i de catalitzar la formació de disulfur.[6] L'Ero1p oxida la PDI, la qual aleshores, directament, oxida les proteïnes plegades. El FAD, que és sintetitzat al citosol, entra fàcilment al reticle endoplasmàtic i s'uneix a l'ERO1p (al qual té la capacitat d'estimular). L'Ero1p lligat al FAD passa els electrons a l'oxigen molecular, reacció de la qual es creu que se'n resulta la producció de ROS. La isomerització de l'enllaç (i també la reducció, és a dir, el trencament) pot ser dut a terme per un dels homòlegs del PDI (Eug1p, Mpd1p, Mpd2p, or Eps1p), a part d'ell mateix. El glutatió, en canvi, és un potent antioxidant, de manera que trenca els enllaços disulfur.[5] La quantitat de FAD servirà com a regulació d'aquest procés.
Formació de ponts disulfur en procariotes
[modifica]La formació d'enllaços disulfur en proteïnes (abreujat en anglès com Dsbs), com s'ha vist en punts anteriors, és una reacció oxidativa que és crucial en el plegament i la maduració d'una gran quantitat de proteïnes, tant de membrana com de les que es secreten. Les cèl·lules procariotes no tenen reticle endoplasmàtic, lloc on es formen els enllaços disulfur en els eucariotes. En els bacteris les proteïnes amb aquests tipus d'enllaços normalment es troben als compartiments extracitoplasmàtics o són secretades. Un dels sistemes millor caracteritzats són les sèries de formació d'enzims de formació d'enllaços disulfur d'E. coli. Tots els enzims reben el nom de Dsb més una lletra, segons el tipus, i són encarregats de catalitzar la formació dels enllaços. Redueixen el temps considerablement, ja que dels mesos que trigaria la reacció redueixen el temps de la reacció a minuts. Entre ells destaquen el DsbA i el DsbB (introductors de disulfurs) i el DsbC i el DsbD (vies d'isomerització del disulfur, que promouen el plegament oxidatiu de les proteïnes secretades). En aquest procés, DsbB coopera amb la ubiquinona, la qual té un paper molt important. Aquests mecanismes estan ben estudiats per aquest bacteri i són aplicables a l'estudi d'aquests sistemes d'altres organismes.[7][8]
Ponts disulfur i perruqueria
[modifica]El cabell està format a partir de cadenes de proteïnes, on abunda la queratina, unides transversalment per enllaços disulfur formats entre les hèlixs alfa de la queratina. Depèn de com es formin aquests enllaços, la forma del cabell variarà, és a dir, serà llis o arrissat (quan els ponts es formin en el mateix nivell els cabells seran llisos, i quan es formin en nivells diferents, arrissats). Als anys 30, investigadors del Rockefeller Institute van demostrar que els enllaços es podien trencar en dissolucions bàsiques. Aquest descobriment ha sigut la base a través de la qual han sorgit diferents tècniques en perruqueria per passar de manera permanent de cabell arrissat a llis, o viceversa (tècnica anomenada permanent). El que es fa és primer de tot trencar els enllaços disulfur (amb tioglicolat, per exemple). Aleshores es remodela el cabell perquè quedi amb la forma que es vulgui i després s'aplica una dissolució com ara la de peròxid d'hidrogen (aigua oxigenada), que farà que es formin nous enllaços disulfur, de manera que es mantindrà la forma del cabell que volem.[9][10] Cal dir, però, que utilitzar un xampú bàsic és perjudicial per als cabells, ja que és el responsable de les puntes obertes i fa que no brilli (doncs els enllaços es trenquen, la superfície del cabell és més aspre i la llum no es pot distribuir uniformement). Un pH molt alcalí (de l'ordre de 12) pot dissoldre el cabell, i és la base d'algunes cremes depilatòries.[11]
Referències
[modifica]- ↑ R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0 471 95512 4
- ↑ Synthesis of Disulfides
- ↑ «Estructura Tridimensional de las Proteínas» (en castellà). Departamento de Bioquímica Facultad de Medicina, Universidad Nacional Autónoma de México. Arxivat de l'1 original el 27 de novembre 2010. [Consulta: 13 desembre 2009].
- ↑ «28 Inhibición enzimática» (en castellà). DEPARTAMENTO DE BIOQUÍMICA Y BIOLOGÍA MOLECULAR, Universidad de Salamanca. [Consulta: 13 desembre 2009].
- ↑ 5,0 5,1 Benjamin P. Tu and Jonathan S. Weissman «[http http://jcb.rupress.org/cgi/content/abstract/164/3/341 Oxidative protein folding in eukaryotes:mechanisms and consequences]». J Cell Biol., 164, 3, Feb 2004, pàg. 341-346. DOI: 10.1083/jcb.200311055. PMC: 2172237. PMID: 14757749.
- ↑ Lars Ellgaard and Lloyd W. Ruddock «[http http://www.nature.com/embor/journal/v6/n1/abs/7400311.html The human protein disulphide isomerase family: substrate interactions and functional properties]». EMBO Rep., 6, 1, Jan 2005, pàg. 28-32. DOI: 10.1038/sj.embor.7400311. PMC: 1299221. PMID: 15643448.
- ↑ Kenji Inaba «Disulfide Bond Formation System in Escherichia coli». J Biochem, 146, 5, Nov 2009, pàg. 591-597. DOI: 10.1093/jb/mvp102. PMC: 19567379. PMID: 19567379.
- ↑ Hiroshi Kadokura, Federico Katzen, and John Beckwith «[http:// http://arjournals.annualreviews.org/doi/abs/10.1146%2Fannurev.biochem.72.121801.161459 Protein Disulfide Bond Formation in Prokaryotes]». Annu Rev Biochem, 72, 0, 2003, pàg. 111-135. DOI: 10.1146/annurev.biochem.72.121801.161459. PMC: 12524212. PMID: 12524212.[Enllaç no actiu]
- ↑ «Proteínas: cabello liso/cabello lacio» (en castellà). Francisco García Carmona, Álvaro Sánchez Ferrer, José Ibañez Mercarder i altres (Universitat de Múrcia). [Consulta: 10 desembre 2009].
- ↑ «Los enlaces disulfuro y el cabello» (en castellà). Departamento de química inorgànica, cristalografía i mineralogía (Universitat de Màlaga). [Consulta: 10 desembre 2009].
- ↑ «El mejor champú» (en castellà). Ana María Sosa Reyes (UNAM). Arxivat de l'original el 18 de desembre 2009. [Consulta: 10 desembre 2009].