Estereoisòmer
Els esteroisòmers són isòmers que tenen la mateixa seqüència d'àtoms units entre ells, però que tenen diferències només en les orientacions tridimensionals dels àtoms a l'espai. Els isòmers estructurals comparteixen la mateixa fórmula molecular, però la seqüència d'àtoms i/o el seu ordre respecte als altres grups funcionals o àtoms pot variar. En els esteroisòmers, l'ordre i els enllaços dels àtoms sempre són els mateixos, però l'orientació en l'espai és diferent.
Enantiòmers
[modifica]Article principal: Enantiòmer
Els enantiòmers són dos esteroisòmers que estan relacionats entre ells per un reflex: són imatges especulars l'un de l'altre, és a dir, que no es poden superposar una de l'altra. Les mans dels humans són un exemple macroscòpic dels esteroisòmers. Cada centre estereogènic en un esteroisòmer té la configuració oposada en la seva parella. Els dos components que formen la parella d'enantiòmers tenen les mateixes propietats físiques, excepte pel que fa a la direcció en la qual desvien el pla de vibració de la llum polaritzada que els travessa i com interaccionen amb diferents isòmers òptics d'altres components biològics. Per aquesta raó, els enantiòmers purs posseeixen el fenomen de l'activitat òptica i poden ser separats només usant una molècula quiral. En la natura, són presents només un tipus d'enantiòmers entre la majoria de molècules quirals, tals com aminoàcids (excepte la glicina, que és no-quiral). Conseqüentment, diferents molècules enantiòmeres poden tenir diferències importants pel que fa als efectes biològics.
Diastereòmers
[modifica]Article principal: Diastereòmer
Els diastereòmers són esteroisòmers que no estan relacionats amb l'efecte de reflex. No són imatges especulars l'un de l'altre. Això inclou meso-composts, és a dir, cis-trans (E-Z) isòmers, i també isòmers òptics no enantiomèrics. Els diastereòmers rarament tenen les mateixes propietats físiques. En l'exemple mostrat a sota, la forma "meso" de l'àcid tàrtric forma un parell de diastereòmers (L i D), que formen el parell enantiomèric.
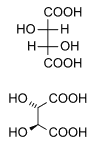
|

| |
|
(natural) tartaric acid |
D-(-)-tartaric acid |
mesotartaric acid |
|
(1:1) |
||
Cal destacar que la nomenclatura D- i L- dels isòmers descrits anteriorment no és el mateix que la nomenclatura que normalment s'usa (d- i l-); fet que explica per què poden aparèixer invertits si fem referència a la segona nomenclatura esmentada. Per a més informació sobre la nomenclatura D- L-: Chirality_(chemistry)#Naming_conventions
Isomerisme cis-trans i E-Z
[modifica]Article principal: Isomerisme cis-trans i notació E-Z
L'esteroisomerisme relacionat amb enllaços dobles sorgeix perquè la rotació dels doble enllaços és restringida, mantenint els elements substituïts fixats entre ells. Si els substituents de cada doble enllaç són els mateixos, no es pot considerar un enllaç estèreo. Tradicionalment, l'estereoquímica dels dobles enllaços va ser descrita de les dues maneres: cis (en llatí, "en aquest cantó") o trans (en llatí, "a través"); fent referència a la posició relativa dels substituents de cada cantó del doble enllaç. Els exemples més simple d'isomerisme cis-trans són els 1,2- disubstituïts etens, com el dicloretè (C₂H₂Cl₂), els isòmers del qual es mostren a sota.
La molècula I és la cis-1,2-dicloretè i la molècula II és la trans-1,2-dicloretè. A causa de l'ocasional ambigüitat, la IUPAC va adoptar un sistema més rigorós en el qual els substituents del final de cada doble enllaç tenen prioritat segons el seu nombre atòmic. Si els substituents que tenen alta prioritat estan al mateix cantó de l'enllaç, s'assigna la lletra Z (en alemany, zusammen, que significa "junts"). Si per contra, estan en cantons diferents, s'assigna la lletra E (en alemany, entgegen, que significa "oposats"). Com que el clor té un nombre atòmic més alt que l'hidrogen, és el grup amb prioritat més alta. Usant aquesta notació per a anomenar les molècules anteriors, la molècula I és (Z)-1,2-dicloretè i la molècula II és (E)-1,2-dicloretè. No és el cas de Z i cis o E i trans, que són sempre intercanviables. La següent molècula és el fluormetilpentè:
El nom d'aquesta molècula tant pot ser trans-2-fluor-3-metil-2-pentè, perquè els grups d'alquil que formen la cadena (per exemple metil i etil) estan en contacte gràcies al doble enllaç, o bé (Z)-2-fluor-3-metil-2-pentè, perquè els grups de prioritat més alta estan al mateix cantó del doble enllaç. El fluor és el grup amb prioritat més alta, al costat esquerre del doble enllaç i l'etil també és un grup amb prioritat alta, situat a la part dreta del doble enllaç. Els termes cis i trans també es poden usar per descriure la posició relativa dels dos substituents d'un anell: cis si és al mateix cantó i trans si és al costat contrari.
Conformacions
[modifica]Article principal: Isomerisme conformacional
L'isomerisme conformacional és una forma d'isomerisme que descriu el fenomen de molècules amb la mateixa fórmula estructural, però que tenen diferents formes a causa de les rotacions d'un o més enllaços. Les diferents conformacions poden tenir diferents energies, poden interconvertir-se, i molt rarament són isolats. Per exemple, el ciclohexà pot existir en una varietat de diferents conformacions, incloses les conformacions en forma de cadira o de vaixell; però el ciclohexà per ell mateix no pot ser mai separat. La conformació de vaixell representa una energia màxima (i no té estat de transició) entre les dues conformacions de cadira equivalents. Hi ha diverses molècules que poden ser isolades en moltes conformacions, a causa de les barreres de gran energia entre diferents conformacions. 2,2,2',2'-tetrasubstituït difenil pot entrar en aquesta última categoria.
Més definicions
[modifica]Un esteroisòmer conformacional és un estereoisòmer d'una molècula que té la configuració oposada a l'estereocentre. (exemple, R- contra S- o E- contra Z-). Això significa que els isòmers configuracionals només poden ser interconvertits trencant enllaços covalents units a l'estereocentre, per exemple, invertint les configuracions d'alguns dels estereocentres de la molècula.
Referències
[modifica]- International Union of Pure and Applied Chemistry. "stereoisomerism". Compendium of Chemical Terminology Internet edition.
- International Union of Pure and Applied Chemistry. "stereoisomerism". Compendium of Chemical Terminology Internet edition.
- International Union of Pure and Applied Chemistry. "geometric isomerism". Compendium of Chemical Terminology Internet edition.
- Columbia Encyclopedia. "Stereoisomers" in Encyclopedia.com, n.l., 2005, December 7th 2005.


