NPC1
La NPC1 és una glucoproteïna integral de membrana, de pas múltiple. Es troba localitzada en el compartiment lisosòmic / endosòmic tardà de moviment ràpid. És clau en la participació del tràfic intracel·lular del colesterol i la regulació de la seva homeòstasi.
Està codificada pel gen homònim, Npc1, que en humans, es troba localitzat al braç llarg del cromosoma 18. El gen codifica una proteïna de membrana d'un sol pas, de 1.278 aminoàcids, que després de ser traduïda és inserida a la membrana dels lisosomes i els endosomes tardans. Les mutacions en aquest gen es relacionen amb la malaltia de Niemann-Pick.
Estructura Bioquímica
[modifica]És un polipèptid glicosilat, format per aminoàcids polars i no polars. Té una seqüència senyal en els aminoàcids 1-22 i la resta de la cadena va des de l'aminoàcid 23 fins al 1278.
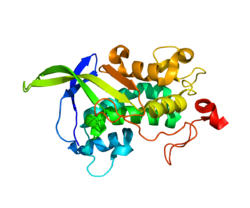
Té un domini N- terminal (NTD)soluble (fig.1), ric en cisteïna i un domini C- terminal amb un motiu(1) de di-leucina d'especial interès biològic, que es troba localitzat en els aminoàcids 1275-1278. També conté un domini SSD(2) (Sterol-Sensing) present en els aminoàcids 620-785.
- NTD:
Regió de la proteïna (232 aminoàcids) estructurada de manera que un 36% es troba en forma d'hèlix alfa (14 hèlix; 84 residus) i un 22% en forma de fulles beta (12 hebras; 52 residus). És clau en el procés de sorting del colesterol del lisosomes. La sortida de les partícules LDL dels lisosomes es produeix per endocitosi mitjançada per receptor i requereix la intervenció de la proteïna de membrana NPC1 i una altra proteïna soluble anomenada NPC2. Quan NPC2 s'uneix al colesterol aquest s'ha de transferir al domini NTD de NPC1 per acabar sortint de la cèl·lula. Aquest procés, requereix una reorientació espacial dels subdominis hèlix del NTD.
- Lligands del NTD: mantenen unides les cadenes d'aminoàcids.
- - 2 glicerols (GOL)
- - 3 N-acetil D-Glucosamina (NAG)
Un oxigen del radical de la metionina en posició 193 de la cadena A forma un pont d'hidrogen amb l'oxigen del GOL 1 i manté una interacció hidròfoba amb l'asparagina en posició 86 de la cadena A. També mantenen interaccions hidròfiles en blau amb l'aigua circumdant.
L'asparagina en posició 41 de la cadena A s'enllaça amb el GOL 2 mitjançant un pont d'hidrogen, de manera que l'H del seu radical interacciona amb un dels oxígens del GOL 2. També manté una interacció hidrofòbica amb els carbonis del radical cíclic de la fenilalanina en posició 203.
Els 3 lligands NAG es troben a la mateixa regió de la proteïna i estan associats a ella mitjançant diverses interaccions:
NAG 1: Unit a l'aspargina 222, la glicina 65 i el glutamat 110 mitjançant ponts d'hidrogen i enllaçat a la fenilalanina 66, cisteïna 109 i aspargina 222 per interaccions hidròfobes.
NAG 2: Un oxigen del radical de la Glicina 65 s'uneix al NAG 2 per pont d'hidrogen i aquest als carbonis del radical cíclic de la fenilalanina 66 mitjançant interaccions hidrofòbiques.
NAG 3: S'uneix a l'aspargina 158, aspartat 162 i a la isoleucina 245 formant interaccions hidrofòbiques però amb el radical de l'aspargina forma també un pont d'hidrogen.
Funció
[modifica]L'homeòstasi del colesterol és essencial per la funcionalitat i integritat de la cèl·lula. La distribució del colesterol a dins les cèl·lules és altament dinàmic i està ben regulada mitjançant la síntesi de novo passant pel reticle endoplasmàtic i per la captació d'esters de colesterol que circulen en el sèrum de les LDL (lipoproteïnes de baixa densitat) via receptor.
La principal estació de sortida del colesterol a dins de la cèl·lula és el LE (endosoma primerenc) i un estat intermedi és la via de tràfic endosoma/lisosoma. Dins el lumen del LE, els esters de colesterol, són hidrolitzats a colesterol lliure per lipases àcides. Un cop fora del LE poden ser conduïts a la membrana cel·lular o transferits al RE on es reesterificaran i si cal s'emmagatzemaran pel seu posterior ús. Hi ha evidències que el sòrting del colesterol es produeix mitjançant dues vies, una vesicular i una altra no vesicular. No obstant això, NPC1 i NPC2 semblen ser claus en la iniciació d'aquest procés. Mutacions en qualsevol d'aquestes dues proteïnes són la causa d'una devastadora malaltia lisosomal infantil, Niemann Pick tipus C (NPC), que es caracteritza per l'acumulació de colesterol i glicoesfingolípids al LE.
Mentre que la funció com a transportador del NPC1 segueix sent polèmica, s'han fet experiments paral·lels, que han descobert que el domini NTD del NPC1 presenta tota la capacitat d'unió als esterols i en concret, té una major capacitat d'unió amb els oxiesterols (1) que amb el colesterol. Aquest descobriment estava en contrast amb el que passava amb la proteïna NPC2, la qual tenia afinitat molt forta pel colesterol i no s'unia als oxiesterols. Mutacions en qualsevol de les dues proteïnes produïen idèntiques malalties amb la qual cosa es va concloure que funcionaven de manera conjunta exportant el colesterol. El colesterol s'uneix lentament al NPC1 i en canvi s'uneix de manera ràpida al NPC2. Els dos es sintetitzen per separat del substrat (colesterol).
(1)Oxiesterols: són anàlegs del colesterol que han estat modificats amb 24, 25 o 26 grups hidroxil i regulen les vies del colesterol.
Bibliografia/Webgrafia
[modifica]BIOLOGÍA CELULAR I MOLECULAR: Lodish, Berk, Matsudaira, Kaiser, Krieger, Scott, Zipursky, Darnell. 5a. Edición. Editorial Médica Panamericana
Articles:
- • NPC1/NPC2 function as a tag team duo to mobilize cholesterol
- Kanagaraj Subramanian* and William E. Balch*
- www.pnas.org/cgi/doi/10.1073/pnas.0808256105
- • NPC1/NPC2 function as a tag team duo to mobilize cholesterol
- • Structure of N-terminal domain of NPC1 reveals distinct subdomains for binding and transfer of cholesterol.
- Cell. 2009 Jun 26;137(7):1213-24.
- Kwon HJ, Abi-Mosleh L, Wang ML, Deisenhofer J, Goldstein JL, Brown MS, Infante RE.
- • Structure of N-terminal domain of NPC1 reveals distinct subdomains for binding and transfer of cholesterol.
Enllaços externs
[modifica]- http://www.pdb.org/pdb/explore.do?structureId=3GKJ
- http://www.uniprot.org/uniprot/O15118
- http://www.ncbi.nlm.nih.gov/pubmed/19563754?itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_RVDocSum&ordinalpos=1
- http://ligand-expo.rcsb.org/reports/G/GOL/index.html
- ↑ «Malalties que s'associen genèticament amb NPC1, vegeu/editeu les referències a wikidata».
- ↑ 2,0 2,1 2,2 GRCh38: Ensembl release 89: ENSG00000141458 - Ensembl, May 2017
- ↑ 3,0 3,1 3,2 GRCm38: Ensembl release 89: ENSMUSG00000024413 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.