Vaccí d'ADN
El vaccí d'ADN o vacuna d'ADN és una vacuna de nova generació que consisteix en la injecció directa d'ADN a través d'un plasmidi o un vector d'expressió.[1] La injecció de material genètic en un hoste viu fa que una petita quantitat de les seves cèl·lules siguin capaces de produir els productes dels gens introduïts que induiran a l'activació específica del sistema immunitari.[2]
Durant les passades dècades, s'ha produït un gran avenç en el coneixement a nivell molecular tant de microorganismes i els diferents fets que els porten a causar malalties com del sistema immunitari, que permet evitar-ho. La gran majoria de vaccins en el seu ús actual estan dirigides contra patògens que poden ser controlats eficaçment amb anticossos. Malgrat tot, l'evolució paral·lela d'aquests microorganismes, que continuen desenvolupant mecanismes de resistència contra els vaccins actuals, és també inevitable. L'eliminació de molts d'aquests nous patògens doncs, requereix noves investigacions i noves varietats de vaccí, anomenades de segona i tercera generació que siguin capaces d'activar mecanismes immunitaris més específics. Els vaccins d'ADN són un tipus de vaccins de nova generació que representen un conjunt d'estratègies innovadores per aconseguir l'activació específica de la resposta immunitària cel·lular.[3]
Història del vaccí d'ADN
[modifica]La vaccinació amb ADN plasmídic troba els seus inicis en Jon A.Wolff, que va intentar utilitzar plasmidis d'ADN com a control negatiu en experiments de transferència genètica en ratolins. El resultat d'aquestes proves va demostrar que les cèl·lules musculars són capaces d'expressar gens provinents de la injecció d'ADN plasmídic, sense haver d'utilitzar vectors virals o ADN encapsulat en liposomes.
Aquests resultats van fer plantejar la possibilitat d'utilitzar la transferència genètica amb ADN plasmídic, per a desenvolupar vaccins. Posteriorment es va treballar amb la inoculació d'ADN que codifiqués l'hormona de creixement humà (hGH, de l'anglès human growth hormone), i l'enzim α1-antitripsina (A1A), i es va observar que es generaven anticossos contra ambdues hormones, en l'individu a qui s'havia inoculat l'ADN. Això va demostrar la possibilitat de realitzar una immunització genètica mitjançant la inoculació d'ADN.[4]
Més endavant, el 1993, es varen injectar plasmidis d'ADN que codificaven proteïnes del virus de la grip en ratolins, i es va veure que, si se'ls exposava a una soca mortal del virus, quedaven totalment immunitzats.[5][6]
A partir dels resultats obtinguts en aquests experiments es va començar a investigar per al desenvolupament de vaccins basats en ADN. Els vaccins d'ADN utilitzen una metodologia relativament simple que ha obert una nova era en la immunologia.
Estructura i formació
[modifica]Els vaccins d'ADN estan formats per un plasmidi bacterià en el qual s'ha inserit la seqüència d'ADN que codifica l'antigen o proteïna que ens interessa. Aquest plasmidi és la unitat funcional dels vaccins d'ADN[5] i està format per dues unitats:
- Antigen: format pel promotor, la seqüència d'ADN en qüestió i un senyal de poliadenització. El promotor és una seqüència curta d'ADN, normalment d'origen víric, on hi ha factors de transcripció que ajuden a guiar i activar les polimerases. El senyal de poliadenització ajuda a estabilitzar la transcripció perquè el gen no sigui degradat.
- Unitat de producció: són seqüències bacterianes necessàries per a l'amplificació i selecció del plasmidi.
La construcció de plasmidis bacterians amb fragments per a un vaccí s'aconsegueix utilitzant la tecnologia d'ADN recombinant. Un cop construït, es transformen bacteris competents amb el plasmidi vaccí (com per exemple E. coli prèviament tractats amb una mescla de cations divalents per permeabilitzar-los temporalment), que permetrà la còpia ràpida gràcies al creixement bacterià. La petita població que adquireix el plasmidi s'identifica amb marcadors selectius que donen resistència a antibiòtics com l'ampicil·lina o la kanamicina. Llavors es purificarà el plasmidi dels bacteris, separant-lo de l'ADN molt més llarg que forma el cromosoma i d'altres impureses bacterianes. Aquest ADN purificat és el que s'utilitzarà de vaccí.
Mètodes d'administració
[modifica]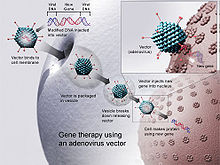
La introducció de vaccins d'ADN a teixits animals és un tema important de recerca recent. Cal tenir en compte que un vaccí d'ADN ha de ser capaç d'introduir-se a la cèl·lula eficientment i expressar l'antigen que té en el seu codi genètic. A més, el vaccí ha d'alertar el sistema immunitari perquè iniciï una resposta immunitària. Per això, actualment s'intenta administrar el vaccí directament a cèl·lules presentadores d'antigen (APCs). També s'ha estudiat que modular la resposta immunitària amb adjuvants (substàncies immunoestimulants com el monofosforil lípid A) dona resultats positius, depenent de la ruta d'administració. Les barreres que dificulten la introducció eficient dels vaccins són les endonucleases del medi extracel·lular i el medi de l'endosoma, la vesícula on l'ADN és transportat dins la cèl·lula.
En definitiva, les estratègies actuals són mètodes d'administració que permetin fer passar l'ADN per les barreres biològiques, arribin a cèl·lules del sistema immunitari i s'introdueixin al nucli per expressar-se en una proteïna.
S'han estudiat diversos mètodes d'administració. Cadascun té els seus avantatges i inconvenients; depenent de quin s'utilitzi es requereix més o menys quantitat d'ADN i s'injecta a diferents tipus de teixits.[7]
Una de les maneres d'introduir el plasmidi en les cèl·lules diana és la injecció salina amb sèrum fisiològic mitjançant una agulla hipodèrmica, de forma intramuscular o intradermal, alliberant l'ADN a l'espai extracel·lular.[8] Per tal que llavors el plasmidi entri a les cèl·lules es fan servir tècniques com l'electroporació, que augmenta la permeabilitat de la membrana cel·lular. Es necessiten relativament grans quantitats d'ADN, ja que haurà de travessar barreres físiques com la làmina basal i teixit connectiu abans d'entrar a la cèl·lula diana. La resposta immunitària resultant dependrà de molts factors com l'edat, el sexe, el tipus de fibra muscular, la velocitat d'injecció i el tipus d'agulla.
Un altre mètode força utilitzat és la biolística, usant microesferes de metall (or o tungstè) cobertes del plasmidi, usant heli comprimit per accelerar i bombardejar l'ADN directament dins la cèl·lula. En aquest cas no es necessitarà tanta quantitat d'ADN.
S'han estudiat tècniques alternatives d'administració mitjançant polímers biodegradables, liposomes o virosomes que cobreixen el plasmidi per entrar dins la cèl·lula.[9]
Efectes en la resposta immunitària
[modifica]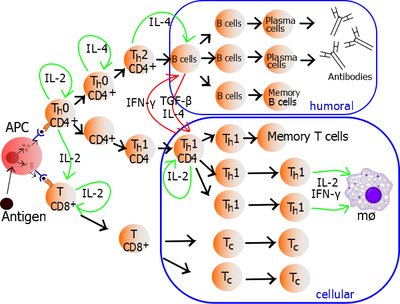
Un dels grans avantatges de la vaccinació d'ADN és la capacitat de limfoproliferació i d'estimular diferents respostes de limfòcits T, tant limfòcit T citotòxic com limfòcits T col·laboradors en patró Th1 o Th2. Així doncs, la vaccinació acaba generant molts patrons diferents de citocines i també de resposta immunitària innata. S'ha comprovat que el mètode d'administració del vaccí determina la resposta. Per exemple, la injecció salina tendeix a generar una resposta Th1 mentre que la biolística indueix a una resposta Th2.
La inducció de la citotoxicitat mitjançant vaccins d'ADN és molt semblant a la inducció a través d'una infecció natural. Com que les cèl·lules T citotòxiques reconeixen pèptids citosòlics presentats en MHC de classe I, codificar les proteïnes de l'ADN del vaccí perquè vagin directament al reticle endoplasmàtic o bé afegir-hi seqüències d'ubiquitinació són maneres d'augmentar la resposta citotòxica.[11]
Respecte a la resposta humoral, la diferent producció d'anticossos dependrà de diversos factors com ara el mètode d'administració, la dosi i el tipus d'antigen codificat. Un vaccí d'ADN produeix una immunització de llarga durada, encara que els efectes (producció d'anticossos, per exemple) són més lents que si es tractés d'una infecció natural.
Modulació de la resposta immunitària causada pel vaccí
[modifica]El vaccí d'ADN té la capacitat d'induir tant una resposta de perfil Th1 com Th2, i consegüentment produir anticossos o cèl·lules citotòxiques. El perfil de la resposta immunitària que genera el vaccí es pot modular mitjançant «adjuvants genètics», gens que codifiquen citocines i altres molècules reguladores del sistema immunitari. Aquests adjuvants es poden administrar de diverses maneres, com ara a través d'un altre plasmidi separat del que codifica l'immunogen o bé dins del mateix plasmidi.
Molts patògens tenen més seqüències CpG (citosina-fosfat-guanina) al seu ADN que els mamífers i aquesta característica és un factor estimulant del sistema immunitari. Per aquest motiu es poden usar plasmidis amb alta freqüència de CpG com a adjuvants.[12]
Avantatges i inconvenients
[modifica]Els vaccins d'ADN tenen una sèrie d'avantatges respecte als vaccins convencionals:[1][5][9]
- Tenen un cost relativament baix si es produeixen grans quantitats, ja que tenen un mètode de purificació força senzill i efectiu.
- Són molt més estables que els vaccins atenuats, inactivats o de partícules proteiques. Això redueix el cost d'emmagatzematge i en facilita la difusió en països en vies de desenvolupament.
- Només s'expressa l'antigen que es vol. Com en els vaccins de partícules proteiques i a diferència dels vaccins atenuats i inactivats, només s'expressa l'antigen seleccionat prèviament com a patogen i capaç de produir immunitat efectiva.
- Són molt segures: els vaccins poden obtenir-se amb un grau de puresa molt elevat sense augmentar gaire els costos, cosa que permet més seguretat, i no poden tornar-se virulents.
- La immunitat és doble: es presenta l'antigen en complex d'histocompatibilitat principal (MHC, de l'anglès major histocompatibility complex) de classe I i de classe II, activant tant la resposta humoral com la citotòxica.
Tot i així, tenen els seus inconvenients, per la qual cosa encara estan en fase d'estudi:[1][5][9]
- Estan limitats a proteïnes, és a dir, no poden induir la immunitat davant antígens no proteics com ara els polisacàrids.
- Segons la via d'administració, es poden obtenir diferents reaccions a un mateix plasmidi.
- Hi pot haver una tolerància a l'antigen, és a dir, que el cos hagi reconegut la proteïna com a pròpia i no es desenvolupi la resposta immunitària cercada amb el vaccí.
- Es pot produir un procés atípic, com ara l'expressió de l'antigen en teixits erronis o la síntesi de proteïnes anòmales.
- Es pot generar immunosupressió, inflamacions cròniques i altres malalties autoimmunitàries.
- Si bé s'ha tingut èxit en la investigació dels vaccins d'ADN en petits animals, en grans animals i en humans encara no s'han obtingut resultats satisfactoris.
Referències
[modifica]- ↑ «Vaccí d'ADN». Gran Enciclopèdia Catalana. Barcelona: Grup Enciclopèdia Catalana.
- ↑ Ingraham, John L. Introducción a la microbiología. Editorial Reverté, 1998 ISBN 84-291-1871-3
- ↑ Arturo Reyes Sandoval, Aguinaldo R.Pinto «Vacunas de DNA». TEMAS DE ACTUALIDAD EM MICROBIOLOGÍA, AMBIENTE Y SALUD., 2002, p. 327-342.
- ↑ 5,0 5,1 5,2 5,3 Hurtado ML, Ramos A, López A. «Vacunas de ADN: ¿Vacunas de tercera generación?», http://e-ciencia.com/blog/divulgacion/vacunas-de-dna-%C2%BFvacunas-de-tercera-generacion/ Arxivat 2012-10-19 a Wayback Machine.
- ↑ Javier Mota-Sánchez, Dr «Vacunas de ADN: inducción de la respuesta inmunitaria». salud pública de México, 51, 2009./
- ↑ Alarcon JB, Waine GW, McManus DP «DNA vaccines: technology and application as anti-parasite and anti-microbial agents». Adv. Parasitol., 42, 1999, pàg. 343–410. DOI: 10.1016/S0065-308X(08)60152-9. PMID: 10050276.
- ↑ Fynan, E.F.; Webster, R.G.; Fuller, D.H.; Haynes, J.R.; Santoro, J.C.; Robinson, H.L. «DNA vaccines: protective immunizations by parenteral, mucosal, and gene-gun inoculations». Proc Natl Acad Sci USA, 90, 24, 1993, pàg. 11478–82. DOI: 10.1073/pnas.90.24.11478. PMC: 48007. PMID: 8265577.
- ↑ 9,0 9,1 9,2 Alpar, H. Oya; Papanicolaou, Irene; Bramwell, Vincent W. «Strategies for DNA vaccine delivery» (en anglès). Expert Opinion on Drug Delivery, 2, 5, 9-2005, pàg. 829–842. DOI: 10.1517/17425247.2.5.829. ISSN: 1742-5247. PMID: 16296781 [Consulta: 31 maig 2022].
- ↑ Rang, H. P.. Pharmacology. Edinburgh: Churchill Livingstone, 2003, p. 223. ISBN 0-443-07145-4.
- ↑ Rodriguez, F.; Zhang, J.; Whitton, J.L. «DNA immunization: ubiquitination of a viral protein enhances cytotoxic T-lymphocyte induction and antiviral protection but abrogates antibody induction.». Journal of Virology, 71, 11, 1997, pàg. 8497–503. PMC: 192313. PMID: 9343207 [Consulta: 21 novembre 2007].
- ↑ Doria-Rose, Nicole A.; Haigwood, Nancy L. «DNA vaccine strategies: candidates for immune modulation and immunization regimens» (en anglès). Methods, 31, 3, 11-2003, pàg. 207–216. DOI: 10.1016/s1046-2023(03)00135-x. ISSN: 1046-2023. PMID: 14511953 [Consulta: 31 maig 2022].