DNA vakcína

DNA vakcína je typ vakcíny, která transfekuje specifickou genetickou informaci DNA do antigenu prezentujících buněk jako mechanismus k vyvolání imunitní odpovědi.[1][2]
DNA vakcíny fungují tak, že se podá v injekci geneticky upravený plazmid obsahující sekvenci DNA antigenu (antigenů), proti kterému je hledána imunitní odpověď, takže buňky přímo produkují antigen, čímž způsobují ochrannou imunologickou odpověď.[3] DNA vakcíny mají oproti konvenčním vakcínám teoretické výhody, včetně „schopnosti vyvolat širší škálu typů imunitní odpovědi“.[4] Několik DNA vakcín bylo testováno pro veterinární použití.[3] V některých případech byla u zvířat vytvořena ochrana před nemocemi, v jiných nikoli.[3] Stále probíhá výzkum ohledně přístupu k léčení virových, bakteriálních a parazitních onemocněních lidí a také ohledně možností léčby různých nádorů.[4] V srpnu 2021 vydaly indické úřady povolení pro nouzové použití společnosti ZyCoV-D. Vakcína byla vyvinuta společností Cadila Healthcare a jedná se o první DNA vakcínu schválenou pro lidi.[5]
Historie
[editovat | editovat zdroj]Konvenční vakcíny obsahují buď specifické antigeny z patogenu, nebo oslabené viry, které aktivují imunitní odpověď u očkovaného člověka. DNA vakcíny patří mezi genetické vakcíny, protože obsahují genetickou informaci (DNA nebo RNA), která podněcuje buněčnou produkci (biosyntézu proteinu) antigenu. DNA vakcíny obsahují DNA, která podněcuje k vytváření specifických antigenů z patogenu. DNA je do těla vpravena injekčně a následně přijata buňkami, jejichž normální metabolické procesy syntetizují proteiny založené na genetickém kódu plazmidu, který přijaly. Protože tyto proteiny obsahují části aminokyselinových sekvencí, které jsou charakteristické pro bakterie nebo viry, jsou rozpoznány jako cizorodé. Poté, co jsou zpracovány hostitelskými buňkami a objeví se na jejich povrchu, imunitní systém je rozpozná. To vede k imunitní reakci.[6][7] Alternativně může být DNA zapouzdřena v proteinu pro usnadnění vstupu do buňky.
V roce 1983 Enzo Paoletti a Dennis Panicali z newyorského ministerstva zdravotnictví vymysleli strategii výroby rekombinantních DNA vakcín pomocí genetického inženýrství transformací obyčejné vakcíny proti neštovicím na vakcíny, které mohou vytváří ochranu proti dalším nemocem.[8] Změnili DNA viru kravských neštovic vložením genu z jiných virů (jmenovitě viru Herpes simplex, hepatitidy B a chřipky).[9][10] V roce 1993 Jeffrey Ulmer a spolupracovníci z Merck Research Laboratories předvedli, jak přímá injekce plazmidové DNA nesoucí chřipkový antigen do myší vytvořila u zvířat ochranu před následnou experimentální infekcí virem chřipky.[11] V roce 2016 se začala testovat DNA vakcína proti viru Zika na lidech v americkém Národním institutu pro zdraví (NIH). Klinická studie byla naplánována tak, aby zahrnovala až 120 subjektů ve věku od 18 do 35 let. Nezávisle na této studii zahájily společnosti Inovio Pharmaceuticals a GeneOne Life Science testy další DNA vakcíny proti Zika v Miami. Vakcína amerického NIH se aplikuje do horní části paže vysokotlakou injekční stříkačkou. Výroba vakcín ve větších objemech zůstala k srpnu 2016 nevyřešena.[12] V únoru 2014 probíhaly klinické testy DNA vakcín proti HIV.[13]
V srpnu 2021 daly indické úřady nouzový souhlas vakcíně ZyCoV-D. Je to první DNA vakcína proti nemoci covid-19 vyvinutá společností Cadila Healthcare.[5]
Aplikace
[editovat | editovat zdroj]Do května roku 2021 nebyly ve Spojených státech schváleny žádné vakcíny DNA pro použití u lidí. Několik experimentálních studií vedlo k úspěšnému vytvoření dostatečně silné ochrany před různými nemocemi, užitečnost těchto vakcín je však stále třeba prokázat na dalších klinických studiích u lidí. Veterinární DNA vakcína proti viru západonilské horečky na ochranu koní byla úspěšně schválena.[14] Imunizace pomocí DNA je mimo jiné zkoumána v souvislosti s vývojem sér proti jedu.[1] DNA imunizace může být použita také jako technologická platforma pro indukci monoklonálních protilátek.[2]
Výhody
[editovat | editovat zdroj]- Žádné riziko infekce[7]
- Prezentace antigenu molekulami MHC I. i II. třídy[7]
- Polarizace odpovědi T-buněk směrem k typu 1 nebo typu 2[7]
- Imunitní odpověď zaměřená na požadovaný antigen
- Snadný vývoj a výroba[7]
- Stabilita při skladování a přepravě
- Nízké náklady
- Není potřeba syntézy peptidů, exprese a purifikace rekombinantních proteinů a použití toxických přídavných látek[15]
- Dlouhodobá životnost imunogenu[6]
- In vivo exprese genu zajišťuje, že se protein více podobá normální eukaryotické struktuře s doprovodnými posttranslačními modifikacemi.[6]
Nevýhody
[editovat | editovat zdroj]- Použití omezeno na proteinové imunogeny (není vhodné pro antigeny, které nejsou založeny na proteinech, jako jsou bakteriální polysacharidy)
- Riziko atypického zpracování bakteriálních a parazitních proteinů[7]
- Riziko transfekce necílových buněk (například mozkových) při podávání nanočástic plazmidové DNA pomocí nosního spreje.[16]
- Riziko křížové kontaminace při výrobě různých typů živých vakcín ve stejném zařízení
Plazmidové vektory
[editovat | editovat zdroj]Vektorový design
[editovat | editovat zdroj]DNA vakcíny vyvolávají nejlepší imunitní odpověď, když jsou použity vektory s vysokou expresí. Jedná se o plazmidy, které se obvykle skládají ze silného virového promotoru, který řídí in vivo transkripci a translaci cílového genu (nebo komplementární DNA).[17] Intron A může být někdy zahrnut pro zlepšení stability mRNA, a tedy pro zvýšení exprese proteinu.[18] Plazmidy také zahrnují silný polyadenylační/transkripční terminační signál, jako jsou hovězí růstový hormon nebo králičí beta-globulinové polyadenylační sekvence.[6][7][19] Polycistronické vektory (s více cílovými geny) jsou někdy vytvářeny tak, aby exprimovaly více než jeden imunogen nebo exprimovaly imunogen a imunostimulační protein.[20]
Protože plazmid – nesoucí relativně krátký genetický kód do přibližně 200 kbp – je „vehikulum“ neboli nosič, ze kterého je exprimován imunogen, je nezbytná optimalizace vektorového designu pro maximální expresi proteinu.[20] Jedním ze způsobů zvýšení proteinové exprese je optimalizace využití kodonů patogenních mRNA pro eukaryotické buňky. Patogeny mají často odlišný obsah GC než cílový druh, takže změna genové sekvence imunogenu tak, aby odrážela kodony běžněji používané u cílového druhu, může zlepšit jeho expresi.[21]
Dalším hlediskem je výběr promotoru. Promotor SV40 byl konvenčně používán, dokud výzkum neprokázal, že vektory řízené promotorem viru Rousova sarkomu (RSV) měly mnohem vyšší míru exprese.[6] V poslední době byla exprese a imunogenicita dále zvýšena v modelových systémech použitím bezprostředního časného promotoru cytomegaloviru (CMV) a retrovirového cis-regulačního transkripčního elementu.[22] Další modifikace pro zlepšení rychlosti exprese zahrnují vkládání zesilujících sekvencí, syntetických intronů, adenovirových tripartitních vedoucích (TPL) sekvencí a modifikací polyadenylačních a transkripčních terminačních sekvencí.[6] Příkladem DNA vakcínového plazmidu je pVAC, který používá promotor SV40.
Fenomén strukturální nestability je zvláště rizikový při výrobě plazmidů, DNA vakcín a genové terapii.[23] Doplňkové informace náležející k plazmidovému základnímu řetězci se mohou podílet na široké škále jevů strukturální nestability. Dobře známé katalyzátory genetické nestability jsou přímé, invertované a tandemové repetice, které se vyskytují v mnoha komerčně dostupných klonovacích a expresních vektorech. Redukcí nebo úplnou eliminací vnějších genových sekvencí hlavního řetězce by tedy byla výrazně snížena náchylnost k takovým událostem a následně celkový rekombinantní potenciál plazmidu.[24]
Mechanismus plazmidů
[editovat | editovat zdroj]Jakmile se plazmid vloží do transfekovaného buněčného jádra, dochází k zápisu peptidového řetězce cizího antigenu. Na svém povrchu buňka zobrazuje cizorodý antigen s molekulami histokompatibilního komplexu (MHC) třídy I a třídy II. Buňka prezentující antigen poté putuje do lymfatických uzlin a prezentuje antigenní peptid a kostimulační molekulu T-lymfocytu, čímž spouští imunitní odpověď.[25]
Design očkovací vložky
[editovat | editovat zdroj]Imunogeny mohou být zacíleny do různých buněčných kompartmentů, aby se zlepšily reakce protilátek nebo cytotoxických T-lymfocytů. Vylučované antigeny nebo antigeny vázané na plazmatickou membránu jsou účinnější při vyvolávání imunitních odpovědí než cytosolové antigeny. Imunitní odpověď cytotoxických T-buněk lze posílit cílením na antigeny pro cytoplazmatickou degradaci a následným vstupem do hlavního histokompatibilního komplexu (MHC) třídy I.[7] Toho je obvykle dosaženo přidáním N-koncových ubiquitinových signálů.[26][27][28]
Konformace proteinu může také ovlivňovat protilátkové odpovědi. „Uspořádané“ struktury (jako jsou virové částice) jsou účinnější než neuspořádané struktury.[29] Řetězce minigenů (nebo epitopů MHC třídy I) z různých patogenů zvyšují cytotoxické reakce T-buněk na některé patogeny, zvláště pokud je zahrnut také epitop TH.[7]
Podání
[editovat | editovat zdroj]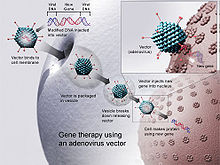
DNA vakcíny byly zaváděny do živočišných tkání mnoha způsoby. V roce 1999 byly dva nejoblíbenější přístupy injekce DNA ve fyziologickém roztoku: pomocí standardní hypodermické jehly nebo pomocí aplikace genové zbraně.[30] V průběhu let bylo zdokumentováno několik dalších technik.
Injekce fyziologického roztoku
[editovat | editovat zdroj]Injekce ve fyziologickém roztoku se normálně provádí nitrosvalově do kosterního svalu nebo intradermálně (ID) a doručuje DNA do extracelulárních prostor. Tomu lze napomoci buď 1) elektroporací ;[31] 2) dočasným poškozením svalových vláken myotoxiny, jako je bupivakain ; nebo 3) použitím hypertonických fyziologického roztoku nebo sacharózy.[6] Imunitní reakce na tuto metodu mohou být ovlivněny faktory, jako je typ jehly,[15] zarovnání jehly, rychlost injekce, objem injekce, typ svalu, věk, pohlaví a fyziologický stav příjemce.[6]
Genová zbraň
[editovat | editovat zdroj]Princip aplikace pomocí genové pistole spočívá v balistickém urychlení plazmidové DNA (pDNA), která je vstřelena do zlatých nebo wolframových mikročástic, které následně přenášejí genetickou informaci do cílových buněk. Jako urychlovač je použito stlačené hélium.[6][20]
Podání pomocí povrchu sliznice
[editovat | editovat zdroj]Alternativy zahrnovaly aerosolovou instilaci holé DNA na slizniční povrchy, jako je nosní a plicní sliznice[20] a lokální podávání pDNA do oka[32] a vaginální sliznice.[20] Doručení na povrch sliznice bylo také dosaženo použitím kationtových lipozomových preparátů DNA,[7] biodegradabilních mikrokuliček,[20][33] atenuovaných bakterií Salmonalla,[34] vektorů Shigella nebo Listeria orálním podáním do střevní sliznice[35] a rekombinantních adenovirových vektorů.[20]
Polymerový nosič
[editovat | editovat zdroj]Pro podání DNA vakcíny je použito hybridní vehikulum složené z bakteriálních buněk a syntetických polymerů. Vnitřní jádro Escherichia coli a vnější plášť z poly(beta-aminoesteru) fungují synergicky pro zvýšení účinnosti tím, že řeší překážky spojené s dodáním antigen prezentujících buněk, které zahrnují buněčnou absorpci a osvojení, fagozomální únik a vnitrobuněčnou koncentraci jednotlivých složek. Testováním na myších bylo zjištěno, že hybridní vektor vyvolává imunitní odpověď.[36][37]
ELI Imunizace
[editovat | editovat zdroj]Dalším přístupem k DNA vakcinaci je imunizace expresní knihovnou (ELI). Pomocí této techniky mohou být potenciálně všechny geny z patogenu dodány najednou, což může být užitečné pro patogeny, které je obtížné oslabit nebo kultivovat.[6] ELI lze použít k identifikaci, které geny vyvolávají ochrannou odpověď. Tato technika byla testována pomocí bakterií Mycoplasma pulmonis, myším plicním patogenem s relativně krátkým genomem. I částečné expresní knihovny mohou vyvolat ochranu před následnou pokusnou nákazou.[38]
| Způsob podání | Formulace DNA | Cílová tkáň | Množství DNA | |
|---|---|---|---|---|
| Parenterální | Injekce (hypodermická jehla) | Vodný roztok ve fyziologickém roztoku | IM (kosterní); ID ; (IV, subkutánně a intraperitoneálně s různou úspěšností) | Velké množství (přibližně 100-200 μg) |
| Genová zbraň | Zlaté kuličky potažené DNA | ED (kůže břicha); vaginální sliznice; chirurgicky obnažené svaly a další orgány | Malé množství (až 16 ng) | |
| Tryskové vstřikování (tryskový injektor) | Vodný roztok | ED | Velmi vysoké množství (až 300 μg) | |
| Místní aplikace | Vodný roztok | Oční; intravaginální | Malé množství (do 100 μg) | |
| Zprostředkování cytofektinem | Lipozomy (kationtové); mikrokuličky; rekombinantní adenovirové vektory; atenuovaný Shigella vektor; aerosolizované kationtové lipidové formulace | IM; IV (pro systémovou transfekci tkání); intraperitoneální; orální imunizace střevní sliznice; nosní/plicní sliznice | variabilní | |
| Způsob podání | Výhody | Nevýhody |
|---|---|---|
| Nitrosvalová nebo nitrokožní injekce |
|
|
| Genová zbraň |
|
|
| Tryskové vstřikování |
|
|
| Podání zprostředkované lipozomy |
|
|
Dávkování
[editovat | editovat zdroj]Způsob podávání určuje dávku potřebnou ke zvýšení účinné imunitní odpovědi. Injekce fyziologického roztoku vyžadují různá množství DNA, od 10 μg až 1 mg, zatímco dávky pomocí genových zbraní vyžadují 100 až 1000krát méně DNA.[39] Obecně je vyžadováno pouze 0,2 μg – 20 μg a dokonce bylo zjištěno, že v některých případech může stačit pouze 16 ng.[6] Tato množství potřebné DNA se liší podle druhu. Myši například potřebují přibližně 10krát méně DNA než primáti.[7] Injekce fyziologického roztoku vyžadují více DNA, protože DNA je dodávána do extracelulárních prostorů cílové tkáně (normálně svalu), kde musí překonat fyzické bariéry (jako je bazální lamina a velké množství pojivové tkáně), předtím, než je absorbována cílovou buňkou. Doručování pomocí genových zbraní vtlačuje DNA přímo do buněk, což vede k menšímu „plýtvání“.[6][7]
Imunitní reakce
[editovat | editovat zdroj]Odpovědi pomocných T lymfocytů
[editovat | editovat zdroj]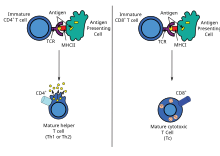
Imunizace pomocí DNA může vyvolat více odpovědí T H buněk, včetně lymfoproliferace a generování různých cytokinových profilů. Hlavní výhodou DNA vakcín je snadnost, s jakou s nimi lze manipulovat, aby ovlivnily typ pomocných T-buněk za účelem odpovědi TH1 nebo TH2.[40] Každý typ odpovědi má odlišné vzorce exprese lymfokinů a chemokinů, specifické typy imunoglobulinů, vzorce přenosu lymfocytů a typy vrozených imunitních odpovědí.
Další typy pomocných T-lymfocytů
[editovat | editovat zdroj]Typ pomocných T-buněk je ovlivněn způsobem dodání a typem exprimovaného imunogenu, stejně jako zacílením na různé lymfoidní kompartmenty.[6][41] Obecně platí, že injekce jehlou fyziologického roztoku (buď IM nebo ID) mají tendenci indukovat reakce TH1, zatímco aplikace genové pistole vyvolávají reakce TH2.[40][41] To platí pro intracelulární antigeny a antigeny vázané na plazmatickou membránu, ale ne pro vylučované antigeny, které, jak se zdá, generují odpovědi TH2, bez ohledu na způsob podání.[42]
Obecně je typ vyvolané pomocné T-buňky stabilní v průběhu času a nemění se během nebo po následných imunizacích, které by normálně vyvolaly opačný typ odpovědi.[40][41] V roce 1995 však vědci zkoušeli[17] imunizovat a posílit myši pomocí pDNA obsahující cirkumsporozoitový protein myšího malarického parazita Plasmodium yoelii (PyCSP) a zjistili, že původní odpověď TH2 se po posílení změnila na odpověď TH1.
Základ pro různé typy pomocných T-lymfocytů
[editovat | editovat zdroj]Zatím není jasné, jak přesně tyto metody vylučování různých forem antigenu a pomocných T-buněk fungují. Předpokládalo se, že relativně velké množství DNA použité při nitrosvalové injekci je zodpovědné za vyvolání odpovědi TH1. Důkazy však neprokazují žádné rozdíly v závislosti na dávce a typu výsledné TH odpovědi.[40] Typ vyvolaných pomocných T-buněk je určen odlišným stavem antigen prezentujících buněk. Dendritické buňky se mohou odlišovat vylučováním IL-12 (který podporuje vývoj buněk TH1) nebo IL-4 (který podporuje reakce TH2).[43] pDNA injektovaná jehlou je endocytována do dendritické buňky, která je pak stimulována k diferenciaci pro produkci cytokinu TH1 (IL-12),[44] zatímco genová zbraň vstřeluje DNA přímo do buňky, čímž se obchází stimulace TH1.
Praktické využití pomocných polarizovaných T-lymfocytů
[editovat | editovat zdroj]Polarizace pomocných T-buněk je užitečná při ovlivňování alergických reakcí a autoimunitních onemocnění. U autoimunitních onemocnění je cílem změnit autodestruktivní odpověď TH1 (s přidruženou aktivitou cytotoxických T buněk) na nedestruktivní odpověď TH2. Toho bylo úspěšně při pokusu v preklinických modelech[7] zabránit onemocnění pomocí primingu a získat požadovaný typ odpovědi. Jedná se o relativně úspěšnou metodu změny typu odpovědi i v případě již probíhající nemoci.[45]
Cytotoxické reakce T-lymfocytů
[editovat | editovat zdroj]Jednou z výhod DNA vakcín je, že jsou schopny uměle vyvolat cytotoxické T lymfocyty (CTL) bez rizika spojeného s živými vakcínami. CTL reakce mohou být vyvolány proti imunodominantním a imunorecesivním CTL epitopům,[46] stejně jako subdominantním CTL epitopům,[33] způsobem, který vypadá, že napodobuje přirozenou infekci. To se může ukázat jako užitečný nástroj při hodnocení CTL epitopů a jejich role při poskytování imunity.
Cytotoxické T-buňky rozpoznávají malé peptidy (8-10 aminokyselin) mezi molekulami MHC I. třídy.[47] Tyto peptidy jsou odvozeny z cytosolických proteinů, které jsou degradovány a přenášeny do vznikající molekuly MHC třídy I v endoplazmatickém retikulu (ER).[47] Zacílení genových produktů přímo na ER (přidáním ER inzerční signální sekvence na N-konci) by tedy mělo zvýšit CTL reakce. Toto bylo úspěšně prokázáno u rekombinantních virů vaccinia exprimujících proteiny chřipky.[47] Tento princip by však měl být použitelný i pro DNA vakcíny. Ukázalo se, že cílení antigenů na intracelulární degradaci (a tedy vstup do dráhy MHC I. třídy) přidáním signálních peptidů ubiquitinu nebo mutací jiných signálních peptidů je účinné při zvyšování CTL odpovědí.[27]
Reakce CTL mohou být zesíleny spojením očkování s povzbuzujícími molekulami, jako jsou B7-1 nebo B7-2 určené pro DNA vakcíny proti chřipkovému nukleoproteinu[46][48] nebo GM-CSF pro DNA vakcíny proti myšímu modelu malárie P. yoelii[49] Ukázalo se, že spojení vakcinace s plazmidy nesoucími stimulační molekuly IL-12 a TCA3 zvyšuje aktivitu CTL proti HIV-1 a chřipkovým nukleoproteinovým antigenům.[48][50]
Humorální (protilátková) imunita
[editovat | editovat zdroj]
Imunitní protilátkové reakce vyvolané vakcinací DNA jsou ovlivněny mnoha proměnnými, včetně typu antigenu; umístění antigenu (tj. intracelulární vs. secernovaný); počet a četnost imunizačních dávek; místo a způsob podání antigenu.
Kinetika protilátkové odpovědi
[editovat | editovat zdroj]Protilátkové reakce po jedné injekci DNA mohou trvat mnohem déle než po jedné injekci rekombinantního proteinu. Protilátkové reakce proti obalovému proteinu viru hepatitidy B (HBV) (HBsAg) se udržely až 74 týdnů bez žádného dalšího posílení a celoživotní zachování ochranné reakce na chřipkový hemaglutinin bylo prokázáno u myší po vstřelení genu pomocí genové zbraně.[51] Buňky vylučující protilátky (ASC) migrují do kostní dřeně a sleziny za účelem dlouhodobé produkce protilátek a obvykle se tam usazují po jednom roce.[51]
Srovnání protilátkových odpovědí generovaných přirozenou (virovou) infekcí, imunizací rekombinantním proteinem a imunizací pDNA jsou shrnuta v tabulce 4. Protilátková odpověď vyvolaná pomocí DNA se vyvíjí mnohem pomaleji, než když dojde k přirozené infekci nebo imunizaci rekombinantním proteinem. K dosažení maximálních titrů u myší může být zapotřebí až 12 týdnů, i když posílení může čas zkrátit. Tato odpověď je pravděpodobně způsobena nízkými hladinami vylučovaného antigenu během několika týdnů. DNA vakcína vylučující protein obsahující malý a střední virový obal HBV byla injektována dospělým s chronickou hepatitidou. Vakcína vedla ke specifické produkci interferonu gama buněk. Vyvinuly se také specifické T-buňky pro antigeny proteinů obsahujících střední virový obal. Imunitní odpověď pacientů však nebyla dostatečně silná, aby zvládla infekci HBV.[52]
| Způsob imunizace | |||
|---|---|---|---|
| DNA vakcína | Rekombinantní protein | Přirozená infekce | |
| Množství indukujícího antigenu | ng | μg | ? (ng-μg) |
| Trvání výskytu antigenu | několik týdnů | < 1 týden | několik týdnů |
| Kinetika protilátkové odpovědi | pomalý vzestup | rychlý vzestup | rychlý vzestup |
| Počet inokulací pro získání IgG s vysokou aviditou a migrace ASC do kostní dřeně | jeden | dva | jeden |
| Ab izotyp (myší modely) | C'-závislý nebo C'-nezávislý | C'-závislý | C'-nezávislý |
Kromě jiného jsou titry specifických protilátek vyvolaných DNA vakcinací nižší než titry získané po vakcinaci rekombinantním proteinem. Protilátky vyvolané imunizací DNA však vykazují bližší vztah k nativním epitopům než protilátky indukované rekombinantním proteinem. Jinými slovy, imunizace DNA vyvolává kvalitativně lepší odpověď. Protilátky bývají vyvolány již po jedné vakcinaci DNA, zatímco vakcinace rekombinantními proteiny obecně vyžaduje posílení. DNA imunizace může být použita ke zkreslení TH profilu imunitní odpovědi a tím i izotypu protilátky, což není možné ani u přirozené infekce, ani u imunizace rekombinantním proteinem. Protilátkové reakce generované pomocí DNA jsou užitečné i jako přípravný nástroj. Mohou být například pomocí nich vytvořeny polyklonální a monoklonální protilátky, které jsou následně použity jako činidlo.
Mechanistický základ imunitních reakcí vyvolaných DNA
[editovat | editovat zdroj]Mechanismus příjmu DNA
[editovat | editovat zdroj]Když byla absorpce DNA a následná exprese poprvé prokázána in vivo ve svalových buňkách,[53] byly tyto buňky považovány za jedinečné díky své rozsáhlé síti T-tubulů. Pomocí elektronové mikroskopie bylo zjištěno, že absorpci DNA usnadňují caveolae (neboli jamky nepotažené klatrinem).[54] Následný výzkum odhalil, že další buňky (jako jsou keratinocyty, fibroblasty a epiteliální Langerhansovy buňky) by také mohly vstřebávat DNA.[45][55] Mechanismus samotného vstřebávání DNA není znám.
Dominují dvě teorie – že in vivo absorpce DNA probíhá nespecificky, metodou podobnou fago – nebo pinocytóze[20] nebo prostřednictvím specifických receptorů.[56] Ty mohou zahrnovat 30kDa povrchový receptor nebo makrofágové scavenger receptory.30kDa povrchový receptor se specificky váže na fragmenty DNA o velikosti 4500 bp a nachází se na profesionálních APC a T-buňkách. Makrofágové scavenger receptory se vážou na různé makromolekuly, včetně polyribonukleotidů, a patří tedy mezi kandidáty pro příjem DNA.[56][57] Receptorem zprostředkovaný příjem DNA by mohl být usnadněn přítomností polyguanylátových sekvencí. Systémy doručení informace pomocí genových zbraní, kationtové lipozomové balení a další způsoby tuto vstupní metodu obcházejí, ale její pochopení může být užitečné například při snižování nákladů (např. snížením požadavku na cytofektiny).
Prezentování antigenu buňkami získanými z kostní dřeně
[editovat | editovat zdroj]
Studie na chimérických myších ukázaly, že antigen je předáván buňkami získanými z kostní dřeně, které zahrnují dendritické buňky, makrofágy a specializované B-buňky nazývané profesionální antigen prezentující buňky (APC).[48][58] Po naočkování pomocí genové zbraně transfekované Langerhansovy buňky migrují do drenážní lymfatické uzliny, kde vystavují vzorky požadovaných antigenů.[7] Po nitrosvalových a podkožních injekcích dendritické buňky prezentují antigen v drenážní lymfatické uzlině[55] a v krevní oběhové soustavě byly nalezeny transfekované makrofágy.[59]
Kromě přímé transfekce dendritických buněk nebo makrofágů dochází ke cross-primingu po nitrosvalové a podkožní injekci a také po vstřelení DNA za pomocí genových zbraní. Ke křížovému posílení dochází, když buňka derivovaná z kostní dřeně prezentuje peptidy z proteinů syntetizovaných v jiné buňce v kontextu MHC třídy 1. To může aktivovat odpovědi cytotoxických T-buněk a zdá se to být také důležité pro úplnou primární imunitní odpověď.[7][60]
Role způsobu aplikace
[editovat | editovat zdroj]Doručení DNA pomocí nitrosvalové a podkožní injekce vyvolává imunitní reakce odlišně. V kůži zachytávají a exprimují antigeny keratinocyty, fibroblasty a Langerhansovy buňky a jsou zodpovědné za vyvolání primární protilátkové odpovědi. Transfekované Langerhansovy buňky putují z kůže (do 12 hodin) do drenážní lymfatické uzliny, kde vyvolávají sekundární reakce B- a T-buněk. V kosterním svalu jsou buňky příčně pruhovaného svalstva nejčastěji transfekovány, ale zdají se být nedůležité pro imunitní odpověď. Místo toho se DNA naočkovaná nitrosvalově během několika minut „promyje“ do drenážní lymfatické uzliny, kde jsou distální dendritické buňky transfekovány a poté iniciují imunitní odpověď. Zdá se, že transfekované myocyty fungují jako „rezervoár“ antigenu pro výměnu s profesionálními APC.[20][53][60]
Udržování imunitní odpovědi
[editovat | editovat zdroj]DNA vakcinace vytváří účinnou imunitní paměť prostřednictvím zobrazování komplexních antigenních protilátek na folikulárních dendritických buňkách (FDC), což jsou silné stimulátory B-buněk. T-buňky mohou být stimulovány podobnými dendritickými buňkami zárodečných center. FDC jsou schopny generovat imunitní paměť, protože produkce protilátek dlouhodobě „překrývá“ expresi antigenu, což umožňuje vytvoření komplexních molekul vzniklých navázáním protilátek na antigen a jejich zobrazení pomocí FDC.[7]
Pomocné i cytotoxické T-buňky mohou kontrolovat virové infekce vylučováním interferonů. Cytotoxické T buňky obvykle zabíjejí virově infikované buňky. Mohou však být také stimulovány k vylučování antivirových cytokinů, jako je IFN-y a TNF-a, které nezabíjejí buňku, ale omezují virovou infekci snížením vylučování virových složek.[61] DNA vakcinace lze použít k potlačení virových infekcí nedestruktivní kontrolou zprostředkovanou pomocí IFN. To bylo prokázáno u hepatitidy B.[62] IFN-γ je kriticky důležitý při kontrole infekcí malárie[63] a uvažuje se nad ním ve spojitosti s antimalarickými DNA vakcínami.
Modulace imunitní odpovědi
[editovat | editovat zdroj]Cytokinová modulace
[editovat | editovat zdroj]Účinná vakcína musí vyvolat odpovídající imunitní odpověď pro daný patogen. DNA vakcíny mohou polarizovat pomocné T-buňky směrem k odpovědím TH1 nebo TH2 a v případě potřeby generovat CTL a/nebo protilátky. Toho lze dosáhnout modifikacemi formy vylučovaného antigenu (tj. intracelulárního vs. secernovaného), způsobu a velikostí podávané dávky.[40][41][64][65][66] Lze toho dosáhnout také společným podáváním plazmidové DNA programující imunitní regulační molekuly, tj. cytokiny, lymfokiny nebo kostimulační molekuly. Tyto „genetické přídavné látky “ lze podávat jako:
- směs 2 plazmidů, jeden programující imunogen a druhý programující cytokin
- jeden bi- nebo polycistronický vektor, oddělený oblastmi mezerníků
- chiméra kódovaná plazmidem nebo fúzní protein
Obecně platí, že současné podávání prozánětlivých látek (jako jsou různé interleukiny, tumor nekrotizující faktor a GM-CSF) a cytokinů vyvolávajících TH2 odpověď zvyšují protilátkové reakce, zatímco prozánětlivé látky a cytokiny vyvolávající odpověď TH1 snižují protilátkové reakce a zvyšují cytotoxické odpovědi (důležitější při virové ochraně). Někdy se používají kostimulační molekuly jako B7-1, B7-2 a CD40L.
Tento koncept byl aplikován při lokálním podávání pDNA kódujícím IL-10.[32] Plazmid kódující B7-1 (ligand na APC) úspěšně zesílil imunitní odpověď v nádorových modelech. Smíchání plazmidů kódujících GM-CSF a cirkumsporozoitového proteinu P. yoelii (PyCSP) zvýšilo ochranu proti následné expozici (zatímco samotný PyCSP kódovaný plazmidem nikoli). Bylo zveřejněno, že GM-CSF způsobil, že dendritické buňky prezentují antigen účinněji a zvyšují produkci IL-2 a aktivaci TH buněk, což řízeně vede ke zvýšené imunitní odpovědi.[49] Ta může být dále zvýšena pomocí primingu se směsí pPyCSP a PGM-CSF, následující posílením pomocí rekombinantního viru neštovic exprimující PyCSP.[67] Nicméně společná injekce plazmidů kódujících GM-CSF (nebo IFN-γ nebo IL-2) a fúzního proteinu merozoitového povrchového proteinu 1 (C-terminus) P. chabaudi- povrchového proteinu viru hepatitidy B (PcMSP1-HBs) úplně zrušila ochranu proti infekci. Při doručení samotného pPcMSP1-HBs zůstala ochrana zachována.[29]
Výhodou genetických přídavných složek je jejich nízká cena a jednoduché podávání, stejně jako vyhnutí se nestabilním rekombinantním cytokinům a potenciálně toxickým, „konvenčním“ přídavným látkám (jako je kamenec, fosforečnan vápenatý, monofosforyl lipid A, cholerový toxin, kationtové a mannanem potažené lipozomy, QS21, karboxymethylcelulóza a ubenimix).[7][20] Potenciální toxicita kvůli prodlouženému vylučování cytokinů však nebyla zatím potvrzena. U mnoha komerčně důležitých živočišných druhů nebyly geny pro cytokiny identifikovány a izolovány. Kromě toho různé cytokiny kódované plazmidem modulují imunitní systém odlišně podle doby doručování. Například některé cytokinové plazmidové DNA se nejlépe doručují pomocí imunogenové pDNA, protože před-reakční nebo souběžné vylučování může snížit specifické odpovědi a naopak nespecifické odpovědi zvýšit.[68]
Imunostimulační CpG motivy
[editovat | editovat zdroj]Zdá se, že samotná plazmidová DNA má podpůrný účinek pro imunitní systém.[6][7] Bakteriálně získaná DNA může spustit vrozené imunitní obranné mechanismy, aktivaci dendritických buněk a produkci cytokinů TH1.[44][69] To je způsobeno rozpoznáním určitých CpG dinukleotidových sekvencí, které jsou imunostimulační.[65][70] CpG stimulační (CpG-S) sekvence se vyskytují dvacetkrát častěji v bakteriálně odvozené DNA než v eukaryotech. Je to proto, že eukaryoty způsobují „potlačení CpG“ – tzn CpG dinukleotidové páry se vyskytují mnohem méně často, než se očekávalo. Navíc jsou CpG-S sekvence hypomethylovány. K tomu dochází často v bakteriální DNA, zatímco CpG motivy vyskytující se v eukaryotech jsou methylovány na cytosinovém nukleotidu. Naproti tomu nukleotidové sekvence, které zabraňují aktivaci imunitní reakce (nazývané CpG neutralizující nebo CpG-N), jsou v eukaryotických genomech nadměrně zastoupeny.[71] Optimální imunostimulační sekvencí je nemethylovaný CpG dinukleotid ohraničený dvěma 5' puriny a dvěma 3' pyrimidiny.[65][69] Kromě toho musí být lemující oblasti mimo tento imunostimulační hexamer bohaté na guanin, aby se zajistila vazba na cílové buňky a příjem látek do těchto buněk.
Vrozený systém spolupracuje s adaptivním imunitním systémem, aby vyvolal reakci proti proteinu kódovaného pomocí DNA. CpG-S sekvence způsobují aktivaci polyklonálních B-buněk a zvyšují expresi a sekreci cytokinů.[72] Stimulované makrofágy vylučují IL-12, IL-18, TNF-a, IFN-a, IFN-p a IFN-y, zatímco stimulované B-buňky vylučují IL-6 a část IL-12.[20][72][73]
Manipulace sekvencí CpG-S a CpG-N v plazmidové kostře DNA vakcín může zajistit úspěšnou imunitní odpověď na kódovaný antigen a řídit imunitní odpověď směrem k fenotypu TH1. To je užitečné, pokud je pro ochranu před patogenem vyžadována TH reakce. Sekvence CpG-S byly použity jako vnější přídavná složka při vakcinaci pomocí DNA i rekombinantním proteinem s různou mírou úspěšnosti. Některé organismy s hypomethylovanými CpG motivy vykazovaly stimulaci expanze polyklonálních B-buněk.[74] Mechanismus za tím může být složitější než prostá methylace – nebylo zjištěno, že by hypomethylovaná myší DNA vyvolala imunitní odpověď.
Většina důkazů pro imunostimulační CpG sekvence pochází ze studií na myších. Přesenení těchto údajů na jiné druhy vyžaduje opatrnost – jednotlivé druhy mohou vyžadovat různé přilehlé sekvence, protože vazebné specificity scavenger receptorů se u různých druhů liší. Navíc druhy, jako jsou přežvýkavci, mohou být necitlivé k imunostimulačním sekvencím kvůli jejich velké střevní zátěži potravou.
Alternativní posílení
[editovat | editovat zdroj]Imunitní reakce vyvolané DNA vakcinací mohou být zesíleny podáváním rekombinantního proteinu nebo rekombinantních poxvirů. Strategie posílení s názvem "Prime-boost" s rekombinantním proteinem úspěšně zvýšily titr neutralizačních protilátek a aviditu a perzistenci protilátek pro slabé imunogeny, jako je obalový protein HIV-1.[7][75] Rekombinantní virové posilovače se ukázaly jako velmi účinné při zesílení DNA vyvolaných CTL odpovědí. Imunizace pomocí DNA zaměřuje imunitní odpověď na požadovaný imunogen, zatímco posílení rekombinantním virem poskytuje větší množství exprimovaného antigenu, což vede k velkému zvýšení specifických CTL odpovědí.
Strategie "primárního posílení" byla úspěšná při vytváření ochrany proti malárii v řadě studií. Myši imunizované plazmidovou DNA kódující cirkumsporozoitový povrchový protein Plasmodium yoelii (PyCSP), poté posilující dávkou rekombinantního virem vaccinia exprimujícím stejný protein, měly významně vyšší hladiny protilátek, CTL aktivitu a IFN-γ, a tudíž vyšší úroveň ochrany než myši imunizované a posílené samotnou plazmidovou DNA.[76] Tento efekt může být dále zesílen směsí plazmidů kódujících PyCSP a pro myši specifické GM-CSF s následným dalším posílením pomocí rekombinantního viru vaccinia.[67] Bylo také úspěšně demonstrováno primární posílení imunitní reakce proti malárii typu P. knowlesi u opic.[77] Opice Rhesus byly imunizovány vícesložkovou, vícestupňovou DNA vakcínou kódující dva antigeny jaterního stadia – povrchový protein cirkumsporozoitu (PkCSP) a povrchový protein sporozoitu 2 (PkSSP2) – a dva antigeny krevního stadia – povrchový protein apikálního merozoitu 1 (PkAMA1) a merozoitový povrchový protein 1 (PkMSP1p42). Poté byly posíleny rekombinantním virem canarypox kódujícím všechny čtyři antigeny (ALVAC-4). U imunizovaných opic se vyvinuly protilátky proti sporozoitům a infikovaným erytrocytům a byly vyvolány odpovědi T-buněk vylučující IFN-y proti peptidům z PkCSP. Bylo dosaženo částečné ochrany proti napadení sporozoity a průměrná parazitémie byla významně snížena ve srovnání s kontrolními skupinou opic. Tyto modely, i když nejsou ideální pro extrapolaci výsledků na P. falciparum u lidí, budou důležité v předklinických studiích.
Posílení imunitních reakcí
[editovat | editovat zdroj]DNA
[editovat | editovat zdroj]Účinnost imunizace DNA lze zlepšit stabilizací DNA proti degradaci a zvýšením účinnosti doručení DNA do antigen prezentujících buněk.[7] To bylo demonstrováno potažením biodegradovatelných kationtových mikročástic (jako je poly(laktid-ko-glykolid) formulovaný s cetyltrimethylamoniumbromidem) DNA. Takové DNA-potažené mikročástice mohou být stejně účinné při zvyšování CTL jako rekombinantní viry, zvláště když jsou smíchány s kamencem.Částice 300 nm v průměru se jeví jako nejúčinnější pro příjem antigen prezentujícími buňkami.[7]
Alfavirové vektory
[editovat | editovat zdroj]Ke zlepšení účinnosti DNA vakcinace byly použity vektory založené na rekombinantním alfaviru.[7] Gen kódující požadovaný antigen je vložen do replikonu alfaviru, přičemž nahrazuje strukturní geny, ale geny nestrukturální replikázy zůstávají nedotčené. Virus Sindbis a virus Semliki Forest byly použity k sestavení rekombinantních replikonů alfaviru. Na rozdíl od konvenčních DNA vakcinací alfavirové vektory zabíjejí transfekované buňky a jsou exprimovány pouze přechodně. Geny replikázy alfaviru jsou exprimovány navíc jako posílení vakcinace. Není jasné, jak replikony alfaviru vyvolávají imunitní odpověď, ale může to být způsobeno vysokými hladinami proteinu exprimovaného tímto vektorem, replikonem indukovanými cytokinovými reakcemi nebo replikonem indukovanou apoptózou vedoucí ke zvýšenému příjmu antigenu dendritickými buňkami.
Odkazy
[editovat | editovat zdroj]Vizte také
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku DNA_vaccine na anglické Wikipedii.
- ↑ a b Henrique Roman Ramos and Paulo Lee Ho. Developing Snake Antivenom Sera by Genetic Immunization: A Review. Clinical Toxinology in Asia Pacific and Africa. S. 401–414. Dostupné online.
- ↑ a b LIU, Shuying; WANG, Shixia; LU, Shan. DNA immunization as a technology platform for monoclonal antibody induction. Emerging Microbes & Infections. April 27, 2016, s. e33. DOI 10.1038/emi.2016.27. PMID 27048742.
- ↑ a b Kishwar Hayat Khan. DNA vaccines: roles against diseases. Germs. March 1, 2013, s. 26–35. DOI 10.11599/germs.2013.1034. PMID 24432284.
- ↑ a b India gives emergency approval for world's first COVID-19 DNA vaccine [online]. 2021-08-20 [cit. 2021-08-22]. Dostupné online. (anglicky)
- ↑ a b c d e f g h i j k l m n Alarcon JB, Waine GW, McManus DP. Advances in Parasitology Volume 42. [s.l.]: [s.n.], 1999. (Advances in Parasitology; sv. 42). ISBN 9780120317424. DOI 10.1016/S0065-308X(08)60152-9. PMID 10050276. Kapitola DNA Vaccines: Technology and Application as Anti-parasite and Anti-microbial Agents, s. 343–410.
- ↑ a b c d e f g h i j k l m n o p q r s t u v Robinson HL, Pertmer TM. DNA vaccines for viral infections: basic studies and applications. [s.l.]: [s.n.], 2000. (Advances in Virus Research; sv. 55). ISBN 9780120398553. DOI 10.1016/S0065-3527(00)55001-5. PMID 11050940. S. 1–74.
- ↑ White LO, Gibb E, Newham HC, Richardson MD, Warren RC. Comparison of the growth of virulent and attenuated strains of Candida albicans in the kidneys of normal and cortison-treated mice by chitin assay. Mycopathologia. July 1979, s. 173–7. DOI 10.1007/bf00470753. PMID 384256. S2CID 31914107.
- ↑ Paoletti E, Lipinskas BR, Samsonoff C, Mercer S, Panicali D. Construction of live vaccines using genetically engineered poxviruses: biological activity of vaccinia virus recombinants expressing the hepatitis B virus surface antigen and the herpes simplex virus glycoprotein D. Proceedings of the National Academy of Sciences of the United States of America. January 1984, s. 193–7. DOI 10.1073/pnas.81.1.193. PMID 6320164. Bibcode 1984PNAS...81..193P.
- ↑ US Patent 4722848 - Method for immunizing animals with synthetically modified vaccinia virus
- ↑ ULMER, J.B.; DONNELLY, J.J.; PARKER, S.E.; RHODES, G.H.; FELGNER, P.L.; DWARKI, V.J.; GROMKOWSKI, S.H. Heterologous protection against influenza by injection of DNA encoding a viral protein. Science. 1993-03-19, s. 1745–1749. Dostupné online. ISSN 0036-8075. DOI 10.1126/science.8456302. PMID 8456302. Bibcode 1993Sci...259.1745U. (anglicky)
- ↑ REGALADO, Antonio. The U.S.government has begun testing its first Zika vaccine in humans [online]. MIT Technology Review Magazine, 2 August 2016 [cit. 2016-08-06]. Dostupné online.
- ↑ Chen Y, Wang S, Lu S. DNA Immunization for HIV Vaccine Development. Vaccines. February 2014, s. 138–59. DOI 10.3390/vaccines2010138. PMID 26344472.
- ↑ Julie E Ledgerwood, Theodore C Pierson, Sarah A Hubka, Niraj Desai, Steve Rucker, Ingelise J Gordon, Mary E Enama, Steevenson Nelson, Martha Nason, Wenjuan Gu, Nikkida Bundrant, Richard A Koup, Robert T Bailer, John R Mascola, Gary J Nabel, Barney S Graham, VRC 303 Study Team. A West Nile virus DNA vaccine utilizing a modified promoter induces neutralizing antibody in younger and older healthy adults in a phase I clinical trial. J Infect Dis. May 15, 2011, s. 1396–404. DOI 10.1093/infdis/jir054. PMID 21398392.
- ↑ a b Sedegah M, Hedstrom R, Hobart P, Hoffman SL. Protection against malaria by immunization with plasmid DNA encoding circumsporozoite protein. Proceedings of the National Academy of Sciences of the United States of America. October 1994, s. 9866–70. DOI 10.1073/pnas.91.21.9866. PMID 7937907. JSTOR 2365723. Bibcode 1994PNAS...91.9866S.
- ↑ HARMON, B.T.; ALY, A.E.; PADEGIMAS, L.; SESENOGLU-LAIRD, O.; COOPER, M.J.; WASZCZAK, B.L. Intranasal administration of plasmid DNA nanoparticles yields successful transfection and expression of a reporter protein in rat brain. Gene Therapy. 2014, s. 514–521. DOI 10.1038/gt.2014.28. PMID 24670994. S2CID 5560134.
- ↑ a b Mor G, Klinman DM, Shapiro S, Hagiwara E, Sedegah M, Norman JA, Hoffman SL, Steinberg AD. Complexity of the cytokine and antibody response elicited by immunizing mice with Plasmodium yoelii circumsporozoite protein plasmid DNA. Journal of Immunology. August 1995, s. 2039–46. Dostupné online. PMID 7636255.
- ↑ Leitner WW, Seguin MC, Ballou WR, Seitz JP, Schultz AM, Sheehy MJ, Lyon JA. Immune responses induced by intramuscular or gene gun injection of protective deoxyribonucleic acid vaccines that express the circumsporozoite protein from Plasmodium berghei malaria parasites. Journal of Immunology. December 1997, s. 6112–9. Dostupné online. PMID 9550412.
- ↑ Böhm W, Kuhröber A, Paier T, Mertens T, Reimann J, Schirmbeck R. DNA vector constructs that prime hepatitis B surface antigen-specific cytotoxic T lymphocyte and antibody responses in mice after intramuscular injection. Journal of Immunological Methods. June 1996, s. 29–40. DOI 10.1016/0022-1759(96)00035-X. PMID 8690928.
- ↑ a b c d e f g h i j k Lewis PJ, Babiuk LA. DNA vaccines: a review. [s.l.]: Academic Press, 1999. Dostupné online. ISBN 978-0-12-039854-6. DOI 10.1016/S0065-3527(08)60367-X. PMID 10547676. S. 129–88.
- ↑ André S, Seed B, Eberle J, Schraut W, Bültmann A, Haas J. Increased immune response elicited by DNA vaccination with a synthetic gp120 sequence with optimized codon usage. Journal of Virology. February 1998, s. 1497–503. DOI 10.1128/JVI.72.2.1497-1503.1998. PMID 9445053.
- ↑ Muthumani K, Zhang D, Dayes NS, Hwang DS, Calarota SA, Choo AY, Boyer JD, Weiner DB. Novel engineered HIV-1 East African Clade-A gp160 plasmid construct induces strong humoral and cell-mediated immune responses in vivo. Virology. September 2003, s. 134–46. DOI 10.1016/S0042-6822(03)00459-8. PMID 14517067.
- ↑ Oliveira PH, Prather KJ, Prazeres DM, Monteiro GA. Structural instability of plasmid biopharmaceuticals: challenges and implications. Trends in Biotechnology. September 2009, s. 503–11. DOI 10.1016/j.tibtech.2009.06.004. PMID 19656584.
- ↑ Oliveira PH, Mairhofer J. Marker-free plasmids for biotechnological applications - implications and perspectives. Trends in Biotechnology. September 2013, s. 539–47. DOI 10.1016/j.tibtech.2013.06.001. PMID 23830144.
- ↑ Kutzler MA, Weiner DB. DNA vaccines: ready for prime time?. Nature Reviews.Genetics. October 2008, s. 776–88. DOI 10.1038/nrg2432. PMID 18781156.
- ↑ Rodriguez F, Zhang J, Whitton JL. DNA immunization: ubiquitination of a viral protein enhances cytotoxic T-lymphocyte induction and antiviral protection but abrogates antibody induction. Journal of Virology. November 1997, s. 8497–503. DOI 10.1128/JVI.71.11.8497-8503.1997. PMID 9343207.
- ↑ a b Tobery TW, Siliciano RF. Targeting of HIV-1 antigens for rapid intracellular degradation enhances cytotoxic T lymphocyte (CTL) recognition and the induction of de novo CTL responses in vivo after immunization. The Journal of Experimental Medicine. March 1997, s. 909–20. DOI 10.1084/jem.185.5.909. PMID 9120397.
- ↑ Huebener N, Fest S, Strandsby A, Michalsky E, Preissner R, Zeng Y, Gaedicke G, Lode HN. A rationally designed tyrosine hydroxylase DNA vaccine induces specific antineuroblastoma immunity. Molecular Cancer Therapeutics. July 2008, s. 2241–51. DOI 10.1158/1535-7163.MCT-08-0109. PMID 18645033.
- ↑ a b Wunderlich G, Moura IC, del Portillo HA. Genetic immunization of BALB/c mice with a plasmid bearing the gene coding for a hybrid merozoite surface protein 1-hepatitis B virus surface protein fusion protects mice against lethal Plasmodium chabaudi chabaudi PC1 infection. Infection and Immunity. October 2000, s. 5839–45. DOI 10.1128/IAI.68.10.5839-5845.2000. PMID 10992493.
- ↑ Weiner DB, Kennedy RC. Genetic vaccines. Scientific American. 1999, s. 34–41. Dostupné v archivu pořízeném z originálu dne 2009-03-25. DOI 10.1038/scientificamerican0799-50. PMID 10396782. Bibcode 1999SciAm.281a..50W.
- ↑ Widera G, Austin M, Rabussay D, Goldbeck C, Barnett SW, Chen M, Leung L, Otten GR, Thudium K, Selby MJ, Ulmer JB. Increased DNA vaccine delivery and immunogenicity by electroporation in vivo. Journal of Immunology. May 2000, s. 4635–40. DOI 10.4049/jimmunol.164.9.4635. PMID 10779767.
- ↑ a b Daheshia M, Kuklin N, Kanangat S, Manickan E, Rouse BT. Suppression of ongoing ocular inflammatory disease by topical administration of plasmid DNA encoding IL-10. Journal of Immunology. August 1997, s. 1945–52. Dostupné online. PMID 9257860.
- ↑ a b Chen Y, Webster RG, Woodland DL. Induction of CD8+ T cell responses to dominant and subdominant epitopes and protective immunity to Sendai virus infection by DNA vaccination. Journal of Immunology. March 1998, s. 2425–32. Dostupné online. PMID 9498786.
- ↑ Lode HN, Huebener N, Zeng Y, Fest S, Weixler S, Gaedicke G. DNA minigene vaccination for adjuvant neuroblastoma therapy. Annals of the New York Academy of Sciences. December 2004, s. 113–21. DOI 10.1196/annals.1322.012. PMID 15650237. S2CID 27240738. Bibcode 2004NYASA1028..113L.
- ↑ Sizemore DR, Branstrom AA, Sadoff JC. Attenuated Shigella as a DNA delivery vehicle for DNA-mediated immunization. Science. October 1995, s. 299–302. Dostupné online. DOI 10.1126/science.270.5234.299. PMID 7569980. S2CID 12532901. Bibcode 1995Sci...270..299S.
- ↑ Nealon, Cory. A hybrid vehicle that delivers DNA [online]. The State University of New York at Buffalo, 25 November 2014 [cit. 2014-12-16]. Dostupné online.
- ↑ Jones CH, Ravikrishnan A, Chen M, Reddinger R, Kamal Ahmadi M, Rane S, Hakansson AP, Pfeifer BA. Hybrid biosynthetic gene therapy vector development and dual engineering capacity. Proceedings of the National Academy of Sciences of the United States of America. August 2014, s. 12360–5. DOI 10.1073/pnas.1411355111. PMID 25114239. Bibcode 2014PNAS..11112360J.
- ↑ Barry MA, Lai WC, Johnston SA. Protection against mycoplasma infection using expression-library immunization. Nature. October 1995, s. 632–5. DOI 10.1038/377632a0. PMID 7566175. S2CID 4306972. Bibcode 1995Natur.377..632B.
- ↑ Fynan EF, Webster RG, Fuller DH, Haynes JR, Santoro JC, Robinson HL. DNA vaccines: protective immunizations by parenteral, mucosal, and gene-gun inoculations. Proceedings of the National Academy of Sciences of the United States of America. December 1993, s. 11478–82. DOI 10.1073/pnas.90.24.11478. PMID 8265577. Bibcode 1993PNAS...9011478F.
- ↑ a b c d e Feltquate DM, Heaney S, Webster RG, Robinson HL. Different T helper cell types and antibody isotypes generated by saline and gene gun DNA immunization. Journal of Immunology. March 1997, s. 2278–84. Dostupné online. PMID 9036975.
- ↑ a b c d Boyle CM, Morin M, Webster RG, Robinson HL. Role of different lymphoid tissues in the initiation and maintenance of DNA-raised antibody responses to the influenza virus H1 glycoprotein. Journal of Virology. December 1996, s. 9074–8. DOI 10.1128/JVI.70.12.9074-9078.1996. PMID 8971047.
- ↑ Sällberg M, Townsend K, Chen M, O'Dea J, Banks T, Jolly DJ, Chang SM, Lee WT, Milich DR. Characterization of humoral and CD4+ cellular responses after genetic immunization with retroviral vectors expressing different forms of the hepatitis B virus core and e antigens. Journal of Virology. July 1997, s. 5295–303. DOI 10.1128/JVI.71.7.5295-5303.1997. PMID 9188598.
- ↑ Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature. March 1998, s. 245–52. DOI 10.1038/32588. PMID 9521319. S2CID 4388748. Bibcode 1998Natur.392..245B.
- ↑ a b Jakob T, Walker PS, Krieg AM, Udey MC, Vogel JC. Activation of cutaneous dendritic cells by CpG-containing oligodeoxynucleotides: a role for dendritic cells in the augmentation of Th1 responses by immunostimulatory DNA. Journal of Immunology. September 1998, s. 3042–9. Dostupné online. PMID 9743369.
- ↑ a b Raz E, Tighe H, Sato Y, Corr M, Dudler JA, Roman M, Swain SL, Spiegelberg HL, Carson DA. Preferential induction of a Th1 immune response and inhibition of specific IgE antibody formation by plasmid DNA immunization. Proceedings of the National Academy of Sciences of the United States of America. May 1996, s. 5141–5. DOI 10.1073/pnas.93.10.5141. PMID 8643542. Bibcode 1996PNAS...93.5141R.
- ↑ a b Fu TM, Friedman A, Ulmer JB, Liu MA, Donnelly JJ. Protective cellular immunity: cytotoxic T-lymphocyte responses against dominant and recessive epitopes of influenza virus nucleoprotein induced by DNA immunization. Journal of Virology. April 1997, s. 2715–21. DOI 10.1128/JVI.71.4.2715-2721.1997. PMID 9060624.
- ↑ a b c Restifo NP, Bacík I, Irvine KR, Yewdell JW, McCabe BJ, Anderson RW, Eisenlohr LC, Rosenberg SA, Bennink JR. Antigen processing in vivo and the elicitation of primary CTL responses. Journal of Immunology. May 1995, s. 4414–22. Dostupné online. PMID 7722298.
- ↑ a b c Iwasaki A, Stiernholm BJ, Chan AK, Berinstein NL, Barber BH. Enhanced CTL responses mediated by plasmid DNA immunogens encoding costimulatory molecules and cytokines. Journal of Immunology. May 1997, s. 4591–601. Dostupné online. PMID 9144471.
- ↑ a b Weiss WR, Ishii KJ, Hedstrom RC, Sedegah M, Ichino M, Barnhart K, Klinman DM, Hoffman SL. A plasmid encoding murine granulocyte-macrophage colony-stimulating factor increases protection conferred by a malaria DNA vaccine. Journal of Immunology. September 1998, s. 2325–32. Dostupné online. PMID 9725227.
- ↑ Tsuji T, Hamajima K, Fukushima J, Xin KQ, Ishii N, Aoki I, Ishigatsubo Y, Tani K, Kawamoto S, Nitta Y, Miyazaki J, Koff WC, Okubo T, Okuda K. Enhancement of cell-mediated immunity against HIV-1 induced by coinnoculation of plasmid-encoded HIV-1 antigen with plasmid expressing IL-12. Journal of Immunology. April 1997, s. 4008–13. Dostupné online. PMID 9103472.
- ↑ a b Justewicz DM, Webster RG. Long-term maintenance of B cell immunity to influenza virus hemagglutinin in mice following DNA-based immunization. Virology. October 1996, s. 10–7. DOI 10.1006/viro.1996.0501. PMID 8862394.
- ↑ Mancini-Bourgine M, Fontaine H, Bréchot C, Pol S, Michel ML. Immunogenicity of a hepatitis B DNA vaccine administered to chronic HBV carriers. Vaccine. May 2006, s. 4482–9. DOI 10.1016/j.vaccine.2005.08.013. PMID 16310901.
- ↑ a b Wolff JA, Dowty ME, Jiao S, Repetto G, Berg RK, Ludtke JJ, Williams P, Slautterback DB. Expression of naked plasmids by cultured myotubes and entry of plasmids into T tubules and caveolae of mammalian skeletal muscle. Journal of Cell Science. December 1992, s. 1249–59. Dostupné online. DOI 10.1242/jcs.103.4.1249. PMID 1487500.
- ↑ Anderson RG, Kamen BA, Rothberg KG, Lacey SW. Potocytosis: sequestration and transport of small molecules by caveolae. Science. January 1992, s. 410–1. DOI 10.1126/science.1310359. PMID 1310359. Bibcode 1992Sci...255..410A.
- ↑ a b Casares S, Inaba K, Brumeanu TD, Steinman RM, Bona CA. Antigen presentation by dendritic cells after immunization with DNA encoding a major histocompatibility complex class II-restricted viral epitope. The Journal of Experimental Medicine. November 1997, s. 1481–6. DOI 10.1084/jem.186.9.1481. PMID 9348305.
- ↑ a b Bennett RM, Gabor GT, Merritt MM. DNA binding to human leukocytes.Evidence for a receptor-mediated association, internalization, and degradation of DNA. The Journal of Clinical Investigation. December 1985, s. 2182–90. DOI 10.1172/JCI112226. PMID 3001145.
- ↑ Bennet RM, Hefeneider SH, Bakke A, Merritt M, Smith CA, Mourich D, Heinrich MC. The production and characterization of murine monoclonal antibodies to a DNA receptor on human leukocytes. Journal of Immunology. May 1988, s. 2937–42. Dostupné online. PMID 2452195.
- ↑ Corr M, Lee DJ, Carson DA, Tighe H. Gene vaccination with naked plasmid DNA: mechanism of CTL priming. The Journal of Experimental Medicine. October 1996, s. 1555–60. DOI 10.1084/jem.184.4.1555. PMID 8879229.
- ↑ Chattergoon MA, Robinson TM, Boyer JD, Weiner DB. Specific immune induction following DNA-based immunization through in vivo transfection and activation of macrophages/antigen-presenting cells. Journal of Immunology. June 1998, s. 5707–18. Dostupné online. PMID 9637479.
- ↑ a b Torres CA, Iwasaki A, Barber BH, Robinson HL. Differential dependence on target site tissue for gene gun and intramuscular DNA immunizations. Journal of Immunology. May 1997, s. 4529–32. Dostupné online. PMID 9144463.
- ↑ Franco A, Guidotti LG, Hobbs MV, Pasquetto V, Chisari FV. Pathogenetic effector function of CD4-positive T helper 1 cells in hepatitis B virus transgenic mice. Journal of Immunology. August 1997, s. 2001–8. Dostupné online. PMID 9257867.
- ↑ Mancini M, Hadchouel M, Davis HL, Whalen RG, Tiollais P, Michel ML. DNA-mediated immunization in a transgenic mouse model of the hepatitis B surface antigen chronic carrier state. Proceedings of the National Academy of Sciences of the United States of America. October 1996, s. 12496–501. DOI 10.1073/pnas.93.22.12496. PMID 8901610. Bibcode 1996PNAS...9312496M.
- ↑ Doolan DL, Hoffman SL. IL-12 and NK cells are required for antigen-specific adaptive immunity against malaria initiated by CD8+ T cells in the Plasmodium yoelii model. Journal of Immunology. July 1999, s. 884–92. Dostupné online. PMID 10395683.
- ↑ Cardoso AI, Blixenkrone-Moller M, Fayolle J, Liu M, Buckland R, Wild TF. Immunization with plasmid DNA encoding for the measles virus hemagglutinin and nucleoprotein leads to humoral and cell-mediated immunity. Virology. November 1996, s. 293–9. DOI 10.1006/viro.1996.0603. PMID 8918915.
- ↑ a b c Sato Y, Roman M, Tighe H, Lee D, Corr M, Nguyen MD, Silverman GJ, Lotz M, Carson DA, Raz E. Immunostimulatory DNA sequences necessary for effective intradermal gene immunization. Science. July 1996, s. 352–4. DOI 10.1126/science.273.5273.352. PMID 8662521. S2CID 9333197. Bibcode 1996Sci...273..352S.
- ↑ Weiss R, Leitner WW, Scheiblhofer S, Chen D, Bernhaupt A, Mostböck S, Thalhamer J, Lyon JA. Genetic vaccination against malaria infection by intradermal and epidermal injections of a plasmid containing the gene encoding the Plasmodium berghei circumsporozoite protein. Infection and Immunity. October 2000, s. 5914–9. DOI 10.1128/IAI.68.10.5914-5919.2000. PMID 10992502.
- ↑ a b Sedegah M, Weiss W, Sacci JB, Charoenvit Y, Hedstrom R, Gowda K, Majam VF, Tine J, Kumar S, Hobart P, Hoffman SL. Improving protective immunity induced by DNA-based immunization: priming with antigen and GM-CSF-encoding plasmid DNA and boosting with antigen-expressing recombinant poxvirus. Journal of Immunology. June 2000, s. 5905–12. DOI 10.4049/jimmunol.164.11.5905. PMID 10820272.
- ↑ Barouch DH, Santra S, Steenbeke TD, Zheng XX, Perry HC, Davies ME, Freed DC, Craiu A, Strom TB, Shiver JW, Letvin NL. Augmentation and suppression of immune responses to an HIV-1 DNA vaccine by plasmid cytokine/Ig administration. Journal of Immunology. August 1998, s. 1875–82. Dostupné online. PMID 9712056.
- ↑ a b Krieg AM, Yi AK, Matson S, Waldschmidt TJ, Bishop GA, Teasdale R, Koretzky GA, Klinman DM. CpG motifs in bacterial DNA trigger direct B-cell activation. Nature. April 1995, s. 546–9. DOI 10.1038/374546a0. PMID 7700380. S2CID 4261304. Bibcode 1995Natur.374..546K.
- ↑ Klinman DM, Yamshchikov G, Ishigatsubo Y. Contribution of CpG motifs to the immunogenicity of DNA vaccines. Journal of Immunology. April 1997, s. 3635–9. Dostupné online. PMID 9103425.
- ↑ Krieg AM, Wu T, Weeratna R, Efler SM, Love-Homan L, Yang L, Yi AK, Short D, Davis HL. Sequence motifs in adenoviral DNA block immune activation by stimulatory CpG motifs. Proceedings of the National Academy of Sciences of the United States of America. October 1998, s. 12631–6. DOI 10.1073/pnas.95.21.12631. PMID 9770537. Bibcode 1998PNAS...9512631K.
- ↑ a b Klinman DM, Yi AK, Beaucage SL, Conover J, Krieg AM. CpG motifs present in bacteria DNA rapidly induce lymphocytes to secrete interleukin 6, interleukin 12, and interferon gamma. Proceedings of the National Academy of Sciences of the United States of America. April 1996, s. 2879–83. DOI 10.1073/pnas.93.7.2879. PMID 8610135. Bibcode 1996PNAS...93.2879K.
- ↑ Yi AK, Chace JH, Cowdery JS, Krieg AM. IFN-gamma promotes IL-6 and IgM secretion in response to CpG motifs in bacterial DNA and oligodeoxynucleotides. Journal of Immunology. January 1996, s. 558–64. Dostupné online. PMID 8543806.
- ↑ Benjamin G.Barwick, Christopher D.Scharer, Ryan J.Martinez, Madeline J.Price, Alexander N.Wein, Robert R.Haines, Alexander P.R.Bally, Jacob E.Kohlmeier, and Jeremy M.Boss. B cell activation and plasma cell differentiation are inhibited by de novo DNA methylation. Nat.Commun.. May 15, 2018, s. 1900. DOI 10.1038/s41467-018-04234-4. PMID 29765016.
- ↑ Letvin NL, Montefiori DC, Yasutomi Y, Perry HC, Davies ME, Lekutis C, Alroy M, Freed DC, Lord CI, Handt LK, Liu MA, Shiver JW. Potent, protective anti-HIV immune responses generated by bimodal HIV envelope DNA plus protein vaccination. Proceedings of the National Academy of Sciences of the United States of America. August 1997, s. 9378–83. DOI 10.1073/pnas.94.17.9378. PMID 9256490. Bibcode 1997PNAS...94.9378L.
- ↑ Sedegah M, Jones TR, Kaur M, Hedstrom R, Hobart P, Tine JA, Hoffman SL. Boosting with recombinant vaccinia increases immunogenicity and protective efficacy of malaria DNA vaccine. Proceedings of the National Academy of Sciences of the United States of America. June 1998, s. 7648–53. DOI 10.1073/pnas.95.13.7648. PMID 9636204. Bibcode 1998PNAS...95.7648S.
- ↑ Rogers WO, Baird JK, Kumar A, Tine JA, Weiss W, Aguiar JC, Gowda K, Gwadz R, Kumar S, Gold M, Hoffman SL. Multistage multiantigen heterologous prime boost vaccine for Plasmodium knowlesi malaria provides partial protection in rhesus macaques. Infection and Immunity. September 2001, s. 5565–72. DOI 10.1128/IAI.69.9.5565-5572.2001. PMID 11500430.
Literatura
[editovat | editovat zdroj]- Hooper JW, Thompson E, Wilhelmsen C, Zimmerman M, Ichou MA, Steffen SE, Schmaljohn CS, Schmaljohn AL, Jahrling PB. Smallpox DNA vaccine protects nonhuman primates against lethal monkeypox. Journal of Virology. May 2004, s. 4433–43. DOI 10.1128/JVI.78.9.4433-4443.2004. PMID 15078924.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu DNA vakcína na Wikimedia Commons
Obrázky, zvuky či videa k tématu DNA vakcína na Wikimedia Commons