Fluorid dusnatý
| Fluorid dusnatý | |
|---|---|
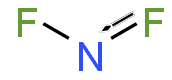 | |
 | |
| Obecné | |
| Systematický název | Fluorid dusnatý |
| Anglický název | Nitrogen difluoride |
| Sumární vzorec | NF2 |
| Identifikace | |
| Registrační číslo CAS | 3744-07-8 |
| PubChem | 138039 |
| SMILES | [N](F)F |
| InChI | InChI=1S/F2N/c1-3-2
Key: BBZREMAMWBDNHH-UHFFFAOYSA-N |
| Vlastnosti | |
| Molární hmotnost | 52,004 g/mol |
| Struktura | |
| Dipólový moment | 0.13 D (4.5×10−31 C·m) |
Některá data mohou pocházet z datové položky. | |
Fluorid dusnatý je anorganická sloučenina s chemickým vzorcem NF2, která patří mezi fluoridy dusíku. Fluorid dusnatý je v rovnováze se svým dimerem tetrafluorhydrazinem, která se s rostoucí teplotou posouvá na stranu fluoridu dusnatého:[1][2]
- N2F4 ⇌ 2 NF2
Molekula je neobvyklá v tom, že má lichý počet elektronů, přesto je dostatečně stabilní pro experimentální studium.[3]
Vlastnosti
[editovat | editovat zdroj]Při pokojové teplotě je tetrafluorhydrazin disociován z 0,7 % do formy fluoridu dusnatého při tlaku 5 mmHg (670 Pa). Při nárůstu teploty na 225 °C již převažuje fluorid dusnatý z 99 %.[4]
Délka vazby ve fluoridu dusnatém je 1,3494 Å a úhel vazby je 103.33°.[5]
V infračerveném spektru má vazba N-F ve fluoridu dusnatém symetrickou valenční vibraci 1075 cm−1. V porovnání s 1115 cm−1 ve fluoridu dusném, 1021 cm−1 ve fluoridu dusitém a 998 cm−1 v tetrafluorhydrazinu.[3]
Základní stav molekuly je 2B1.[5]
Plyn je často kontaminován oxidem dusnatým nebo oxidem dusným.[3]
Využití
[editovat | editovat zdroj]Fluorid dusnatý vzniká při práci excimerového laseru xenonného fluoridu. Fluorid dusitý je nosný plyn halogenu, která při dopadu elektronů uvolňuje fluoridové ionty:[6]
- NF3 + e− → NF2 + F−
Volné fluoridové ionty reagují s kationty xenonu.[6]
Fluorid dusnatý může být spotřebován následně na fluorid dusný:[6]
- NF2 + e− → NF + F−
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Nitrogen difluoride na anglické Wikipedii.
- ↑ JÄGER, Susanne; VON JOUANNE, Jörn; KELLER-RUDEK, Hannelore. F Fluorine. Příprava vydání Dieter Koschel, Peter Kuhn, Peter Merlet, Sigrid Ruprecht, Joachim Wagner. Berlin, Heidelberg: Springer Berlin Heidelberg Dostupné online. ISBN 978-3-662-06341-5, ISBN 978-3-662-06339-2. DOI 10.1007/978-3-662-06339-2. (anglicky)
- ↑ JOHNSON, Frederic A.; COLBURN, Charles B. The Tetrafluorohydrazine-Difluoroamino Radical Equilibrium 1. Journal of the American Chemical Society. 1961-07, roč. 83, čís. 14, s. 3043–3047. Dostupné online [cit. 2023-11-24]. ISSN 0002-7863. DOI 10.1021/ja01475a018. (anglicky)
- ↑ a b c BROWN, R. D.; BURDEN, F. R.; HART, B. T. The electronic structure of the NF2 radical. Theoretica Chimica Acta. 1973, roč. 28, čís. 4, s. 339–353. Dostupné online [cit. 2023-11-24]. ISSN 0040-5744. DOI 10.1007/BF00529015. (anglicky)
- ↑ BOHN, Robert K.; BAUER, Simon Harvey. An electron diffraction study of the structures of NF2 and N2F4. Inorganic Chemistry. 1967-02, roč. 6, čís. 2, s. 304–309. Dostupné online [cit. 2023-11-24]. ISSN 0020-1669. DOI 10.1021/ic50048a024. (anglicky)
- ↑ a b BROWN, R.D.; BURDEN, F.R.; GODFREY, P.D. Microwave spectrum of NF2. Journal of Molecular Spectroscopy. 1974-08, roč. 52, čís. 2, s. 301–321. Dostupné online [cit. 2023-11-24]. DOI 10.1016/0022-2852(74)90121-0. (anglicky)
- ↑ a b c TRAINOR, Daniel W. Electron dissociative attachment to nitrogen difluoride radicals. The Journal of Physical Chemistry. 1989-02, roč. 93, čís. 3, s. 1134–1136. Dostupné online [cit. 2023-11-24]. ISSN 0022-3654. DOI 10.1021/j100340a022. (anglicky)